超疏水釉质表面抑制黏蛋白吸附和细菌黏附
殷佳莉,唐旭炎,李全利,曹 颖
超疏水釉质表面抑制黏蛋白吸附和细菌黏附
殷佳莉,唐旭炎,李全利,曹 颖
目的 探讨涂有超疏水材料釉质片表面对于黏蛋白吸附和变形链球菌黏附的影响。方法 制备牛牙釉质块若干,随机分为两组:用十七氟癸基三甲氧基硅烷处理釉质片作为实验组,用去离子水处理牙釉质片作为空白对照组。用场发射扫描电镜对样品分别面进行检测。对两组样品分别进行接触角和唾液黏蛋白的吸附的测定。通过场发射扫描电子显微镜观察样品表面生物膜形态特征以及计数菌落形成单位评估样品表面变形链球菌生物膜形成情况。结果 场发射扫描电镜检测样品表面可见实验组与对照组形貌不同。接触角测试结果显示,实验组的接触角明显大于对照组的接触角(P<0.05)。实验组样品的唾液黏蛋白的吸附量明显少于对照组(P<0.05)。场发射扫描电镜观察结果显示2 h和24 h的实验组样品表面均只有极少量的菌落,而对照组样品表面有大量的菌斑生物膜。48 h后,两组样品表面均被大量细菌生物膜完全覆盖。菌落形成单位计数结果与扫描电镜结果一致。结论 涂有超疏水材料釉质片表面对于黏蛋白吸附和变形链球菌生物膜形成有抑制作用。
牙菌斑生物膜;超疏水;釉质表面;唾液黏蛋白;变形链球菌
牙菌斑是嵌入到保护性基质和细菌聚合物中的复杂的多物种生物膜[1-2]。牙菌斑是龋病与牙周病的致病因素之一[3-4]。同时,牙菌斑中的细菌以及牙周组织炎症也与许多全身疾病相关[5]。因此,控制口腔牙菌斑生物膜对于人类健康具有非常积极的意义。目前最常用的方法就是机械清除法,包括刷牙、使用牙线等。这些方法可以清除牙面上已经形成的牙菌斑,但是大多数个体难以保持长期达到菌斑控制的标准[6]。因此,许多口腔护理产品中加入抗菌药物以确保效果。常用的有氯己定和三氯生[7],这两种均为广谱抗菌剂,因此这些试剂最大的缺点是长期使用会产生耐药性以及引起口腔菌群失调[6]。该研究是在牙釉质表面形成超疏水表面,研究该表面抑制口腔致病细菌的黏附和定植的效果,为超疏水纳米膜在龋病预防领域提供依据。
1 材料与方法
1.1 主要材料与仪器 脑心浸出液肉汤(brain heart infusion broth,BHI)和蔗糖购自美国Sigma公司;其它试剂均购于上海阿拉丁试剂公司。接触角测试仪(JGW-360A1,承德惠城仪器公司);多功能酶标仪(ELX800,美国BioTek仪器有限公司);场发射扫描电子显微镜(Sirion 200,美国FEI公司);厌氧培养箱(DG250,广州华粤行仪器有限公司)。
1.2 牙片制备 从屠宰场获取牛牙,用手术刀片剔除牙上软组织。将牙齿用3%次氯酸钠处理,以除去细菌,并用磷酸缓冲盐溶液(phosphate buffer saline,PBS)冲洗。由水冷金刚砂片慢速切割机制备的4 mm×4 mm×2 mm釉质块,挑选100片无裂缝完整的釉质片。先后用600、1 200、2 400、4 000粒度的金刚砂纸抛光釉质片。接着使用丙酮超声清洗20 min,随后使用无水乙醇超声20 min,最后再用离子水超声清洗20 min。清洗完成后置于去离子水中4℃ 储存,备用。
1.3 样本制备 将上述釉质片先用紫外线杀菌30 min,然后用37%磷酸酸蚀30 s,PBS冲洗3次,烘干备用。将釉质片随机分成两组,分别做下述处理:将样品用去离子水微微湿润后,浸没于十七氟癸基三甲氧基硅烷液中。24 h后取出样品,吹去多余液体,作为实验组样品备用。将样品浸没于去离子水中,作为对照组样品备用。
1.4 样品表面性质检测
1.4.1 接触角检测 样品置于接触角测试仪的载物台上,用移液管滴取3 μl去离子水于样品表面。使用软件捕获液滴图片并传送到计算机用于角度测量。每组有6个样品。
1.4.2 场发射扫描电镜检测 将样品用酒精梯度脱水后,冷冻干燥,喷金。用扫描电镜观察样品表面形貌。
1.5 黏蛋白黏附及检测 将样品置于10 g/L的黏蛋白溶液中37℃ 孵育2 h,取出PBS溶液漂洗3次,置于阿新蓝溶液中染色30 min取出,PBS溶液漂洗3次,置于1 ml水中,震荡。离心后,用多功能酶标仪测试溶液595 nm的吸光度值。
1.6 细菌生物膜形成以及检测
1.6.1 细菌生物膜形成 将变形链球菌(ATCC35668)接种于BHI培养基上,厌氧箱中37 ℃ 培养48 h后,分别挑取单个菌落于培养液中,37℃下厌氧(80%N2、10%CO2、10%H2)培养24 h后。调整菌液浓度,使其在550 nm的吸光度值为0.26。取200 μl菌液分别接种于培养板中,加补充5%蔗糖的BHI至1 ml。37℃培养2 h后,用PBS液冲洗3次,再将样品置于BHI培养基中培养2、24、48 h分别取出检测。
1.6.2 生物膜扫描电镜检测 将样品置于2.5%戊二醛4℃固定,12 h后取出,用PBS(pH 7.2)漂洗,梯度脱水(50%乙醇溶液10 min、70%乙醇溶液10 min、90%乙醇溶液10 min、100%乙醇溶液20 min)。随后将样品冷冻干燥,喷金,扫描电镜观察。
1.6.3 菌落计数 将样品置于1 ml BHI培养液中,超声震荡60 s,将获得的原液梯度稀释,接种于BHI平板上,厌氧培养。72 h后,按菌落形成单位(colony-forming units,CFU)计数法计数,并计算各组Log10的值。
1.7 统计学处理 采用SPSS 17.0软件进行分析,数据以表示,两组间比较采用t检验。
2 结果
2.1 样品表面检测结果 两组样品的接触角,实验组与对照组分别为(153.386±3.054)°和(10.869± 2.261)°。实验组数据明显大于对照组,差异有统计学意义(t=123.438,P<0.05),见图1。在同一放大倍数的场发射扫描电镜下,观察两组样本表面形貌,可见实验组表面粗糙颗粒度较小,而对照组可见酸蚀后釉柱鱼鳞状地排列,表面起伏较大,见图2。
2.2 黏蛋白的吸收 实验组和对照组样本的黏蛋白吸附量的吸光度值分别为0.049±0.003、0.187± 0.027。实验组吸光度值明显小于对照组,差异有统计学意义(t=-17.693,P<0.05)。

图1 样品表面水滴接触角

图2 样本表面形貌扫描电镜图 ×10 000
2.3 生物膜形态 由扫描电镜结果图可见实验组2 h的样品表面几乎看不见菌落,见图3 A1。而对照组2 h的样品表面可见成团块状聚集的细菌,菌落之间的间隙可见釉质表面,见图3 B1。24 h后,实验组样品表面仍未见明显菌落,见图3 A2。而对照组样品表面被细菌生物膜密集覆盖,见图3 B2。48 h,实验组样品表面可见多层细菌生物膜,但视野中部分区域仍可见釉质表面,见图3 A3。而对照组样品表面被多层厚的细菌生物膜完全覆盖,釉质表面完全不可见,见图3 B3。

图3 样品表面菌落形态扫描电镜图 ×1 000
2.4 菌落计数结果 实验组和对照组样品的菌落计数值(Log CFU/ml)如图4所示。在3个时间点,实验组和对照组同一时间样品菌落计数结果比较差异均有统计学意义(t=-31.705、-62.349、-16.40,P<0.05)。
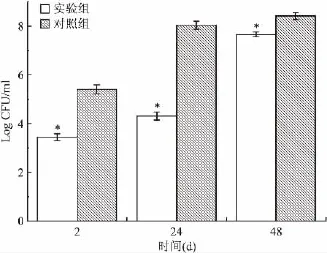
图4 菌落计数结果
3 讨论
牙菌斑生物膜是龋病和牙周病发生的主要因素之一。在牙菌斑生物膜的形成第一阶段是唾液蛋白在定植表面先形成获得性膜,其可作为中间界面介导随后细菌的黏附和定植。口腔链球菌是早期定植的先锋菌,其对于后续其它口腔细菌的定植具有重要的作用。变形链球菌被认为是口腔链球菌中最具有致龋性的,而与其致龋性相关的主要因素包括黏附、产酸性和耐酸性[8-9]。这些细菌能利用蔗糖合成葡聚糖,而葡聚糖可以介导变形链球菌和其它口腔细菌菌群对牙齿表面的黏附,促进牙齿生物膜的形成。在口腔生物膜中的致龋菌,可更多地利用碳水化合物进而增加pH降低的幅度以及釉质脱矿的概率,最终导致龋齿的形成。
然而目前还没有哪一种方法或材料能明确有效地预防龋病,常用来抑制口腔细菌生物膜方法都有其局限性。因此,寻求新的防龋措施非常必要。在其它的领域中,抑制细菌生物膜的一个比较热门和常用的方法就是构建“生物清污”界面。大自然中许多界面都具有自清洁功能,例如蝴蝶翅膀、苍蝇眼睛、荷叶及其它许多植物的枝叶。其中研究最多的是荷叶,其疏水性(θ>150°)是由于表面的双层微观结构。这种结构由微凸结构(乳突表皮细胞)浸没在大量密集的表面蜡质中而构成。正如其它拒水的植物一样,污染颗粒落在荷叶上被水滴带走。为了能够实现这种超疏水的自清洁过程,污染微粒在叶子的表面的黏附力要比水滴小,这种自洁现象被称为荷叶效应[10]。在过去二十年里,围绕这种超疏水自洁表面有大量的研究,人们在这一领域的研究中也取得了很大的进展,而且己经利用多种方法制备出了多种性能优异的超疏水性表面。采用物理、化学等方法来产生表面微细结构制备超疏水自洁表面的方法一般包含两个部分:一是在疏水材料基底上构建微细结构化表面结构,二是在微细结构化表面上修饰低表面能的物质[11]。
生物材料表面的化学组成、临界表面张力、界面能、表面亲水或疏水性、表面电荷等对细菌附着影响较大。如果能够在牙齿表面修饰上一层超疏水纳米膜,将能够有效阻止细菌与牙齿界面的接触,并可阻止酸性物质对牙齿硬组织的侵蚀,就能有效防止龋病的发生。有两种方式可以在牙齿界面形成较为致密的纳米单分子薄膜:一是利用脂肪酸的羟基和牙齿表面的钙离子通过静电相互作用结合在一起;另外一种是利用硅烷化链状有机分子与牙齿界面存在的水分子发生水解,并缩合形成较为致密的单分子,从而形成牢固结合[12]。如果应用超疏水型有机分子,由于单分子膜外部端链分子的高度疏水特性,表面静态接触角一般可以大于150度,这样能够使牙齿表面自由能大幅降低,阻止细菌黏附到牙齿表面。有研究[13]显示可以利用有机硅烷改性口腔正畸矫治器的表面来减少生物膜形成和促进其被机械清除。本实验采用十七氟癸基三甲氧基硅烷这种试剂来对牙釉质表面改性。这种硅烷化偶联剂的一侧端能与酸蚀后多孔的牙齿表面发生紧密结合,而另一侧端高度的疏水特性可使牙齿表面的自由能降低。一般而言,低黏附性表面都具有低表面能和疏水性的特点,故而在蛋白或者细菌等黏附时具有大的接触角[14]。同时,十七氟癸基三甲氧基硅烷中有碳氟化合物的存在,这可以改变有机硅烷的功能,并且在其应用于表面改性时,可赋予表面低滞留效应[15]。因此,这种硅烷化的表面可以抑制细菌对牙面的附着,影响菌斑的形成,进而减少了致病细菌的黏附数量,消除致龋的环境,从而有效预防龋病形成。在本实验中,微生物实验的结果可以表明至少在24 h内可以有效减少变形链球菌的黏附以及生物膜的形成。关于涂层性能稳定性方面的内容,还需要进一步研究。
综上所述,超疏水纳米膜在釉质表面形成涂层后,影响了致病细菌的黏附能力,这对于口腔微生态环境及防治龋病和牙周病等牙菌斑相关性疾病的发展都具有重要意义。
[1] Lazǎr V,Chifiriuc M C.Architecture and physiology of microbial biofilms[J].Roum Arch Microbiol Immunol,2010,69(2):95-107.
[2] Seneviratne C J,Zhang C F,Samaranayake L P.Dental plaque biofilm in oral health and disease[J].Chin J Dent Res,2011,14 (2):87-94.
[3] Struzycka I.The oral microbiome in dental caries[J].Pol J Microbiol,2014,63(2):127-35.
[4] Genco R J,Borgnakke W S.Risk factors for periodontal disease [J].Periodontol 2000,2013,62(1):59-94.
[5] Mawardi H H,Elbadawi L S,Sonis S T.Current understanding of the relationship between periodontal and systemic diseases[J].Saudi Med J,2015,36(2):150-8.
[6] Kalesinskas P,Kaêergius T,Ambrozaitis A,et al.Reducing dental plaque formation and caries development.A review of current methods and implications for novel pharmaceuticals[J].Stomatologija,2014,16(2):44-52.
[7] Prasanth M.Antimicrobial efficacy of different toothpastes and mouthrinses:an in vitro study[J].Dent Res J(Isfahan),2011,8 (2):85-94.
[8] Krzyšciak W,Jurczak A,Košcielniak D,et al.The virulence of Streptococcus mutans and the ability to form biofilms[J].Eur J Clin Microbiol Infect Dis,2014,33(4):499-515.
[9] 张红艳,董六一,杨 柳,等.天然植物黄蜀葵提取物对变形链球菌生长及产酸的抑制作用[J].安徽医科大学学报,2009,44 (4):479-81.
[10]Yu S,Guo Z,Liu W.Biomimetic transparent and superhydrophobic coatings:from nature and beyond nature[J].Chem Commun (Camb),2015,51(10):1775-94.
[11]莫春燕,郑燕升,王发龙,等.超疏水性生物表面及其仿生制备的研究进展[J].工程塑料应用,2015,43(1):124-8.
[12]Zhao H,Law K Y.Directional self-cleaning superoleophobic surface[J].Langmuir,2012,28(32):11812-8.
[13]Oliveira A S,Kaizer M R,Azevedo M S,et al.(Super)hydrophobic coating of orthodontic dental devicesand reduction of early oral biofilm retention[J].Biomed Mater,2015,10(8):329-38.
[14]Shirtcliffe N J,McHale G,Atherton S,et al.An introduction to super-hydrophobicity[J].Adv Colloid Interface Sci,2010,161(1 -2):124-38.
[15]Zanini S,Polissi A,Maccagni E A,et al.Development of antibacterial quaternary ammonium silane coatings on polyurethane catheters[J].J Colloid Interface Sci,2015,451:78-84.
The superhydrophobic enamel surface inhibition of mucin adsorption and bacterialadhesion
Yin Jiali,Tang Xuyan,Li Quanli,et al
(Stomatologic College of Anhui Medical University;Dept of Prosthetics,Affiliated Stomatological Hospital
of Anhui Medical University,Key Lab of Oral Diseases Research of Anhui Province,Hefei230032)
Objective To investigate the effect of superhydrophobic enamel surfacein salivary mucin adhesion and oral biofilm formation.Methods Bovine enamel blocks were prepared as specimens and they were randomly divided into two groups.The experimental group received(heptadecafluoro-1,1,2,2-tetradecyl)trimethoxysilane application,while the control group received deionized water application.The sample surfaces were detected by field emission scanning electron microscope(FE-SEM).Contact angles and salivary mucin absorption were measured.The morphological characteristics were observed by FE-SEM and oral biofilm formation inhibition on enamel disks was assessed by counting colony-forming units(CFU).Results The surface topographies of the experimental group and the control group were different according to the FE-SEM.And the contact angles of the experimental group were significantly bigger than the control group(P<0.05).The mucin absorbed by the experimental group was significantly less than the control group(P<0.05).Very few bacteria were found in the experimental group after 4 hours and 24 hours.While bacteria were widely distributed in the control group.After 48 hours bacteria growth,the surfaces were completely covered by biofilms in all samples.And the results of Log(CFU)were consistent with that. Conclusion Superhydrophobic surfaces can inhibit salivary mucin adhesion and oral biofilm formation.
plaque biofilm;superhydrophobic;enamel surface;salivary mucin;Streptococcus mutans
R 780.1
A
1000-1492(2016)09-1273-04
时间:2016-8-1 14:07
http://www.cnki.net/kcms/detail/34.1065.R.20160801.1407.018.html
2016-05-04接收
国家自然科学基金(编号:81571018、81400559)
安徽医科大学口腔医学院、安徽医科大学附属口腔医院修复科、安徽省口腔疾病研究中心实验室,合肥 230032
殷佳莉,女,硕士研究生;唐旭炎,男,副教授,副主任医师,硕士生导师,责任作者,E-mail:txy8302@hotmail.com;
李全利,男,教授,主任医师,硕士生导师,责任作者,E-mail:ql-li@126.com

