烟草中烟碱转化的遗传机理研究现状及展望
蔡长春,程玲,冯吉
湖北省烟草科学研究院,武汉 430030
综述
烟草中烟碱转化的遗传机理研究现状及展望
蔡长春,程玲,冯吉
湖北省烟草科学研究院,武汉 430030
介绍了普通烟草中烟碱向降烟碱转化的生物合成过程、遗传机理与NND基因的假基因化研究进展,系统整理和总结了烟草中5个细胞色素P450家族基因的特征特性,并对亚甲基四氢叶酸还原酶基因(Methylenetetrahydrofolate Reductase,MTHFR)间接调控烟碱转化过程进行了深入分析,同时分析了烟碱转化率在不同烟草类型间存在差异的原因及烟草生物碱谱进化的动力,最后结合中国烟草基因组计划对后续研究思路包括新基因挖掘与低烟碱转化烟草分子育种进行了讨论和展望。
烟草;烟碱转化;遗传机理;研究现状;展望
烟草中的生物碱是一类非常重要的化学成分,目前已鉴定的烟草生物碱有40多种[1],其中以烟碱(nicotine,俗称尼古丁)、降烟碱(nornicotine)、新烟碱(anatabine)和假木贼碱(anabasine)等4种为主[2],烟碱属于叔胺类生物碱,吡咯环被氧化断裂后才能发生亚硝化反应生成烟草特有亚硝胺(Tobacco-speci fi c Nitrosamines,TSNAs),其他三种属于仲胺类生物碱,可直接发生亚硝化反应生成TSNAs[3]。
烟草属中具有栽培价值的普通烟草(N. tabacum)和黄花烟草(N. rustica)均为烟碱积累型,烟碱占总生物碱含量的94%以上,降烟碱仅占2.5%~5%[4]。在栽培烟草群体中个别烟株因不稳定转化基因位点重新被激活而具备了烟碱去甲基化的能力,从而导致烟碱大量被转化为降烟碱,这个过程被称为烟碱转化(nicotine conversion),具备烟碱转化能力的烟株被称为转化株(converter)。就烟草类型而言,白肋烟和马里兰烟等晾烟的烟碱转化率显著高于烤烟,其原因与调制方式和转化位点的数量及稳定性有关[5]。
降烟碱易于在调制和陈化等过程中在微生物作用下与亚硝酸盐发生亚硝化反应而生成TSNAs,降烟碱与TSNAs的产生水平呈显著正相关关系[6]。动物医学试验表明[3,7-10],目前已鉴定出8种TSNAs,其中亚硝基去甲基尼古丁(Nitrosonornicotine,NNN)和4-甲基亚硝氨基-1-3-吡啶-1-丁酮(4-N-methylnitrosamino-1-3-pyridyl-1-butanone,NNK)对啮齿类动物具有强致癌性,且后者活性大于前者[11],另外,降烟碱本身还可导致吸烟者血液中蛋白质的异常糖基化而影响人体健康[12]。国际癌症组织(International Agency of Research on Cancer,IARC)已将NNN和NNK列为一级人体致癌物。此外,降烟碱还会影响烟叶的外观质量[13-14]和香味品质[15-16],降低烟叶使用价值。
在全球性禁烟运动此起彼伏的大背景下,降低烟草有害成分如TSNAs含量以提高卷烟安全性已成为各国烟草企业及科研机构的关注焦点[17]。相比于栽培、生化调控等措施,品种选育和改良被认为是降低烟草降烟碱和TSNAs含量最有效的手段,目前已对骨干亲本和主栽品种进行了大量的有效改良[18-21]。剖析烟碱转化过程的遗传控制机理是培育低危害烟草新品种的重要前提和基础。
本文详细介绍了烟草中烟碱向降烟碱转化的生物合成过程与遗传机理研究进展,重点总结了5个P450家族基因与亚甲基四氢叶酸还原酶基因(MTHFR)对烟碱转化的影响,并结合中国烟草基因组计划(China Tobacco Genome Initiative,CTGI)展望了下一步研究思路,这对于全面深入了解烟碱转化现象、开发减害烟草新材料及促进行业健康发展意义重大。
1 烟碱转化的生物合成过程
烟碱转化是烟草体内非常重要的次生代谢反应之一。20世纪40年代,Dawson[22]研究发现,耳状烟草(N.otophora)和绒毛状烟草(N. tomentosformis)中的降烟碱来源于烟碱的去甲基化。烟草-番茄嫁接试验表明[23],烟叶是烟碱转化的主要场所,调制和陈化过程则是烟碱转化发生的集中时间段。确切的研究表明,烟碱转化过程主要是一个酶促氧化去甲基化过程,其中关键的酶是烟碱去甲基化酶(nicotine N-demethylase,NND),它催化了烟碱去甲基向降烟碱的转化[24-25]。这个过程可简化为:烟碱分子上的N’-甲基在NND酶和P450氧化酶的联合作用下发生氧化反应从而被去掉,生成不稳定的衍生物羟基化烟碱,自然分解后生成甲醛和去甲基烟碱,此过程不涉及吡咯环开环事件,也没有生成其他中间产物。
2008年,Chakrabarti等[26]研究认为,烟叶衰老是影响烟碱转化的最主要诱导因素,其次是乙烯处理和烟草花叶病毒(Tobacco Mosaic Virus,TMV)。烟碱转化主要发生在烟叶收获后调制开始的前3周,但随着烟叶细胞的逐渐死亡,烟碱去甲基化酶活性逐渐减弱,烟碱转化反应则逐渐中止[27]。团棵期使用乙烯处理新鲜烟叶可诱导转化关键基因CYP82E4(CYP即Cytochrome P450 proteins)的高表达,促进烟碱大量被转化[28]。
2 烟碱转化的遗传机理研究
目前烟草属中60%左右的种属于烟碱积累型,30%~40%的种属于降烟碱积累型,如林烟草(N.sylvestris)、绒毛状烟草(N. tomentosformis)和耳状烟草(N. otophora)[29]。普通烟草是林烟草和绒毛状烟草杂交后自然加倍形成的异源四倍体。在烟草栽培历史中,人工选择不具备烟碱转化能力的普通烟草突变体进行栽培利用,经过长期定向选择和驯化,普通烟草进化成烟碱积累型。但在烟草群体中,由于基因突变使得某些烟株具备了烟碱去甲基化的能力,其中白肋烟的转化现象比烤烟更普遍和严重[5]。
1955年Griffith等[30]根据育种实践首次提出烟碱转化属于简单遗传现象,受1个或2个显性基因位点控制。现代基因组学研究表明[29],烟草中P450基因家族的基因在基因组上呈串联排列状态,发生共分离的概率较高,为烟碱转化现象呈现简单遗传现象提供了证据。Mann和Webrew[31]研究发现分别来自林烟草和绒毛状烟草中的两个显性基因位点CS和CT控制着烟碱转化过程,其中CT更为活跃,它的突变率可高达14%,因而更易导致降烟碱的形成。1968年Wernsman等[32]研究表明,CT能引起烟叶衰老前烟碱向降烟碱转化,而CS能引起衰老过程中烟碱的转化。有研究认为,含有控制烟碱转化关键等位基因ctct、CT ct及CTCT的试验烟株的烟叶中降烟碱占总烟碱的比例平均分别为3%~9%、17%~51%与73%~94%[27]。
另外,对于烟草中烟碱转化性状的遗传稳定性研究表明[5],高转化性状较为稳定,而低转化性状易发生突变,有学者认为这是由烟碱转化关键基因不稳定突变所致,也有学者认为转座因子可能参与了烟碱转化过程。
3 烟碱转化相关基因的研究进展
有研究学者通过试验推测[22],烟碱转化过程中可能存在着一个至关重要的烟碱去甲基化酶,但由于该酶属于液泡膜镶嵌蛋白,离体后极不稳定,难以通过纯化获得,直到1993年,Hao和Yeoman[24]在烟草悬浮细胞中证明了这种酶的存在。对烟碱去甲基化酶的特征研究显示[5],它属于细胞色素P450单加氧酶家族成员。
尽管烟草是细胞遗传学的模式植物,但因其基因组巨大(4.5G)且属异源四倍体而导致其分子生物学研究远落后于其他模式植物。2002年,美国菲利普-莫里斯烟草公司向美国北卡罗来纳州立大学支持研究经费1760万美元,计划花四年半时间获得90%的烟草全基因组序列,到2007年美国只完成了烟草基因组计划的部分任务,有保留的向公共数据库提交了烟草基因组数据,后续测序工作也未见公开报道。2010年,中国启动了烟草基因组计划,2013年底顺利完成两个野生祖先种林烟草和绒毛状烟草及栽培种红花大金元的全基因组测序,这些烟草基因组数据的获得对于分离克隆与烟碱转化相关的基因、剖析烟碱转化过程及遗传机理提供了强有力的支撑。
利用国际公共数据库Genbank所公布的烟草表达序列标签(Expressed Sequence Tag, EST)数据,2005年到2010年间,以美国北卡罗来纳州立大学和肯塔基大学为主的研究机构相继分离和鉴定了与烟碱转化密切相关的五个基因(表1):CYP82E2[29]、CYP82E3[33]、CYP82E4v1[28]、CYP82E5v2[34]和CYP82E10[35],其中CYP82E5v2在鲜叶中特异表达,CYP82E10在根部特异表达,CYP82E4v1主要在衰老叶片中表达,是烟碱转化的关键基因,这些基因之间具备高度的同源性(表2)。另外,2013年发现一个亚甲基四氢叶酸还原酶基因(MTHFR1),通过负调控CYP82E4v1基因的表达水平来影响烟碱向降烟碱的转化[36]。下面对这些基因或酶的来源、特征与功能及NND基因的假基因化进行逐一分述。
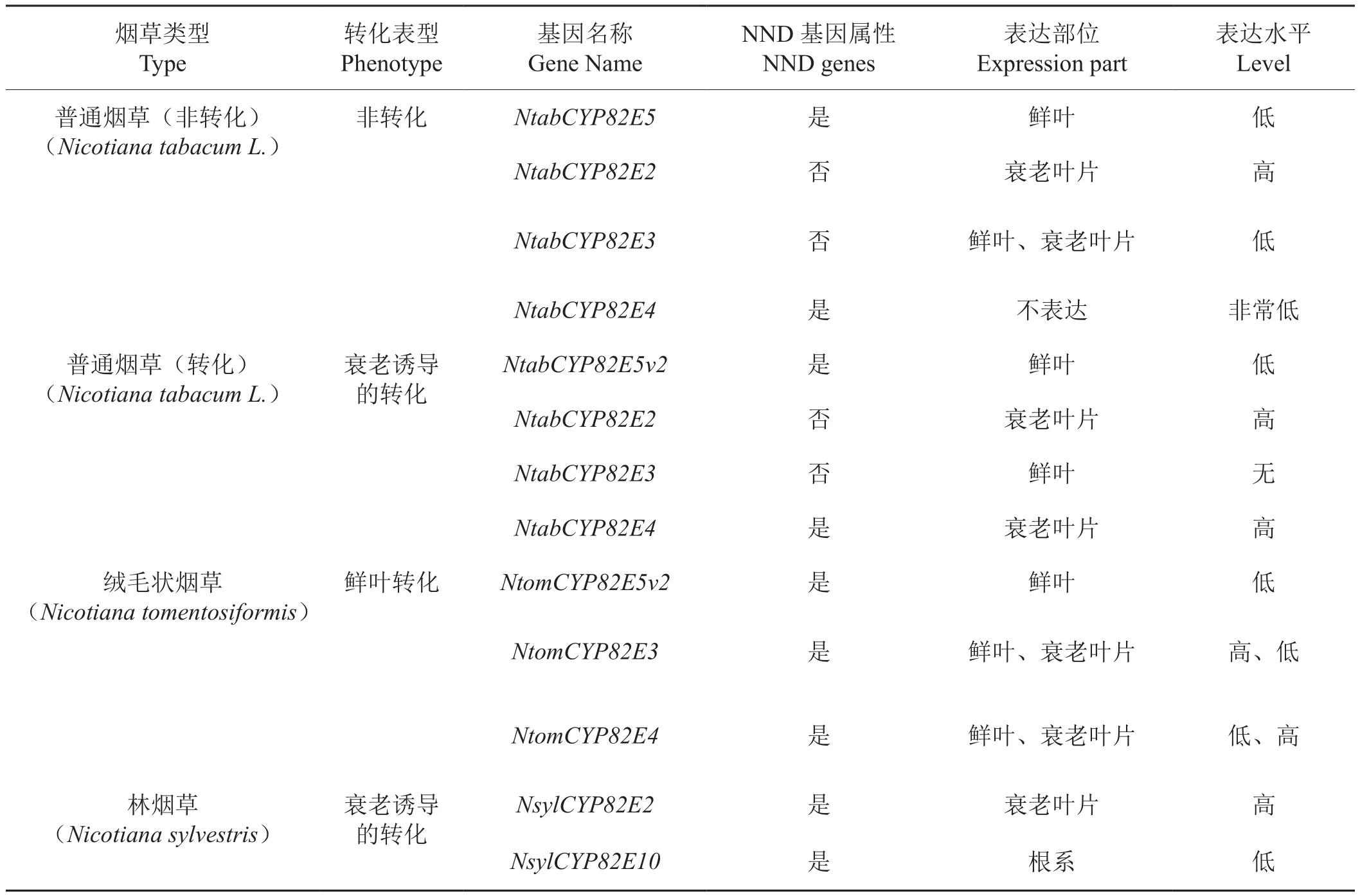
表1 烟草中已被鉴定和特征分析的调控烟碱转化的基因Tab. 1 The identi fi ed and characterized genes mediating nicotine-to-nornicotine conversion in tobacco
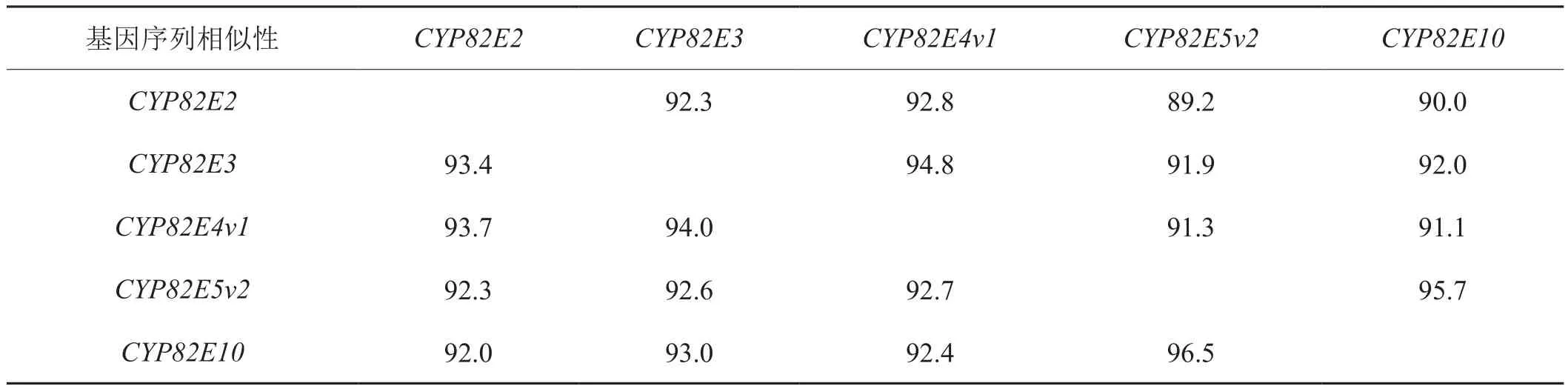
表2 烟草中烟碱转化基因之间的序列相似性Tab. 2 Sequence identity among genes mediating nicotine-to-nornicotine conversion in tobacco %
3.1 CYP82E2
CYP82E2和CYP82E3是CYP82E2基因家族中最先通过微列阵芯片杂交技术被鉴定的基因[28],但在普通烟草中,这两个基因发生了替换突变从而丧失了催化烟碱向降烟碱转化的能力。2007年,Chakrabarti等[29]从林烟草和普通烟草cDNA(complementary DNA)文库中分别特异扩增获得两个序列相似性高达99.8%的P450基因,这两个扩增基因分别命名为NsylCYP82E2(Nsyl代表林烟草,下同)和NtabCYP82E2(Ntab代表普通烟草,下同),而没有从绒毛状烟草中获得扩增产物,说明该基因来源于林烟草。同源序列比较显示,NsylCYP82E2与NtabCYP82E3和NtabCYP82E4的编码区均具备94%的相似性,氨基酸的相似性分别为92.7%和93.4%。DNA序列比对结果表明,NsylCYP82E2与NtabCYP82E2只在基因组序列第1123位、1243位和1265位存在3个碱基差异,其中第1123位和1265位的碱基差异分别导致第375位氨基酸(NsylCYP82E2为谷氨酸,NtabCYP82E2为赖氨酸)和422位氨基酸(NsylCYP82E2为色氨酸,NtabCYP82E2为亮氨酸)存在差异,分别被命名为E375K和W420L替换突变,它们是这两个同源基因所编码的NND酶活性存在差异的关键原因。而第1243位的碱基替换属于无义突变,不影响NND酶活性。定点诱变和酵母异源表达试验揭示,这两个突变中的任何一个均可导致NsylCYP82E2编码的NND酶活性消失。换言之,NsylCYP82E2编码一个有功能的NND酶,其活性受控于这两个基因位点,而NtabCYP82E2编码的NND酶活性消失恰是因为进化过程中发生了这两个碱基替换突变事件。RT-PCR(Reverse Transcription-Polymerase Chain Reaction)试验表明,鲜叶中NsylCYP82E2和NtabCYP82E2的表达均较低,但在晾制后烟叶中表达急剧上升,其中林烟草中上升幅度最大,由此推断,NsylCYP82E2属于衰老诱导型NND基因,而NtabCYP82E2虽然在晾制后烟叶中高表达,但它的表达与烟碱转化无关而不属于NND基因。等位基因特异PCR分析将NsylCYP82E2定位于CS转化位点所在的基因组区域内。综上所述,这两个氨基酸的替换突变是现代烟草生物碱谱进化过程中的关键事件。
3.2 CYP82E3
该基因是2005年由Siminszky等[28]最先从普通烟草中鉴定出来的CYP82E2基因家族成员之一,虽然在普通烟草中NtabCYP82E3与NtabCYP82E4氨基酸序列相似性高达94.8%(核苷酸序列相似性为94.0%)(表2),但NtabCYP82E3并非NND基因。2007年,肯塔基大学的Gavilano等[34]采用特异同源PCR扩增证明了CYP82E3来源于绒毛状烟草。利用NtabCYP82E3与NtabCYP82E4序列的高度相似性,采用片段替换、定点诱变和酵母表达等技术鉴定了NtabCYP82E3核苷酸序列第900处的碱基C到G的替换(即氨基酸第330处色氨酸到半胱氨酸的替换,命名为W330C突变),这是NtabCYP82E3所编码的NND酶活性丧失的关键原因,而其他基因位点的差异与NND酶活性无关。酵母异源表达试验证明,绒毛状烟草中的NtomCYP82E3(Ntom代表绒毛状烟草,下同)和NtomCYP82E4均编码有活性的NND酶,分别在鲜叶和衰老叶片中高表达。序列分析表明,NtomCYP82E3与NtabCYP82E3关键的W330C突变导致了NND酶活性差异,而NtomCYP82E4与NtabCYP82E4仅有的两个碱基差异没有导致NND酶活性改变。综上所述,NtabCYP82E3的W330C替换突变造成NND酶活性的丧失是在CYP82E2发生两个碱基替换突变导致烟草NND酶活性改变之后的又一类似进化事件,这对于现代烟草生物碱谱的形成同样意义重大。
3.3 CYP82E4
2005年,Siminszky等[28]采用以cDNA微阵列芯片技术为核心的分析策略,比较白肋烟高转化和非转化烟草衰老叶片中的基因差异表达,成功鉴定出6个与细胞色素P450基因家族同源的基因,被命名为CYP82E2家族,彼此之间的同源性均超过了90%(表2),其中3个成员高度同源,即NtabCYP82E2、NtabCYP82E3和NtabCYP82E4(又分v1和v2两种亚型,实际上为同一基因),NtabCYP82E4v1与NtabCYP82E2和NtabCYP82E3核苷酸序列的同源性分别为92.8%和94.8%。转录表达分析表明,这3个基因在高烟碱转化烟草中的转录量是非转化烟草中的2倍。RNAi(Ribonucleic Acid interference)干扰试验和转基因试验表明,只有NtabCYP82E4v1编码有活性的NND酶,因此该基因被鉴定为烟碱转化过程中的关键基因。同时也证明了NtabCYP82E4v1基因本身编码NND酶,而不是编码NND酶上游的调控因子。另外,2008年Chakrabarti等[26]的研究表明,烟草中CYP82E4基因对烟碱转化过程的调控受一个衰老特异的信号诱导途径控制,它的转录表达仅受非生物处理如晾制和生物处理如乙烯、TMV(Tobacco Mosaic Virus)病毒侵染等导致烟叶衰老的处理影响。
3.4 CYP82E5v2
2007年,Gavilano等[34]根据CYP82E3基因保守区域序列设计特异引物从普通烟草鲜叶cDNA文库中扩增出一个不同用于所有已鉴定的CYP82E2基因家族序列的基因,被命名为NtabCYP82E5v2,它与NtabCYP82E2、NtabCYP82E3及NtabCYP82E4的 核苷酸序列相似性分别为92.3%、92.6%及92.7%,氨基酸序列相似性分别为89.2%、91.9%及91.3%(表2)。特异引物扩增试验表明CYP82E5v2来源于绒毛状烟草。酵母异源表达试验证明该基因编码有活性的NND酶。采用RT-PCR分析了CYP82E5v2的表达模式,结果表明,在鲜叶中CYP82E5v2的转录水平显著高于CYP82E4v1,在晾制后烟叶中,情况恰好相反。CYP82E5v2基因在鲜叶特异表达,但它在烟草鲜叶和衰老烟叶中的表达水平均较低,远低于CYP82E4v1在衰老叶片中的表达水平,因此,CYP82E5v2只是烟碱转化的次要基因。
3.5 CYP82E10
2010年,Lewis等[35]发现白肋烟高烟碱转化品种 DH98-325-6(DH 即 Doubled Haploid) 的 RNAi(沉默NtabCYP82E4v1基因)转基因烟株的烟碱转化率(0.7%)远低于其NtabCYP82E4v1单突变株转化率(2.6%)或NtabCYP82E4v1和NtabCYP82E5v2的纯合双突变株转化率(2.3%),由此推测,烟草中可能存在与NtabCYP82E4v1同源的其他NND基因在RNAi过程中也被同源沉默了。为此,研究人员以NtabCYP82E4v1基因的核苷酸和蛋白质序列为搜索序列,对Genbank中的烟草EST数据库进行了BLASTN(The Basic Local Alignment Search Tool Nucleotide)和BLASTX(The Basic Local Alignment Search Tool X)搜索比对,发现有7个来自于烟草根部cDNA文库中的EST(Expressed Sequence Tags)序列与之前鉴定的其他NND基因序列存在差异,且该基因优先在根部表达,这也是之前一直未被发现的原因,获得该基因全长序列后被命名为NtabCYP82E10,与NtabCYP82E4v1和NtabCYP82E5v2的核酸序列相似性分别为92.4%和96.5%(表2)。通过NtabCYP82E10特异引物扩增试验证明了该基因来源于林烟草,但NtabCYP82E10也只是影响烟碱转化的次要基因。
3.6 MTHFR
MTHFR(亚甲基四氢叶酸还原酶)是由四氢叶酸酯(Tetrahydrofolate,THF)所调控的C1(one-carbon)代谢途径的关键酶,它催化着5,10-亚甲基-四氢叶酸酯还原为5-甲基-四氢叶酸酯,而后者可将其甲基贡献给同型半胱氨酸,形成甲硫氨酸(Methionine,Met),用于腺苷蛋氨酸(S-adenosyl-L-methionine,SAM)的合成,SAM是一个大多数甲基化反应的甲基供体,比如烟碱的生物合成。2013年,Hung等[36]根据拟南芥、玉米和水稻的MTHFR基因保守区域设计特异引物获得烟草MTHFR基因全长。序列比对揭示,普通烟草中存在NtMTHFR1和NtMTHFR2两个同源基因,二者核苷酸序列相差4%,同源性检测证明,NtMTHFR1来源于林烟草,NtMTHFR2来源于绒毛状烟草。超表达试验和RNAi敲除试验表明,在超表达NtMTHFR1基因烟草中,NtMTHFR1的表达水平比对照增加2~3倍,而CYP82E4的表达水平却比对照减少了4~8倍,烟碱转化率比对照减少20%~40%,降烟碱含量比对照减少25%~50%。而在敲除NtMTHFR1基因烟草中,NtMTHFR1的表达比对照减少了3~8倍,CYP82E4的表达受到强烈的上调诱导,其转录水平却比对照高出达700倍之多,烟碱转化率显著高于对照,降烟碱含量却比对照增加40%~400%。这充分表明,NtMTHFR1稳定负调控着CYP82E4基因的表达,进而影响烟碱向降烟碱的转化。但乙烯产量试验表明,敲除NtMTHFR1基因的烟草鲜叶中CYP82E4基因的高诱导表达可能并非由衰老信号引发。本研究推测出一种甲基供给的调控机制:由MTHFR催化的生化反应最终的目的是要产生大量的甲基以促进初级和次级代谢产物的生成,当NtMTHFR1基因被超表达时,可催化5,10-亚甲基-四氢叶酸酯还原为5-甲基-四氢叶酸酯,将产生的甲基贡献给同型半胱氨酸合成甲硫氨酸,继续合成作为甲基供体的腺苷蛋氨酸,生成的甲基进入C1代谢途径合成初级和次级代谢物如烟碱,为保持甲基供应的平衡,抑制了烟碱去甲基化的转化关键基因CYP82E4的表达;相反,当NtMTHFR1基因表达被抑制时,甲基供体腺苷蛋氨酸合成受到抑制,导致甲基供应不足,因此,CYP82E4基因被上调诱导,强烈促进烟碱向降烟碱转化,产生大量甲基,进入C1途径生产初级和次级代谢产物。
3.7 NND基因的假基因化
2012年,Pakdeechanuan等[37]根据CYP82E基因的保守区序列设计引物从花烟草(N. alata)和蓝格斯多夫烟草(N. langsdorffii)分别获得四个CYP82E基因:NalaCYP82E1、NalaCYP82E2、NalaCYP82E3和NalaCYP82E4和两个CYP82E基因:NlanCYP82E1和NlanCYP82E2。这六个CYP82E基因编码的蛋白质序列与普通烟草、林烟草和绒毛状烟草CYP82E基因编码的蛋白质序列高度相似。内含子位置与普通烟草的CYP82E4和林烟草的CYP82E2的内含子位置完全一致,只是长度存在差别而已,其中NlanCYP82E2核苷酸序列第一个外显子第345处发生了一个碱基删除,导致编码的氨基酸发生移框突变,最终导致一个截断的CYP82E蛋白质(翻译提前终止),从而失去NND酶活性,最终无法催化烟碱形成降烟碱,如果把碱基C插入删除位置,那么恢复的氨基酸序列与花烟草和蓝格斯多夫烟草的CYP82E蛋白质高度相似。酵母表达试验表明,花烟草四个CYP82E基因和蓝格斯多夫烟草的NlanCYP82E1均能催化烟碱向降烟碱的转化,属于NND基因,NlanCYP82E1基因由于顺式作用激活缺陷而没有在蓝格斯多夫烟草和F1代中检测到表达,而NlanCYP82E2提前终止翻译仅获得截断的不具备NND酶活性的不完整蛋白质,均导致蓝格斯多夫烟草最终没有合成降烟碱。而花烟草四个NND基因均在其根部表达。基因型与表型分离试验表明,这些NND基因在烟草染色体上呈遗传连锁分布,彼此相距较近。NlanCYP82E1基因失活的机制不同于CYP82E4基因的转录失活机制,前者的失活是稳定的,且不是由多倍化所导致,它失活的原因可能是NlanCYP82E1基因启动子上关键转录因子结合位点的丢失导致顺式失活,后者的失活是不稳定的,极易被重新激活具备编码有活性NND酶的能力,这为揭示CYP82E4基因的失活机制及高频率的回复突变提供了科学依据。
4 讨论和展望
本综述系统介绍了烟草中烟碱向降烟碱转化的生物合成过程、遗传机理及五个CYP82E2家族基因与MTHFR基因控制烟碱转化的分子机理及NND基因的假基因化影响,对于深入了解烟草生物碱谱进化改变与开展精准分子设计育种,培育减害烟草新品种具有较强的指导作用,也为后续深入挖掘影响烟碱转化的新基因最终构建完整的烟碱代谢网络奠定了坚实基础。
4.1 烟草生物碱谱的进化与关键基因的突变
已有的研究表明,自然界中大约有20%的植物能够产生生物碱,它对于植物的自我防御与人类的健康是不可或缺的[35-36,38-41]。普通烟草的祖先种绒毛状烟草和林烟草均为降烟碱积累型,而普通烟草属于烟碱积累型。这种生物碱谱改变的进化动力存在两种可能:一种是自然选择或者自然突变。毒理学研究表明[42],烟碱比降烟碱具备更强的杀虫能力与对食草动物更大的毒性,因此,在自然选择压力下,控制烟碱转化的基因发生了自然突变导致NND酶活性丧失,如CYP82E2基因的E375K与W420L替换突变、CYP82E3基因的W330C替换突变与CYP82E4基因的不稳定突变等,这是烟草适应环境而做出的自我防御反应。另一种可能是人工选择的结果[32]。低转化株的烟叶比高转化株具备更好的吸食品质,导致人类在长期的烟草栽培历史中偏向性筛选烟碱含量高的突变株进行大面积种植,而高转化株逐渐被淘汰掉,尽管因不稳定转化基因位点的回复突变而始终存在少量的高转化株,但现代烟草已进化为烟碱积累型。这两种进化途径极有可能不是孤立的,而应是同时存在共同推进了烟草生物碱谱的进化改变,不过,精确的结论仍有待未来研究的继续深入。
4.2 烤烟与白肋烟烟碱转化率的差异分析
不同烟草类型间的烟碱转化率存在较大差异[43],比如白肋烟群体中一般转化株占15%~20%的比例,转化率可高达90%以上,而烤烟的转化率一般在3%以下,推测产生这种差异的可能原因主要有三[34]:一是烟碱转化基因如CYP82E4在烤烟中的稳定性高于白肋烟;二是烟碱转化基因在白肋烟与烤烟中存在数量上的差异;三是调制方式的差异影响了烟碱转化基因的转录表达水平与NND酶活性差异。
4.3 烟草中降烟碱的合成途径
迄今为止,已分离和鉴定出烟草中影响烟碱转化的五个基因:CYP82E2、CYP82E3、CYP82E4v1、CYP82E5v2与CYP82E10,均属于P450家族基因,其中CYP82E2与CYP82E10来源于林烟草,其他三个基因来源于绒毛状烟草,CYP82E5v2在鲜叶中特异表达,CYP82E10在根部特异表达,普通烟草中的CYP82E2与CYP82E3因发生了替换突变从而导致编码的NND酶活性丧失,CYP82E4v1是烟碱转化过程中的关键基因,CYP82E5v2与CYP82E10仅起次要作用。另外,在烟草中鉴定了一个NtMTHFR1基因[36],该基因来源于林烟草,稳定负调控CYP82E4基因的表达,进而影响烟碱转化过程。但三基因敲除纯合突变株(e4e4/e5e5/e10e10)的烟碱转化率仍有0.5%~0.7%[35],这说明烟草中存在促使降烟碱合成的其他因子或途径。2007年Heim等[44]同源克隆和特征分析了烟草根部表达烟碱合成代谢途径中的关键基因:甲基腐胺氧化酶基因(MPO),MPO蛋白质的动力学属性试验表明,MPO蛋白质在非特异性情况下可利用腐胺和尸胺分别合成降烟碱和假木贼碱,这是目前发现的降烟碱可由除烟碱之外的其他物质合成的新途径,这也较好的解释了三突变体(e4e4/e5e5/e10e10)仍然会有少量降烟碱存在的现象。
4.4 中国烟草基因组计划与分子育种展望
已完成烟草全基因组测序的中国烟草基因组计划(即将公开数据)不仅可以挖掘其他潜在的新烟碱转化基因,更能为解析烟碱合成代谢整个网络提供强有力的基因数据支撑。本文采用以上基因标记对高转化与低转化的白肋烟近等基因系烟草材料进行了基因组与表达谱检测,初步结果表明,可能存在1个以上不同于以上烟碱转化基因的新位点(数据未公开),准确结论有待后续的测序与分析工作的完成。2012年,李丹丹等[45]针对CYP82E4v1的截断突变开发出4个 dCAPS(derived Cleaved amplified Polymorphic Sequence)标记、CYP82E5v2的截断突变开发出一个dCAPS标记和CYP82E10的错义突变开发出两个CAPS(Cleaved ampli fi ed Polymorphic Sequence)标记,其中来源于CYP82E4v1的dCAPs标记E4D1标记具有较高的育种价值,不仅可有效区分杂合体与纯合体,而且能从海量的EMS诱变株中准确筛选出稳定的多基因突变纯合低烟碱转化品系,大大提高了育种工作的精确度与效率。这些与烟碱转化过程密切相关的基因的分离、鉴定与特征分析大大有利于开发分子标记,进而开展非转基因的分子育种以选育低烟碱转化的减害烟草新品种,对降低烟草危害具有重大的经济和社会意义。
[1]安佰义,席景会,杨朔,等. 烟草去甲基尼古丁产生的机理[J]. 植物学通报,2007,24(4):544-552.AN Baiyi, XI Jinghui, YANG Shuo, et al. Mechanism of nicotine N-demethylation to nornicotine in tobacco [J].Chinese Bulletin of Botany, 2007, 24(4): 544-552.
[2]Leete E. Biosynthesis and metabolism of the tobacco alkaloids[M]. In: pelletier S, ed. Alkaloids: Chemical and Biological Perspective. Chichester: John Wiley and Sons.1983:85-152.
[3]Hecht S S. Biochemistry, biology, and carcinogenicity of tobacco-specific N-nitrosamines [J]. Chem Res Toxicol,1998, 11: 559-603.
[4] 史宏志,张建勋. 烟草生物碱[M]. 北京:中国农业出版社,2004:45-56.SHI Hongzhi, ZHANG Jianxun. Alkaloids in tobacco[M].Beijing: China Agriculture Press, 2004:45-56.
[5]Balazs Siminszcky, Ralph E Dewey. 烟碱转化为去甲基烟碱的原理研究与遗传资源开发[J]. 中国烟草学报,2006,12(4):65-66.Balazs Siminszcky, Ralph E Dewey. Developing a genomic resource for elucidating the mechanism of nicotine to nornicotine conversion[J]. Acta Tabacaria Sinica, 2006,12(4): 65-66.
[6]Bush L P, Cui Mingwu, Shi Hongzhi, et al. Formation of tobacco-specific nitrosamines in air-cured tobacco[C]. The 55th Tobacco Science Research Conference, 2006, 23-46.
[7]Hecht S S. Tobacco carcinogens, their biomarkers and tobacco-induced cancer [J]. Nat Rev Cancer, 2003, 3:733-744.
[8]Boyland E, Roe F J, Gorrod J W. Induction of pulmonary tumors in mice by nitrosonornicotine, a possible constituent of tobacco smoke [J]. Nature, 1964, 202: 1126.
[9]Maser E. Signi fi cance of reductases in the detoxi fi cation of the tobacco-speci fi c carcinogen NNK [J]. Trends Pharmacol Sci, 2004, 25: 235-237.
[10]K El-Bayouny, Iatropoulos M, Amin S, et al. Increased expression of cyclooxygenase in rat lungtumors induced by the tobacco specific nitrosamines 4 –( methylnitrosamino)-4-( 3-pyridyl)-1-butanone: the impact of a high-fat diet[J].Cancer Research, 1999, 59: 1400-1403.
[11]Hecht S S, Chen C B, Hoffmann D. Tobacco-specific nitrosamines: occurrence, formation, carcinogenicity and metabolism [J]. J Am Chem Soc, 1979,12: 92-98.
[12]Dickerson F J, Janda K D. Glycation of the amyloid β-protein by a nicotine metabolite: a fortuitous chemical dynamic between smoking and Alzheimer’s disease [J]. Proc Natl Acad Sci USA, 2002, 99: 15084-15088.
[13]Je ff ery R N, Tso T C. Qualitative di ff erences in the alkaloid fraction of cured tobacco [J]. J Agric Food Chem, 1955,3:680.
[14]Weybrew J A, Mann T J, Moor E L. Nicotine conversion and cherry redness [J]. Tob Sci, 1960, 4: 190-193.
[15]Roberts D L. Natural tobacco fl avor [J]. Recent Adv. Tob Sci,1988, 14: 49-51.
[16]史宏志,李进平,Bush L P,等. 烟碱转化率与卷烟感官评吸品质和烟气TSNA含量的关系[J]. 中国烟草学报,2005,(2):9-14.SHI Hongzhi, LI Jinping, Bush L P, et al. Relationship of percent nicotine conversion with sensory evaluation scores and TSNA contents in cut tobacco and cigarette smoke[J].Acta Tabacaria Sinica, 2005,(2): 9-14.
[17]Brandy Fisher. Reducing Risk [J]. Tobacco Reporter, 2000,(6): 56-61.
[18]史宏志,李进平,李宗平,等. 白肋烟杂交种烟碱转化性状的改良[J]. 河南农业大学学报,2007,41(1):21-24.SHI Hongzhi, LI Jinping, LI Zongping, et al. Improvement of the trait of nicotine conversion in burley tobacco hybrid [J].Journal of Henan Agricutural University, 2007, 41(1): 21-24.
[19]孙红恋,周海燕,王瑞云,等. 基于不同烟碱转化株鉴别标准的白肋烟品种改良效果[J]. 中国烟草学报,2014,20(3):56-62.SUN Honglian, ZHOU Haiyan, WANG Ruiyun, et al.Improvement e ff ect of burley varieties based on identi fi cation standard of different nicotine converter [J]. Acta Tabacaria Sinica, 2014, 20(3):56-62.
[20]史宏志,李超,杨兴友,等. 四川白肋烟亲本改良及低烟碱转化杂交种的增质减害效果[J]. 中国烟草学报,2010,16(4):24-29.SHI Hongzhi, LI Chao, YANG Xingyou, et al. Improvement for hybrid parents and the quality enhancing and harm reducing e ff ect of low nicotine conversion hybrids in burley tobacco in Sicuan [J]. Acta Tabacaria Sinica, 2010, 16(4):24-29.
[21]史宏志,李进平,李宗平,等. 遗传改良降低白肋烟杂交种烟碱转化率研究[J]. 中国农业科学,2007,40(1):153-160.SHI Hongzhi, LI Jinping, LI Zongping, et al. Study on decreasing nicotine conversion in Chinese burley hybrid through genetic improvement [J]. Scientia Agricultura Sinica,2007, 40(1):153-160.
[22]Dawson R F. On the biosynthesis of nornicotine and anabasine [J]. J Am Chem Soc, 1945, 67: 503-504.
[23]左天觉. 烟草的生产、生理和生物化学[M]. 朱尊权,等译.上海:上海远东出版社,1993:306-352.ZUO Tianjue. Production, physiology and biochemistry of tobacco[M]. Translated by Zhu Zunquan, et al. Shanghai:Shanghai Far-East Press,1993:306-352.
[24]Hao D Y, Yeoman M M. Bioconversion of added (-)-nicotine to (-)-nornicotine by cell suspension cultures ofNicotiana tabacumL. cv. ‘Wisconsin-38’ [C]. In: Richard L, ed.Abstract and Poster Proceedings of the 15th International Botanical Congress. New York: Plenum Press, 1993, 4037-4369.
[25]Hao D Y, Yeoman M M. Nicotine N-demethylase in cell-free preparations from tobacco cell cultures [J]. Phytochemistry,1996b, 42: 325-329.
[26]Manohar Chakrabarti, Steven W Bowen, Nicholas P Coleman, et al.CYP82E4-mediated nicotine to nornicotine conversion in tobacco is regulated by a senescence-speci fi c signaling pathway [J]. Plant Mol Biol, 2008, 66: 415-427.
[27]史宏志. 烟草中烟碱向降烟碱转化的研究进展[J]. 烟草科技,2004(11):17-22.SHI Hongzhi. Advance in nicotine to nornicotine conversion in tobacco [J]. Tob Sci Tec, 2004, 11: 17-22.
[28]Balazs Siminszky, Lily Gavilano, Steven W Bowen, et al.Conversion of nicotine to nornicotine inNicotianatobacumis mediated by CYP82E4, a cytochrome P450 monooxygenase[J]. Proc Natl Acad Sci USA, 2005, 102 (41): 14919-14924.
[29]Manohar Chakrabarti, Karen M Meekins, Lily Gavilano, et al. Inactivation of the cytochrome P450 geneCYP82E2by degenerative mutations was a key event in the evolution of the alkaloid pro fi le of modern tobacco [J]. New Phytologist,2007, 175: 565-574.
[30]Griffith R B, Valleu W D, Stokes G W. Demethylation and inheritance of nicotine to nornicotine conversion in tobacco[J]. Science, 1955, 121: 343-344.
[31]Mann T J, Webrew J A. Inheritance of alkaloids in hybrids between flue-cured tobacco and related amphidiploids [J].Tobacco Science, 1958, 2: 29-34.
[32]Wernsman E A, Mazinger D F. Time and site of nicotine conversion in tobacco [J]. Tobacco Science, 1968, 12: 226-228.
[33]Lily B Gavilano, Nicholas P Coleman, Steven W Bowen, et al. Functional analysis of nicotine demethylase genes reveals insights into the evolution of modern tobacco [J]. Journal of Biological Chemistry, 2007, 282 (1): 249-256.
[34]Lily B Gavilano, Balazs Siminszky. Isolation and characterization of the cytochrome P450 geneCYP82E5v2that mediates nicotine to nornicotine conversion in the green leaves of tobacco [J]. Plant Cell Physiol, 2007, 48 (11): 1567-1574.
[35]Ramsey S Lewis, Steven W Bowen, Matthew R Keogh, et al. Three nicotine demethylase genes mediate nornicotine biosynthesis inNicotianatabacumL.: Functional characterization of theCYP82E10gene [J]. Phytochemistry,2010, 71: 1988-1998.
[36]Chiu-Yueh Hung, Longjiang Fan, Farooqahmed S Kittur, et al Alteration of the alkaloid profile in genetically modified tobacco reveals a role of methylenetetrahydrofolate reductase in nicotineN-demethylation [J]. Plant Physiology, 2013, 161:1049-1060.
[37]Phattharaporn pakdeechanuan, Seddon Teoh, Tsubasa Shoji, et al. Non-functionalization of twoCYP82Enicotine N-demethylase genes abolishes nornicotine formation in Nicotiana langsdorffii [J]. Plant Cell Physiology, 2012, 53(12): 2038-2046.
[38]Baldwin I T, Halitschke R, Kessler A, et al. Merging molecular and ecological approaches in plant-insect interactions[J]. Curr Opin Plant Bio, 2001, 4:351-358.
[39]Verpoorte R, Memelink J. Engineering secondary metabolite production in plants [J]. Curr Opin Biotechnol, 2002, 13:181-187.
[40]Cragg G M, Newman D J. Plants as a source of anti-cancer agents [J]. J Ethnopharmacol, 2005, 100: 72-79.
[41]Ziegler J, Facchini P J. Alkaloid biosynthesis: metabolism and tra fi cking [J]. Annu Rev Plant Biol, 2008, 59: 735-769.
[42]Siegler E H, Bowen C V. Toxicity of nicotine, nornicotine,and anabasine to codling moth larvae [J]. Journal of Economic Entomology, 1946, 39: 673-674.
[43]Shi Hongzhi, Fannin F F, Burton H R, et al. Factors a ff ecting nicotine to nornicotine conversion in burley tobacco[C]. The 54th Tobacco Science Research Conference, Nashville, USA,2000, 54:33.
[44]William G Heim, Katie A Sykes, Sherry B Hildreth, et al. Cloning and characterization of aNicotianatabacummethylputrescine oxidase transcript [J]. Phytochemistry,2007, 68: 454-463.
[45]Dandan Li, Ramsey S Lewis, Anne M Jack, et al.Development of CAPS and dCAPS markers forCYP82E4,CYP82E5v2andCYP82E10gene mutants reducing nicotine to nornicotine conversion in tobacco [J]. Mol Breeding, 2012,29: 589-599.
Advances and prospects in research on genetic mechanisms of nicotine to nornicotine conversion inNicotiana tabacumL.
CAI Changchun, CHENG Ling, FENG Ji
Hubei Provincial Tobacco Research Institute, Wuhan 430030, China
Biosynthetic process of genetic mechanisms of nicotine to nornicotine conversion inNicotiana tabacumL. and research progress of non-functionalization of N-demethylase (NND) genes were introduced in detail in this paper. Genetic features of fi ve identi fi edCYP82E2family members, namelyCYP82E2,CYP82E3,CYP82E4v1,CYP82E5v2andCYP82E10belong to cytochrome P450 genes were summarized and in-depth analysis of the function of methylenetetrahydrofolate reductase gene (MTHFR) in indirectly a ff ecting nicotine conversion by regulatingCYP82E4v1negatively was conducted. Reasons for di ff erences of nicotine to nornicotine conversion rate (NCR)in di ff erent tobacco species, especially between burley tobacco and fl ue-cured tobacco, and driving forces for the evolution of alkaloid pro fi le of tobacco was investigated. Prospects of discovering new genes controlling nicotine conversion and developing tobacco varieties with low NCRs by molecular breeding were discussed.
tobacco; nicotine to nornicotine conversion; genetic mechanisms; research advances; prospects
蔡长春,程玲,冯吉. 烟草中烟碱转化的遗传机理研究现状及展望 [J]. 中国烟草学报,2016,22(4)
湖北省烟草公司重点科技项目(027Y2012-098)
蔡长春(1974—),博士,副研究员,主要从事烟草遗传育种和分子生物学研究,Tel: 027-83608892;E-mail:ccchun2001@aliyun.com
冯 吉(1981—),博士,农艺师,主要从事烟草基因组学研究,Email:fengji1981@163.com
2015-06-03
:CAI Changchun, CHENG Ling, FENG Ji. Advances and prospects in research on genetic mechanisms of nicotine to nornicotine conversion inNicotianatabacumL. [J]. Acta Tabacaria Sinica, 2016,22(4)

