生物有机肥对新整理烟田古菌群落组成的影响
苏婷婷,徐宸,周鑫斌,,谢德体
1 西南大学资源环境学院,重庆市北碚区天生路2号 400716;2 中国烟草总公司重庆市公司烟草科学研究所,重庆市北碚区天生路2号 400716
生物技术
生物有机肥对新整理烟田古菌群落组成的影响
苏婷婷1,徐宸2,周鑫斌1,2,谢德体1
1 西南大学资源环境学院,重庆市北碚区天生路2号 400716;2 中国烟草总公司重庆市公司烟草科学研究所,重庆市北碚区天生路2号 400716
适宜的土壤微生物环境是烟草优质适产的必要条件,古菌对土壤生态系统碳氮循环起着非常重要作用。本研究采用定点田间试验的方法,研究了磷肥和生物有机肥连续三年配施对新整理黄壤烟田烤烟产质量与烟田古菌群落结构的影响。结果表明,新整理黄壤烟田土壤古菌群落主要由奇古菌门、广古菌门和未分类古菌门这三个菌门组成,其中奇古菌门的古菌数量较多;连续三年施用生物有机肥土壤古菌群落多样性提高,菌属种类增加7~13个,76.5%的菌属相对丰度高于传统施肥,施用生物有机肥的处理各菌门分布更为均匀,这有利于烟田土壤微生物生态系统趋于稳定,尤其是生物有机肥与磷肥配施效果更佳。随着烟田土壤古菌群落结构的改善,烟叶的产量、产值与上中等烟比例分别比传统施肥增加3.0%、3.7%和8.5%以上,烤烟经济效益明显提高。对于新整理黄壤烟田,采用基施生物有机肥配合根际营养土的方式,能够提高土壤古菌群落的多样性,有利于增强烟田土壤微生物生态系统的稳定性,提高烟叶质量和上中等烟比例。
新整理烟田;生物有机肥;磷;古菌
微生物作为土壤中最活跃的部分,在土壤生态系统的物质循环和能量流动中起重要作用。著名的三域理论将生物分为三大系统:真核生物、细菌与古菌[1]。近年来,随着分子生物学技术的发展,发现古菌在农田[2]、森林[3]以及草原[4]等旱地土壤生态系统的碳、氮循环中起着至关重要的作用[5]。古菌在土壤中分布广泛,数量巨大,能以独特形式固定CO2,是土壤中潜在的巨大碳库[6]。
增加土壤中的硝态氮对植物营养非常重要,氨氧化是硝化作用的第1步,在土壤生态和植物根际环境中,氨氧化古菌将氨氧化成羟胺,是整个氮素循环中关键的生物学过程[7]。研究发现,在中国西藏、云南的高原土壤[8]与美国亚利桑那州北部半干旱土壤中[9],与氨氧化细菌(AOB)相比,氨氧化古菌(AOA)是更具主导地位的氨氧化微生物。烤烟作为一种注重品质的作物,氨氧化菌可将部分铵态氮转化为硝态氮,而铵硝比例适宜时,即可稳定烤烟产量,又能保证烟叶品质[10]。
近年来,为推动山区烟草农业的健康持续发展,我国南方烟区实施了旨在促进机械化作业的烟田整理,调查发现整理后烟田耕层土壤微生物有益性指标显著下降[11]。有研究报道施用生物有机肥能增加烟田土壤细菌、真菌和放线菌数量[12],提高烤烟产质量[13],但尚缺乏对烟田土壤古菌群落的相关研究。本试验采用Mesiq高通量测序技术对古菌DNA进行测定,研究生物有机肥与磷肥配施对新整理黄壤烟田土壤古菌群落的影响,以期为新整理烟田土壤微生态环境的改善及烟叶可持续生产提供理论及技术支撑。
1 材料与方法
1.1 材料与试验地概况
试验于2012—2014年在重庆市巫山县骡镇团山村烟草种植基地进行,土壤类型为黄壤,整理后当年烟田土壤碱解氮113.1 mg・kg-1,有效磷18.72 mg・kg-1,速效钾150.2 mg・kg-1,有机质21.07 g・kg-1和C/N 13.7。2012年基础土壤微生物数量(105cfu·g-1)分别如下:真菌数量为1.46,细菌数量为265.4,放线菌数量为11.67。供试烤烟品种为云烟87,栽植密度16 500株・hm-2。
生物有机肥:采用江苏新天地生物肥料工程中心有限公司生产的Bio促生型高效生物有机肥。内含从中国科学院微生物研究所购买的解磷细菌、解钾细菌和固氮菌与从烟田土壤分离获得的其它有益菌种,经扩繁、复壮后接种到含有50% ~ 70%腐熟有机堆肥与30% ~ 50%腐熟饼肥混合物中。所制的生物有机肥有效菌数每克0.5亿个,有机质457.5 g・kg-1,N 38.2 g・kg-1,P2O522.7 g・kg-1和K2O 17 g・kg-1。商品有机肥:采用重庆市梁平县丰疆生物科技有限公司生产的无公害发酵有机肥,其养分含量分别为N 28.0 g・kg-1、P2O525.9 g・kg-1、K2O 38.1 g・kg-1,有机质470 g・kg-1。火土灰:烟农采用枯枝落叶和泥土堆积熏烧而成,其养分含量分别为N 1.8 g・kg-1,P2O52.5 g・kg-1和K2O 6.5 g・kg-1。磷肥:普通过磷酸钙(含P2O512%)。
1.2 试验设计
试验共设4个施肥处理(表1),每处理3次重复,每小区6垄,垄长5.2 m,小区面积34 m2,随机区组排列。试验各处理施总氮量均为120 kg・hm-2。所有处理均基施复合肥(8-12-25)450 kg・hm-2,即在起垄前将肥料均匀撒施烟田,然后再用旋耕机翻耕起垄。表1中的商品有机肥,全部采用基施的方法,生物有机肥,一部分基施,一部分混入营养土中移栽穴施用。营养土需在烟苗移栽前30 d配置完成,并加入适量水分,手握成团,混合均匀,用地膜覆盖堆积发酵,于烟苗移栽时,在移栽穴底部施入,每株约90 g。表1中T、T1、T2和T3处理移栽穴中施用总氮一致,即9.5 kg・hm-2,营养土不足的氮用硝铵补充。
烟苗移栽方法采用中国烟草总公司全面推广的小苗井窖式移栽方法。烟苗移栽后,施用提苗肥为氮钾复合肥(30-0-15)75 kg・hm-2和追肥硝酸钾225 kg・hm-2。其它生产操作,如育苗、起垄和病虫害防治均按当地烤烟生产技术规范执行。试验从2012年开始连续进行3年,于2014年对当年烟叶产量、产值与上中等烟比例进行统计,并采集烟田各处理土壤进行土壤古菌群落组成分析。
1.3 土壤样品采集与分析
2014年烟叶采收完毕后,采集0 ~ 20 cm的耕层土壤,混匀后留下约1 kg立即放入4 ℃的冰盒中保存。将冷藏土样带回室内,迅速过2 mm筛,拣去杂物后在-20 ℃条件下保存,用于土壤古菌16S rDNA基因测序。
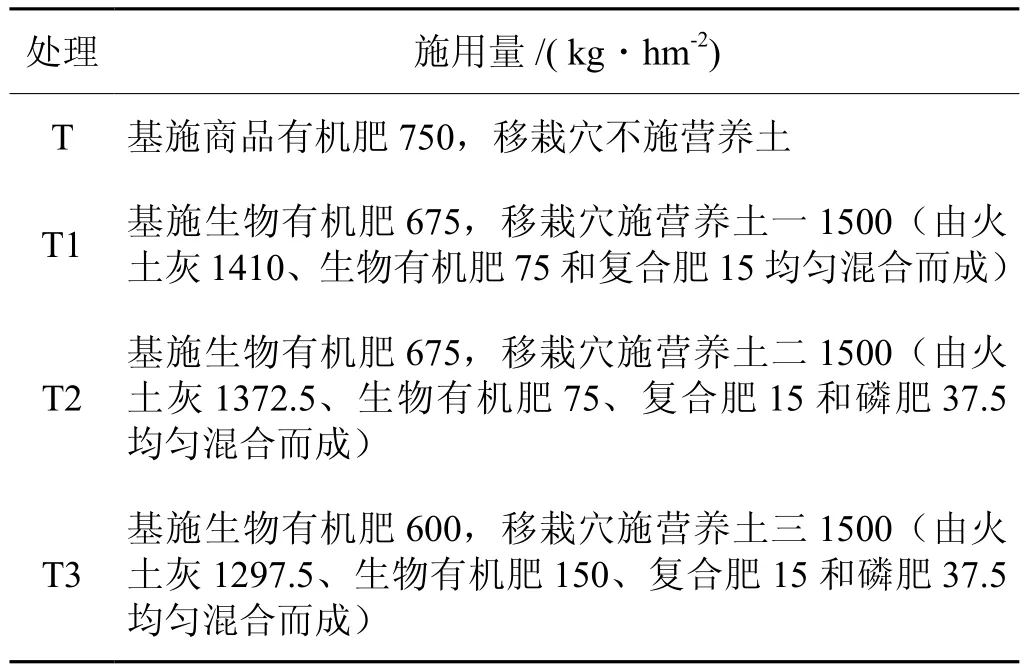
表1 试验设计Tab.1 Experimental design
古菌16S rDNA 基因测序在上海美吉生物医药科技有限公司进行。参照Miseq高通量测序方法进行DNA提取、扩增、纯化、定量和均一化,古菌16S rDNA 基因PCR扩增引物序列:Arch-amoAF(5’-STAATGGTCTGGCTTAGACG-3’),ArchamoAR(5’-GCGGCCATCCATCTGTATGT-3’)。测序后,进行去杂、修剪、去除嵌合体序列等过滤处理,得到优化序列,通过聚类分析形成分类单元(operational taxonomic units,OTU),采用BLAST程序对比GenBank中的已知序列,根据97%的相似度,确定古菌16S rDNA 基因序列对应的古菌名称。
1.4 数据处理
利用土壤古菌种类数(OTU)和16S rDNA 序列数(Reads)计算生成稀释曲线、香农-威尔(Shannon-Wiener )曲线、OTU分布图、古菌群落分布柱状图、PCA图 。
香农(shannon)多样性指数计算公式[14]:

式中,S为实际测量出的OTU数目,ni为含有i条序列的OTU数目,N为所有的序列数。
试验数据用Excel 2007进行基本计算,SPSS 18.0软件进行统计分析,差异显著性水平为P= 0.05,以a、b、c表示其差异性,数字后不含有相同字母表示差异有统计学意义。
2 结果分析
2.1 施肥对新整理黄壤烟田土壤古菌群落的影响
2.1.1 土壤样本取样深度验证及测序结果
图1为4个处理的土壤样本在相似度0.97条件下的稀释曲线。由图可知,随着测序数量的增加,所有土壤样本稀释曲线斜率逐渐降低,趋向平缓但仍未达到平台期,说明取样合理,土壤中虽有少量的菌群未被发现,但总体上能够比较真实地反映出土壤样本的古菌群落结构水平。
将古菌16S rDNA测序并过滤、去杂后,得到48143条有效序列,并在97%相似度下将其聚类为用于物种分类的OTU,统计得4个处理的土壤样本共产生1234个OTU。根据OTU在各处理中的分布情况绘制图2。由图可得出,T1处理含有最多数量的OTU,其次是T2处理,T3处理OTU数量最少。T1、T2、T3与T处理共同存在的OTU占19.1%~25.2%,T1、T2和T3各处理间共同存在的OTU占37.7%~49.2%,与传统施肥相比,生物有机肥处理的样本间差异性较小。

图1 土壤样本稀释曲线Fig.1 Rarefaction curve of soil samples
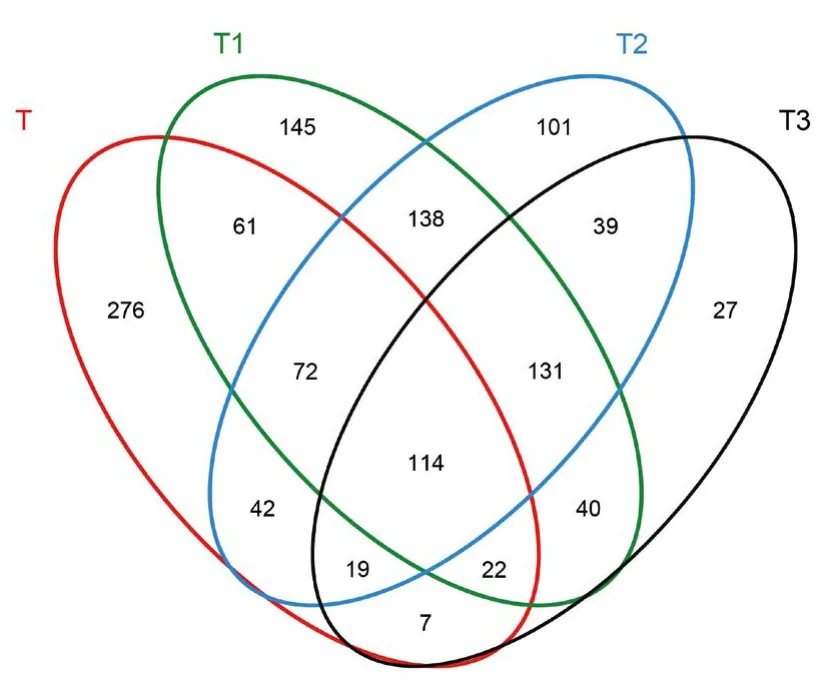
图2 不同施肥处理土壤OTU分布Fig.2 The distribution of OTU in different treatments
2.1.2 施肥对土壤古菌群落多样性的影响
构建各施肥处理土壤样本的测序量在不同测序深度时的古菌香农威尔指数曲线,结果(图3)显示,与传统施肥(T)相比,施用生物有机肥处理的土壤古菌香农多样性指数明显增高。一般而言,在稳定良好的生态环境中,生物数量增加,种群丰富,反之亦然。生物有机肥使烟田土壤古菌群落多样性增加,说明烟田土壤环境良好,适合土壤古菌的生长繁殖。

图3 各样本香农-威尔曲线Fig.3 The Shannon-Wiener curve of soil samples
2.1.3 施肥对土壤古菌群落结构的影响
对不同施肥处理的土壤样本序列进行门水平分析,结果显示(图4),T1、T2与T3处理土壤样本菌门组成相似度较大,T2与T3处理间尤为相似,说明与传统施肥相比,施用生物有机肥的各处理之间土壤古菌群落组成相近。4种施肥处理的土壤样本古菌群落由未分类古菌门(Archaea_unclassified6%~25%)、广古菌门(Euryarchaeota13%~51%)、奇古菌门(Thaumarchaeota43%~77%)组成。本试验研究显示,随着施肥方式的变化,这三类菌群在土壤中的结构发生了改变。施用生物有机肥后,奇古菌门在各处理土壤样本中所占比重下降,而广古菌门所占比重上升,其中T3处理的广古菌门所占比重最大,其次为T2处理,传统施肥处理广古菌门所占比重最小,传统施肥处理的未分类古菌所占比重与T3处理的相近,均低于T1、T2处理。与传统施肥相比,施用生物有机肥的处理各菌门分布更为均匀,这有利于烟田土壤微生物生态系统更加稳定发展。
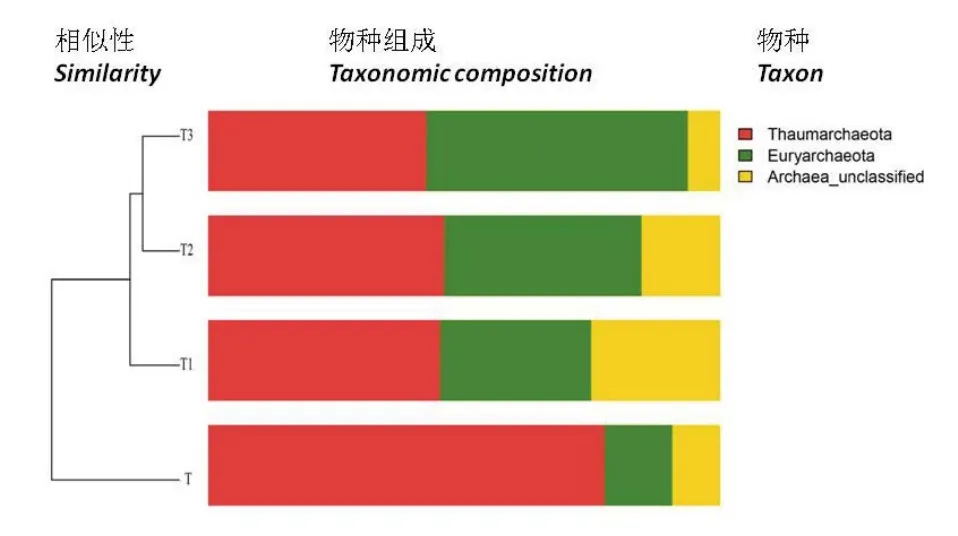
图4 土壤古菌群落结构相似性分析Fig.4 Similarity analysis of soil bacterial community structure
对不同施肥处理的土壤样本序列进行属水平分析得出,4种施肥处理的土壤样本共含有40个古菌菌属,其中包含67.5%的未知菌属。T、T1、T2与T3各处理含有土壤古菌菌属数分别为:20、27、33与29。将各处理菌属丰度均小于1.0%的属归为一类(Others),形成包括Others在内的17个菌属(图5)。其中,76.5%的菌属相对丰度为施用生物有机肥处理高于传统施肥处理,58.8%的菌属相对丰度为添加磷肥处理(T2)高于不添加磷肥处理(T1),52.9%的菌属相对丰度为生物有机肥基施675 kg・hm-2结合穴施75 kg・hm-2处理(T2)高于基施600 kg・hm-2结合穴施150 kg・hm-2处理(T3)。

图5 土壤古菌菌属相对丰度的变化Fig.5 Changes of soil bacteria relative abundance
2.1.4 不同施肥处理土壤古菌群落主成分分析
通过对4个施肥处理土壤样本的OTU 组成进行主成分分析,主成分个数的提取原则是相对应特征值大于1的前m个主成分,根据此原则,共提取出了3个主成分因子,累计贡献率达100.00%。其中第一主成分(PC1)贡献率为97.6%,权重最大,第二主成分(PC2)贡献率为1.99%,第三主成分(PC3)贡献率为0.41%,本文取PC1和PC2贡献率作如下图来表征古菌群落特征。分析表明,不同的处理在PC轴上出现了明显的分布差异(图6)。在第一主成分上,基施生物有机肥配合根际营养土处理(T1、T2和T3)的土壤古菌OTU分布具有相对一致性,且均与传统施肥处理(T)存在较大差异。在第二主成分上,营养土中含磷肥处理(T2、T3)与营养土中无磷肥处理(T1)的土壤古菌OTU分布出现差异。PC1的贡献率大于95%,能够解释原始变量绝大部分信息,具有显著代表性。因此,可以认为基施生物有机肥配合根际营养土的施肥方式对新整理黄壤烟田土壤古菌群落产生较大影响。
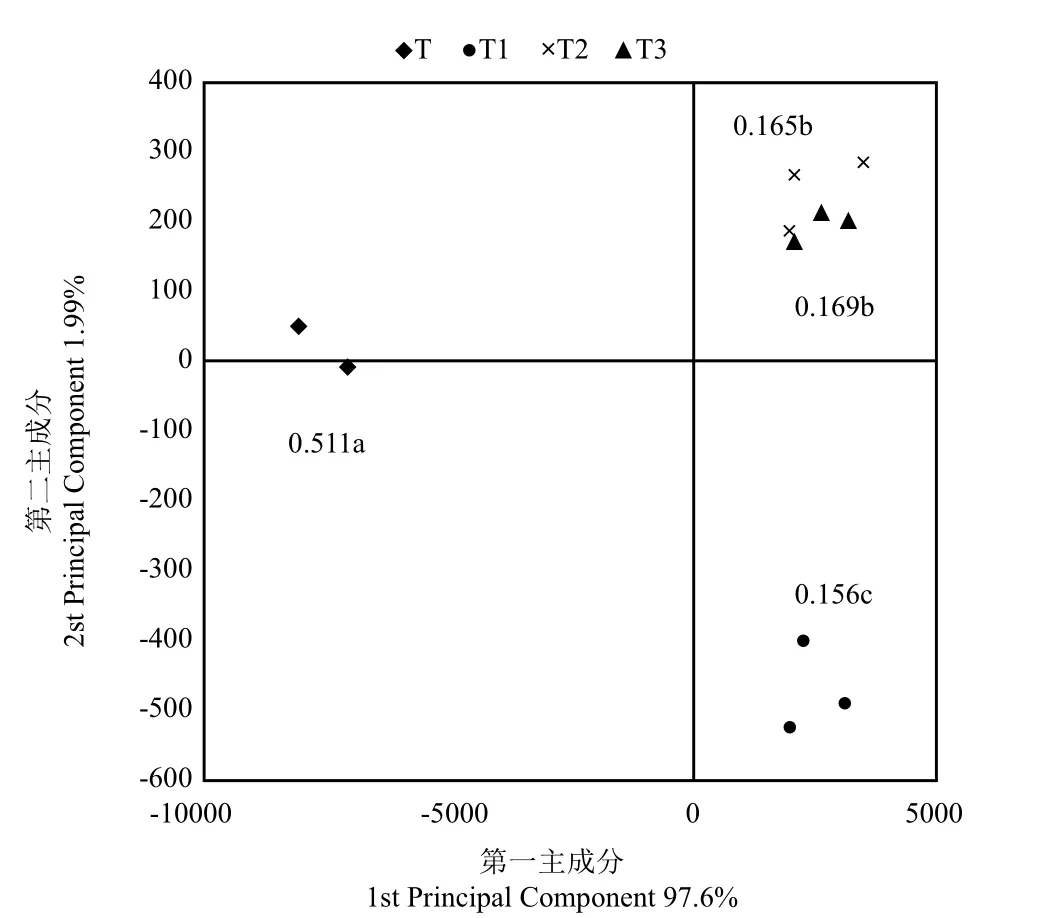
图6 不同施肥处理土壤古菌群落PCA分析Fig.6 Principal component analysis of soil bacterial community in different fertilizing treatments
2.2 施肥对烟叶产量、产值及上中等烟比例的影响
施肥对烟叶产量、产值及上中等烟比例的影响如表2所示,从表2可以看出,T2处理的烟叶产量、产值和上中等烟比例分别比对照(传统施肥)增加9.2%、13.1%和20.2%;T3处理比对照增加9.7%、10.2%和8.8%;T1处理比对照增加3.0%、3.7%和8.5%。综上,基施生物有机肥配合根际营养土的施肥方式使新整理黄壤烟田土壤古菌群落结构更加协调,随着新整理黄壤烟田土壤古菌群落结构的改善,烟叶的产值与上中等烟比例显著增加,烤烟经济效益提高。

表2 不同施肥处理对烤烟产量、产值及上中等烟比例的影响Tab.2 Influence of different fertilization treatments on the yield,income and high quality leaves of flue-cured tobacco
3 讨论
土壤微生物是土壤最活跃的组分[15],参与有机质分解、腐殖质合成和生长活性物释放等多种生物化学反应[16-18],它们在烟田中的数量、分布及代谢特征反映了烟田土壤肥力状况,对烟草生长发育起重要作用[19]。本试验通过对新整理黄壤烟田土壤古菌群落多样性进行研究,发现新整理烟田古菌种类丰富的施肥处理对应的烤烟产量、产值与上中等烟比例显著增加。这可能是因为古菌自身或其活动代谢产物能促使土壤养分的有效转化,提高烟田土壤肥力,进而促进烤烟生长发育。研究表明,在嫌气条件下的土壤中广古菌数量通常较高[20],烤烟生长初期由于地膜覆盖形成厌氧微环境,此时可能主要依赖厌氧菌分解有机物质,释放有效养分供烟草利用;也有研究证实,农田土壤中古菌氨单加氧酶基因(amoA)约为细菌amoA基因数量的几十到上千倍,古菌可能是土壤生态系统中最丰富的氨氧化微生物[21]。烤烟是喜硝氮作物,但硝态氮不易被土壤胶体固定,施用量高容易造成氮肥流失浪费,所以生产上一般施用较低比例的硝态氮,而氨氧化古菌可将部分铵态氮转化为硝态氮,可为烟草源源不断提供一定比例的硝态氮,适宜的铵硝比例有利于增加烤烟多酚类物质含量与酶活性[22],提高烟叶化学成分协调性与烤烟产质量[23]。
土壤微生物的生长需要适宜的碳氮比条件。微生物对有机物质正常分解作用所需求的碳氮比为25∶1,而新整理后烟田土壤碳氮比仅为13.7∶1。一定条件下,施用有机肥可以提升微生物对碳源的利用效率,显著增加微生物多样性[24]。本实验连续3年施肥处理后烟田土壤肥力得到提升,碳氮比增加到16.5:1,土壤古菌群落多样性提高,菌属种类增加7~13个,76.5%的菌属相对丰度高于传统施肥处理。导致这种差异的机制可能为:一方面,生物有机肥含有30% ~ 50%腐熟饼肥与50% ~ 70%高温腐熟的有机堆肥混合物,有机碳含量高达265.4 g/kg,施入土壤后,给古菌提供更多的能源物质,从而促进烟田土壤古菌生长与繁殖[25];另一方面,生物有机肥含有解磷、解钾和固氮细菌等大量的外源菌株,这些菌株随着有机肥进入土壤后,通过其代谢活动增加土壤有效养分。另外烟株通过光合作用同化的碳输入土壤生态系统,也刺激了土壤微生物(包括古菌)的生长,从而烟田土壤古菌群落多样性提高。Yevdokimov等[26]研究表明,作物根际沉积碳(光合碳)主要转化为微生物量碳,从而显著促进了微生物繁殖生长。烟株同化碳在地上部-根际-土壤系统中的分配及对土壤微生物(特别是古菌)的刺激调节机制还需深入研究。
古菌在土壤中的分布与土壤养分状况紧密相关[27],磷是组成古菌遗传物质的主要成分,而整理后的黄壤烟田土壤有效磷含量下降[28]。本研究显示,营养土中添加磷肥处理(T2)比未添加磷肥处理(T1)的烟田土壤古菌多出6个菌属,58.8%的菌属相对丰度增高。首先,这是因为磷是古菌生长繁殖的必需营养元素,施肥补充了新整理烟田中缺失的磷素;其次,磷也是烟草生长发育必需的营养元素,施用磷肥促进烟草生长[29],烟株根系分泌物促进了根际微生物的繁衍,而丰富的微生物又进而促进土壤有机物质的矿化与有效养分的转换,从而为土壤古菌生长创造一个良好的微生物—土壤—植物环境[30]。
4 结论
新整理黄壤烟田土壤古菌群落主要由奇古菌门、广古菌门和未分类古菌门这三个菌门组成,其中奇古菌门的古菌数量较多。连续3年生物有机肥配合根际营养土施用后,烟田土壤古菌菌属种类增加,菌属相对丰度与古菌群落多样性提高,各菌门古菌在土壤中分布更加均匀,生物有机肥与磷肥配施更有利于烟田土壤古菌的生长繁殖。随着新整理黄壤烟田土壤古菌群落结构的改善,烟叶的产值与上中等烟比例显著增加,烤烟经济效益提高。
[1] Woese C R, Fox G E. Phylogenetic structure of the prokaryotic domain the primary kingdoms[J]. Proceedings of the National Academy of Sciences, 1977, 74(11): 5088-5090.
[2] Simon H M, Dodsworth J A, Goodman R M. Crenarchaeota colonize terrestrial plant roots[J]. Environmental Microbiology, 2001, 3(2): 495-505.
[3] Kemnitz D, Kolb S, Conrad R. High abundance of Crenarchaeota in a temperate acidic forest soil[J].Microbiology Ecology, 2007, 60(3): 442-448.
[4] Catão E, Castro A, Barreto C C, et al. Diversity of Archaea in Brazilian savanna soils[J]. Archives of Microbiology,2013, 195(7): 507-512.
[5] 贺纪正, 沈菊培, 张丽梅. 土壤中温泉古菌研究进展[J].生态学报, 2009, 29(9): 5047-5055.HE Jizheng, SHEN Jupei, ZHANG Limei. Advance in the research of soil non-thermophilic Crenarchaeot[J]. Acta Ecologica Sinica, 2009, 29(9): 5047-5055.
[6] Berg I A, Kockelkorn D, Buckel W, et al. A 3-hydroxypropionate/ 4-Hydroxybutyrate autotrophic carbon dioxide assimilation pathway in Archaea[J]. Science,2007, 318(5857):1782-1786.
[7] 刘晶静, 吴伟祥, 丁颖, 等. 氨氧化古菌及其在氮循环中的重要作用[J]. 应用生态学报, 2010, 21(8): 2154-2160.LIU Jingjing, WU Weixiang, DING Ying, et al. Ammoniaoxidizing archaea and their important roles in nitrogen biogeochemical cycling : A review[J]. Chinese Journal of Applied Ecology, 2010, 21(8): 2154-2160.
[8] DING Kun, WEN Xianghua, CHEN Liang, et al.Abundance and distribution of ammonia-oxidizing archaea inTibetan and Yunnan plateau agricultural soils of China[J].Frontiers of Environmental Science and Engineering, 2014,8(5): 693-702.
[9] Adair K L, Schwartz E. Evidence that Ammonia-Oxidizing Archaea are More Abundant than Ammonia-Oxidizing Bacteria in Semiarid Soils of Northern Arizona, USA [J].Microbial Ecology, 2008, 56: 420-426.
[10] 张梦, 梁永江, 张长华, 等. 不同氮源对烤烟漂浮育苗氮素利用及烟苗生长的影响[J]. 植物营养与肥料学报,2012, 18(1): 139-145.ZHANG Meng, LIANG Yongjiang, ZHANG Changhua,et al. Effects of nitrogen sources on nitrogen utilization and growth of flue- cured tobacco in the floating- seeding system[J]. Plant Nutrition and Fertilizer Science, 2012,18(1): 139-145.
[11] 蒲元瀛, 张光辉, 仝景川, 等. 恩施州基本烟田土地整理建设模式研究与实践[J]. 中国烟草科学, 2012, 33(6):1-6.PU Yuanying, ZHANG Guanghui, TONG Jinchuan, et al.Study and practice of land consolidation for fundamental tobacco fields in Enshi[J]. Chinese Tobacco Science, 2012,33(6): 1-6.
[12] 李姣, 刘国顺, 高琴, 等. 不同生物有机肥与烟草专用复合肥配施对烤烟根际土壤微生物及土壤酶活性的影响[J]. 河南农业大学学报, 2013, 47(2): 132-137.LI Jiao, LIU Guoshun, GAO Qin, et al. Effect of application of different bio-organic fertilizer with tobacco specific chemical fertilizer on the amount of microbe and enzyme activities in the rhizosphere soil of flue-cured tobacco[J].Journal of Henan Agricultural University, 2013, 47(2): 132-137.
[13] 滕桂香, 邱慧珍, 张春红, 等. 微生物有机肥对烤烟育苗、产量和品质的影响[J]. 中国生态农业学报, 2011, 19(6):1255-1260.TENG Guixiang, QIU Huizhen, ZHANG Chunhong, et al.Effect of microbial organic fertilizer on seedling growth,yield and quality of flue-cured tobacco[J]. Chinese Journal of Eco-Agriculture, 2011, 19(6): 1255-1260.
[14] 陈丹梅, 陈晓明, 梁永江, 等. 轮作对土壤养分、微生物活性及细菌群落结构的影响[J]. 草业学报, 2015, 24(12):56-65.CHEN Danmei, CHEN Xiaoming, LIANG Yongjiang, et al. Influence of crop rotation on soil nutrients, microbial activities and bacterial community structures[J]. Acta Prataculturae Sinica, 2015, 24(12): 56-65.
[15] DENG Qi, CHENG Xiaoli, HUI Dafeng, et al. Soil microbial community and its interaction with soil carbon and nitrogen dynamics following afforestation in central China[J], Science of the Total Environment, 2016, 541:230-237.
[16] GUO Xiaoping, CHEN Han Y H, MENG Miaojing, et al. Effects of land use change on the composition of soil microbial communities in a managed subtropical forest[J].Forest Ecology and Management, 2016, 373: 93-99.
[17] Nielsen U N, Ayres E, Wall D H, et al. Soil biodiversity and carbon cycling: a review and synthesis of studies examining diversity-function relationships[J]. European Journal of Soil Science, 2011, 62(1): 105-116.
[18] Cosentino D, Chenu C, Le B Y. Aggregate stability and microbial community dynamics under drying-wetting cycles in a silt loam soil[J]. Soil Biology and Biochemistry, 2006,38(8): 2053-2062.
[19] 雷丽萍, 郭荣君, 缪作清, 等. 微生物在烟草生产中应用研究进展[J]. 中国烟草学报, 2006, 12(4): 47-51.LEI Liping, GUO Rongjun, MIAO Zuo qing, et al. Progress of microbes application research in tobacco production[J].Acta Tabacaria Sinica, 2006, 12(4): 47-51.
[20] Timonen S, Bomberg M. Archaea in dry soil environments[J]. Phytochemistry Reviews, 2009, 8(3): 505-518.
[21] Leininger S, Urich T, Schloter M, et al. Archaea predominate among ammonia-oxidizing prokaryotes in soils[J]. Nature, 2006, 442(17): 806-809.
[22] 孟祥东, 赵铭钦, 李元实, 等. 不同氮素形态及比例对烤烟多酚及相关酶活性动态的影响[J]. 江西农业大学学报,2010, 32(1): 25-30.MENG Xiangdong, ZHAO Mingqin, LI Yuanshi, et al.Effects of different NO3-N/ NH4+-N ratios on polyphenols and related enzyme activity of flue-cured tobacco leaves[J].Acta Agriculturae Universitatis Jiangxiensis, 2010, 32(1):25-30.
[23] 谢晋, 严玛丽, 陈建军, 等. 不同铵态氮硝态氮配比对烤烟产量、质量及其主要化学成分的影响[J]. 植物营养与肥料学报, 2014, 20(4): 1030-1037.XIE Jin, YAN Mali, CHEN Jianjun, et al. Effect of nitrogen forms on yield, quality and main chemical components of flue- cured tobacco[J]. Journal of Plant Nutrition and Fertilizer, 2014, 20(4): 1030-1037.
[24] 王利利, 董民, 张璐, 等. 不同碳氮比有机肥对有机农业土壤微生物生物量的影响[J]. 中国生态农业学报, 2013,21(9): 1073-1077.WANG Lili, DONG Min, ZHANG Lu, et al. Effects of organic manures with different carbon-to-nitrogen ratios on soil microbial biomass of organic agriculture[J]. Chinese Journal of Eco-Agriculture, 2013, 21(9): 1073-1077.
[25] 张云伟, 徐智, 汤利, 等. 不同有机肥对烤烟根际土壤微生物的影响[J]. 应用生态学报, 2013, 24(9): 2551-2556.ZHANG Yunwei, XU Zhi, TANG Li, et al. Effects of different organic fertilizers on the microbes in rhizospheric soil of flue- cured tobacco[J]. Chinese Journal of Applied Ecology, 2013, 24(9): 2551-2556.
[26] Yevdokimov I, Ruser R, Buegger F, et al. Microbial immobilisation of13C rhizodeposits in rhizosphere and root-free soil under continuous13C labelling of oat[J]. Soil Biology and Biochemistry, 2006, 38(6): 1202-1211.
[27] 沈菊培, 张丽梅, 贺纪正. 几种农田土壤中古菌、泉古菌和细菌的数量分布特征[J]. 应用生态学报, 2011,22(11): 2996-3002.SHEN Jupei, ZHANG Limei, HE Jizheng. Abundance of archaea, crenarchaea and bacteria in selected agricultural soils of China[J]. Chinese Journal of Applied Ecology,2011, 22(11): 2996-3002.
[28] 许安定, 周鑫斌, 苏婷婷, 等. 土地整理对烟田土壤理化及生物学性状的影响[J]. 西南大学学报(自然科学版),2016, 38(3): 156-164.XU Anding, ZHOU Xinbin, SU Tingting, et al. Effects of land consolidation on soil physical, chemical and biological properties on hilly land[J]. Journal of Southwest University(Natural Science Edition), 2016, 38(3): 156-164.
[29] 贾志红, 易建华, 符建国, 等. 磷肥处理对烤烟生长生理及根系构型的影响[J]. 土壤, 2011, 43(3): 388-391.JIA Zhihong, YI Jianhua, FU Jianguo, et al. Effects of phosphorus treatment on flue-cured tobacco growth physiological characteristics and root configuration[J].Soils, 2011, 43(3): 388-391.
[30] Satyavir S S, Manisha P, Sita R C, et al. Phosphorus Cycling: Prospects of Using Rhizosphere Microorganisms for Improving Phosphorus Nutrition of Plants[J].Geomicrobiology and Biogeochemistry, 2013, 39: 199-237.
Effects of applying biological organic manure on archaea community in newly consolidated tobacco field
SU Tingting1, XU Chen2, ZHOU Xinbin1,2, XIE Deti1
1 College of Resource and Environment, Southwest University, Chongqing 400716, China;2 Chongqing Institute of Tobacco Science, Chongqing 400716, China
Suitable soil microbial environment is essential for high-quality tobacco, and archaea community plays a very important role in carbon and nitrogen cycling of soil ecosystem. A field experiment was conducted to study the effects of applying biological organic manure with phosphorus fertilizer on tobacco quality in newly consolidated tobacco field and archaea community structure in three consecutive years. Results showed that archaea community of newly consolidated tobacco-planting field was composed of Thaumarchaeota,Euryarchaeota and Archaea_unclassified. Application of biological organic manure in three consecutive years increased the number of archaea species by seven to thirteen, and relative abundances of 76.5% archaea genera were higher than those of traditional fertilizer treatment alone. Application of bio-organic fertilizer led to more evenly distributed bacterium, which was conducive to stabilize soil microbe ecosystem, and application of biological organic manure with phosphorus fertilizer yielded better results. The improvement of archaea community structure in tobacco fields significantly increased yield, output value and percentage of high and middle grade tobacco by 3.0%, 3.7% and 8.5%, so that the economic efficiency of flue-cured tobacco was significantly improved. For newly consolidated tobacco-planting field, application of biological organic manure and rhizosphere nutrient soil can be used to improve soil quality and hence diversity of soil archaea community.
newly consolidated tobacco field; biological organic fertilizer; phosphate; archaea
苏婷婷,徐宸,周鑫斌,等. 生物有机肥对新整理烟田古菌群落组成的影响[J]. 中国烟草学报,2016,22(6)
中国烟草总公司重点项目“山地烟田分类治理与降酸提质关键技术研究与应用”(110201502015);中国烟草总公司重庆市公司重点项目“新整理烟田快速培肥及土壤微生态恢复与重建研究与示范”(NY20130501070004)
苏婷婷(1991—),研究生,主要从事烟草栽培生理研究,Tel:023-68251249,Email:1553738701@qq.com
周鑫斌(1978—),Tel:023-68251249,Email:zxbissas@swu.edu.cn
2016-04-05
:SU Tingting, XU Chen, ZHOU Xinbin, et al. Effects of applying biological organic manure on archaea community in newly consolidated tobacco field [J]. Acta Tabacaria Sinica, 2016, 22(6)

