丹江口水库上下游古菌优势菌群落结构特征分析
林亚萱 党晨原 钟思宁 王佳文 郑彤 倪晋仁
丹江口水库上下游古菌优势菌群落结构特征分析
林亚萱 党晨原 钟思宁 王佳文 郑彤 倪晋仁†
教育部水沙科学重点实验室, 北京大学环境工程系, 北京 100871; †通信作者, E-mail:nijinren@iee.pku.edu.cn
采用 16S rRNA Illumina Miseq 高通量测序技术, 分析丹江口水库库区及汉江下游古菌物种组成, 并对大坝上、下游水体与沉积物中占优势的氨氧化古菌(Ammonia-oxidizing archaea, AOA)和产甲烷古菌(Methanogenic archaea)群落结构进行分析。结果表明, 优势种群落结构组成受到水体与沉积物样本差异的影响, 可由氨氧化古菌的好氧特性与产甲烷古菌的厌氧特性合理地解释。网络图分析表明, 丹江口水库上游氨氧化古菌与产甲烷古菌具有显著的相关关系。受丹江口水库运行的影响, 大坝下游水体及沉积物中氨氧化古菌丰度皆比大坝上游少, 而沉积物中产甲烷古菌丰度较高, 二者间相关性不明显。
大坝; 氨氧化古菌; 产甲烷古菌; 高通量测序
河流是重要的生态系统, 在生态平衡和人类生活中起着至关重要的作用[1]。河流是地球陆地表面因流水作用而形成的典型地貌类型[2], 具有泄洪、供水、自净、航运、发电和景观等多种功能[3]。河流中含有丰富的微生物, 它们是生物地球化学过程(如氮、硫和碳循环)的关键参与者, 是各生态系统的主要生产者和消费者[4], 对水质有重要的影响[5]。为了实现水资源优化配置, 利用水库可以实现蓄水、防洪和发电等诸多功能, 但也会导致河流生境和生物的变化[6]。
汉江是长江最大的支流, 水利资源丰富[7]。汉江上游山谷具有天然的地势落差, 丹江口水库的建设使库区水位上升, 由于周边土壤被淹没, 导致土壤中养分进入水体, 水中氮和磷的含量增加[8]。前人的研究表明, 大坝对生境以及细菌、鱼类等群落结构和多样性造成影响[9–10]。Reyes-Gavilán 等[11]指出, 水坝建设会对鱼类群落的迁徙造成影响, 从而影响整体多样性。Wang 等[12]指出, 大坝会对浮游细菌的生物量和多样性造成影响。另有研究表明, 大坝会导致沉积物物理化学性质改变, 使得微生物群落结构发生变化[13]。
古菌中的氨氧化古菌(ammonia-oxidizing archa-ea, AOA)在河流生态系统的氮循环中发挥着重要作用[14]。例如, Zhou等[15]的研究发现, 氨氧化古菌可以适应极端环境, 并在极端环境中对全球氮循环发挥不可或缺的作用。产甲烷古菌(methanogenic ar-chaea)则是介导土壤和河流底泥中甲烷循环的重要功能物种[16], 广泛分布在海洋沉积物[17]、淡水沉积物[18]、水稻田[19]、湿地[20]、人类和动物的肠道[21]以及厌氧消化器等极端环境。有研究估计, 河流对全球甲烷的贡献将从每年 1.5Tg CH4升高到 26.8 Tg CH4, 相当于湿地与湖泊甲烷排放量的 15%和40%[22–23]。鉴于氨氧化古菌及产甲烷古菌存在的广泛性和重要性, 本文选择汉江代表性河段进行采样, 重点了解汉江受丹江口水库建设影响区域的古菌群落与优势种, 揭示大坝对研究区域古菌优势种的影响。
1 研究区域与研究方法
1.1 研究区域及样点布设
汉江全长 1532km, 流域面积有 15.9 万 km2[24]。根据汉江的国家水文站点分布情况, 设置 6 个采样点, 从上游到下游分别是白河、陶岔、丹江口坝下、襄阳、仙桃和集家嘴(图 1), 于 2014 年春季(3月)和秋季(10月)同步采集水样与沉积物样本。
1.2 样品采集与处理
参照中华人民共和国环境保护行业标准 HJ/T- 2002《地表水和污水检测技术规范》中的等比例混合水样采集法[25], 将采集的水样在 24 小时内用孔径为 0.22μm 的聚碳酸酯膜(Millipore, 美国)进行过滤。过滤水样的滤膜与沉积物样本都置于干冰中, 运输至实验室, 贮藏在−80oC冰箱中备用。
水样 DNA 提取使用液氮反复冻融法来裂解细胞, 后续与沉积物样本一致, 依据 FastDNA SPIN Kit for Soil (MP Biomedicals, 美国)试剂盒协议步骤进行。
1.3 数据处理与分析
采用 524F10extF/Arch958RmodR[26]引物对 16S rRNA 进行 3 次 PCR 重复扩增。本研究采用 MiSeq高通量测序技术, 以 97% 的相似性阈值进行 OUT 聚类, 后与 Silva 数据库比对, 获得 OTU 物种表格。
使用 R 语言软件(R version 3.5.1)的 pheatmap, vegan, ggplot2 和 igraph程序包, 分别对数据进行热图(Heatmap)分析、非度量多维标定 (non-metric multi-dimensional scaling, NMDS)分析、ANOSIM分析、方差分析和网络关系(Network)图分析。其中, NMDS 使用 Bray-Curtis 距离, 方差分析以< 0.05 作为筛选标准。Network 以= 0.85 作为阈值, 做 Spearman 相似性分析, 使用Gephi 作图。
2 结果与讨论
2.1 古菌及优势种的群落组成
通过 16S rRNA 高通量测序技术, 分析汉江生态系统中古菌群落组成。此次调查共得到 2908 个OTU, reads 数 966898 条。所有样品共检测出 21 个门, 相对丰度大于 0.01%的共有 12 个门以及一个未分类微生物, 分别为(奇古菌门, 53.9%)、(广古菌门, 26%)、(深古菌门, 9.5%)、(0.7%)、(洛基古菌, 0.8%)、(1.1%)、(0.6%)、(0.4%)、(0.3%)、(0.3%)、(0.3%)、(0.3%)及unclassified (5.3%), 如图 2 所示。奇古菌门和广古菌门是汉江流域的主要优势菌门, 数量占有绝对优势, 但两者在水样和泥样中的相对丰度有显著区别: 奇古菌门在水体样品中的相对丰度(超过 50%)都比在沉积物中高(约占 20%); 广古菌门是汉江流域沉积物中古菌丰度最高的门(43.5% (春泥)和 42.8%(秋泥)), 也是浮游古菌丰度第二高的优势门(23.5% (春水)和4.7% (秋水))。
奇古菌门中以氨氧化古菌(87.90%)为主, 广古菌门内物种丰富, 包括产甲烷菌(65.34%)、甲烷氧化菌(7.64%)与嗜盐菌(0.02%)等, 由此得出氨氧化古菌是奇古菌门的优势种, 产甲烷菌是广古菌门的优势种的结论。汉江中的优势功能物种是氨氧化古菌和产甲烷古菌, 二者分别在汉江的水体与沉积物中起重要作用。发现的氨氧化古菌共有 4 种属, 分别是(),(),()和(), 其中在氨氧化古菌中相对丰度最高。产甲烷古菌中是属属和属的相对丰度最高。属和属是已知产甲烷古菌中仅有的两种可以使用乙酸作为底物的属[27]。研究表明, 在淡水环境中是乙酸型的产甲烷古菌占主导, 其中乙酸型和氢营养产甲烷古菌分别占 CH4产量的 70%和 30%[28–29]。
汉江上游的丹江口水坝是南水北调中线工程的调水源头。图 3 比较古菌优势种在丹江口水坝上、下游的相对丰度差异, 其中 4 个区域分别是丹江口水坝上游水体、上游沉积物、下游水体和下游沉积物中古菌的相对丰度, 颜色的深浅代表相对丰度的高低。4 个分组中, 氨氧化古菌的属、属纲和纲以及产甲烷古菌的属、属和属都是丰度较高的物种。属和纲在水体中相对丰度高, 体现氨氧化古菌对好氧环境的偏好。属与属则在水体中相对丰度较低, 在沉积物中相对丰度较高, 显示产甲烷古菌的厌氧特性。
本研究中, 浮游古菌以好氧的氨氧化古菌为主, 沉积物古菌则以厌氧的产甲烷古菌为主, 这种现象可由氨氧化古菌的好氧特性与产甲烷古菌的厌氧特性来合理的解释。虽然在水体与沉积物中也分别发现产甲烷古菌与氨氧化古菌, 但这是由于氨氧化古菌可以在低氧环境中生存[15]。另一方面, 产甲烷古菌也在好氧环境中被发现[30–32], 但有氧环境对产甲烷有抑制作用。
分别筛选出坝上与坝下水体和沉积物中具有显着性差异的优势物种(<0.05)。图 4 显示, 水库下游浮游氨氧化古菌的丰度略少于上游, 而产甲烷古菌的丰度在上、下游的差别不显著(尤其是属和属)。图 5 显示, 沉积物中氨氧化古菌的丰度在丹江口水坝下游减少, 表明沉积物中氨氧化古菌受到水坝运行的影响, 而产甲烷古菌的丰度在下游比上游有明显的提升, 可能与上、下游沉积物中有机质含量的差异有关。
2.2 古菌优势种群落结构空间分布
采用 NMDS 分析法, 分别分析大坝上、下游两个优势菌群落结构的时空格局(图 6)。坝上与坝下的氨氧化古菌群落组成在沉积物与水体间有差异, 沉积物中的物种形成一个明显的区块, 浮游物种相对分散, 但也形成一个区块, 表明汉江流域的氨氧化古菌群落结构组成受到水体和沉积物样本差异的影响。产甲烷古菌与氨氧化古菌的分析结果一致, 产甲烷古菌的群落结构组成在坝上与坝下都受到样品差异的影响。
为验证结果的可靠性, 对 NMDS 分析结果进行相似性分析(图 7)。坝上氨氧化古菌的值为 0.5,值为 0.01; 坝下值为 0.5643,值为 0.001。坝上产甲烷古菌的值为 0.3056,值为 0.04; 坝下值为 0.3047,值为 0.007。值表示结果具有统计学意义, 表明优势种在丹江口水库上、下游的样品差异分组具有意义, 显示氨氧化古菌和产甲烷古菌都受到水体与沉积物样品差异的影响。
对古菌优势种的时空格局分析结果表明, 虽然丹江口水库在一定程度上影响古菌优势种在上、下游的相对丰度, 但并未显著地影响古菌群落结构, 表明古菌对不同环境具有更广泛的适应性。温度、pH和氧气浓度等的变化是导致水体与沉积物中优势种群落结构变化的关键因素, 例如,属和属常在海洋与河口沉积物中被发现[33],属偏好酸性土壤,属则主要在陆地土壤中被发现[34]。产甲烷古菌内部物种同样对环境有不同的需求, 如甲烷属要求乙酸浓度高的生存环境,属则可在乙酸浓度偏低的环境中生存[35]。产甲烷菌根据对温度的要求不同, 可分为嗜热菌(55~80°C 左右)、嗜温菌(35°C 左右)以及嗜冷菌(低于 25°C)。例如, 研究表明低温条件下产甲烷古菌以乙酸型的属占主导[36], 嗜冷菌的属物种不能在超过 20°C的地方生长[37]。
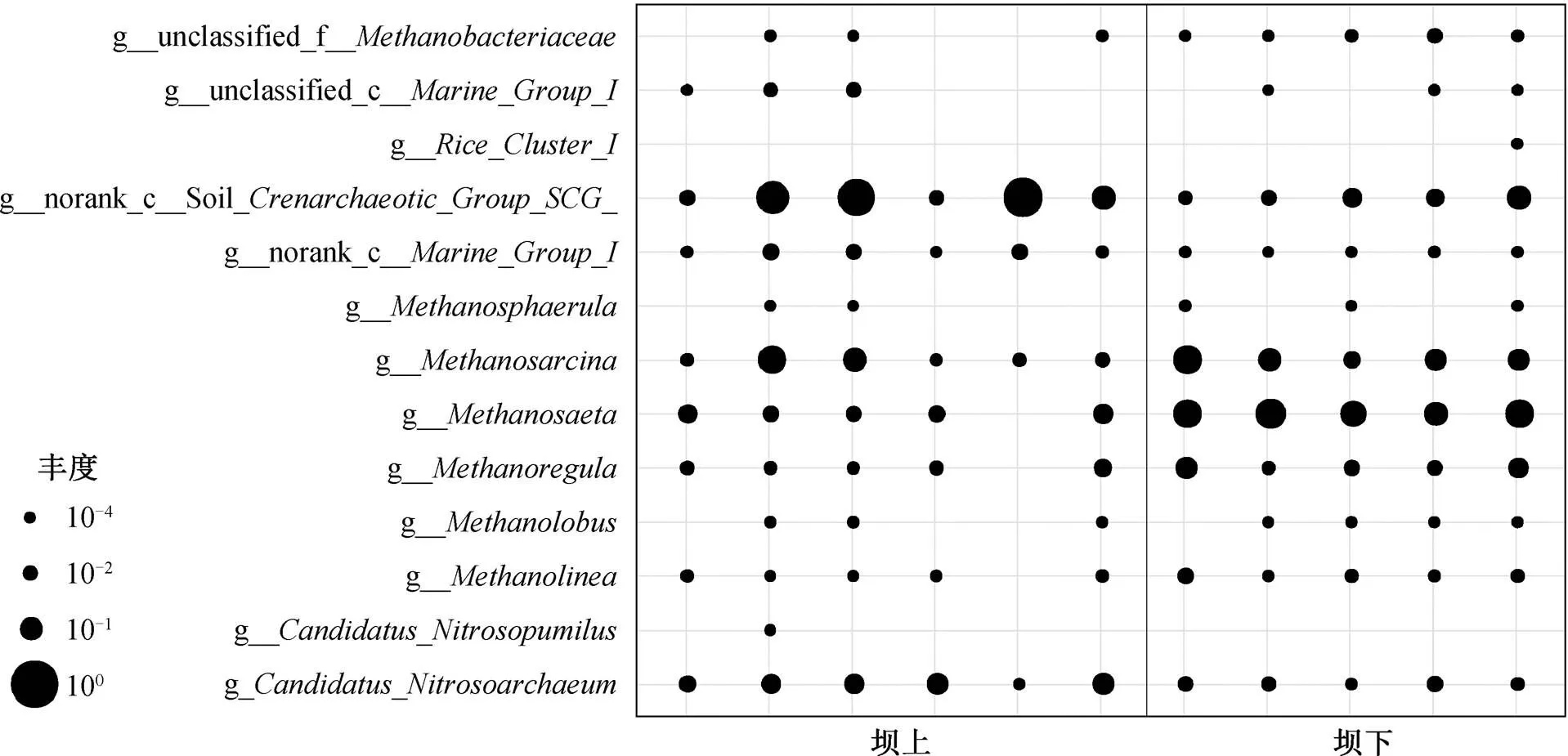
图5 沉积物中优势物种在大坝上游与下游的丰度
2.3 古菌优势种之间的关系
通过网络关系图(图 8), 分析氨氧化古菌与产甲烷古菌在大坝上、下游物种之间的关系。丹江口水坝上游优势物种共生网络的节点中, 氨氧化古菌和产甲烷古菌分别占 44.44%和 55.56%, 两者之间的关系以正相关为主。上游优势物种的共生网络(图 8(a))可以分为 3 个部分: 氨氧化古菌的独立部分、产甲烷古菌独立部分以及两者相互关联的部分。两者相互关联的部分主要包括 OTU2577, OTU 4187, OTU1436, OTU4358, OTU2748, OTU2799, OTU2545, OTU2543, OTU3255, OTU3089, OTU 3469 和 OTU4227, 分别属于氨氧化古菌的纲与, 以及产甲烷古菌的,,,,和。
丹江口水坝下游氨氧化古菌与产甲烷古菌的比例分别是 47.22%和 52.78%。两个优势种之间的关系以正相关为主, 负相关仅占总体的不到 1%。下游两个优势种各自形成独立的区块(图 8(b)), 彼此之间基本上没有关联。既属于上游相互联系的又在下游相关的 OTU 有 OTU1436, OTU2577, OUT2545, OTU3255, OTU3089 和 OTU4227, 分别属于氨氧化古菌的纲以及产甲烷古菌的和。
对比丹江口水库上、下游物种间的关系, 可知丹江口水库上游氨氧化古菌与产甲烷古菌具有显著的相关关系, 而下游的相关性并不明显。黄柳琴等[38]的研究表明, 虽然水库运行对氨氧化古菌群落结构的影响并不明显, 但会改变其生存方式, 如在三峡大坝上游的氨氧化古菌以附着为主, 而下游以浮游为主。这与我们的研究结果十分类似, 即坝上游氨氧化古菌与产甲烷古菌关联密切, 但坝下游因河床的剧烈冲刷大大削弱了二者之间的联系。
3 结论
本文基于 2014 年春季(4 月)和秋季(10 月)在受丹江口水库影响的汉江河段监测结果, 对古菌物种组成、群落结构及优势种的相互关系进行分析, 得到以下主要结论。
1)汉江流域古菌物种的组成由奇古菌门和广古菌门主导, 水体中以奇古菌门中的氨氧化古菌为主, 沉积物中则以广古菌门的产甲烷古菌为主, 这可用氨氧化古菌和产甲烷古菌分别适宜好氧和厌氧环境进行很好的解释。
2)丹江口水库对氨氧化古菌丰度的影响更主要地表现为对沉积物中古菌的影响。沉积物中产甲烷古菌的丰度在坝下游明显增高, 可能与上、下游沉积物中有机质含量的差异有关。大坝上、下游氨氧化古菌与产甲烷古菌的群落结构组成受水体与沉积物样本类型差异的影响更大。
3)网络图分析表明, 丹江口水库上游氨氧化古菌与产甲烷古菌具有显著的相关性, 但是在大坝下游二者之间未呈现明显的相关性, 推测与坝下河床冲刷造成物种生存方式的变化有关。
[1] Vos W M D, Eekert M H A V, Smidt H, et al. Structure and function of microbial communities in river ecosystems in response to global environmental changes and pollution. ACM Communications in Computer Algebrahelp, 2004, 42(1/2): 55–56
[2] 栾建国, 陈文祥. 河流生态系统的典型特征和服务功能. 人民长江, 2004, 35(9): 41–43
[3] 倪晋仁, 刘元元. 河流健康诊断与生态修复. 中国水利, 2006(13): 4–10
[4] Fan L, Song C, Meng S, et al. Spatial distribution of planktonic bacterial and archaeal communities in the upper section of the tidal reach in Yangtze River. Scientific Reports, 2016, 6(1): 39147
[5] Hahn M W. The microbial diversity of inland waters. Current Opinion in Biotechnology, 2006, 17(3): 256–261
[6] 蔡玉鹏. 大型水利工程对长江中下游关键生态功能区影响研究[D]. 南京: 河海大学, 2007
[7] 邢雯慧, 王坚红, 张方伟, 等. 秋汛期影响汉江流域降雨的水汽通道特征研究. 人民长江, 2019, 50 (2): 1–6
[8] 李雯, 逯建维, 王蜜. 南水北调工程对丹江口生态环境影响. 居舍, 2018(32): 151–151
[9] Jansson R. The effect of dams on biodiversity [D]. Umeå: Umeå University, 2006
[10] Liu T, Zhang A N, Wang J, et al. Integrated bio-geography of planktonic and sedimentary bacterial communities in the Yangtze River. Microbiome, 2018, 6(1): 16
[11] Reyes-Gavilán F G, Garrido R, Nicieza A G, et al. Fish community variation along physical gradients in short streams of northern Spain and the disruptive effect of dams. Hydrobiologia, 1996, 321(2): 155–163
[12] Wang P, Wang X, Wang C, et al. Shift in bacterio-plankton diversity and structure: influence of anthro-pogenic disturbances along the Yarlung Tsangpo River on the Tibetan Plateau, China. Scientific Reports, 2017, 7(1): 12529
[13] Li J P, Dong S K, Yang Z F, et al. Effects of cascade hydropower dams on the structure and distribution of riparian and upland vegetation along the middle-lower Lancang-Mekong River. Forest Ecology & Manage-ment, 2012, 284(3): 251–259
[14] 刘正辉. 氨氧化古菌及其对氮循环贡献的研究进展. 微生物学通报, 2015, 42(4): 774–782
[15] Zhou L, Wang S, Zou Y, et al. Species, abundance and function of ammonia-oxidizing Archaea in Inland Wa-ters across China. Scientific Reports, 2015, 5: 15969
[16] 佘晨兴, 仝川. 闽江口芦苇沼泽湿地土壤产甲烷菌群落结构的垂直分布. 生态学报, 2012, 32(17): 5299–5308
[17] Whiticar M J, Faber E, Schoell M. Biogenic methane formation in marine and freshwater environments: CO2reduction vs. acetate fermentation — isotope evidence. Geochimica et Cosmochimica Acta, 1986, 50(5): 693–709
[18] Chan O C, Wolf M, Hepperle D, et al. Methanogenic archaeal community in the sediment of an artificially partitioned acidic bog lake. FEMS Microbiology Ecology, 2002, 42(1): 119–129
[19] Sakai S, Imachi H, Hanada S, et al.gen. nov. sp. nov. a methane-producing archaeon, the first isolate of the lineage “Rice Cluster I”, and proposal of the new archaeal orderord. nov. International Journal of Systematic and Evolutionary Microbiology, 2008, 58(4): 929–936
[20] Angle J C, Morin T H, Solden L M, et al. Metha-nogenesis in oxygenated soils is a substantial fraction of wetland methane emissions. Nature Commu-nications, 2017, 8(1): 1567
[21] Pester M, Brune A. Hydrogen is the central free intermediate during lignocellulose degradation by termite gut symbionts. ISME Journal, 2007, 1(6): 551–565
[22] Bastviken D, Tranvik L J, Downing J A, et al. Fresh-water methane emissions offset the continental car-bon sink. Science, 2011, 331: 50–50
[23] Stanley E H, Casson N J, Christel S T, et al. The ecology of methane in streams and rivers: patterns, controls, and global significance. Ecological Mono-graphs, 2016, 86(2): 146–171
[24] 况琪军, 谭渝云, 万登榜, 等. 汉江中下游江段藻类现状调查及“水华”成因分析. 长江流域资源与环境, 2000, 9(1): 63–70
[25] 国家环境保护局. 地表水和污水监测技术规范. HJ/T91-2002. 北京: 中国环境科学出版社, 2003
[26] Pires A C C, Cleary D F R, Almeida A, et al. Denaturing gradient gel electrophoresis and barcoded pyrosequencing reveal unprecedented archaeal diver-sity in mangrove sediment and rhizosphere samples. Applied and Environmental Microbiology, 2012, 78 (16): 5520–5528
[27] Liu Y, Whitman W B. Metabolic, phylogenetic, and ecological diversity of the methanogenic archaea. Annals of the New York Academy of Sciences, 2010, 1125(1): 171–189
[28] Whiticar M J. Carbon and hydrogen isotope syste-matics of bacterial formation and oxidation of me-thane. Chemical Geology, 1999, 161(1/2/3): 291–314
[29] Conrad R. Contribution of hydrogen to methane pro-duction and control of hydrogen concentrations in methanogenic soils and sediments. Fems Microbiology Ecology, 1999, 28(3): 193–202
[30] Grossart H P, Frindte K, Dziallas C, et al. Microbial methane production in oxygenated water column of an oligotrophic lake. Proceedings of the National Aca-demy of Sciences, 2011, 108(49): 19657–19661
[31] Bogard M J, Del Giorgio P A, Boutet L, et al. Oxic water column methanogenesis as a major component of aquatic CH4fluxes. Nature Communications, 2014, 5: 5350
[32] Tang K W, Mcginnis D F, Ionescu D, et al. Methane production in oxic Lake waters potentially increases aquatic methane flux to air. Environmental Science & Technology Letters, 2016, 3(6): 227–233
[33] Mosier A C, Allen E E, Kim M, et al. Genome sequence of “Nitrosoarchaeum limnia” BG20, a low-salinity ammonia-oxidizing archaeon from the San Francisco Bay estuary. American So-ciety for Microbiology, 2012, 194(8): 2119–2120
[34] Tourna M, Stieglmeier M, Spang A, et al. Nitroso-sphaera viennensis, an ammonia oxidizing archaeon from soil. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108 (20): 8420–8425
[35] Conrad R. Microbial ecology of methanogens and methanotrophs. Advances in Agronomy, 2007, 96(7): 1–63
[36] Grosskopf R. Diversity and structure of the metha-nogenic community in anoxic rice paddy soil mic-rocosms as examined by cultivation and direct 16S rRNA gene sequence retrieval. Applied and Environ-mental Microbiology, 1998, 64(3): 960–969
[37] Franzmann P D, Liu Y, Balkwill D L, et al.sp. nov. a psychrophilic, H2-using methanogen from Ace Lake, Antarctica. International Journal of Systematic Bacteriology, 1997, 47(4): 1068–1072
[38] 黄柳琴, 蒋宏忱, 王尚, 等. 长江三峡大坝两侧水体中氨氧化微生物种群结构分析. 微生物学报, 2011, 51(1): 83–90
Community Characteristics of Dominant Archaea before and after the Danjiangkou Dam
LIN Yaxuan,DANG Chenyuan,ZHONG Sining,WANG Jiawen,ZHENG Tong,NI Jinren†
Key Laboratory of Water and Sediment Sciences (MOE), Department of Environmental Engineering, Peking University, Beijing 100871;† Corresponding author, E-mail: nijinren@iee.pku.edu.cn
The 16S rRNA Illumina Miseq high-throughput sequencing technology was used to analyze the species composition of archaea in the Danjiangkou reservoir area and the downstream Hanjiang River. The structure of ammonia-oxidizing archaea (AOA) and methanogenic archaeathat dominated the water and sediments in the upstream and downstream dam was analyzed. The results showed that the structure of the dominant species was affected by the samples difference, which could be explained by the aerobic preference of the ammonia-oxidizing archaea and the anaerobic properties of the methanogenic archaea. According to the network analysis, there was a significant correlation between the ammonia-oxidizing archaea and the methanogenic archaea in the upstream of the Danjiangkou reservoir. Because of the operation of the Danjiangkou reservoir, the abundance of ammonia-oxidizing archaea in the water and sediments of downstream of the dam was reduced, and the abundance of methanogenic archaea in the sediments was relatively high. The relation between them was not obvious.
dam; ammonia-oxidizing archaea; methane-oxidizing archaea; high-throughput sequencing
10.13209/j.0479-8023.2020.034
国家自然科学基金(51539001)资助
2019–04–18;
2019–06–25

