过表达天山雪莲SikCDPK1基因提高转基因烟草耐低温能力的机制初探
田晓涵,庞学兵,祝建波,朱新霞
石河子大学 生命科学学院农业生物技术重点实验室,新疆 石河子 832000
过表达天山雪莲SikCDPK1基因提高转基因烟草耐低温能力的机制初探
田晓涵,庞学兵,祝建波,朱新霞
石河子大学 生命科学学院农业生物技术重点实验室,新疆 石河子 832000
钙依赖型蛋白激酶(calcium-dependent protein kinases,CDPKs)在植物参与非生物胁迫信号响应中发挥着重要作用。本研究利用实时荧光定量PCR技术分析了天山雪莲钙依赖性蛋白激酶基因SikCDPK1在-4 ℃低温胁迫处理下的表达量,发现低温胁迫可以诱导天山雪莲内源SikCDPK1基因表达,且在处理3 h表达量迅速积累达到最高值。将SikCDPK1基因构建在由组成型CaMV35S强启动子控制的双子叶转化载体pCAMBIA2300上,利用农杆菌介导法转化烟草NC89,发现转基因烟草植株在低温胁迫后,耐低温能力明显增强;脯氨酸、可溶性蛋白含量及超氧化物歧化酶、过氧化物酶活性均高于非转基因烟草植株;丙二醛含量和相对电导率均低于非转基因烟草植株。上述研究结果表明,SikCDPK1基因可以通过积累渗透调节物质、增强抗氧化酶活性和维持细胞膜稳定性来提高植物的耐低温能力。
天山雪莲;SikCDPK1基因;低温;表达分析;转基因
低温、干旱、盐渍、洪涝等非生物逆境胁迫是制约农作物产量和品质的主要限制因素[1],在长期的进化过程中,植物形成了复杂而又精细的信号转导途径,从而保护自身免受胁迫伤害。在植物细胞的信号转导过程中,钙离子作为第二信使,在植物生长发育和感知环境刺激的过程中扮演了非常重要的角色,其中钙依赖型蛋白激酶(calcium-dependent protein kinases, CDPKs)是一类广泛存在于植物中的Ser/Thr类蛋白激酶,可不需钙调素而被钙信号直接激活,对植物感受钙信号并在细胞内放大信号和传递信号起关键作用[2]。自1982年在豌豆[3]中发现钙依赖蛋白激酶至今,陆续又在拟南芥[4]、水稻[5]、小麦[6]、烟草[7]、玉米[8]、黄瓜[9]等多种植物中发现,是植物中研究较多、了解较清楚的一类蛋白激酶。在转录水平上,CDPKs基因能够被多种胁迫信号诱导表达。过表达拟南芥AtCDPK1基因能明显提高转基因拟南芥在低温、高盐和ABA胁迫下的耐受能力[10];低温能诱导胡杨PeCPK10基因的表达,PeCPK10在拟南芥中异源表达可以提高转基因拟南芥的抗寒性[11];低温胁迫下,玉米ZmCPK1基因表达上调,ZmCPK1可以抑制冷胁迫诱导的Zmerf3基因的表达[12];低温能诱导水稻OsCDPK13基因的表达,在OsCDPK13启动子区发现了低温应答元件LTRECOREATCORl5[13]。
天山雪莲(Sasussured involucrataKar.et Kir)能够在常年积雪、气候多变、昼夜温差悬殊的海拔2400 m至4100 m的山坡、山谷和石缝中生长,完成生活史,是优异的抗逆资源。本研究利用前期研究获得的天山雪莲SikCDPK1基因,构建组成型表达载体导入烟草,测定低温胁迫下转基因植株体内渗透调节物质、抗氧化酶活性和细胞膜稳定性变化,探讨在烟草中过表达天山雪莲SikCDPK1基因对低温逆境胁迫的响应机制。
1 材料和方法
1.1 材料
1.1.1 植物材料
天山雪莲 (Sasussured involucrataKar.et Kir),烟草(Nicotiana tabacumL.)品种NC89均由新疆石河子大学农业生物技术重点实验室保存。
1.1.2 菌株及试剂
大肠杆菌DH5α、农杆菌GV3101、植物表达载体pCAMBIA- 2300由本实验室保存。植物总RNA提取试剂盒购于北京艾德莱生物科技有限公司,cDNA合成试剂盒购于北京全式金生物技术有限公司,限制性内切酶、T4DNA ligase购自普洛麦格(北京)生物技术有限公司,SYBR GreenⅠMaster Mix购自罗氏诊断产品(上海)有限公司,其他试剂均为分析纯。引物合成由北京六合华大基因科技股份有限公司完成,本实验所用引物见表1,酶切位点用下划线标注。

表1 引物序列Tab. 1 Primer sequences
1.2 方法
1.2.1 低温胁迫下天山雪莲内源SikCDPK1基因表达分析
将天山雪莲无菌苗置于-4℃光照培养箱进行低温胁迫处理,分别取处理0(CK)、1、3、6、12、24 h叶片样品,液氮速冻,-70℃保存。分别提取对照和不同时间处理的雪莲RNA,以cDNA为模板,对SikCDPK1基因在低温胁迫下的表达进行分析。以天山雪莲看家基因GAPDH作为内参基因,按照Roche公司SYBR GreenⅠMaster Mix 试剂盒说明书操作,利用Light Cycler® 480Ⅱ PCR仪(Roche)进行扩增。反应程序为94℃预变性5min;94℃变性15s,62℃退火30s,72℃延伸30s,40个循环。试验进行3次重复,取平均值,结果采用2-ΔΔCt法对数据进行分析。
1.2.2 pCAMBIA2300- SikCDPK1植物表达载体的构建
用BamHI和SalI分别双酶切植物表达载体pCAMBIA2300和阳性克隆载体pMD19-SikCDPK1,用1%琼脂糖凝胶电泳检测后,回收目的基因和载体大片段。经T4DNA连接酶16℃过夜连接,重组子转化大肠杆菌 DH5α 感受态细胞,经菌落PCR、双酶切鉴定,阳性克隆命名为pCAMBIA2300-SikCDPK1,电击法转入农杆菌GV3101。
1.2.3 烟草转化及分子鉴定
将含有质粒pCAMBIA2300-SikCDPK1的农杆菌通过叶盘法转化无菌烟草NC89,将侵染的烟草叶片置于含有80 μg﹒mL-1卡那霉素抗性的培养基上进行初步筛选,待叶边缘的愈伤组织逐渐分化出丛生芽,并长至2~3 cm左右时,置于卡那霉素抗性的生根培养基中,待根系发达后移入营养土中。经过15~20 d左右,改良CTAB法提取烟草基因组DNA,进行PCR检测,提取PCR阳性的转化株和受体烟草的总RNA,RT-PCR法检测SikCDPK1基因的转录水平。
1.2.4 转SikCDPK1基因烟草低温胁迫实验
选取生长旺盛、大小一致的野生型和T0代转基因烟草株系(line1、line2)各3株,放入-4℃的人工气候箱进行低温胁迫处理0、3、6、9、12h,然后将植株放入25℃培养箱恢复24h,记录各阶段烟草的形态变化,并在不同处理阶段分别取样,-70℃冷冻保存。
1.2.5 生理指标的测定
采用李合生[14]的方法测定野生型和转基因型株系烟草叶片在低温胁迫处理0、3、6、9、12h后的脯氨酸(Proline)、丙二醛(MDA)、可溶性蛋白含量、相对电导率及超氧化物歧化酶(SOD)、过氧化物酶(POD)活性变化,实验进行生物学重复3次。
1.2.6 数据分析
实验数据采用SPSS17.0软件进行统计分析,以LSD法进行差异显著性分析,显著性水平设定为P<0.05(显著水平)和P<0.01(极显著水平),采用Excel软件作图。
2 结果与分析
2.1 天山雪莲SikCDPK1基因受低温胁迫诱导表达
qRT-PCR结果表明,低温胁迫能够改变雪莲内源SikCDPK1基因的表达量(图1)。-4 ℃胁迫处理1 h,SikCDPK1基因表达量急速下降,而后表达量迅速上升,处理3h时达到最大值,为对照的5.8倍;随着处理时间的延长,表达量降为初始水平;12h时表达量降至最低,仅为对照表达量的9.6 %;24h时表达量又开始上升,为对照的1.79倍,推测SikCDPK1基因在低温胁迫中起作用。本研究中胁迫处理1 h的表达量要低于未胁迫的表达量,这可能是由于天山雪莲在-4℃环境呈现应激反应导致。
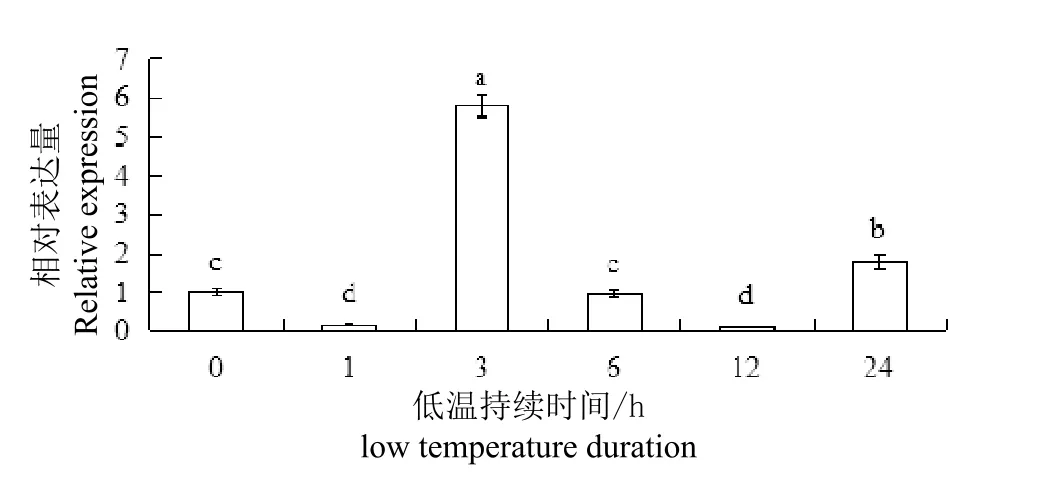
图1 低温胁迫下SikCDPK1基因的表达分析Fig. 1 Analysis of SikCDPK1 gene expression under cold stress
2.2 转基因烟草的获得及鉴定
将SikCDPK1基因插入到由组成型CaMV35S启动子控制的表达载体pCAMBIA2300上(图2)。SikCDPK1基因特异引物PCR检测阳性转化株(图3)。提取鉴定为阳性植株叶片中的RNA,进行半定量表达分析,结果表明SikCDPK1基因在过表达烟草中可以正常转录(图3),其中泳道9和10分别命名为Line1、Line2,用于后续实验。

图2 载体pCAMBIA2300-SikCDPK1构建简图Fig. 2 Figure of pCAMBIA2300-SikCDPK1 vector

图3 转SikCDPK1基因烟草的PCR和RT-PCR检测Fig.3 PCR and RT-PCR identification of the SikCDPK1 transgenic plants
2.3 转基因烟草耐低温能力分析
2.3.1 低温胁迫下转基因烟草表型变化
将野生型和表达量高的转基因株系放入-4℃人工气候箱内进行低温胁迫处理。如图4 A所示,室温生长状态下,野生型和转基因株系没有明显表型差异;置于-4℃培养箱3 h后,野生型烟草叶片轻度下垂,表现出轻微冷害特征,转基因烟草无明显表型变化(图4 B);低温胁迫6 h后,野生型烟草冷害症状愈发明显,叶片中度萎蔫,出现伤斑,而转基因烟草依旧未出现明显变化(图4 C);低温胁迫9 h后,野生型烟草基本完全萎蔫,水渍状明显,只有顶部小叶芽还有生命体征,而转基因烟草此时叶片轻微疲软(图4 D);低温胁迫12 h后,野生型烟草完全萎蔫,而转基因烟草叶片卷曲并下垂,萎蔫严重(图4 E);室温恢复24 h后,野生型烟草无明显恢复现象,而转基因烟草叶片开始伸展,逐渐恢复(图4 F)。
2.3.2 低温胁迫下转基因烟草生理指标变化
对低温胁迫不同处理时间的野生型和转基因烟草分别进行了脯氨酸、可溶性蛋白、MDA含量,POD、SOD活性和相对电导率的测定。

图4 野生型和转基因烟草低温胁迫下的形态特征Fig. 4 Phenotypes of WT, line 1 and line 2 under cold stress

图5 低温胁迫对野生型(WT)和转SikCDPK1基因烟草部分生理指标的影响Fig. 5 Effect of cold stress on physiological contentis of WT and SikCDPK1 tobacco
结果表明,低温处理前,野生型和转基因型烟草脯氨酸含量差别不大,随着低温胁迫时间的增加,脯氨酸含量呈现上升—下降—上升—下降的趋势,转基因植株脯氨酸含量高于野生型(图5 A),在3 h和9 h之间达到极显著水平。说明低温胁迫下,转基因烟草可以积累更多的脯氨酸,从而提高植株的耐冷性。
低温处理前,野生型和转基因型烟草可溶性蛋白含量差别较小,随着低温胁迫时间的增加,转基因烟草叶片可溶性蛋白含量增加幅度大于野生型(图5 B),在6 h后达到极显著水平;室温恢复24 h后,野生型烟草可溶性蛋白含量仍在增加,而转基因烟草开始逐渐下降。说明在低温胁迫下,转基因烟草叶片可溶性蛋白含量增加使细胞液浓度增大,从而增强了植株的抗寒性。
低温处理前,野生型和转基因型烟草MDA含量差别不大,随着低温胁迫时间的延长,野生型和转基因烟草MDA含量均呈现上升趋势(图5 C),转基因植株MDA含量低于野生型,在9 h时达到极显著水平;在室温恢复阶段MDA含量开始下降。说明低温胁迫下转基因植株细胞膜受损程度较轻。
在正常生长状态下,野生型和转基因烟草POD和SOD活性无明显差异(图5 D, E),随着低温胁迫时间的延长,野生型和转基因烟草POD活性持续上升,在冷处理6 h达到最高值,分别为初始的2.16倍和2.29倍,随后开始下降,在恢复阶段又开始上升;而SOD活性处于持续上升状态,转基因烟草SOD活性增长幅度高于野生型,在恢复24 h后开始下降。说明低温胁迫下,转基因烟草拥有更高的POD和SOD活性,对细胞膜能起到保护作用,从而增强植株的抗寒性。
随着胁迫时间的延长,野生型和转基因烟草相对电导率均呈明显上升趋势(图5 F),在室温恢复24 h后转基因烟草相对电导率开始下降,而CK仍保持上升趋势;整个过程转基因植株相对电导率显著低于野生型,其中第6 h和第9 h达到极显著水平。说明低温胁迫下,转基因植株细胞膜透性变化相对较小,胞质外渗程度较低,细胞膜受损较轻。
本试验结果显示SikCDPK1基因显著提高了转基因烟草的耐低温能力。CDPKs基因家族成员较多,且不同CDPK基因成员对低温胁迫的响应模式可能不同,后续还需要发掘并研究CDPK低温信号转导途径的关键分子、筛选出下游有价值的与SikCDPK1相互作用的蛋白等,从而更好的揭示SikCDPK1基因的抗逆分子机制。
[1] Lobell D B, Wolfram S, Justin C R. Climate trends and global crop production since 1980 [J]. Science, 2011,333(6042): 616-620.
[2] Boudsocq M, Sheen J. CDPKs in immune and stress signaling [J]. Trends in plant science, 2013, 18(1): 30-40.
[3] Hetherington A, Trewavas A. Calcium-dependent protein kinase in pea shoot membranes [J]. Febs Letters, 1982,145(1): 67-71.
[4] Hrabak E M, Chan C W M, Michael G, et al. TheArabidopsisCDPK-SnRK superfamily of protein kinases[J]. Plant Physiology, 2003, 132(2): 666-680.
[5] Asano T, Tanaka N, Yang G, et al. Genome-wide identification of the rice calcium-dependent protein kinase and its closely related kinase gene family: comprehensive analysis of the CDPKs gene family in rice [J]. Plant Cell Physiol, 2005, 46 (2): 356-366.
[6] LI A L, ZHU Y F, TAN X M, et al. Evolutionary and functional study of the CDPK gene family in wheat (Triticum aestivumL.) [J]. Plant Molecular Biology, 2008, 66(4): 429-43.
[7] Witte C P, Keinath N, Dubiella U, et al. Tobacco calciumdependent protein kinases are differentially phosphorylated in vivo as part of a kinase cascade that regulates stress response [J]. J Biol Chem, 2010, 285 (13): 9740-9748.
[8] MA P, LIU J, YANG X, et al. Genome-wide identification of the maize calcium-dependent protein kinase gene family[J]. Appl Biochem Biotechnol, 2013, 169 (7): 2111-2125.
[9] XU Xuewen, LIU Min, Lu L, et al. Genome-wide analysis and expression of the calcium-dependent protein kinase gene family in cucumber [J]. Molecular Genetics &Genomics, 2015, 290(4): 1403-1414.
[10] 卢慧星. 拟南芥AtCDPK1参与非生物胁迫响应和ABA信号途径的证据[D]. 内蒙古农业大学, 2009.LU Huixing. The Evidence of AtCDPK1 Involved in Abiotic Stresses and ABA Signaling Pathway [D].Inner Mongolia Agricultural University, 2009.
[11] Chen J, Xue B, Xia X, et al. A novel calcium-dependent protein kinase gene fromPopulus euphratica, confers both drought and cold stress tolerance [J]. Biochemical &Biophysical Research Communications, 2013, 441(3): 630-636.
[12] Weckwerth P, Ehlert B, Romeis T.ZmCPK1, a calciumindependent kinase member of theZea maysCDPK gene family, functions as a negative regulator in cold stress signalling [J]. Plant Cell & Environment, 2014, 38(3): 544-558.
[13] Abbasi F, Onodera H, Toki S, et al.OsCDPK13, a calcium-dependent protein kinase gene from rice, is induced by cold and gibberellin in rice leaf sheath [J]. Plant Molecular Biology, 2004, 55(4): 541-52.
[14] 李合生. 植物生理生化实验原理和技术[M]. 高等教育出版社, 2000.LI Hesheng. Principles and techniques of plant physiological biochemical experiment [M]. Higher Education Press, 2000.
[15] 李聪, 郭梦阳, 韩烈保. 转OjDREB基因提高烟草耐盐能力的研究 [J]. 中国烟草学报, 2012, 18(4): 72-76.LI Cong, GUO Mengyang, HAN Liebao. Overexpression ofOjDREBgene increases tolerance to salt in transgenic tobacco [J]. Acta Tabacaria Sinica, 2012, 18(4): 72-76.
[16] Saijo Y, Hata S, Kyozuka J, et al. Over-expression of a single Ca2+-dependent protein kinase confers both cold and salt/drought tolerance on rice plants [J]. Plant Journal for Cell & Molecular Biology, 2000, 23(3): 319-327.
[17] Dubrovina A S, Kiselev K V, Khristenko V S, et al.VaCPK20, a calcium-dependent protein kinase gene of wild grapevineVitis amurensis, Rupr. mediates cold and drought stress tolerance [J]. Journal of Plant Physiology, 2015, 185:1-12.
:TIAN Xiaohan, PANG Xuebing, ZHU Jianbo, et al. Effect of over-expression ofSaussurea involucrataSikCDPK1gene on improving cold tolerance in transgenic tobacco [J]. Acta Tabacaria Sinica, 2016, 22(6)
◇相关论文推荐
转OjDREB基因提高烟草耐盐能力的研究
【作者】 李聪,郭梦阳,韩烈保
中国烟草学报,2012年第4期
摘要:利用农杆菌介导法将沿阶草OjDREB基因转入烟草植株中。通过RT-PCR检测,获得转OjDREB基因的烟草植株。以400mmol/L NaCl处理转基因烟草植株和野生型对照10 d后,结果显示:转基因烟草体内叶绿素含量和SOD酶活性是野生型对照的16.98倍和1.91倍;体内的MDA含量和电解质渗透率分别是野生型对照的59.23%和55.07%,说明过量表达OjDREB基因可以提高烟草的耐盐能力。
关键词:沿阶草;OjDREB基因;耐盐性;烟草
Effect of over-expression ofSaussurea involucrata SikCDPK1gene on improving cold tolerance in transgenic tobacco
TIAN Xiaohan, PANG Xuebing, ZHU Jianbo, ZHU Xinxia
Key Laboratory of Agricultural Biotechnology,College of Life Science, Shihezi University, Shihezi 832000, Xinjiang Uygur Autonomous Region, China
CDPKs(calcium-dependent protein kinases) play a very important role in abiotic stress response. Real-time PCR was used to analyze expression ofSikCDPK1gene to cold stress inSaussurea involucrata. Results showed that endogenousSikCDPK1gene was induced by cold stress, andSikCDPK1expression reached the peak after 3 h. TheSikCDPK1gene was constructed on dicotyledonous transformation vector pCAMBIA2300, which was composed of a strong promoter of CaMV35S, and the gene was introduced into tobacco NC89 byAgrobacturium-mediated transformation method to identify the gene function. It turned out that after cold stress, cold resistance of transgenic tobacco plants was significantly enhanced, and the content of proline, soluble protein and the activities of POD and SOD in transgenic tobacco plants were higher than that of wild type, whereas the MDA content and electrolyte leakage were lower than that of wild type plants. These results indicated thatSikCDPK1gene could enhance the resistance of plants to cold stress by accumulating more osmotic adjustment substances, enhancing the activity of the antioxidant system and maintaining the stability of the cell membrane.
Sasussured involucrataKar.et Kir;SikCDPK1; low temperature; expression analysis; transgenosis
田晓涵,庞学兵,祝建波,等. 过表达天山雪莲SikCDPK1基因提高转基因烟草耐低温能力的机制初探[J]. 中国烟草学报,2016,22(6)
新疆生产建设兵团“新疆特色植物基因资源研究与利用创新团队”(2014CC005); 石河子大学育种专项(gxjs2014-yz04)
田晓涵(1990—),硕士,研究方向为环境生物技术,Email:723745781@qq.com
朱新霞(1968—),Email:302641316@qq.com
2016-06-12

