活血解毒方对干燥综合征小鼠颌下腺AQP5表达的影响
李方凯,谷新怡,崔民英,王东峰,王 敏,朱跃兰△
1北京中医药大学东方医院,北京100078;2北京中医药大学第三附属医院
活血解毒方对干燥综合征小鼠颌下腺AQP5表达的影响
李方凯1,谷新怡1,崔民英2,王东峰2,王 敏2,朱跃兰1△
1北京中医药大学东方医院,北京100078;2北京中医药大学第三附属医院
目的:探讨活血解毒方对干燥综合征(SS)模型小鼠颌下腺A Q P5表达的影响。方法:以BA BL/C小鼠为正常组,选取N O D小鼠为SS模型并随机分为模型组、活血解毒方组(H X JD)和白芍总苷胶囊组(TG PC),给药后观察各组小鼠颌下腺形态学和分泌功能的改变,并采用SA BC法检测各组小鼠颌下腺A Q P5表达水平的变化。结果:药物干预8周后,模型组较正常组表达A Q P5明显降低;与模型组比较,TG PC组和H X JD组A Q P5表达均显著升高;TG PC组和H X JD组之间A Q P5表达无明显差异。结论:活血解毒方可改善SS模型鼠颌下腺腺泡的分泌功能,提高其颌下腺指数,增加SS模型鼠的唾液分泌量;其作用机理与上调A Q P5的表达水平有关。
干燥综合征;活血解毒方;A Q P5
干燥综合征(sjogren′s syndrome,SS)是一种累及全身多系统的慢性炎症性自身免疫疾病,病理特征为高度淋巴细胞浸润,主要侵犯唾液腺和泪腺等外分泌腺,临床症状主要表现为口眼干燥、关节肌肉疼痛、皮肤黏膜干燥等,现代医学对SS病因和发病机制的研究尚未达成一致。近年相关研究结果表明[1],水通道蛋白(aquaporins,water channel protein,AQ P)在SS发病过程中发挥重要作用,而AQ P5是最早被确定分布在涎腺腺泡细胞的水通道蛋白,它构成涎腺唾液分泌的通道而具有水转运的特性。SS的中医病机以阴津亏虚为基础,以燥毒瘀互结为病理关键,同时燥毒贯穿始终,运用清燥解毒、活血化瘀法调节颌下腺AQ P5的分布,从而改善腺体的分泌功能,在改善SS患者临床症状方面取得了一定疗效。在此基础上,本研究从腺体分泌功能变化方面探讨活血解毒方对SS的干预途径,为临床应用活血解毒方治疗SS提供生物学依据。从腺体分泌功能变化方面着手,研究AQ P5表达在SS发病机制中的作用,初步探讨活血解毒方对SS模型鼠腺体分泌功能的影响及其干预机理,测定SS模型鼠颌下腺AQ P5的表达。
1 材料与方法
1.1 动物 9~10周龄雌性BALB/c小鼠,体质量18~20 g[维通利华实验动物技术公司,实验动物合格证号:SCXK(京)2006-0009];9~10周龄雌性N O D/Ltj小鼠,体质量16~18 g[华阜康生物技术有限公司,实验动物合格证号:SCXK(京) 2009-0004])。
1.2 药品 活血解毒方(丹参、当归、川芎、鸡血藤、玄参、连翘、甘草、生地黄、麦冬等由附属医院中草药房提供并统一煎煮);白芍总苷胶囊(帕夫林,宁波立华制药有限公司,批号:110916)根据体表面积换算成小鼠用量并按比例配成23.4m g/m L。
1.3 试剂 Anti-AQ P5抗体(美国Abcam公司);SABC免疫组化染色试剂盒(上海联硕生物科技有限公司);DAB染色试剂盒(北京赛驰生物科技有限公司);苏木素染色液(上海研域生物科技有限公司)等。
1.4 仪器 EP214C电子分析天平(O H AUS,美国);图像分析系统Im age Pro Pl us5.0;正置显微镜BX51(O l ym pus,日本)等。
1.5 分组与给药 正常组为BALB/c小鼠6只,将N O D/Ltj小鼠18只按体质量随机分为模型组、白芍总苷组(TGPC)、活血解毒方组(H XJ D)各6只;各组用药量根据人与小鼠体表面积比计算等效剂量,小鼠灌胃体积为10m L/kg。
1.6 标本收集 各组均在第1周起给药,每天1次至第8周;8周后,小鼠摘眼球放血并解剖摘取颌下腺进行指标检测;取一侧新鲜颌下腺组织,10%甲醛固定,常规脱水、透明,石蜡包埋,切片。
1.7 指标测定
1.7.1 小鼠一般状态 进食量的测定:每日测定各组小鼠24小时的饲料重量之差,计为进食量;饮水量的测定:每日测定各组小鼠24小时的水瓶重量之差,计为饮水量。
1.7.2 小鼠颌下腺功能变化观察 颌下腺指数:药物干预8周后取一侧颌下腺称重,颌下腺指数=颌下腺重量(m g)/小鼠体质量(g);唾液分泌量:给药后动态测定小鼠唾液分泌量,将干棉球放入口颊内3分钟后取出称湿重,唾液分泌量(m g)=湿重(m g)-干重(m g)。
1.7.3 小鼠颌下腺A Q P5表达测定 运用免疫组化SABC法进行AQ P5表达染色:标本常规脱蜡、水化,抗原修复,PBS洗5分钟;滴加兔血清封闭液,室温20分钟;滴加一抗AQ P5抗体,室温1小时,PBS洗3次各2分钟;滴加二抗兔抗山羊IgG,室温20分钟,PBS洗3次各2分钟;滴加SABC试剂,室温20分钟,PBS洗4次各5分钟;DAB试剂盒染色,蒸馏水洗涤,苏木素复染2分钟;脱水、透明、封片,显微镜下观察。
1.8 统计学方法 数据应用SPSS 17.0统计学软件进行分析,计量资料以(±s)表示,组间多重比较采用LSD-t检验,方差不齐则用Gam es-H ow el l检验,P<0.05为差异有统计学意义。
2 结果
2.1 小鼠体质量 正常组小鼠体质量随时间稳定增加,与模型组比较在第4周起体质量低于正常组(P<0.05)。第8周时,模型组、H XJ D组及TGPC组体质量低于正常组(P<0.05);与模型组相比,H XJ D组体质量升高(P<0.05);而TGPC组差异无统计学意义(P>0.05);H XJ D组和TGPC组相比差异无统计学意义(P>0.05),见表1。
表1 小鼠体质量变化情况(±s) g
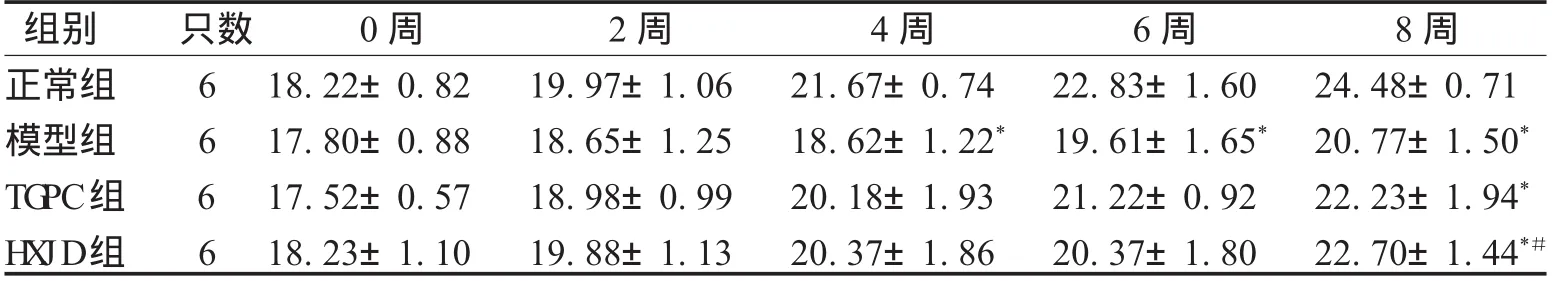
表1 小鼠体质量变化情况(±s) g
注:*表示与正常组比较,P<0.05;#表示与对照组比较,P<0.05。
2 4 6 8
2.2 小鼠颌下腺指数 与正常组比较,对照组、TGPC组、H XJ D组小鼠颌下腺萎缩(P<0.01),而TGPC组、H XJ D组颌下腺指数高于对照组,但差异无统计学意义(P>0.05),见表2。
表2 各组小鼠颌下腺指数比较(±s) m g/g
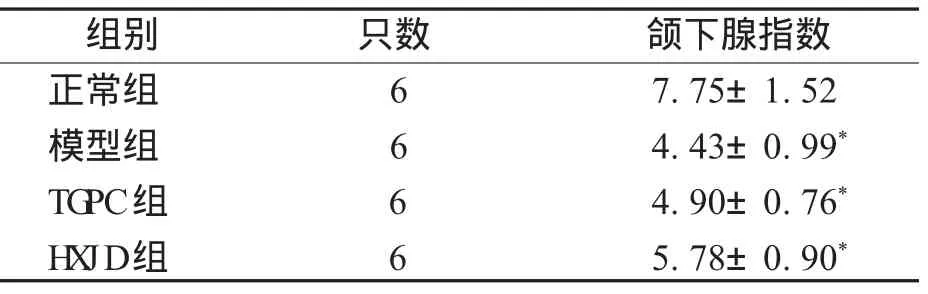
表2 各组小鼠颌下腺指数比较(±s) m g/g
注:*表示与正常组比较,P<0.01。
组别 只数 颌下腺指数正常组 6 7.75±1.52模型组 6 4.43±0.99*TG PC组 6 4.90±0.76*H X JD组 6 5.78±0.90*
2.3 小鼠唾液分泌量变化 正常组唾液分泌量一直保持稳定;从实验开始至结束时,与正常组相比,对照组、TGPC组、H XJ D组唾液分泌量均降低(P<0.01);3组组间比较,在6周时差异无统计学意义(P>0.05),但到第8周时,与对照组相比,TGPC组和H XJ D组唾液分泌量有所增加,差异有统计学意义(P<0.05);TGPC组和H XJ D组相比差异无统计学意义(P>0.05),见表3。
表3 各组不同时间点唾液流量比较(±s) m g/m i n
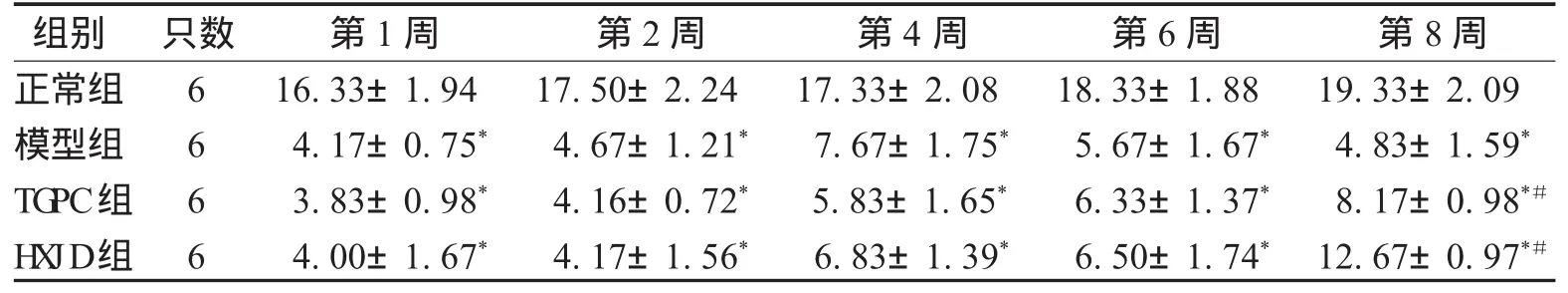
表3 各组不同时间点唾液流量比较(±s) m g/m i n
注:*表示与正常组比较,P<0.01;#表示与对照组比较,P<0.05。
组别 只数 第1周 第2周 第4周 第6周 第8周正常组 6 16.33±1.94 17.50±2.24 17.33±2.08 18.33±1.88 19.33±2.09模型组 6 4.17±0.75* 4.67±1.21* 7.67±1.75* 5.67±1.67* 4.83±1.59*TG PC组 6 3.83±0.98* 4.16±0.72* 5.83±1.65* 6.33±1.37* 8.17±0.98*#H X JD组 6 4.00±1.67* 4.17±1.56* 6.83±1.39* 6.50±1.74* 12.67±0.97*#
2.4 小鼠颌下腺A Q P5表达测定 使用SABC免疫组化法对颌下腺AQ P5表达进行染色,其主要分布于腺泡的顶膜、侧膜和导管上皮细胞等处[2],染色结果判定以细胞膜和细胞质染色呈现淡黄色至棕褐色为阳性细胞标准,各组染色情况见图1—4。
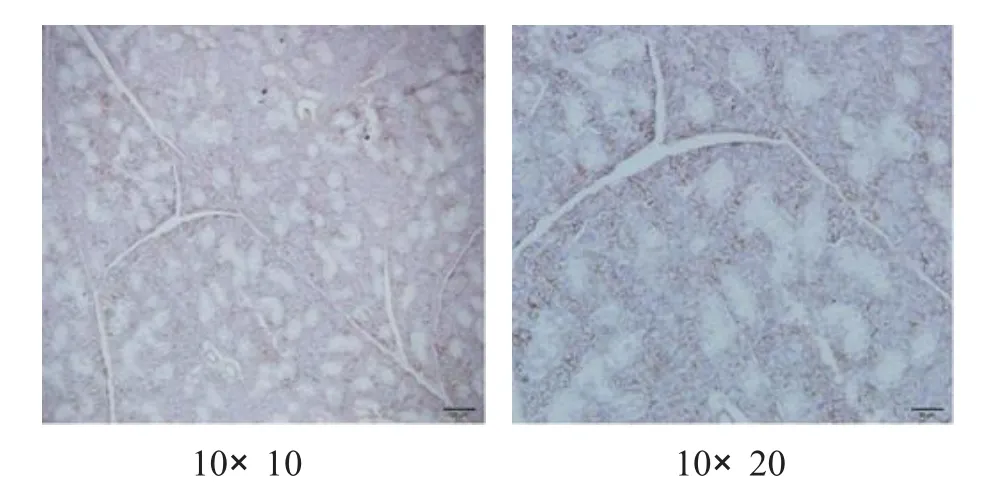
图1 正常组
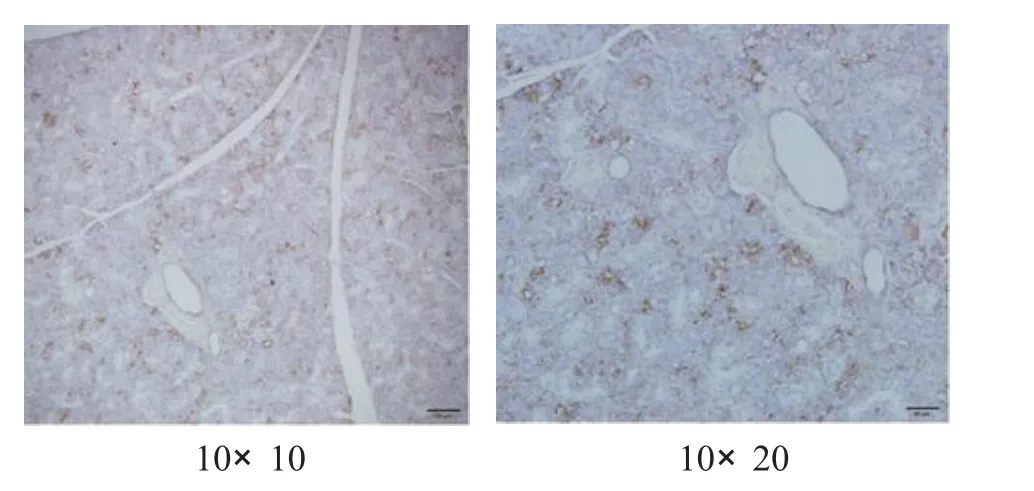
图2 对照组
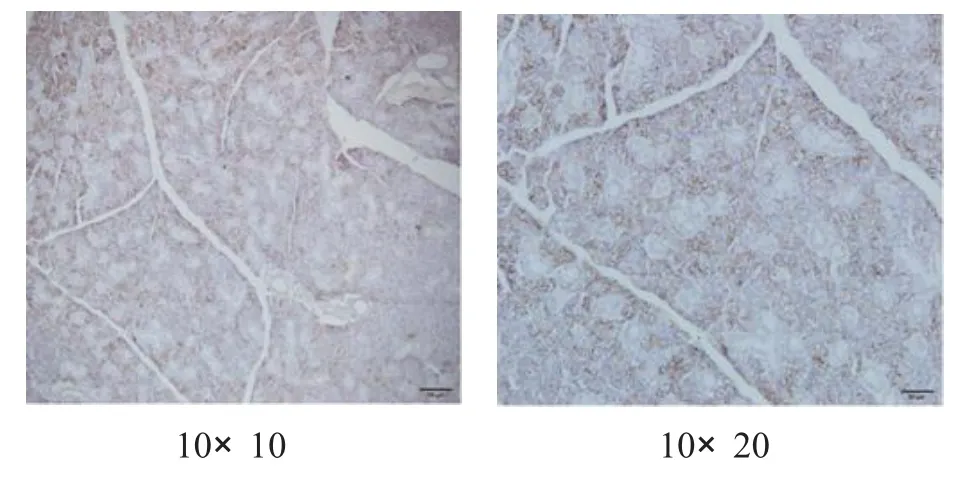
图3 TG PC组
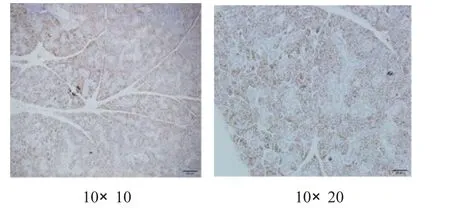
图4 H X JD组
使用Im age Pro Pl us 5.0软件图像半定量分析技术,在BX51 O l ym pus正置显微镜下对图片染色强度进行半定量分析,测定阳性细胞染色的积分光密度值(IO D),染色越强则IO D值越高,表示蛋白表达量越多,见表4—5。
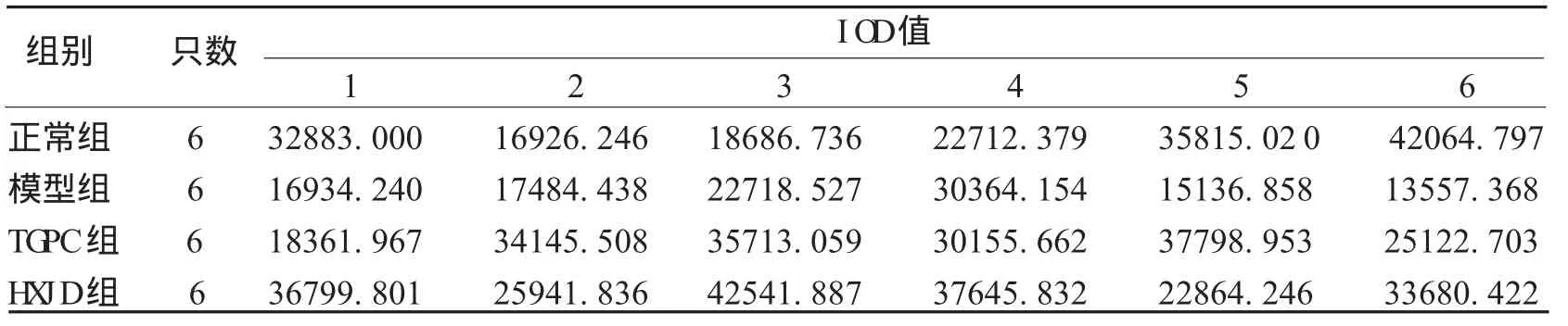
表4 各组IO D值比较
表5 各组IO D值比较(±s)
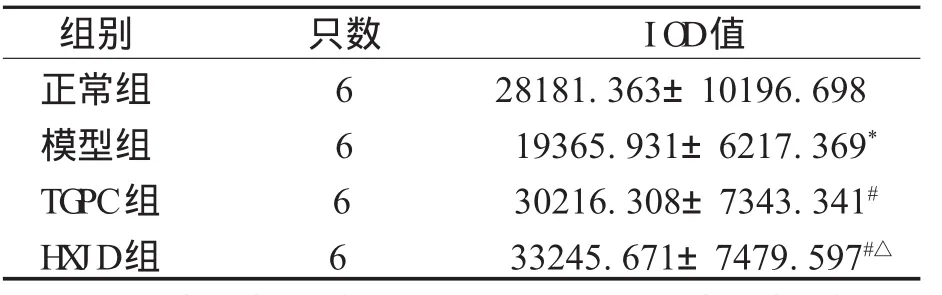
表5 各组IO D值比较(±s)
注:*表示与正常组比较,P<0.05;#表示与对照组比较,P<0.05,△表示与TG PC组比较,P>0.05。
组别 只数 IO D值正常组 6 28181.363±10196.698模型组 6 19365.931±6217.369*TG PC组 6 30216.308±7343.341#H X JD组 6 33245.671±7479.597#△
3 讨论
SS的发病机制至今尚未阐明,目前对SS发病机制的研究逐渐从引起外分泌腺组织损伤的免疫因素转移到支配腺体的神经受体,对后者启动和延续因素的进一步深入研究是彻底阐明SS发病机制的关键[3]。近年来,分布在涎腺分泌细胞表面、对水分子具有高通透性的AQ P5作为自主神经系统调控涎腺过程中的效应蛋白,逐渐引起了SS发病机制研究领域的兴趣。关于AQ P5在SS发病机制的报道最早见于M oore等[4]的研究中,此后的研究则主要集中在AQ P5在涎腺中的分布及腺泡细胞内的转运异常,应用免疫组织化学或免疫荧光染色进行定量分析[5-7]。据目前研究推测,AQ P5是抗Ⅲ型毒蕈碱样胆碱能受体(m useari ni c receptor,M 3R)胞内信号传导下游的效应蛋白之一,M 3R的激活能使AQ P5蛋白上调,二者共同参与SS的发病[8],因此作为M 3R效应蛋白的AQ P5将成为SS病机和治疗研究的主要方向。
总结近年来诸多医家对SS的中医病因病机的认识,本病基于素体禀赋不足,以阴津亏虚为本,燥、毒、瘀为标,并且后者是病情发展变化的关键因素[9-10];而燥盛蓄积,日久成毒,瘀血与燥毒互结,成为本病缠绵难愈的重要原因[11]。SS之燥具有邪毒的性质,此毒邪寓于燥邪却猛于燥邪,更易于销烁津液、败坏形体,同时燥、毒、瘀三者相互结合,形成了本病纷繁复杂的病因病机。与此同时,现代药理研究表明活血解毒中药具有抑制腺体自身免疫炎症性破坏、改善腺体局部免疫微环境、挽救和保护腺体功能的作用。因此,围绕燥毒的核心病理环节及燥毒瘀互结的病理特点,在SS发病早期重视解毒清燥、活血化瘀法的运用,配合益气养阴生津等扶正之品,在改善患者临床症状方面疗效肯定。
基于上述关于SS的中西医病因病机理论,本研究初步探讨了活血解毒方对SS模型鼠颌下腺AQ P表达的影响及其干预机制,分析研究结果:1)活血解毒方能改善SS模型鼠的颌下腺功能,显著上调AQ P5的表达;2)与正常组相比,对照组AQ P5表达明显降低,而治疗组AQ P5表达无明显差异;3)与对照组相比,TGPC组和H XJ D组AQ P5表达均有升高,但组间比较差异无统计学意义(P>0.05)。因此认为,SS模型鼠唾液分泌量减少、颌下腺指数降低与其颌下腺AQ P5表达显著下调有关,这与Stei nfel d等[6]的研究结果一致,说明颌下腺AQ P5表达减低与SS发病和口干等症状相关。
总之,活血解毒方可以改善SS模型鼠颌下腺分泌功能,提高颌下腺指数,增加唾液分泌量,其作用机理与上调颌下腺AQ P5的表达水平有关。
[1]Raina S,Preston GM,Guggino WB,et al.Molecular cloning and characterization of an aquaporin cDNA fromsa-livary,lacrimal,and respiratory tissues[J].J Biol Chem,1995,270(4):1908-1912.
[2]Gresz V,Kwon TH,Hurley PT,et al.Identification and localization of aquaporin water channels in humansalivary glands[J].Am J Physiol Gastrointest Liver Physiol,2001,281(1):247-254.
[3]林华鹏,庄俊汉.干燥综合征发病机制研究进展[J].中国老年保健医学,2007,5(2):36-37.
[4]Moore M,Ma T,Yang B,et al.Tear secretion by lacrimal glands in transgenic mice lacking water channels AQP1,AQP3,AQP4 and AQP5[J].Exp Eye Res,2000,70(5):557-562.
[5]Gresz V,Kwon TH,Hurley PT,et al.Identification and localization of aquaporin water channels in human salivary glands[J].Am J Physiol,2001,281(1):247-254.
[6]Steinfeld S,Cogan E,King LS,et al.Abnormal distribution of aquaporin-5 water channel protein in sa-livary glands from sjo¨gren′s syndrome patients[J]. Lab Invest,2001,81:143-148.
[7]Beroukas D,Hiscock J,Jonsson R,et al.Subcellular distributi on of aquaporin5 in salivary glands in primary sjo¨gren′s syndrome[J].Lancet,2001,358(9296):1875-1876.
[8]李菁,赵岩,唐福林,等.水分子通道蛋白-5在干燥综合征唇腺中的异常表达[J].中华风湿病学杂志,2005,9(8):453-457.
[9]张前德,谈文峰,杨宁.干燥综合征的中医诊疗思路探讨[J].江西中医药,2003,34(11):11-12.
[10]赵敏,王金淘,鲍英存,等.干燥综合征的中医辨证论治现状[J].西部中医药,2013,26(11):133-136.
[11]马武开.干燥综合征辨证分型探讨[J].光明中医,2001,16(1):30-32.
The Effects of HuoXue JieDu Prescription on AQP5 Expressions in the Salivary Gland of SS Mice
LI Fangkai1,GU Xinyi1,CUI Minying2,WANG Dongfeng2,WANG Min2,ZHU Yuelan1△
1 Dongfang Hospital of Beijing University of Chinese Medicine,Beijing 100078,China;2 The Third Affiliated Hospital of Beijing University of Chinese Medicine
Objective:To explore the effects of HuoXue JieDu prescription on AQP5 expressions in the salivary gland of sjogren's syndrome(SS)mice.Methods:BABL/C mice were chosen as the normal group,NOD mice as SS models,and randomized into the model group,HuoXue JieDu(HXJD)prescription group and total glucosides of paenoy capsule(TGPC)group.Morphological changes and secretion functions of salivary gland in the mice of different groups were observed after the medication,and the levels of AQP5 expressions were determined by adopting SABC method.Results:After intervened for eight weeks with the medicine,the model group was lower than the normal group in AQP5 expressions obviously;compared with the model group,AQP5 expressions raised notably in TGPC group and HXJD group obviously,and there was no obvious difference in the comparison between TGPC group and HXJD group.Conclusion:HuoXue JieDu prescription could improve acini secretion function of salivary gland of SS mice,improve the index of salivary gland,and increase saliva secretion of SS mice,its mechanism is related to AQP5 expressions up regulation.
sjogren's syndrome;HuoXue JieDu prescription;AQP5
R285.5
A
1004-6852(2016)09-0019-04
2015-09-22
李方凯(1986—),男,硕士学位,医师。研究方向:风湿免疫疾病的中医药防治。
△通讯作者:朱跃兰(1959—),女,博士学位,主任医师,教授。研究方向:风湿免疫疾病的中医药防治。

