月桂酸氯甲酯的合成
陈根花,陈文斌,朱英超
(浙江司太立制药股份有限公司,浙江仙居317300)
月桂酸氯甲酯的合成
陈根花,陈文斌,朱英超
(浙江司太立制药股份有限公司,浙江仙居317300)
月桂酸与固体三光气在DM F的引发下制得月桂酰氯,再与多聚甲醛、无水氯化锌,在二氯甲烷中于10℃下进行反应,即可制得较纯的月桂酸氯甲酯,总收率为95.0%,结构经气相色谱-质谱、核磁共振氢谱确证。该化合物是阿德福韦双月桂酰氧甲酯的重要中间体。
月桂酸氯甲酯;阿德福韦;中间体;合成
月桂酸氯甲酯,又名氯甲基十二酸酯,是重要的医药中间体,可用于合成一种具有肝靶向抗乙肝病毒作用的前药—阿德福韦双月桂酰氧甲酯。该前药是在核苷类抗病毒药物阿德福韦上连接具有肝靶向作用的月桂酸甲氧基基团,肠溶性好且生物利用性高。其摄入体内后富集于肝脏中再分解,这样可以减少用量、提高疗效、降低肾药浓度、减少毒副作用,克服了阿德福韦在体内离子化、肠溶性差、不易被吸收、生物利用度低、不能直接使用等缺陷,成为一种疗效理想的抗乙肝前药[1]。
月桂酸氯甲酯有两种传统的合成方法[2](图1):①用月桂酸经过中间体月桂酰氯再和多聚甲醛在路易斯酸的存在下反应制得目标化合物;②用月桂酸与氯甲基氯磺酸在四正丁基硫酸氢铵作相转移催化剂的条件下反应直接制得。
方法一:由月桂酰氯与多聚甲醛在路易斯酸的催化下反应,报道的收率都不高,只有45%[3],70%[4]左右,同时需要过柱提纯,且传统使用二氯亚砜氯化制备月桂酰氯具有腐蚀性大,副产物异味大等缺点。方法二:报道的反应条件虽然较温和,但使用了潜在的致癌烃化剂氯甲基氯磺酸酯,而且该合成方法的转化率虽有所提高,达84%左右[2],但需要过硅胶柱提纯,大大加大了溶剂的使用量,限制了产品的工业化生产。

图1 两种经典的目标化合物的合成路线图
本研究以月桂酸为起始原料,与固体三光气反应,在DMF的引发下制得月桂酰氯,克服了传统使用二氯亚砜氯化的缺陷,三光气可以准确计量、毒性低、使用安全方便,而且反应条件温和、选择性好、污染小、收率高。随后月桂酰氯与多聚甲醛在二氯甲烷作溶剂,无水氯化锌作催化剂的条件下,10℃反应48 h,反应液用5%的碳酸钠溶液洗至中性,无需过柱,即可得到含量为99.4%,单杂为0.2%以下的月桂酸氯甲酯产品。摩尔总收率为95.0%(以月桂酸计)。该工艺简单,收率高,适合工业化生产。合成路线见图2。

图2 本研究的合成路线图
1 实验部分
1.1实验原料
月桂酸(工业级),三光气(工业级),多聚甲醛(工业级),氯化锌,氮,氮二甲基甲酰胺,碳酸钠。
1.2月桂酰氯的合成
向连有尾气吸收装置的(以氢氧化钠水溶液为吸收液)500mL的三颈瓶中加入100 g(0.5mol)月桂酸,装上温度计,加热升温至50℃,搅拌,待料液全部溶清后,再加入5 g DMF催化剂,升温至55℃~60℃,缓慢加入三光气59.2 g(0.2mol),投料完毕后,稍稍升温,控制温度在55℃~60℃,保温反应2 h,减压蒸馏,收集145℃~150℃(2.1~2.3 kPa)馏分,得到无色透明液体108.4 g,气相含量为99.6%,摩尔收率为99.0%。
1.3月桂酸氯甲酯的合成
在室温下,在装有干燥管、温度计的500 mL的三颈瓶中加入以上所得的108.4 g(0.495mol)的月桂酰氯,300mL二氯甲烷,再加入2.17 g无水氯化锌作催化剂,即月桂酰氯重量的2%,开始搅拌,当体系温度恒定在10℃时,加入19.3 g(0.644 mol)多聚甲醛,保温48 h,停止反应,用适量的5%碳酸钠水溶液洗至中性,分层,收集有机相,再用50mL的二氯甲烷萃取水相,合并有机相,用20 g无水硫酸镁干燥,旋蒸,得到118.3 g的目标化合物,气相含量为99.4%,摩尔收率为96.0%。MS(EI)m/z 248.2(M+),183.2(M-OCH2Cl)+,121(M-C9H20)+;1H NMR(400 MHz,CDCl3)δ:0.89(t,J =6.8Hz,3H),1.26~1.30(m,16H),1.61~1.68(m,2H),2.39 t,J=7.6Hz,2H),5.70(s,2H)。
2 结果与讨论
为了确定最优的反应条件,我们分别对两个合成步骤的主要影响因素温度和配比进行详细的研究。
2.1温度对月桂酰氯合成的影响
按1.2所述投料反应,其它不变,只改变反应温度,我们发现如果温度没有到达55℃时,反应2 h后取样检测,基本没有月桂酰氯的生成,通过尾气吸收也可以观察到体系基本无气泡产生,说明反应温度过低无法引发该反应;当体系温度高于60℃时,反应变得剧烈起来,同时月桂酸的二缩合物含量明显升高,我们认为温度过高可能导致月桂酸在该体系中缩合成酯,带来新的杂质,而且缩合产生的水分使月桂酰氯水解,如此循环而不向主反应方向进行,从而给后处理带来很大的麻烦,较大地影响收率及纯度。通过温度筛选,我们认为55℃~60℃为该步反应的最佳温度,反应很温和,且蒸出的月桂酰氯的气相含量可达99.6%,摩尔收率为99.0%。具体数据见表1。
2.2月桂酸与三光气摩尔配比对月桂酰氯合成的影响
按1.2所述投料反应,改变三光气的投料量,其它因素不变,实验结果表明:当月桂酸与三光气摩尔配比为5:2时,反应很温和,同时月桂酰氯的气相含量及收率最高;当三光气的占比增大时,反应更剧烈,且转化率稍有回落;二者等当量时又反应不彻底,故确定月桂酸与三光气最佳摩尔配比为5:2。具体数据见表2。

表1 反应温度对月桂酰氯合成的影响
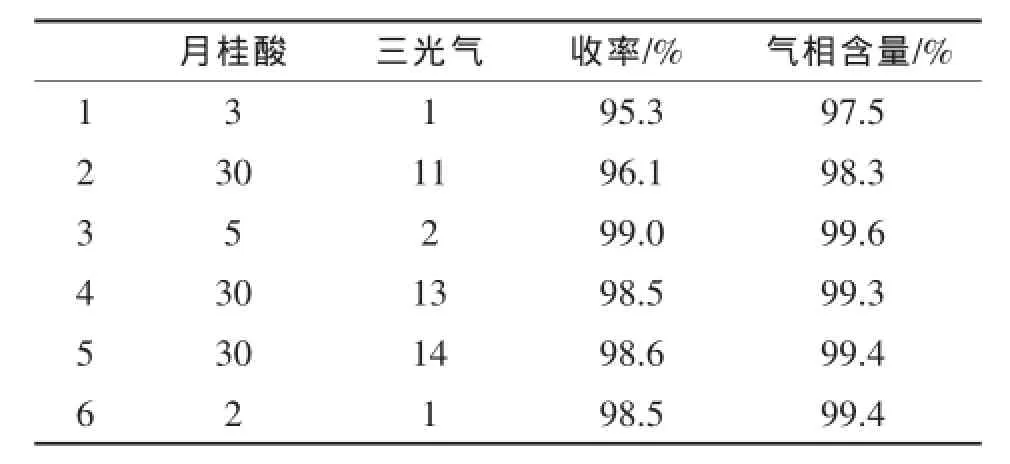
表2 月桂酸与三光气投料配比对月桂酰氯合成的影响
2.3温度对月桂酸氯甲酯合成的影响
按1.3操作反应,只改变反应的温度,发现温度为10℃的反应得到的产品含量及收率是最好的。温度太低,反应不彻底,使用5%的碳酸钠水溶液洗涤,气相纯度可以有所升高,但收率影响较大,温度高于10℃后,收率及含量明显降低,杂质含量明显升高。具体数据见表3。2.4月桂酰氯与多聚甲醛摩尔配比对月桂酸氯甲酯合成的影响

表3 反应温度对月桂酸氯甲酯合成的影响
按1.3操作反应,只改变多聚甲醛的投料量,当月桂酰氯与多聚甲醛摩尔配比为1:1.3时,反应的效果最佳,得到的产品含量及收率都较理想;当多聚甲醛的摩尔数增加时,收率及含量有所下降,详细的考察数据见表4。

表4 月桂酰氯与多聚甲醛投料配比对月桂酸氯甲酯合成的影响
3 结论
该合成方法能够有效控制各杂质的生成,使用三光气合成酰氯,能够较简便、环境较友好地得到高纯度、高收率的月桂酰氯,气相含量达99.6%,摩尔收率为99.0%,可直接用于进一步的酯化反应;酯化反应结束时使用5%碳酸钠水溶液洗涤,可以去除大部分月桂酸、月桂酸二缩合物、月桂酰氯等酸性杂质,起到提纯月桂酸氯甲酯的作用,使得产品气相纯度高达99.4%,且单杂小于0.2%,摩尔收率为96.0%,无需过柱纯化,从而大大降低成本,缩短生产周期。本合成方法简便、高效、成本低,本公司吨位级放大生产,都无明显的放大效应,有较好的工业应用前景。
[1]秦引林,张荣久,曹庆先.一种具有肝靶向抗乙肝病毒作用的前药:CN,101307076[P].2008-11-19.
[2]Azema J,Guidetti B,Malet-Martino M,et al.Efficient ap proach to acyloxymethyl esters of nalidixic acid and in vitro evaluation as intra-ocular prodrugs[J].Bioorganic& Medicinal Chemistry,2006,14(8):2569-2580.
[3]Higuchi T,Higuchi K W,Wong O,et al.Imidazolin-2-ones:US,4845233[P].1989-07-04.
[4]Bodor N S,Zupan J A.Esters of cromoglycates:US,4189571[P].1980-02-19.
Synthesis of Chloromethyl Dodecanoate
CHEN Gen-hua,CHENWen-bin,ZU Ying-chao
(Zhejiang Starry Pharmaceutical Co.,Ltd.,Xianju,Zhejiang 317300,China)
Chloromethyl dodecanoate,the key intermediate of adefovir dilauroyl oxygenmethyl ester,was synthesized from lauric acid.Lauroyl chloride,which was prepared by the reaction of lauric acid and bis(trichloromethyl)carbonate(BTC)in the presence of DMF,reacted with paraformaldehyde in DCM under the catalysis of zinc chloride to provide chloromethyl dodecanoate.The overall yield was up to 95.0%and the structure of the target compound was confirmed by1HNMR and GC-MS.
chloromethyl dodecanoate;adefovir;intermediate;synthesis
1006-4184(2016)10-0010-03
2016-04-24
陈根花(1980-),女,硕士研究生,工程师,从事原料药的合成及工艺研究。E-mail:chengenhua1223@163.com。

