手性三氟甲基胺类化合物的合成与应用
刘小华,徐国明,翁建新,刘景伟,张天明
(捷马化工股份有限公司,浙江龙游324400)
手性三氟甲基胺类化合物的合成与应用
刘小华,徐国明,翁建新,刘景伟,张天明
(捷马化工股份有限公司,浙江龙游324400)
手性三氟甲基胺类化合物是重要的医药、农药中间体。从不同三氟甲基化试剂的角度出发概括了手性三氟甲基胺类化合物的合成,以及指出了其在药物领域的应用。
手性;三氟甲基胺;不对称合成;进展
手性三氟甲基胺类化合物在氟化学领域以及有机化学领域越来越受到化学家们的关注。胡金波[1]和Soloshonok[2]分别概括了不对称合成含氟的胺类化合物的方法,采用N-叔丁基-亚磺酰亚胺为底物,用手性的亚磺酰基团调节的方法。马军安[3-4]总结了不对称构建三氟甲基基团的手性碳原子的方法,以前手性的三氟甲基化合物为底物,如三氟乙醛、3,3,3-三氟丙酮酸酯、4,4,4-三氟乙酰乙酸乙酯、三氟甲基酮、三氟甲基烯烃及其衍生物。程桂林[5]等总结了以三氟甲基亚胺为底物手性三氟甲基胺类化合物的合成。本文从不同三氟甲基化试剂的角度概括了手性三氟甲基胺类化合物的合成。
1 手性三氟甲基胺类化合物的合成
1.1以三氟甲基-三甲基硅烷(TMSCF3)为三氟甲基化试剂
Prakash G K S等[6-7]采用三氟甲基-三甲基硅烷(TMSCF3)为三氟甲基化试剂,对映立体选择性合成一系列的三氟甲基取代的胺类化合物,提供了一种三氟甲基化试剂亲核加成,有效合成手性的三氟甲基胺类化合物及其衍生物的重要途径。Prakash G K S等[6-7]分别以N-叔丁基-亚磺酰亚胺和α,β-不饱和N-叔丁基-亚磺酰酮亚胺为底物,以四丁基铵二氟三苯基硅酸盐(TBAT)为可溶解的非金属的氟引发剂,进行三氟甲基化反应。采用此方法,三氟甲基化试剂TMSCF3与TBAT,或者以四甲基氟化铵(TMAF)为氟源,原位生成三氟甲基阴离子,立体选择性地加成到亚胺底物,分别合成一系列的手性三氟甲基胺类化合物[6]和烯丙基胺类化合物[6-7]。Prakash G K S等[8]同样以TMSCF3作为有效的三氟甲基亲核试剂,通过非对映立体选择性亲核加成α-氨基N-叔丁基-亚磺酰亚胺,合成手性的三氟甲基取代的邻二胺化合物。Prakash G K S等[8]选择了立体位阻较小的TMAF作为氟引发剂,Reetz氨基醛与Ellman(R)-N-叔丁基-亚磺酰胺进行缩合反应,生成中间体α-氨基N-叔丁基-亚磺酰亚胺,然后与三氟甲基化试剂进行亲核加成反应,得到光学活性的三氟甲基取代的邻二胺化合物。三氟甲基化试剂TMSCF3还被应用于对映立体选择性催化偶氮甲碱亚胺的三氟甲基化反应。Kawai H等[9]提出从反应活性和立体选择性的角度来看,传统的亚胺如N-磺酰亚胺都是比较差的底物选择,其立体选择性较差主要归因于N-磺酰亚胺的体积大小和构型易变性,转化率较低主要原因在于所生成的磺酰胺中间体对三氟甲基化试剂的亲核性较差。所以,Kawai H等[9]采用偶氮甲碱亚胺作为一种立体空间需要的亚胺等价物,在手性相转移催化剂(PTC)存在下,偶氮甲碱亚胺的构型是被限定的。在碱性(KOH)条件下,金鸡纳生物碱的溴化物作为手性催化剂,催化三氟甲基化试剂TMSCF3对一系列偶氮甲碱亚胺化合物进行亲核加成反应,高效地合成手性的三氟甲基胺类化合物,具有很高的对映立体选择性[9]。
Khiar等[10]报导了一种方便有效地对映立体选择性合成钙敏感受体调节剂NPSR-568的三氟甲基取代的同类物,并可以得到两种构型的对映异构体。由于异丙基亚磺酰基具有很高的反应活性,且空间立体位阻较大,易控制立体选择性,所以三氟甲基化试剂对N-异丙基-亚磺酰亚胺进行亲核加成反应,异丙基亚磺酰基能有效平衡反应活性和非对映立体选择性,获得较为满意的结果。三氟甲基化试剂TMSCF3的亲核加成反应,一般都是以三氟甲基阴离子的形式,但也可以以三氟甲基自由基的形式进行三氟甲基化反应。通常情况下,使用等当量的过渡金属复合物如银盐[11-13]或者铜盐[14]作为引发剂,催化Me3SiCF3的单电子氧化反应,产生所需的三氟甲基自由基。最近,Wang Y F等[15]发展了一种不需要过渡金属复合物引发,直接采用Ph I(OAc)2催化三氟甲基化试剂Me3SiCF3释放出三氟甲基自由基,与乙烯基叠氮化合物作用,生成α-三氟甲基取代的连氮化合物,可作为底物合成一系列有价值的医药农药中间体。
1.2以4-溴-1,1,1-三氟-2-丁烯为三氟甲基化试剂
除了Ruppert-Prakash三氟甲基化试剂(TMSCF3)以外,还可以采用其它的三氟甲基化试剂。卿凤翎等[16]以4-溴-1,1,1-三氟-2-丁烯为三氟甲基化试剂,对(R)-N-苄基-2,3-O-异亚丙基甘油醛亚胺进行三氟甲基烯丙基化,得到三氟甲基胺类化合物。从同一个三氟甲基衍生化的中间体出发,选择不同的合成路线,可分别生成Cbz保护的(2R,3S)-4,4,4-三氟异亮氨酸和Boc保护的(2R,3S)-4,4,4-三氟缬氨酸78,提供了一种有效合成手性的三氟甲基氨基酸的方法。
1.3以三氟甲基炔基锂为三氟甲基化试剂
卿凤翎等[17]采用三氟甲基炔基锂为三氟甲基化试剂,对各种取代的N-叔丁基-亚磺酰亚胺进行亲核加成反应,得到一系列的三氟甲基取代的炔丙基亚磺酰胺化合物。以醛亚胺为底物,可以通过选择不同极性的溶剂,调节产物的非对映立体选择性。对于N-叔丁基-亚磺酰酮亚胺底物,在亲核加成反应中加入三甲基铝试剂,可显著提高合成产率和非对映立体选择性。
2 手性三氟甲基胺类化合物的应用
药物分子中引入三氟甲基基团提高其生物活性的主要原因在于三氟甲基具有庞大的体积,是强吸电子基团(电负性为3.5 Pauling单位),可强烈影响相邻官能团的反应活性。α-三氟甲基胺在新药和新型材料的设计中可作为重要的手性合成子[19]。例如,含三氟甲基基团的多肽能缓解蛋白质降解,并可通过形成生物屏障提高蛋白质的吸收和渗透。三氟乙胺官能团[CH(CF3)NH]在多肽类似化合物中可取代肽键[CONH]。Zanda课题组提出手性的2,2,2-三氟乙胺可以取代平面的酰胺键,主要原因在于三氟甲基的特性可降低胺基的碱性,从而可以保持强的氢键作用,并与蛋白质水解的四面体过渡态结构类似。
目前,手性三氟甲基胺类化合物及其衍生物的研究处于有机氟化学研究和发展的最前沿,吸引越来越多的研究者在不同的化合物分子中同时引入三氟甲基和胺基基团,使其具有高的生物活性。图1中列举了一系列这类高生物活性的药物及其中间体:α-胺基羰基合成酶的不可逆抑制剂[20-21];苯乙醇胺N-甲基转移酶(PNMT)的抑制剂[22-23];中性肽链内切酶抑制剂[24];酪氨酸(TrK)激酶抑制剂,在治疗疼痛、癌症、炎症、神经病变及某些传染性疾病中起到重要作用[25];治疗风湿的制剂[26];γ-氨基丁酸(GABA)调节剂,其对GABA Aα5受体具有亲和性与选择性[27];抗癌制剂[28];酪氨酸蛋白激酶抑制剂,主要用于治疗骨髓增殖性疾病和乳腺癌[29-30];糖(肾上腺)皮质激素类似物或配体,调节糖皮质激素受体的功能,用于治疗其受体功能受限引发的各种疾病[31]。
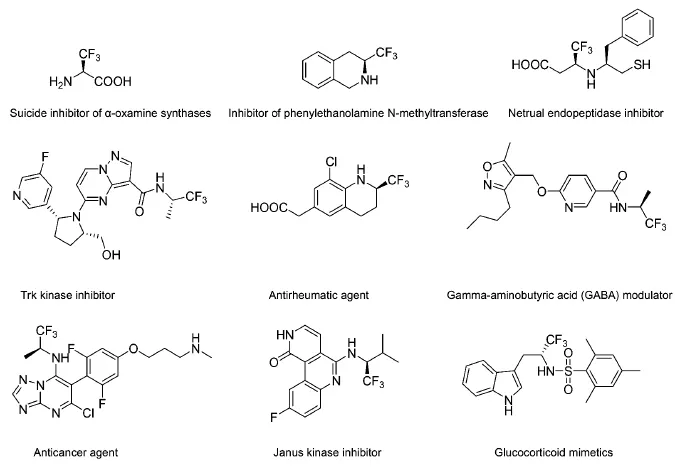
图1 具有三氟甲基胺基基团的高生物活性的手性化合物Fig.1 Biologically active compoundswith chiralα-trifluoromethylated aminemotif
3 总结与展望
尽管近年三氟甲基化反应取得重要进展,三氟甲基化反应仍将是有机氟化学的重要研究方向,特别是发展无金属存在下的三氟甲基化反应.三氟甲氧基化反应(CF3O)和三氟甲硫基化反应(CF3S)将会引起更多的关注。
[1]Liu J,Hu JB.Synthesis of fluorinated chiral amines using N-tert-butylsulfinyl imines[J].Future Med.Chem.,2009,1:875-888.
[2]Sorochinsky A E,Soloshonok V A.Asymmetric synthesis of fluorine-containing amines,amino alcohols,α-andβam ino acidsmediated by chiral sulfinyl group[J].J.Fluorine Chem.,2010,131:127-139.
[3]Ma J A,Cahard D.Asymmetric fluorination,trifluoromethylation,and perfluoroalkylation reactions[J].Chem. Rev.,2004,104:6119-6146.
[4]Nie J,Guo H C,Cahard D,et al.Asymmetric construction of stereogenic carbon centers featuring a trifluoromethyl group from prochiraltrifluoromethylated substrates[J]. Chem.Rev.,2011,111:455-529.
[5]程桂林.酶/金属催化合成手性α-三氟甲基胺的方法研究[D].杭州:浙江大学,2015.
[6]Prakash G K S,Mandal M,Olah G A.Stereoselective nucleophilic trifluoromethylation of N-(tert-butylsulfinyl)-im ines by using trimethyl(trifluoromethyl)-silane[J].Angew. Chem.Int.Ed.,2001,40:589-590.
[7]Prakash G K S,Mandal M,Olah G A.Asymmetric synthesis of trifluoromethylated allylic amines usingα,β-unsaturated N-tert-butanesulfinimines[J].Org.Lett.,2001,3: 2847-2850.
[8]Prakash G K S,Mandal M.Stereoselective synthesis of trifluoromethylated vicinal ethylenediamines withα-Amino N-tert-butanesulfinimines and TMSCF3[J].J.Am.Chem. Soc.,2002,124:6538-6539.
[9]KawaiH,Kusuda A,Nakamura S,etal.Catalytic enantioselective trifluoromethylation of azomethine im ines with trimethyl(trifluoromethyl)silane[J].Angew.Chem.Int.Ed.,2009,48,6324-6327.
[10]Fernández I,Valdivia V,Alcudia A,et al.Enantiodivergent approach to trifluoromethylated am ines:A concise route to both enantiomeric analogues of calcimimetic NPS R-568[J].Eur.,J.Org.Chem.,2010:1502-1509.
[11]Wang X,Xu Y,Mo F Y,et al.Silver-mediated trifluoromethylation of aryldiazonium salts:Conversion of amino group into trifluoromethyl group[J].J.Am.Chem.Soc.,2013,135:10330-10333.
[12]Hafner A,Bräse S.Ortho-trifluoromethylation of functionalized aromatic triazenes[J].Angew.Chem.Int.Ed.,2012,51:3713-3715.
[13]Ye Y D,Lee S H,Sanford M S.Silver-mediated trifluoromethylation of arenes using TMSCF3[J].Org.Lett.,2011,13:5464-5467.
[14]Danoun G,Bayarmagnai B,Grünberg M F,et al.Sandmeyertrifluoromethylation of arenediazoniumtetrafluoroborates[J].Angew.Chem.Int.Ed.,2013,52:7972-7975.
[15]Wang Y F,Lonca G H,Chiba S.PhI(OAc)2-Mediated radical trifluoromethylation of vinyl azides with Me3SiCF3[J]. Angew.Chem.Int.Ed.,2014,53:1067-1071.
[16]Chen Q,Qiu X L,Qing F L.Indium-mediated diastereoselectiveallylation of D-and L-glyceraldimineswith 4-bromo-1,1,1-trifluoro-2-butene:highly stereoselective synthesis of 4,4,4-trifluoroisoleucines and 4,4,4-trifluorovaline[J].J.Org.Chem.,2006,71:3762-3767.
[17]Chen X Y,Qiu X L,Qing F L.Asymmetric synthesis of trifluoromethylatedpropargylam ines via 1,2-additions of trifluoromethylacetylide to N-tert-butanesulfinyl imines[J].Tetrahedron,2008,64:2301-2306.
[18]Shibata N,Mizuta S,Kawai H.Recent advances in enantioselective trifluoromethylation reactions[J].Tetrahedron: Asymmetr.,2001,19:2633-2644.
[19]Howard JA K,Hoy V J,O'Hagan D,et al.How good is fluorine as a hydrogen bond acceptor[J].Tetrahedron,1996,52:12613-12622.
[20]Alexeev D,Baxter R L,Campopiano D J,et al.Suicide inhibition of a-oxamine synthases:structures of the covalent adducts of 8-amino-7-oxononanoate synthase with trifluoroalanine[J].Org.Biomol.Chem.,2006,4:1209-1212.
[21]Smits R,Cadicamo C D,Burger K,et al.Synthetic strategies to alpha-trifluoromethyl and alpha-difluoromethyl substituted alpha-amino acids[J].Chem.Soc.Rev.,2008,37:1727-1739.
[22]Grunewald G L,Galdwell TM,LiQ F,et al.Synthesis and evaluation of 3-trifluoromethyl-7-substituted-1,2,3,4-tetrahydroisoquinolines as selective inhibitors of phenylethanolamine N-methyltransferase versus theα2-adrenoceptor[J].J.Med.Chem.,1999,42:3315-3323.
[23]Grunewald G L,Lu J,Criscione K R,et al.Inhibitors of phenylethanolamine N-methyltransferase devoid ofα2-adrenoceptor affinity[J].Bioorg.Med.Chem.Lett.,2005,15: 5319-5323.
[24]MolteniM,Volonterio A,FossatiG,etal.Conjugated additions of amines and beta-amino alcohols to trifluorocrotonic acid derivatives:synthesis of psi[NHCH(CF3)]-retro-thiorphan[J].Tetrahedron Lett.,2007,48:589-593.
[25]Allen S,Andrews S S,Condroski K R,et al.Substituted pyrazolo[1,5-a]pyrimidine compounds as Trk kinase inhibitors:WO,2011006074A1[P].2011-01-13.
[26]Kohno Y,Awano K,Miyashita M,et al.Synthesis and antirheumatic activity of novel tetrahydro-6-quinolineacetic acid derivatives[J].Bioorg.Med.Chem.Lett.,1997,7: 1519-1524.
[27]Buettelmann B,Jakob-roetne R,Knust H,et al.Isoxazolepyridine derivatives as GABA modulators:WO,2010127978A1[P].2010-11-11.
[28]Zhang N,Ayral-Kaloustian S,Nguyen T,et al.Synthesis and SAR of[1,2,4]Triazolo[1,5-a]pyrimidines,a class of anticancer agentswith a uniquemechanism of tubulin inhibition[J].J.Med.Chem.,2007,50,319-327.
[29]Kozina E,Dinsmore C,Young J,et al.Inhibitors of janus kinases and/or 3-phosphoinositide-dependent protein kinase-1:WO,2008112217A1[P].2008-09-18.
[30]Siu T,Young J,Altman M,et al.Inhibitors of janus kinases:WO,2009035575 A1[P].2009-03-19
[31]Kuzmich D,DiSalvo D,Regan JR,et al.Glucocorticoid mimetics,methods ofmaking them,pharmaceutical compositions,and uses thereof:US,20060154925A1[P].2006-07-13.
Synthesis and App lication of Chiral Trifluoromethyl Am ines Com pounds
LIU Xiao-hua,XU Guo-m ing,WENG Jian-xin,LIU Jing-wei,ZHANG Tian-ming
(Jingma Chemical Co.,Ltd.,Longyou,Zhejiang 324400,China)
Chiral trifluoromethyl amine compounds are important intermediates in medicine and pesticide.The synthesis of chiral trifluoromethyl amineswas summarized from the point of view of different trifluoromethylating agents,and their applications in the field of pharmaceuticalswere pointed out.
chirality;trifluoromethyl amines;asymmetric synthesis;progress
1006-4184(2016)10-0001-04
2016-04-09
刘小华(1975-),男,浙江龙游人,工程师,主要从事农药和精细化工产品的研发与技术管理工作。E-mail:lxh75925@163. com。

