黄曲霉毒素污染控制的研究进展
沈青山,周 威,莫海珍,胡梁斌*
(河南科技学院食品学院,河南 新乡 453003)
黄曲霉毒素污染控制的研究进展
沈青山,周 威,莫海珍,胡梁斌*
(河南科技学院食品学院,河南 新乡 453003)
黄曲霉可以引起粮油作物的霉变,其产生的毒素能够污染粮食及其制品,对人类和动物的健康造成极其严重的危害。本文概述了黄曲霉毒素在产生、运输和调控阶段的分子生物学过程,重点对黄曲霉毒素污染控制方法,如:遗传育种法、物理降解法及化学降解法等进行综述,并对植物源杀菌剂控制前期毒素污染,以及干预吸收控制后期毒素污染的前景进行展望。
黄曲霉毒素;污染;控制方法
黄曲霉(Aspergillus flavus,AF)属于曲霉属,是一种腐生真菌,常见于发霉的粮食和其他富含有机物的霉变物体表面。菌落可在马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基和沙氏琼脂培养基等营养表面上生长。菌体由许多复杂的分枝菌丝构成,孢子繁殖,适宜生长温度为25~42 ℃,最佳生长温度为37 ℃。最初黄曲霉被认为是无性繁殖只产生无性繁殖的孢子、分生孢子以及过冬的子实体和菌核。然而,最近研究表明黄曲霉也会处于有性状态,被归属于石座菌属[1]。黄曲霉的形态特征比较复杂,因此根据黄曲霉在30 ℃条件下察氏琼脂培养基(含质量分数为3%的NaNO3)中产生菌核的大小可以大致将其分为L型菌株和S型菌株,其中菌核直径大于400 μm为L型菌株,小于400 μm为S型菌株。L型菌株和S型菌株都可以产生黄曲霉毒素B1和黄曲霉毒素B2,而S型菌株只能产生黄曲霉毒素G1和黄曲霉毒素G2[2-3]。黄曲霉是酿造工业中的一种常见菌种,可与米曲霉一起用于酱油的生产。然而,生活中黄曲霉导致的食品污染给我们带来了很大危害。黄曲霉可使粮油作物发生霉变,其产生的次级代谢产物黄曲霉毒素(aflatoxin,AFT)同样能造成粮食污染。黄曲霉是一种机会致病菌,可以感染人和动物,使其患曲霉病甚至导致死亡。黄曲霉毒素对人和动物具有致癌性。在美国,每年由真菌毒素污染而造成的经济损失超过数十亿,其中由黄曲霉毒素导致的污染占绝大部分[4]。
黄曲霉毒素主要是由黄曲霉和寄生曲霉产生的次级代谢产物,Kurtzman等[5]发现红绶曲霉(Aspergillus nomius)等其他一些真菌也能产生黄曲霉毒素。黄曲霉毒素是一类化学结构类似的二呋喃环和香豆素的衍生物,呋喃环与毒素的致病性相关,而香豆素主要影响其致癌性[6]。这些毒素中黄曲霉毒素B1(aflatoxin B1,AFB1)是该类毒素中毒性最强的物质,其毒性是氰化物的10 倍,砒霜的68 倍[7],AFB1是目前发现毒性和致癌性最强的化学物质之一,已被世界卫生组织认定为1A级危险物。
黄曲霉和黄曲霉毒素虽然很早就已经被发现且被广泛地研究,但对黄曲霉及其毒素污染的根除依然没有找到快速有效的方法。目前来讲,黄曲霉和黄曲霉毒素污染的控制和清除仍然是世界级难题。本文主要对国内外黄曲霉和黄曲霉毒素的研究状况,以及当前对黄曲霉素污染的控制方法进行综述,并对今后黄曲霉毒素污染控制的发展进行展望,为该领域的研究提供一定的参考依据。
1 黄曲霉及黄曲霉毒素危害
1.1 黄曲霉的危害
黄曲霉作为一种常见的丝状真菌,通常会侵染花生、玉米、大米等并使其发生霉变[8-9],对于含脂肪量较高的油料作物,黄曲霉及黄曲霉毒素的侵染更为严重。目前虽然我国对饲料原料的监管十分严格,但是仍有非正规的养殖场收购发生轻微霉变的玉米等作物经简单处理后制成动物饲料,这种饲料被牲畜食用后对其健康造成潜在的危害,导致病害畜产品的产生,最终将这种潜在危害转嫁给人。黄曲霉对于粮食作物的污染首先是影响到粮油作物的使用和经济价值。其次,黄曲霉产生的黄曲霉毒素引起毒素污染,对人和动物的危害更为严重。黄曲霉本身就是一种病原菌会导致人和动物患上曲霉病,其致病性仅次于烟曲霉,报道指出南美患曲霉病的儿童中有68%是由黄曲霉引起的[10-12]。在肺移植、骨髓移植的过程中通常会导致相关病症的出现[13-14],当人体呼吸到黄曲霉的孢子或是食用被黄曲霉污染的粮食时会引起过敏性疾病的发生[15],另外还有报道称黄曲霉会导致人类患上角膜炎[16],也会引起兔子、家畜类动物感染曲霉病[17]。
1.2 黄曲霉毒素的危害
1960年英国10 万只火鸡和鸭子在几个月内突然死亡,其原因是这些家禽食用了南美地区被真菌毒素污染的花生粕[18],经证实该毒素就是黄曲霉产生的黄曲霉毒素。从此,人们揭开了对黄曲霉和黄曲霉毒素的研究序幕。目前,已经分离鉴定出的黄曲霉毒素已有20余种,包括B族黄曲霉毒素(AFB1、AFB2和AFB2a)、G族黄曲霉毒素(AFG1、AFG2和AFG2a)、M族黄曲霉毒素(AFM1和AFM2)以及毒醇等。在365 nm紫外光照射下AFB1和AFB2可以发出蓝光,AFG1和AFG2可以发出绿光。M族黄曲霉毒素常见于牛奶中,其中AFM1是AFB1在体内经过羟化而衍生成的代谢产物。这些毒素尤其是AFB1对人和动物都有很强的致病性,其致病能力与结构式有很大关系(图1)。研究表明AFB1和AFG1中的呋喃环不饱和键是否发生环氧化,决定了这2 种毒素的致癌能力[19],其中环氧化形式的AFB1是通过体内细胞色素P450单氧酶体统代谢形成[20],而未被氧化的AFB2和AFG2的致病性与之相比就小了很多。环氧化物可以与细胞脱氧核糖核酸(deoxyribonucleic acid,DNA)结合形成毒素-DNA加合物,这种加合物可以在尿液中检测到[21-22],可随尿液排出体外。环氧化的AFB1会导致DNA的碱基序列发生突变,这种现象常见于患肝癌病人的癌细胞中[23]。黄曲霉毒素对人体的靶器官主要是肝脏,肝脏细胞的癌变是引起肝癌病变和死亡的主要原因[24]。调查显示中国每年大约有700 000人患肝癌的病例产生,超过300 000 人因患肝癌死亡[21]。近20 a的流行病学研究发现,肝细胞的癌变率与黄曲霉毒素的摄入有关。研究表明AFB1对啮齿动物、灵长类动物以及鱼类等多种动物都有很强的致癌能力[25]。黄曲霉毒素还可以抑制动物的生长,有报道指出婴儿的成长也会受到黄曲霉毒素的影响,但这种作用机制目前还不清楚[26-27]。

1.3 黄曲霉毒素的合成及运输
随着人们对黄曲霉及黄曲霉毒素的深入研究,黄曲霉毒素的合成途径、合成过程中相关基因的调控、相关酶的参与都已基本清楚。目前普遍认为AFB1的合成过程为:乙酸盐(acetate)→聚酮化合物(poyketide)→诺素罗瑞尼克酸(norsolorinic acid,NOR)→奥佛兰提素(averantin,AVN)→hydroxyaverantin(HAVN)→oxoaverantin(OAVN)→奥佛尼红素(averufin,AVF)→杂色半缩醛乙酸(versiconal hemiacetal acetate,VHA)→versiconal(VAL)→杂色曲霉素B(versicolorin B,VERB)→杂色曲霉素A(versicolorin A,VERA)→柄曲霉素(sterigmatocystin,ST)→O-甲基柄曲霉素(O-methylsterigmatocystin,OMST)→AFB1。在AFB1合成中或合成后,相继衍化出AFB2、AFG1、AFG2、AFM1和AFM2
[28-31]。黄曲霉毒素的合成过程中会受到如光线、温度、pH值、氮源、碳源和重金属等环境条件因素的影响(表1)[32]。贮藏的温度以及通风条件也会影响黄曲霉的产毒,在低温、通风、干燥、碱性环境可以有效地抑制黄曲霉毒素的产生[33]。不同的碳源[34]、氮源[35]、培养温度[36-37]以及培养生长的pH值[38-39]对于黄曲霉毒素的产生都有影响。Price等[40]研究了温度、pH值、氮源、碳源等4 种因素对黄曲霉毒素通过特定基因转录的影响,发现温度对其影响最大,其次是pH值、氮源、碳源。营养条件、生长条件以及不利的环境胁迫作用等外界条件都会导致黄曲霉毒素的合成受阻,但其根本原因是这些条件影响了黄曲霉相关产毒基因的表达从而引起毒素的产生发生了变化。

黄曲霉毒素作为一种重要的次级代谢产物,在细胞内如何转运到细胞外一直未得到解决。2009年,Chanda等[41]提出了黄曲霉亚细胞区域化、毒素基因表达、碳源途径等调控黄曲霉毒素合成运输的模型。2010年Chanda等[42]又提出了囊泡化合成释放激素的理论模型,揭示了囊泡和大液泡在黄曲霉毒素合成、转运、输出等过程中起到的重要作用。研究表明在AFB1合成过程中至少最后两步的酶反应是在囊泡中完成,囊泡数量增加与AFB1的累积或者输出成正相关。当囊泡与液泡融合后,AFB1合成代谢明显减少,可能是液泡中存在某些酶类破坏了催化AFB1合成的酶类。阻断囊泡与液泡的融合,则可以提高AFB1的合成或输出速率。这一发现或许为抑制AFB1的合成提供了新的思路。
1.4 合成黄曲霉毒素的基因调控
目前来讲合成黄曲霉毒素的基因调控过程是一个极其复杂的网络,并非由某一个或是某些基因来调控的。黄曲霉全基因组序列的公开为黄曲霉毒素调控途径的研究提供了大量的参考数据[43]。研究表明近30 个合成黄曲霉毒素的调控基因,控制了超过20 种酶类的合成,这些酶不同程度地参与了乙酸盐到黄曲霉毒素的合成过程[44],其中基因aflA和aflB可以控制脂肪酸合成酶、aflC控制聚酮合酶、两个相邻的基因aflR和aflS对合成黄曲霉毒素的调控起重要作用,aflR编码的一个锌指结构的DNA结合蛋白,能够激活黄曲霉毒素合成通路上的基因表达,该蛋白是其他大部分毒素合成时所必需的[45-46]。aflR与相邻的毒素调控基因aflS的间区非常短,但是各自的启动子却不同[47]。研究表明,aflS的转录依赖于aflR[46,48],aflS蛋白能与aflR蛋白结合从而调节产毒基因的表达,进而改变黄曲霉毒素的合成途径[32]。与aflR相比,aflS的许多功能还有待进一步的研究。其他相关基因aflD、aflM、aflP等都在不同程度地调控毒素的合成,其中aflD的高表达量起到减弱毒素合成的作用[49,32]。
2 黄曲霉及黄曲霉毒素的污染控制
除黄曲霉外像寄生曲霉(Aspergillus parasiticus)[50]、红绶曲霉(Aspergillus nomius)[5]、Aspergillus pseudoamarii[51]、Aspergillus bombycis[52]等霉菌都能够产生黄曲霉毒素。该类霉菌与黄曲霉一样都属于真菌,它们可以在粮油作物的生长、收获、运输、贮藏以及加工等各个环节引起作物的霉变,并对其相关制品造成不可避免的经济损失,所产生的黄曲霉毒素对人类和动物的健康危害更为严重。对该类霉菌的污染控制常常通过控制其生长条件的方法达到。如降低温度和水分含量等。本文主要是从黄曲霉及黄曲霉毒素污染的前、后两个时期进行控制的角度进行论述,前期主要针对黄曲霉或黄曲霉毒素的污染控制,后期主要针对黄曲霉毒素的污染控制,从而起到清除或降低毒素的效果,整个控制流程见图2。
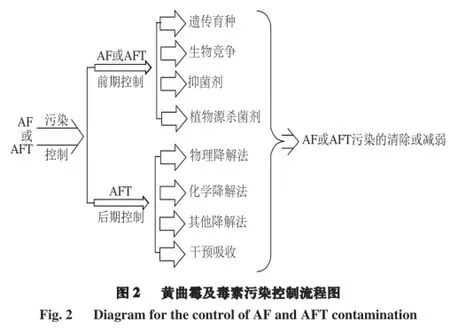
2.1 黄曲霉及毒素污染的前期控制
2.1.1 遗传育种
从源头上培育抗黄曲霉品种是黄曲霉污染前期能够得到有效控制的良好途径。该方法可以从两个方面入手:1)利用基因工程改造产毒菌株的基因。并非所用菌株都能产生黄曲霉毒素,因此,可以通过消除产毒菌株中调控毒素关键基因,从而使其失去产毒性[53]。然而,自然消除关键的产毒基因却很难实现。2)改造粮食作物使之具有抗黄曲霉的特性。自20世纪60年代以来,国际上开始了花生黄曲霉抗性育种的研究,且已取得显著成效[54]。美国农业部农业研究局与尼日利亚国际热带农业研究所合作研制了抗黄曲霉的玉米品种,该品种玉米在实验室和田间获得良好的抗菌效果[55]。我国福建农林大学油料所,在1997年也研究出了抗黄曲霉的花生品种,并在2009年通过国家农作物品种审定委员会的审定[56]。长远来看,选育抗黄曲霉作物品种应该是防治黄曲霉污染的有效途径,但选育抗病品种周期长,对黄曲霉有免疫或高抗的花生、玉米等作物的遗传资源比较缺乏,另外抗黄曲霉和抗黄曲霉毒素是两个完全不同的多基因控制的性状,因此对于这两种性状的整合是一个很大挑战。
2.1.2 生物竞争
在黄曲霉及毒素污染的前期,可以采用微生物之间的拮抗作用和生存竞争来控制黄曲霉毒素的污染。该方法在美国通过无毒优势菌株在田间防治黄曲霉毒素的实验中已得到认证[57]。在我国,有研究也证实枯草芽孢杆菌、乳酸菌、醋酸菌能够显著地降解黄曲霉毒素[58]。萎缩芽孢杆菌、以及从不同物料中分离出的枯草芽孢杆菌对黄曲霉的生长都有抑制作用[59-60]。另外还可以利用黄曲霉本身进行生物竞争。如利用不产毒菌株与产毒黄曲霉菌株之间的生存竞争进行污染控制。将不产毒菌株大量接种到田地从而生长为强势菌株来淘汰产毒菌株,从而达到污染控制的目的。然而,将拮抗菌株或是不产毒黄曲霉菌株直接应用于食品行业的事例还没有报道,并且活体无毒菌株对生态平衡是否会造成负面影响有待于进一步的评估。
2.1.3 抑菌剂
研究报道,一些植物源的化合物在不污染粮食作物的前提下可以有效地抑制黄曲霉的生长并且对毒素的产生也有不同程度的抑制作用。目前报道的抑制剂主要有生物碱、抗生素、双黄酮、阻断剂香豆素类、黄酮类、氧肟酸、氧类脂、多烯不饱和脂肪酸、萜类化合物、某些精油等。肉桂醛和改良后的纳米化肉桂醛可以进入黄曲霉真菌细胞内,刺激细胞产生大量的活性氧破坏细胞膜,引起细胞膜的损伤从而对黄曲霉菌丝的生长和黄曲霉毒素的产生抑制作用[61]。多糖等抗肿瘤活性成分物质,尤其是海带多糖,通过与细胞膜上受体蛋白的结合对黄曲霉菌丝的生长和毒素的产生具有显著地抑制作用[62-63]。另有研究指出茶叶水提物对黄曲霉的菌丝生长虽然没有明显的抑制作用,但是可以显著地抑制黄曲霉毒素的产生[64],如茶多酚、儿茶素、槲皮素[65]。Reverberi等[66]发现寄生曲霉细胞内的氧化还原稳态对黄曲霉毒素的合成发挥着重要的作用,而多酚类物质所具有抗氧化活性打破了这种氧化还原稳态从而影响毒素的产生。这一类植物源抑菌剂最大的优势在于不会对被污染物造成二次污染和药物的残留,但是该类抑菌剂大量的提取以及工业化生产可能会有一定的困难。因此,对于植物源抑菌剂的研究可能会成为对黄曲霉及黄曲霉毒素污染控制的一个热点。
2.2 黄曲霉毒素污染的后期控制
2.2.1 物理降解法
物理降解法是常用的控制毒素污染的方法。通常使用的物理方法有辐照法和吸附法。辐照法因其方便、快速、无污染的特点而被广泛应用于食品行业。研究发现一定的照射剂量可以有效去除花生油中2 mg/kg的AFB1,且不会引起花生油品质的改变[67]。在研究γ射线对黄曲霉孢子辐照效应中,发现辐射不仅能杀灭霉菌孢子,也能抑制霉菌毒素产生[68]。在吸附法中,目前常见的黄曲霉毒素吸附剂主要是铝硅酸盐类和酵母细胞壁提取物类吸附剂,还有活性炭、活菌制剂、交联聚乙烯吡咯烷酮(crosslinking polyvingypyrrolidone,PVPP)、复合吸附剂等其他类型吸附剂。李娟娟等[69]研究了酵母培养物、水合铝硅酸盐、复合吸附剂等对黄曲霉毒素B1吸附效果,发现水合铝硅酸盐的吸附能力最强,能够降低毒素对肉仔鸡的危害。夏鹏等[70]发现在精料补充料中添加真菌毒素吸附剂对奶牛乳中AFM1具有一定吸附和降低其含量的作用,且对乳成分和其他相关指标无显著影响。
2.2.2 化学降解法
常见的化学去除黄曲霉毒素的方法有氢氧化钠降解法和氨熏法。在氢氧化钠强碱条件下黄曲霉毒素的结构通常会被破坏,生成水邻位香豆素钠盐[71]。氨熏法氨处理法主要是利用氨气与AFB1结合后发生脱羟作用,从而使AFB1的内环发生裂解,达到去毒素降解的效果,经过7.05%氨气熏蒸96 h的玉米中AFB1的降解率为92%[72]。烟熏法在降解黄曲霉毒素的同时,不会破坏被处理物质的营养价值,并且该方法处理简单、成本较低,适于大规模应用。
2.2.3 其他降解法
除了上述物理化学方法之外,针对控制黄曲霉及黄曲霉毒素的污染,还有使用强氧化剂、农药和酶解等其他降解法。通过二氧化氯、强酸性氧化离子水、次氯酸钠等氧化剂也能完成黄曲霉毒素的脱毒[73]。高毒农药等也可以杀死黄曲霉真菌,消除黄曲霉和毒素的污染。但这两种污染控制方法会对环境和原料造成不同程度的污染或引入了二次污染。采用微生物产生的酶及其制剂来进行黄曲霉毒素控制,具备效率高、特异性强、条件相对温和、对原料和环境没有污染的优势,也不会破坏产品品质,可以成为今后研究的方向。
3 结 语
对于前期黄曲霉及黄曲霉毒素污染的控制,植物源杀菌剂的研制有可能成为今后的研究重点。目前的药物处理大多对黄曲霉的生长具有有效的抑制作用,如生物碱类、抗生素类、酚类物质以及一些植物精油等[60-63],但是这些药物大都是抑菌而不是杀菌,一旦处理时间过久,药物的这种抑制作用就会消失,并且有些药物在食品的应用中还有一定的局限性,例如造成二次污染等。因此,从植物源的抑菌剂层面上升至杀菌剂的层面将有效地控制黄曲霉及其毒素的污染。植物源杀菌剂应该存在以下几个优点:1)高效快速杀死黄曲霉,阻止黄曲霉的继续生长繁殖,可以减小前期粮食的污染程度;2)能够杀死黄曲霉的孢子,从根本上杜绝黄曲霉的再繁殖再污染;3)可有效抑制黄曲霉毒素的产生,从而降低对人和牲畜健康的危害;4)这种杀菌剂通常具有低毒挥发性或是无毒,不会对产品造成二次污染的特点;5)植物源杀菌剂可能含有特殊的香味物质,为产品增加特有的香味等。因此,植物源杀菌剂可能成为今后研究的重点,用于黄曲霉及黄曲霉毒素污染的控制。
对于后期黄曲霉毒素污染的控制,干预剂可能成为研究的重点,干预剂主要用来干预后期毒素在人和动物体内的吸收。水合硅酸铝作为抗凝剂经常用于动物饲料,在肠道中可以有效吸收黄曲霉毒素[74]。小鼠和人体实验中,通过血液和尿液的检测可以发现黄曲霉毒素显著减少,并且短期内水合硅酸铝对小鼠和人体没有产生不良后果[74-76]。还有研究表明,一些益生菌可以吸附黄曲霉毒素形成菌体-毒素复合物从而降低对毒素的吸收,有助于将毒素排出体外,因此益生菌与黄曲霉毒素的结合作用可以对肝癌起到一定的预防作用[77]。叶绿酸是叶绿素的衍生物,在动物体内具有抗癌作用[78],并且叶绿酸与AFB1结合成复合物可以也可以减少黄曲霉毒素在肠道中的转运吸收。有研究发现叶绿素也可以有效地帮助小鼠抵抗黄曲霉毒素诱导的癌症[79-80]。因此,经常食用含有叶绿素的食物或是补品对于预防肝癌的发生具有一定的作用。另外一些中药中的黄酮、多酚类活性物质可作用于酶代谢系统,从而影响黄曲霉毒素的代谢,起到解毒作用[81]。环境中彻底消除黄曲霉毒素的污染几乎是不可能的,因此干预黄曲霉毒素在人体内的吸收代谢具有重要意义。
[1] HORN B W, MOORE G G, CARBONE I. Sexual reproduction in Aspergillus flavus[J]. Mycologia, 2009, 101(3): 423-429. DOI:10.3852/09-011.
[2] COTTY P J. Virulence and cultural characteristics of two Aspergillus flavus strains pathogenic on cotton[J]. Phytopathology, 1989, 79(7):808-814. DOI:10.1094/Phyto-79-808.
[3] HORN B W. Ecology and population biology of aflatoxigenic fungi in soil[J]. Toxin Reviews, 2003, 22(2/3): 351-379. DOI:10.1081/TXR-120024098.
[4] RICHARD J L, PAYNE G A, DESJARDINS A E, et al. Mycotoxins:risks in plant, animal and human systems[J]. CAST Task Force Report,2003, 139: 101-103.
[5] KURTZMAN C P, HORN B W, HESSELTINE C W. Aspergillus nomius, a new aflatoxin-producing species related to Aspergillus flavus and Aspergillus tamarii[J]. Antonie van Leeuwenhoek, 1987, 53(3):147-158. DOI:10.1007/BF00393843.
[6] ASAO T, BUCHI G, ABDEL-KADER M M, et al. Aflatoxins B and G[J]. Journal of the American Chemical Society, 1963, 85(11): 1706-1707. DOI:10.1021/ja00894a050.
[7] 居乃虎. 黄曲霉毒素[M]. 北京: 中国轻工业出版社, 1980: 58-326.
[8] FARFAN I D B, de la FUENTE G N, MURRAY S C, et al. Genome wide association study for drought, aflatoxin resistance, and important agronomic traits of maize hybrids in the sub-tropics[J]. PLoS ONE,2015, 10(2): e0117737. DOI:10.1371/journal.pone.0117737.
[9] LAI X W, ZHANG H, LIU R C, et al. Potential for aflatoxin B1and B2production by Aspergillus flavus strains isolated from rice samples[J]. Saudi Journal of Biological Sciences, 2015, 22(2): 176-180. DOI:10.1016/j.sjbs.2014.09.013.
[10] KRISHNAN S, MANAVATHU E K, CHANDRASEKAR P H. Aspergillus flavus: an emerging non-fumigatus Aspergillus species of significance[J]. Mycoses, 2009, 52(3): 206-222. DOI:10.1111/j.1439-0507.2008.01642.x.
[11] HETHERINGTON S V, HENWICK S, PARHAM D M, et al. Monoclonal antibodies against a 97-kilodalton antigen from Aspergillus flavus[J]. Clinical and Diagnostic Laboratory Immunology,1994, 1(1): 63-67.
[12] STEINBACH W J. Pediatric aspergillosis: disease and treatment differences in children[J]. The Pediatric Infectious Disease Journal,2005, 24(4): 358-364. DOI:10.1097/01.inf.0000157218.37603.84.
[13] REQUENA F, SAUME E Y, LEÓN A. Micotoxinas: enemigas silenciosas de la salud[J]. Ceniap Hoy, 2005, 9: 32.
[14] DIBA K, MAKHDOOMI K, MIRHENDI H. Molecular characterization of Aspergillus infections in an Iranian educational hospital using RAPD-PCR method[J]. Iranian Journal of Basic Medical Sciences, 2014, 17(9): 646-650.
[15] DIXON D M, WALSH T J. Human pathogenesis[J]. Biotechnology,1992, 23: 249-267.
[16] TILAK R, SINGH A, MAURYA O P S, et al. Mycotic keratitis in India: a five-year retrospective study[J]. The Journal of Infection in Developing Countries, 2010, 4(3): 171-174. DOI:10.3855/jidc.309.
[17] HEDAYATI M T, PASQUALOTTO A C, WARN P A, et al. Aspergillus flavus: human pathogen, allergen and mycotoxin producer[J]. Microbiology, 2007, 153(6): 1677-1692. DOI:10.1099/ mic.0.2007/007641-0.
[18] BLOUNT W P. Turkey “X” disease[J]. Turkeys, 1961, 9(2): 52-55.
[19] GROOPMAN J D, KENSLER T W. Role of metabolism and viruses in aflatoxin-induced liver cancer[J]. Toxicology and Applied Pharmacology,2005, 206(2): 131-137. DOI:10.1016/j.taap.2004.09.020.
[20] GALLAGHER E P, WIENKERS L C, STAPLETON P L, et al. Role of human microsomal and human complementary DNA-expressed cytochromes P4501A2 and P4503A4 in the bioactivation of aflatoxin B1[J]. Cancer Research, 1994, 54(1): 101-108.
[21] KENSLER T W, ROEBUCK B D, WOGAN G N, et al. Aflatoxin:a 50-year odyssey of mechanistic and translational toxicology[J]. Toxicological Sciences, 2011, 120(Suppl 1): 28-48. DOI:10.1093/ toxsci/kfq283.
[22] BENNETT R A, ESSIGMANN J M, WOGAN G N. Excretion of an aflatoxin-guanine adduct in the urine of aflatoxin B1-treated rats[J]. Cancer Research, 1981, 41(2): 650-654.
[23] BRESSAC B, PUISIEUX A, KEW M, et al. p53 mutation in hepatocellular carcinoma after aflatoxin exposure[J]. The Lancet,1991, 338: 1356-1359. DOI:10.1016/0140-6736(91)92236-U.
[24] FERLAY J, SHIN H R, BRAY F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. International Journal of Cancer, 2010, 127(12): 2893-2917. DOI:10.1002/ijc.25516.
[25] BUSBY W F, WOGAN G N. Aflatoxins[J]. Chemical Carcinogens,1984, 2: 945-1136.
[26] GONG Y, HOUNSA A, EGAL S, et al. Postweaning exposure to aflatoxin results in impaired child growth: a longitudinal study in Benin, West Africa[J]. Environmental Health Perspectives, 2004,112(13): 1334-1338. DOI:10.1289/ehp.6954.
[27] TURNER P C, COLLINSON A C, CHEUNG Y B, et al. Aflatoxin exposure in utero causes growth faltering in Gambian infants[J]. International Journal of Epidemiology, 2007, 36(5): 1119-1125. DOI:10.1093/ije/dym122.
[28] MINTO R E, TOWNSEND C A. Enzymology and molecular biology of aflatoxin biosynthesis[J]. Chemical Reviews, 1997, 97(7): 2537-2556. DOI:10.1021/cr960032y.
[29] HUNTER I S. Microbial secondary metabolites: biosyntheses, genetics and regulation[M]. Berlin, German: Spring Press, 2002: 141-166. DOI:10.1007/s11427-013-4501-5.
[30] YABE K, NAKAJIMA H. Enzyme reactions and genes in aflatoxin biosynthesis[J]. Applied Microbiology and Biotechnology, 2004,64(6): 745-755. DOI:10.1007/s00253-004-1566-x.
[31] YU J, BHATNAGAR D, EHRLICH K C. Aflatoxin biosynthesis[J]. Revista Iberoamericana de Micología, 2002, 19(4): 191-200.
[32] GEORGIANNA D R, PAYNE G A. Genetic regulation of aflatoxin biosynthesis: from gene to genome[J]. Fungal Genetics and Biology,2009, 46(2): 113-125. DOI:10.1016/j.fgb.2008.10.011.
[33] 罗自生, 秦雨, 徐艳群, 等. 黄曲霉毒素的生物合成、代谢和毒性研究进展[J]. 食品科学, 2015, 36(3): 250-257. DOI:10.7506/spkx1002-6630-201503048.
[34] BUCHANAN R L, STAHL H G. Ability of various carbon sources to induce and support aflatoxin synthesis by Aspergillus parasiticus[J]. Journal of Food Safety, 1984, 6(4): 271-279. DOI:10.1111/j.1745-4565.1984.tb00488.x.
[35] KACHHOLZ T, DEMAIN A L. Nitrate repression of averufin and aflatoxin biosynthesis[J]. Journal of Natural Products, 1983, 46(4):499-506. DOI:10.1021/np50028a013.
[36] DIENER U L, DAVIS N D. Limiting temperature and relative humidity for growth and production of aflatoxin and free fatty acids by Aspergillus flavus in sterile peanuts[J]. Journal of Oil & Fat Industries,1967, 44(4): 259-263. DOI:10.1007/BF02639271.
[37] SCHINDLER A F, PALMER J G, EISENBERG W V. Aflatoxin production by Aspergillus flavus as related to various temperatures[J]. Applied and Environmental Microbiology, 1967, 15(5): 1006-1009.
[38] COTTY P J, COTTY P J. Aflatoxin and sclerotial production by Aspergillus flavus: influence of pH[J]. Phytopathology, 1988, 78(9):1250-1253. DOI:10.1094/phyto-78-1250.
[39] KELLER N P, NESBITT C, SARR B, et al. pH regulation of sterigmatocystin and aflatoxin biosynthesis in Aspergillus spp.[J]. Phytopathology, 1997, 87(6): 643-648. DOI:10.1094/ PHYTO.1997.87.6.643.
[40] PRICE M S, CONNERS S B, TACHDJIAN S, et al. Aflatoxin conducive and non-conducive growth conditions reveal new gene associations with aflatoxin production[J]. Fungal Genetics and Biology, 2005, 42(6): 506-518. DOI:10.1016/j.fgb.2005.03.009.
[41] CHANDA A, ROZE L V, KANG S, et al. A key role for vesicles in fungal secondary metabolism[J]. Proceedings of the National Academy of Sciences, 2009, 106(46): 19533-19538. DOI:10.1073/ pnas.0907416106.
[42] CHANDA A, ROZE L V, LINZ J E. A possible role for exocytosis in aflatoxin export in Aspergillus parasiticus[J]. Eukaryotic Cell, 2010,9(11): 1724-1727. DOI:10.1128/EC.00118-10.
[43] YU J, PAYNE G A, NIERMAN W C, et al. Aspergillus flavus genomics as a tool for studying the mechanism of aflatoxin formation[J]. Food Additives and Contaminants, 2008, 25(9): 1152-1157. DOI:10.1080/02652030802213375.
[44] CLEVELAND T E, YU J, FEDOROVA N, et al. Potential of Aspergillus flavus genomics for applications in biotechnology[J]. Trends in Biotechnology, 2009, 27(3): 151-157. DOI:10.1016/ j.tibtech.2008.11.008.
[45] CHANG P K, YU J, BHATNAGAR D, et al. Repressor-AFLR interaction modulates aflatoxin biosynthesis in Aspergillus parasiticus[J]. Mycopathologia, 1999, 147(2): 105-112. DOI:10.1023/ A:1007157309168.
[46] PRICE M S, YU J, NIERMAN W C, et al. The aflatoxin pathway regulator AFLR induces gene transcription inside and outside of the aflatoxin biosynthetic cluster[J]. FEMS Microbiology Letters, 2006,255(2): 275-279. DOI:10.1111/j.1574-6968.2005.00084.x.
[47] EHRLICH K C, CARY J W, MONTALBANO B G. Characterization of the promoter for the gene encoding the aflatoxin biosynthetic pathway regulatory protein AFLR[J]. Biochimica et Biophysica Acta(BBA)-Gene Structure and Expression, 1999, 1444(3): 412-417. DOI:10.1016/S0167-4781(99)00022-6.
[48] DU W, OBRIAN G R, PAYNE G A. Function and regulation of aflJ in the accumulation of aflatoxin early pathway intermediate in Aspergillus flavus[J]. Food Additives and Contaminants, 2007, 24(10):1043-1050. DOI:10.1080/02652030701513826.
[49] MEYERS D M, OBRIAN G, DU W L, et al. Characterization of aflJ, a gene required for conversion of pathway intermediates to aflatoxin[J]. Applied and Environmental Microbiology, 1998, 64(10): 3713-3717.
[50] YU J, CHANG P K, CARY J W, et al. Comparative mapping of aflatoxin pathway gene clusters in Aspergillus parasiticus and Aspergillus flavus[J]. Applied and Environmental Microbiology, 1995, 61(6): 2365-2371.
[51] ITO Y, PETERSON S W, WICKLOW D T, et al. Aspergillus pseudotamarii, a new aflatoxin producing species in Aspergillus section Flavi[J]. Mycological Research, 2001, 105(2): 233-239. DOI:10.1017/S0953756200003385.
[52] PETERSON S W, ITO Y, HORN B W, et al. Aspergillus bombycis, a new aflatoxigenic species and genetic variation in its sibling species,A. nomius[J]. Mycologia, 2001, 93(4): 689-703. DOI:10.2307/3761823.
[53] KUSUMOTO K I, NOGATA Y, OHTA H. Directed deletions in the aflatoxin biosynthesis gene homolog cluster of Aspergillus oryzae[J]. Current Genetics, 2000, 37(2): 104-111. DOI:10.1007/ s002940050016.
[54] 田立荣, 廖伯寿, 李玉荣, 等. 花生抗黄曲霉遗传改良研究进展[J].河北农业科学, 2010, 14(9): 80-83.
[55] MENKIR A, BROWN R L, BANDYOPADHYAY R, et al. Registration of six tropical maize germplasm lines with resistance to aflatoxin contamination[J]. Journal of Plant Registrations, 2008, 2(3):246-250. DOI:10.3198/jpr2008.01.0028crg.
[56] 王再兴, 官德义, 石新国, 等. 抗黄曲霉花生良种 “闽花 6号”[J]. 福建农业科技, 2010 (3): 23-24. DOI:10.13651/j.cnki. fjnykj.2010.03.017.
[57] DORNER J W, COLE R J, CONNICK W J, et al. Evaluation of biological control formulations to reduce aflatoxin contamination in peanuts[J]. Biological Control, 2003, 26(3): 318-324. DOI:10.1016/ S1049-9644(02)00139-1.
[58] 朱新贵, 林捷. 几种食品微生物降解黄曲霉毒素作用的研究[J].食品科学, 2001, 22(10): 65-68.
[59] 刘丁, 秦文. 萎缩芽孢杆菌处理提高花生黄曲霉抗性的作用机制[J].食品科学, 2013, 34(23): 266-270. DOI:10.7506/spkx1002-6630-201323054.
[60] 郭艳萍, 盛海圆, 陈晓琳, 等. 抑黄曲霉乳酸菌的筛选及菌种鉴定[J].中国微生态学杂志, 2010(7): 583-586. DOI:10.13381/j.cnki. cjm.2010.07.002.
[61] LI H B, SHEN Q S, ZHOU W, et al. Nanocapsular dispersion of cinnamaldehyde for enhanced inhibitory activity against aflatoxin production by Aspergillus flavus[J]. Molecules, 2015, 20(4): 6022-6032. DOI:10.3390/molecules20046022.
[62] 李红波, 胡梁斌, 王淼焱, 等. 几种多糖对黄曲霉菌生长及产毒的抑制作用[J]. 江西农业学报, 2011(5): 82-84.
[63] HU L B, LI H B, SUN J L, et al. Effect of laminarin on Aspergillus flavus growth and aflatoxin production[J]. Advanced Materials Research, 2012, 343: 1168-1171. DOI:10.4028/www.scientific.net/ AMR.343-344.1168.
[64] 吴清华. 茶叶中抑制黄曲霉毒素产生的组分及相关特性研究[D]. 杨凌: 西北农林科技大学, 2013: 28-37.
[65] ZHOU W, HU L B, ZHAO Y, et al. Inhibition of fungal aflatoxin B1biosynthesis by diverse botanically-derived polyphenols[J]. Tropical Journal of Pharmaceutical Research, 2015, 14(4): 605-609. DOI:10.4314/tjpr.v14i4.7.
[66] REVERBERI M, ZJALIC S, RICELLI A, et al. Oxidant/antioxidant balance in Aspergillus parasiticus affects aflatoxin biosynthesis[J]. Mycotoxin Research, 2006, 22(1): 39-47. DOI:10.1007/BF02954556.
[67] 刘睿杰, 金青哲, 陈波, 等. 紫外照射去除黄曲霉毒素工艺对花生油品质的影响[J]. 中国油脂, 2011, 36(6): 17-20.
[68] 钟凯, 高翔, 计融.60Co γ 射线对生理盐水和玉米中黄曲霉孢子的辐照效应研究[J]. 卫生研究, 2011, 40(3): 352-354.
[69] 李娟娟, 苏晓鸥. 不同吸附剂对黄曲霉毒素B1吸附效果的研究[J].中国畜牧兽医, 2009, 36(8): 5-10.
[70] 夏鹏, 连红, 王根林. 饲喂霉菌毒素吸附剂对牛奶中黄曲霉毒素M1残留量的影响[J]. 中国饲料, 2011(7): 23-24. DOI:10.15906/j.cnki. cn11-2975/s.2011.07.010.
[71] 王波, 杨琳, 张宇昊, 等. 黄曲霉毒素去毒方法研究进展[J]. 中国油脂,2011, 36(2): 60-63.
[72] 陈志娟, 刘阳, 邢福国, 等. 氨气熏蒸降解玉米中黄曲霉毒素B1的条件优化[J]. 食品科学, 2010, 31(8): 33-37.
[73] 许菲菲, 刘亚丽, 田富饶. 黄曲霉毒素检测方法研究[J]. 化学分析计量, 2010, 19(5): 93-94.
[74] PHILLIPS T D, LEMKE S L, GRANT P G. Characterization of clay-based enterosorbents for the prevention of aflatoxicosis[J]. Advances in Experimental Medicine & Biology, 2002, 504: 157-171. DOI:10.1007/978-1-4615-0629-4_16.
[75] AFRIYIE-GYAWU E, MACKIE J, DASH B, et al. Chronic toxicological evaluation of dietary NovaSil clay in Sprague-Dawley rats[J]. Food Additives and Contaminants, 2005, 22(3): 259-269. DOI:10.1080/02652030500110758.
[76] WANG J S, LUO H, BILLAM M, et al. Short-term safety evaluation of processed calcium montmorillonite clay (NovaSil) in humans[J]. Food Additives and Contaminants, 2005, 22(3): 270-279. DOI:10.1080/02652030500111129.
[77] van RENSBURG C J, van RENSBURG C E J, van RYSSEN J B J,et al. In vitro and in vivo assessment of humic acid as an aflatoxin binder in broiler chickens[J]. Poultry Science, 2006, 85(9): 1576-1583. DOI:10.1093/ps/85.9.1576.
[78] BREINHOLT V, HENDRICKS J, PEREIRA C, et al. Dietary chlorophyllin is a potent inhibitor of aflatoxin B1hepatocarcinogenesis in rainbow trout[J]. Cancer Research, 1995, 55(1): 57-62.
[79] VERSANTVOORT C H M, OOMEN A G, van de KAMP E, et al. Applicability of an in vitro digestion model in assessing the bioaccessibility of mycotoxins from food[J]. Food and Chemical Toxicology, 2005, 43(1): 31-40. DOI:10.1016/j.fct.2004.08.007.
[80] SIMONICH M T, EGNER P A, ROEBUCK B D, et al. Natural chlorophyll inhibits aflatoxin B1-induced multi-organ carcinogenesis in the rat[J]. Carcinogenesis, 2007, 28(6): 1294-1302. DOI:10.1093/ carcin/bgm027.
[81] 王清兰, 陶艳艳, 刘成海. 黄曲霉毒素体内吸收与代谢的干预措施研究进展[J]. 肿瘤, 2007, 27(5): 415-418.
Recent Advances in the Control of Aflatoxin Contamination
SHEN Qingshan, ZHOU Wei, MO Haizhen, HU Liangbin*(Department of Food Science, Henan Institute of Science and Technology, Xinxiang 453003, China)
Aspergillus flavus can contaminate crops and food products, and produce aflatoxins which cause extremely serious damage to human and animal health. In this study, the molecular mechanisms involving aflatoxins biosynthesis, regulation and transport are reviewed. The existing strategies used to control aflatoxin contamination, such as genetic engineering and breeding, and physical and chemical decomposition are summarized. Additionally, the development and application of botanical fungicides and biological interventions are also highlighted and discussed.
aflatoxins; contamination; control strategy
10.7506/spkx1002-6630-201609044
TS201.6
A
1002-6630(2016)09-0237-07
沈青山, 周威, 莫海珍, 等. 黄曲霉毒素污染控制的研究进展[J]. 食品科学, 2016, 37(9): 237-243. DOI:10.7506/spkx1002-6630-201609044. http://www.spkx.net.cn
SHEN Qingshan, ZHOU Wei, MO Haizhen, et al. Recent advances in the control of aflatoxin contamination[J]. Food Science,2016, 37(9): 237-243. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201609044. http://www.spkx.net.cn
2015-06-18
国家自然科学基金青年科学基金项目(31101231);河南省高等学校青年骨干教师资助计划项目(2013GGJS-134);教育部“新世纪优秀人才支持计划”项目(NCET-12-0694)
沈青山(1989—),男,硕士研究生,研究方向为黄曲霉毒素代谢与污染控制。E-mail:sqs973@hotmail.com
*通信作者:胡梁斌(1979—),男,副教授,博士,研究方向为食源性病原物控制。E-mail:hulb973@163.com

