大肠杆菌在食品加工贮藏中胁迫响应机制的研究进展
石 慧,陈卓逐,阚建全*
(西南大学食品科学学院,重庆 400715)
大肠杆菌在食品加工贮藏中胁迫响应机制的研究进展
石 慧,陈卓逐,阚建全*
(西南大学食品科学学院,重庆 400715)
大肠杆菌能够感受环境信号并对环境的变化迅速做出反应。因此,在食品加工贮藏中,大肠杆菌在面对物理、化学因子胁迫时会产生应激反应,使其仍然能够生存和保持毒力,给食品安全带来极大的威胁。本文总结了在常见的食品加工贮藏胁迫因子下,包括热激、冷激、干燥、高渗透压、抗菌肽和酸,大肠杆菌的分子及生理响应机制及其在食品工业中的应用,并对大肠杆菌胁迫响应的未来研究做出展望。
大肠杆菌;食品加工贮藏;胁迫因子;响应机制
大肠埃希氏菌(Escherichia coli)简称大肠杆菌,广泛分布于自然界和动物肠道,是一种极易造成食品污染的细菌。尤其是致病性大肠杆菌可通过污染饮水及食品引起疾病的暴发,例如引起严重腹泻和败血症,病情严重者,可危及生命,其对儿童和老人的危害更为严重[1-3]。此外,大肠杆菌还能通过人与人之间的接触进行传播[2,4]。1982年,美国首次披露大肠杆菌O157:H7引起了疾病暴发[3]。2006年,美国又大面积暴发毒菠菜事件,2 周内有199 人确诊中毒,其中3 人死亡,调查发现病人都是因食用了被大肠杆菌O157:H7污染的菠菜而中毒[5-6]。
微生物是通过与不断变化的外界环境发生相互作用而进行生长繁殖。在外界环境条件适宜时,如丰富的营养,合适的温度、溶氧水平、pH值、水分含量,微生物会以较快的生长速率生长。一旦环境发生改变,就会造成对微生物的胁迫,抑制其生长,甚至死亡。实际上,除了在实验室培养条件下,微生物都长期处于环境胁迫中。因此,微生物对环境变化的感受和迅速做出反应的能力对其生存尤为重要,大多数微生物都具有这样的能力[7]。
在食品加工贮藏过程中,加热、冷藏、干燥、高渗透压、酸处理、发酵、加抗菌药物等处理方法均使大肠杆菌处于胁迫环境下。大量研究表明,大肠杆菌能对这些物理和化学胁迫因素做出迅速的应激反应,使其在不良环境下仍能够维持生存,并且保持一定的代谢活性和致病能力。一旦环境适宜其生长,会迅速修复并且繁殖[8-12]。在食品加工贮藏过程中,如果食品中有胁迫应激后仍存活的大肠杆菌,会造成安全隐患。尤其是致病性大肠杆菌,极少含量也会对人类健康造成极大的危害。同时,由于多数胁迫应激后的大肠杆菌以特殊的生理状态存活,如亚致死性损伤状态或者存活但不可培养状态(viable but not culturable,VBNC),导致对其检测较为困难,极易发生漏检[13]。因此,深入开展大肠杆菌在食品加工贮藏过程中的胁迫响应机制的研究,对于保障食品加工贮藏安全,建立健全食品质量安全控制体系方面具有重要意义。在理论上,可以深入理解大肠杆菌在不同的加工与贮藏条件下的胁迫响应机制,及其重要响应基因及信号传导过程;在实践上,理解大肠杆菌在哪些加工贮藏条件下会发生应激反应,对确定加工贮藏条件,加强安全预防措施提供重要借鉴。现在人们对食品新鲜度和营养要求越来越高,在降低灭菌对食品营养和口感造成影响的同时,又能尽量避免大肠杆菌胁迫应激反应,也成为了一个重要问题。而深入了解胁迫相应基因,对研究协同灭菌方法,开发新型的抗微生物制剂方面都有重要的意义。本文对大肠杆菌在食品加工贮藏过程中的胁迫耐受机制的研究进行综述,并对未来的发展方向做出展望。
1 大肠杆菌热应激机制
热处理是目前食品工业中经常使用的重要灭菌方法,为了降低高温对食品营养及风味的影响,很多食品热加工中需要采取低温灭菌,如水果、蔬菜的漂烫,罐头的杀菌,牛乳、啤酒、果汁的巴氏杀菌[11,17-18]。微生物如果突然面对环境温度的变化,其生理也要发生变化。例如,当温度突然由30 ℃上升到42 ℃时,大肠杆菌会迅速做出热激应答,如诱导相关基因的表达,大量合成热休克蛋白(heat shock proteins,HSPs)[14-15]。热休克蛋白大多数是分子伴侣和蛋白酶,具有以下功能:协助蛋白质的折叠、降解未准确折叠的蛋白质、在高温下保持蛋白质和膜的稳态、在高温下保持核酸的拓扑结构、与σ32翻译过程有关[15-17]。许多热休克蛋白是提高大肠杆菌的耐热性所必需的,其中包括DnaK、DnaJ、GrpE、GroES、GroEL[18]。
在大肠杆菌中,热应激反应受到σ32调控。σ32是由rpoH(htpR)基因编码的次级σ因子,大小为32 000 D。它可以指导核糖核酸(ribonucleic acid,RNA)聚合酶与特定的启动子结合,调控相关热休克基因的表达。当环境温度由30 ℃迅速上升到42 ℃时,σ32的含量由大约为10~30 拷贝/细胞在4~6 min内增加到原来的17 倍,合成超过20 种热休克蛋白,这些热休克蛋白可以帮助大肠杆菌获得对热的抗性[18]。

大肠杆菌能够在不同水平(σ32的转录、翻译及降解)对σ32进行调控[19]。首先,在σ32的转录水平,rpoH至少有4 个启动子,3 个启动子可被σ70-RNA聚合酶所识别,另一个启动子(P3)可被σ24-RNA聚合酶所识别(图1)。σ70是一个由σ32诱导产生的热休克蛋白,因此,σ32含量的增多导致σ70的增多,反过来又增加σ32的合成[20]。其次,外界胁迫特别是热激诱导会影响rpoH mRNA的翻译,σ32的合成在42 ℃要比30 ℃提高约12 倍[20]。rpoH mRNA开放阅读框(open-reading frames,ORFs)5'端的220nt序列可以形成对温度敏感的次级结构。在正常温度下,这些次级结构是闭合的,而在较高温度下,次级结构打开,使得rpoH mRNA能够更有效的翻译成σ32,进而迅速地诱导热休克蛋白的表达[20]。最后,σ32的降解也受到调控。σ32在大肠杆菌稳态生长时是一个极其不稳定的蛋白质,其半衰期少于1 min。然而,当温度由30 ℃上升到42 ℃时,σ32的半衰期时间延长了8 倍,变得具有暂时的稳定性[20]。σ32可被细胞内膜上的ATP依赖型蛋白酶FtsH所降解,其降解机制在于这些游离的σ32是否与RNA聚合酶核心酶(RNA polymerase core)相结合,如果它们紧密结合,σ32则免遭FtsH降解[20-21]。DnaK、DnaJ、GrpE等热休克蛋白(都是由σ32调控合成)也调控σ32降解,抑制rpoH mRNA的翻译(图1)。在30 ℃或更低温度,DnaK、DnaJ、GrpE等热休克蛋白可与σ32相互作用,使之不能与RNA聚合酶核心酶结合,加速σ32被FtsH降解;在42 ℃或更高的温度下,细胞内产生大量非折叠或变性蛋白,DnaK、DnaJ、GrpE优先与变性蛋白作用,因此能与σ32结合的游离分子伴侣减少,保证σ32能充分和RNA聚合酶核心酶结合(图1)[22]。σ32的大量合成调控热休克蛋白的表达,然而热休克蛋白含量的增加会反馈调节σ32的含量,σ32与热休克蛋白之间的相互制约关系,使它们的含量能在热激响应过程中保持相对稳定的高水平。σ32调控成员除了合成分子伴侣保护蛋白质免遭降解,还涉及保护其他大分子和细胞过程免受危害,如有些蛋白质可以保护细胞内脱氧核糖核酸(deoxyribonucleic acid,DNA)和RNA[7]。
在理解了大肠杆菌的热胁迫应激的基础上,近年来一些研究者开始进一步研究如何在低温灭菌中使其快速失活,避免大肠杆菌由于胁迫应激而维持生存。如Sung等[23]研究了在25、45、50、55 ℃下,使用3.0 L/min流速及质量浓度为2.0~3.0 g/m3的气体臭氧联合对苹果汁中的大肠杆菌O157:H7进行灭菌处理。结果显示,在这些温度下加入臭氧联合灭菌,都会显著提高大肠杆菌灭活效率。在50 ℃条件下,臭氧和热处理产生了协同灭菌效果。另外,也有研究证实大肠杆菌在鸡胸肉等固体食品中,比其在液体中的热抗性更强[24]。这些为食品加工提供了借鉴,但是其中涉及的机制,如不同的杀菌方式是如何产生协同作用,大肠杆菌胁迫应激基因如何对协同作用做出响应,食品介质对大肠杆菌的胁迫响应产生怎样的影响,还没有清楚的解释,需要进一步探索。
2 大肠杆菌冷应激机制
冷冻贮藏或冷链运输是食品产业链中经常使用的保藏或运输方式,如肉类、果蔬、速冻食品等食品的保鲜。在冷冻贮藏过程中,大肠杆菌会遭受低温的胁迫,温度降低会造成细胞内酶活性降低(影响胞内新陈代谢),膜的流动性降低(影响营养物质的运输),RNA结构趋于稳定(影响翻译过程)[25-26]。当温度突然降低时,细胞中会产生一种冷休克反应,通过一些特殊基因的表达产生一大类特殊的蛋白质(冷休克蛋白)使细胞适应这一急剧降低的低温环境,冷休克蛋白(cold shock proteins,CSPs)可以保持细胞膜的完整性和促进有效转录和翻译[25-27]。
研究表明,将大肠杆菌从37 ℃突然转移至10 ℃时,很多蛋白质立即被诱导表达。这些蛋白质大多数直接或间接与转录和翻译过程有关,如典型的冷休克蛋白、RNA解旋酶(DeaD)、DNA旋转酶(GyrA)、转录因子NusA和翻译因子InfBD等[27-28]。冷休克蛋白是高度保守的核苷酸结合蛋白,一般由68~74 个氨基酸构成,都存在5 个反平行B折叠的B桶状片层结构。冷休克蛋白分子质量大约为7.4 kD,含有典型的冷休克区域(cold shock domain,CSD),通过RNP1和RNP2基元(motif)与单链RNA或单链DNA结合,但不能与DNA结合[27-30]。在大肠杆菌中已经发现9 种同源冷休克蛋白,分别命名为CspA~CspI。其中,CspA、CspB、CspE、CspG、CspI只在冷激条件下诱导产生, CspC升温或降温条件下都会诱导其表达,而 CspD在稳定期,营养饥饿,氧化应激时产生[30-31]。
CspA是大肠杆菌主要的冷休克蛋白,是分子质量为7.4 kD的细胞质蛋白。正常情况,CspA几乎不存在,而且半衰期只有10~47 s,但是当大肠杆菌所处温度骤然降低时,它被大量诱导合成,可占细胞蛋白质总量的13%,其稳定期提高,半衰期大大延长(>10 min)。CspA能结合冷诱导基因,如染色体结合蛋白基因h-ns的110 bp的启动子区域,可以对h-ns基因进行转录激活。CspA还可以结合到DNA旋转酶A亚基基因(gyrA)的启动子上激活其转录。一般认为,DNA旋转酶含量的增加有助于细胞对低温的适应[29-31]。
冷休克蛋白除了可以结合冷诱导基因的启动子区域激活这些基因的转录外,还能清除不必要的二级结构来促进这些基因的转录和翻译。例如,冷诱导的RNA解旋酶CsdA能与CspA相互作用并清除mRNA上的二级结构,使其免受RNase E的切除从而稳定mRNA;另外,mRNA上的二级结构的清除有利于夏因-达尔加诺序列(Shine-Dalgarno sequence,SD)序列的暴露,翻译得以顺利进行[27-30]。
研究证实,将大肠杆菌污染的鸡胸肉过夜4 ℃冷藏,会提高大肠杆菌在沸水加热中的热抗性[24]。近年来的研究证实,致病菌大肠杆菌O157比模式菌株大肠杆菌K12的耐低温能力更强[32]。由于低温冷藏是一种常见的保藏方式,我国的研究者也开始研究冷冻胁迫下,其他致病菌如金黄色葡萄球菌的亚致死性损伤及失活规律[33]。
3 大肠杆菌干燥及高渗透压应激机制
为了延长食品的保质期和货架期,干燥以及高盐高糖的高渗透压处理,是非常常见的食品加工方法,它们都能够尽可能降低食品的含水量,抑制微生物的生长。一方面,各种微生物都有其生长最适宜的水分活度(water activity,aw)下降,微生物的生长率也随之下降。而研究表明,大肠杆菌能够在低水分活度食品中长期存活[34]。在食品干燥过程中,水分活度未下降到大肠杆菌致死的水平前,其对水含量的减少会做出应激响应,诱导相关基因的表达,合成一些特殊的物质,降低由于水分活度下降对其生长造成的影响,并且进入休眠期长时间存活。另一方面,高渗透压环境会导致水分子单方向地从细胞质向细胞内膜外移动,和干燥过程类似,都会造成细胞失水。据报道[35-40],大肠杆菌有以下2 套相似的调节机制应对干燥及高渗透压胁迫。
第一是胞外抵抗机制,糖被(glycocalyx)起着关键作用。在干燥和高渗透压环境下,大肠杆菌都会调节产生糖被来应对胁迫[35-36]。糖被是包被于大肠杆菌细胞壁外的一层厚度不定的透明胶状物质,主要由胞外多糖和蛋白质构成。糖被的有无、厚薄除与大肠杆菌的遗传性相关外,还与环境尤其是营养条件密切相关。糖被的成分一般是多糖,少数是蛋白质或多肽,也有多糖与多肽复合型的。糖被除了贮藏养料和给大肠杆菌提供表面附着力外,还起着保护作用,其上大量极性基团可保护大肠杆菌菌体减少水分流失造成的损伤[36]。Alpert[37]认为糖被由于其胶凝结构,能够与大量的水分紧密结合,降低细胞水分在干燥或高渗环境中流失的速率,对大肠杆菌在干燥胁迫下维持生存起着重要作用。
第二是胞内调节机制,海藻糖(trehalose)起主要作用。海藻糖是由2 个葡萄糖分子以α,α,1,1-糖苷键构成非还原性糖,是一种亲和性溶质,自身性质非常稳定。海藻糖对包括大肠杆菌在内的多种生物体具有高效的保护作用,因为海藻糖在高渗透压及干燥失水等恶劣环境条件下在细胞表面能形成独特的保护膜,有效地稳定细胞膜上的蛋白质和脂质的结构和功能[38-39]。在大肠杆菌中,海藻糖由OtsAB操纵子的编码产物合成:OtsA是海藻糖-6-磷酸合成酶,OtsB是海藻糖-6-磷酸酶。调节海藻糖合成的蛋白OtsAB受到σs的调控,因此在其他多种环境胁迫下诸如高温、氧化等,大肠杆菌也会合成大量海藻糖[40]。
大肠杆菌除了上述两方面应对干燥及高渗透压胁迫的相似机制,研究者还发现其在高渗透压环境下,双组分系统EnvZ/OmpR会感应外界环境的变化,并且调高外膜蛋白OmpC的表达量,从而为糖、多元醇、甜菜碱、氨基酸等相容性溶质进入细胞质提供通道,维持菌体内外渗透压平衡;同时,ProP和ProU膜转运系统也会帮助这类相容性溶质进入细胞[41]。但是相对而言,对大肠杆菌的干燥响应机制了解甚少,这也是近年来研究的热点。如有研究证实大肠杆菌胞内合成海藻糖的浓度与其干燥抵抗能力成正相关[42],这也直接进一步证实了海藻糖在大肠杆菌应对干燥中的重要作用。Koseki等[34]研究了在婴儿配方奶粉中,大肠杆菌O157:H7干燥抗性的规律,并分别在5、22、35 ℃条件下建立了数学模型,证实了在干燥环境下,随着温度的升高,大肠杆菌O157:H7对干燥的抗性越高。这些研究为采取有效的食品加工与贮藏方法提供了借鉴。另外,高通量测序技术的发展,为研究者深入研究微生物在干燥环境下分子响应提供了契机。如近年来有报道沙门氏菌处于不锈钢、塑料、纸片这些不同的材质表面时,其主要胁迫响应基因是不同的[43-45]。对于大肠杆菌,暂没有类似报道,但相信在不远的将来会有更深入的认识。
4 抗菌肽及大肠杆菌应激机制
当前,由于抗生素的滥用、食品防腐剂的过量添加,食品安全事件屡有发生。因此,人们对天然防腐剂的关注与日俱增。抗菌肽(antimicrobial peptide,AP)抑制微生物的生长,对食品中的多种革兰氏阴性细菌和革兰氏阳性细菌都有很强的杀灭作用[46-47]。抗菌肽在人、畜体内易被消化水解且无毒副作用,在酸性条件下活性强,有良好的溶解性和稳定性,是一种新型的食品防腐剂,与传统的抗生素相比具有分子质量小、抗菌谱广、热稳定性好、抗菌机理独特等优点[46]。抗菌肽根据其来源的不同通常可以分为四大类:来源于动物、昆虫、微生物基因工程菌的抗菌肽以及人工合成的抗菌肽,还可以根据是否带电荷分为阳离子抗菌肽和非阳离子抗菌肽[46,48]。目前,大多数研究者认为抗菌肽抑制微生物的机理在于抗菌肽能够与细胞膜表面相互作用,使膜的通透性发生改变。阳离子抗菌肽的正电荷区域与细胞膜上的负电荷区域相互作用,使抗菌肽分子的疏水端插入细胞膜的脂质膜中,形成跨膜电位,打破细胞内酸碱平衡,导致物质渗透,影响渗透压平衡,抑制微生物的呼吸作用[46]。总之抗菌肽与膜的相互作用直接关系到抗菌肽的抗菌效果[46]。
当大肠杆菌处于含有抗菌肽的环境时,细胞会发生相应的生理生化变化,并诱导一批新蛋白质或者已存在的蛋白质的合成,构建防御体系,抵抗抗菌肽与细胞膜作用。这种反应即为抗菌肽胁迫反应(antimicrobial peptide-stress response,APSR)。大肠杆菌对抗菌肽的胁迫响应主要包括两方面:膜表面物质被修饰,减少膜整体所带的负电荷;外膜的一些相关蛋白酶水解抗菌肽[48-49]。首先,膜表面物质特别是脂多糖被修饰,减少其整体负电荷,细胞膜结合位点随之减少,影响抗菌肽与细胞膜的结合作用。脂多糖有3 个部分(图2):O-抗原,含有重复的碳水化合物单位,微生物抵抗不利因素的重要部分,也是微生物的毒力因子;核心区域,由一个内核心和外核心组成;脂质A(lipid A),是D-葡萄胺二糖单位链组成的链,其中所有的羟基都被取代,取代物可以是多糖,也可以是脂肪酸[50]。当面对抗菌肽胁迫时,大肠杆菌的一些基因被激活,如pmrE、pmrC,它们直接或间接地受到PhoPQ、PmrAB等双组份系统的调控。pmrE调控合成4-氨基-阿拉伯糖(4-amino-arabinose,Ara4N),pmrC调控合成磷酸乙醇胺(phosphoenthanolamine,pEtN)。然后,4-氨基-阿拉伯糖或磷酸乙醇胺添加到脂多糖的脂质A部分上,使之磷酸化,中和负电荷(图2)[49]。
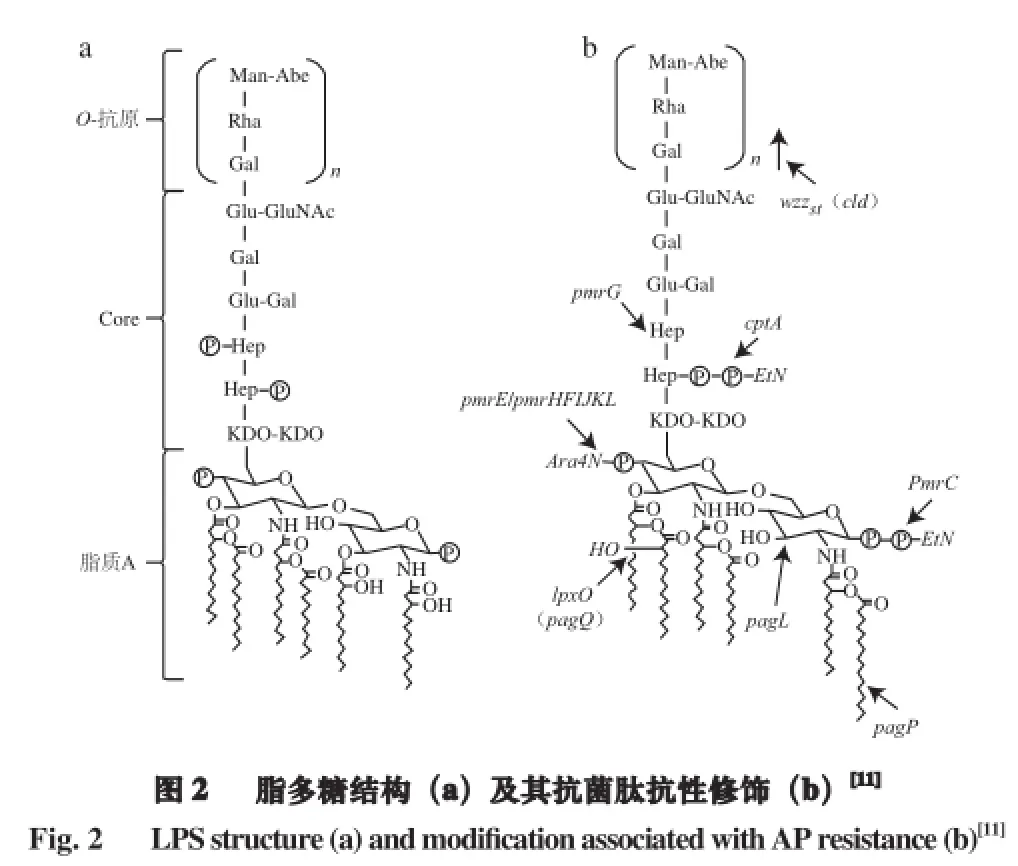
其次,外膜的一些相关蛋白酶能够降解抗菌肽[50]。大肠杆菌外膜蛋白酶T(outer-membrane protease T,OmpT)由10 条反向平行的β片层折叠而成中空的桶状结构,属于革兰氏阴性菌omptin外膜蛋白家族[51]。大肠杆菌外膜蛋白酶T由编码基因ompT合成,可水解抗菌肽,促纤溶等[51-53]。大肠杆菌外膜蛋白酶T在细胞质产生并被运输到内膜,再通过外周胞质到达外膜,定位于大肠杆菌外膜,镶嵌在脂质双层中,形成孔道[51]。大肠杆菌外膜蛋白酶T 的活性受到其结构顶端天冬氨酸的极大影响,同时,也受到脂多糖的影响,外膜蛋白酶T与脂多糖结合后,才能恢复酶活性。屈娅荣等[53]证明人防御素(human β-defensin-4,HBD-4)对大肠杆菌野生菌株和OmpT突变体的最小抑菌浓度有显著差异,野生株为10 μg/mL,敲除株为6 μg/mL。刘小露等[51]通过体外实验发现,重组蛋白OmpT能水解抗菌肽鱼精蛋白和兔肌肉肌酸激酶,而OmpT突变体则无上述功能。
5 大肠杆菌酸胁迫应激机制
酸胁迫发生在发酵食品或添加如有机酸等作防腐剂的食品中。食品酸处理过程中,微生物也面临着酸胁迫,国外常用1%~2.5%的乳酸洗涤牛肉,但是Dickson等[54]发现用1%的乳酸或醋酸洗涤牛肉,并不能杀死全部微生物,存在亚致死沙门氏菌和大肠杆菌。酸性食品检测出大肠杆菌O157:H7的报道屡见不鲜。大肠杆菌具有较强的耐酸能力,特别是其处于稳定期的细胞能够耐受pH≤2.5的酸性环境数小时,这主要是由于其具有葡萄糖-阻碍耐酸系统、氨基酸依赖型耐酸系统、伴侣蛋白抗酸作用以及保持膜电荷稳定等耐酸机制(图3)[55-56]。大肠杆菌对酸的应激响应非常复杂和多变,在不同成分或不同pH值的食品里,大肠杆菌发挥主要抗酸作用的机制会不同。例如葡萄糖-阻碍耐酸系统受到葡萄糖的抑制,氨基酸依赖型耐酸系统需要特定的氨基酸存在时才能产生耐酸作用。
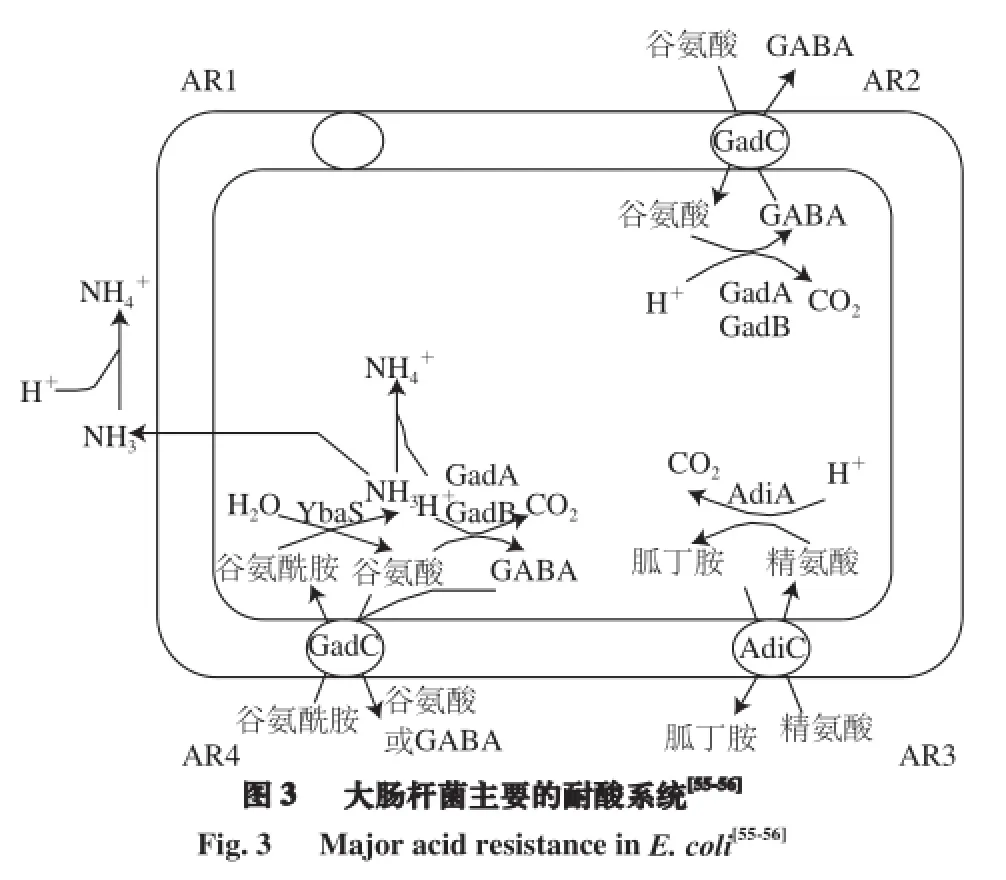
葡萄糖-阻碍耐酸系统(acid resistance system 1,AR1)需要选择性信号因子σ38、总调控蛋白CRP(cAMP receptor protein)和F0F1-ATP酶(F0/F1proton-translocating ATPase)参与[57-58]。选择性信号因子σ38又称σs,由RpoS编码,RpoS是细菌一般胁迫反应的主要调控因子。碳源和氮源饥饿、渗透压升高、低pH值、温度升高等一些胁迫条件可以诱导RpoS表达,另外,一些细胞内信号如ppGpp含量的变化会诱导RpoS表达。AR1的结构组分和保护机制仍不明确,但是研究者发现酸性环境可以直接作用RpoS,诱导RpoS的翻译、抑制RpoS的降解,从而增加RpoS的含量,PhoP/PhoQ、ArcB/RssB等双组分系统也将影响RpoS的含量和活性[59]。因此,在酸性环境下RpoS的量将明显提高并产生一定量的酸休克蛋白(acid shock proteins,ASPs),酸休克蛋白与热休克蛋白功能类似,能保护和修复大分子[14]。
氨基酸依赖型耐酸系统包括谷氨酸依赖型耐酸系统(acid resistance system 2,AR2)、精氨酸依赖型耐酸系统(AR3)、谷氨酰胺依赖型耐酸系统(AR4)[55-56]。谷氨酸依赖型耐酸系统是在谷氨酸存在的情况下,依赖于2 个谷氨酸脱羧酶(GadA和GadB)的异构体和谷氨酸-γ-氨基丁酸(γ-aminobutyric acid,GABA)反转运体(GadC)共同发挥耐酸作用。谷氨酸在谷氨酸脱羧酶的作用下脱羧生成γ-氨基丁酸并消耗细胞内的一分子H+,转运蛋白GadC将γ-氨基丁酸转运到细胞外并交换新的底物谷氨酸(glutamate,Glu)(图3)。精氨酸依赖型耐酸系统则需要精氨酸存在,由精氨酸脱羧酶(AdiA)参与脱酸反应,使精氨酸脱羧生成胍丁胺(agmatine),反转运体(AdiC)参与转运,泵出胍丁胺并交换精氨酸(图3)[55-56]。谷氨酰胺依赖型耐酸系统(AR4)是2013年由我国施一公教授等[56]发现的新型大肠杆菌氨基酸依赖耐酸系统,其与谷氨酸依赖型耐酸系统、精氨酸依赖型耐酸系统调控机制略有不同,其在谷氨酰胺(glutamine,Gln)存在的条件下,依赖于谷氨酰胺酶(YbaS)和氨基酸反向转运蛋白(GadC)共同发挥对酸的抵抗能力(图3)大肠杆菌利用谷氨酰胺酶将L-谷氨酰胺(L-Gln)转化为L-谷氨酸(L-Glu)并释放气态氨,游离氨中和质子,使细胞内的pH值不至于降低到致死的水平[56]。另外,研究者也发现一些起辅助作用的耐酸机制,如在酸性条件下,大肠杆菌周质空间分子伴侣HdeA和HdeB可与蛋白质结合并防止其聚集沉淀对细胞造成毒害作用[60]。HdeA和HdeB发挥抗酸作用的pH值不同,HdeA在pH 2.0~3.0都具有抗酸能力,然而HdeB只有在pH 3.0左右才能发挥抗酸性;而通过改变细胞膜成分和保持膜电荷稳定也会增强大肠杆菌的耐酸能力[61]。
6 结 语
大肠杆菌是一种极易感染肉类、乳制品、果汁、发酵食品等食品的肠道致病菌。在食品加工及感染宿主等过程中,需要相应的应激调控因子调节相关基因的表达,启动胁迫反应,以适应各种胁迫条件。因此,了解胁迫反应有助于全面了解微生物生理,有助于开发新的抗微生物制剂以及制定新的食品安全措施。然而,随着对胁迫反应逐渐深入了解,发现胁迫反应的复杂性和关联性,尚有很多未知机制有待于揭示。
回顾以往的研究并结合当前研究中所遇到的问题,未来可以从以下几个方面开展工作:1)目前对于大肠杆菌的一些胁迫响应机制和信号传导过程还了解甚少,如其在干燥胁迫下的应激机制、在酸胁迫下的葡萄糖-阻碍耐酸系统,都需要进一步研究。另外,在大肠杆菌长期应对不同环境的过程中,会发生进化并增强其抗性,需要在不断研究中发现并应对。2)在食品加工流通中,大肠杆菌常常受到多种逆境的共同胁迫,这些不利环境的种类和作用方式不同。对大肠杆菌产生的胁迫耐受性也各不相同。因此,仅研究大肠杆菌对某一种胁迫条件的抗性,已经不能真实地反映其在食品加工环境中所处状态。而需要采取有效的栅栏技术对它们的控制加以系统研究,充分研究各种胁迫在时空上综合效应,揭示和理解大肠杆菌在多种复合环境胁迫下的应激反应。3)通过构建基因缺陷株,并比较野生株与缺陷株之间生物学特性的差异,是目前研究阐明大肠杆菌在抵抗加工环境胁迫的分子机制常用技术,这种技术有很大的局限性。随着基因组、蛋白质组及代谢组学的飞速发展,基因芯片全基因组表达谱、双向蛋白质组表达谱等分析技术可应用于环境胁迫下大肠杆菌胁迫耐受分子机制的研究中。4)在自然界中有一些微生物嗜好极端点的pH值、温度、渗透压等生存条件,处于这种环境中的极端微生物的反应与大多数微生物的胁迫反应不同。比较极端微生物和普通微生物在胁迫条件下的生存机制的差异性、特殊性,对全面了解微生物生理功能有重要意义。相信在接下来几十年里,对大肠杆菌胁迫响应的研究将继续成为一个令人振奋的基础性和应用型的研究领域。
[1] RAFFAELLI R M, PALADINI M, HANSON H, et al. Child careassociated outbreak of Escherichia coli O157:H7 and hemolytic uremic syndrome[J]. The Pediatric Infectious Disease Journal, 2007,26(10): 951-953. DOI:10.1097/INF.0b013e31812571f6.
[2] HERMOS C R, JANINEH M, HAN L L, et al. Shiga toxin-producing Escherichia coli in children: diagnosis and clinical manifestations of O157:H7 and non-O157:H7 infection[J]. Journal of Clinical Microbiology, 2011, 49(3): 955-959. DOI:10.1128/JCM.02119-10.
[3] RILEY L W, REMIS R S, HELGERSON S D, et al. Hemorrhagic colitis associated with a rare Escherichia coli serotype[J]. New England Journal of Medicine, 1983, 308(12): 681-685. DOI:10.1056/ NEJM198303243081203.
[4] 山珊, 赖卫华, 陈明慧, 等. 农产品中大肠杆菌O157:H7的来源及分布研究进展[J]. 食品科学, 2014, 35(1): 289-293. DOI:10.7506/ spkx1002-6630-201401057.
[5] ARTHUR M W, DIEP H J, UMID S, et al. Multistate outbreak of Escherichia coli O157:H7 infection associated with consumption of packaged spinach, August-September 2006: the Wisconsin investigation[J]. Clinical Infectious Diseases, 2009, 48(8): 1079-1086. DOI:10.1086/597399.
[6] JULIANA G, ARON M W, ARTHUR W, et al. Spinach-associated Escherichia coli O157: H7 outbreak, Utah and New Mexico, 2006[J]. Emerging Infectious Diseases, 2008, 14(10): 1633-1636. DOI:10.3201/ eid1410.071341.
[7] 李颖, 关国华. 微生物生理学[M]. 北京: 科学技术出版社, 2013:335-336.
[8] SUO B, WANG Y. Evaluation of a multiplex selective enrichment broth SEL for simultaneous detection of injured Salmonella,Echerichia coli O157:H7 and Listeria monocytogenes[J]. Brazilian Journal of Microbiology, 2014, 44(3): 737-742. DOI:10.1590/S1517-83822013000300011.
[9] BI X, WANG Y, ZHAO F, et al. Sublethal injury and recovery of Escherichia coli O157:H7 by high pressure carbon dioxide[J]. Food Control, 2015, 50: 705-713. DOI:10.1016/j.foodcont.2014.10.014.
[10] WU V C H. A review of microbial injury and recovery methods in food[J]. Food Microbiology, 2008, 25(6): 735-744. DOI:10.1016/ j.fm.2008.04.011.
[11] SPECTOR M P, KENYON W J. Resistance and survival strategies of Salmonella enterica to environmental stresses[J]. Food Research International, 2012, 45(2): 455-481. DOI:10.1016/ j.foodres.2011.06.056.
[12] BLOUNT Z D. The unexhausted potential of E. coli[J]. Elife, 2015, 4:e05826. DOI:10.7554/eLife.05826.
[13] 史贤明, 施春雷, 索标, 等.食品加工过程中致病菌控制的关键科学问题[J]. 中国食品学报, 2011, 11(9): 194-208. DOI:10.3969/ j.issn.1009-7848.2011.09.021.
[14] WESCHE A M, GURTLER J B, MARKS B P, et al. Stress, sublethal injury, resuscitation, and virulence of bacterial foodborne pathogens[J]. Journal of Food Protection, 2009, 72(5): 1121-1138.
[15] MASAYUKI M, HIROKO F, KAORI N, et al. Molecular strategy for survival at a critical high temperature in Eschierichia coli[J]. PLoS ONE, 2011, 6(6): e20063. DOI:10.1371/journal.pone.0020063.
[16] 张冬冬. 肠炎沙门氏菌热损伤修复方法研究及其rpoH基因的敲除[D].合肥: 合肥工业大学, 2009.
[17] MUÜLLER A, HOFFMANN J, MEYER H E, et al. Nonnative disulfide bond formation activates the σ32-dependent heat shock response in Escherichia coli[J]. Journal of Bacteriology, 2013,195(12): 2807-2816. DOI:10.1128/JB.00127-13.
[18] VIDOVIC S, MANGALAPPALLI I, ANIL K, et al. Heat acclimation and the role of RpoS in prolonged heat shock of Escherichia coli O157[J]. Food Microbiology, 2012, 30(2): 457-464. DOI:10.1016/ j.fm.2011.12.029.
[19] YURA T, KANEMORI M, MORITA M T. The heat shock response:regulation and function[M]. Washington: Bacterial Stress Responses,ASM Press, 2000: 99-102.
[20] ARSENE F, TOMOYASU T, BUKAU B. The heat shock response of Escherichia coli[J]. International Journal of Food Microbiology, 2000,55(1/3): 3-9. DOI:10.1016/S0168-1605(00)00206-3.
[21] BLASZCZAK A, GEORGOPOULOS C, LIBEREK K. On the mechanism of FtsH-dependent degradation of σ32the transcriptional regulator of Escherichia coli and the role of the DnaK chaperone machine[J]. Molecular Microbiology, 1999, 31: 157-166. DOI:10.1046/j.1365-2958.1999.01155.x.
[22] SHANNON M D, SHANKAR S, ANDREA N K, et al. Interplay between E. coli DnaK, ClpB and GrpE during protein disaggregation[J]. Journal of Molecular Biology, 2015, 427(2): 312-327. DOI:10.1016/j.jmb.2014.10.013.
[23] SUNG H J, SONG W J, KIM K K, et al. Combination effect of ozone and heat treatments for the inactivation of Escherichia coli O157:H7,Salmonella typhimurium, and and Listeria monocytogenes in apple juice[J]. International Journal of Food Microbiology, 2014, 171(3):147-153. DOI:10.1016/j.ijfoodmicro.2013.11.001.
[24] de JONG A E I, van ASSELT E D, ZWIETERING M H, et al. Extreme heat resistance of food borne pathogens Campylobacter jejuni, Escherichia coli, and Salmonella typhimurium on chicken breast fillet during cooking[J]. International Journal of Microbiology,2012: 1-10. DOI:10.1155/2012/196841.
[25] UPPAL S, MAURYA S R, HIRE R S, et al. Cyclic AMP receptor protein regulates cspE, an early cold-inducible gene, in Escherichia coli[J]. Journal of Bacteriology, 2011, 193(22): 6142-6151. DOI:10.1128/JB.05728-11.
[26] ASHLEY P, DEVYN G, PAMELA G. Escherichia coli cold shock protein CsdA effects an increase in septation and the resultant formation of coccobacilli at low temperature[J]. Archives of Microbiology, 2011, 193(5): 373-384. DOI:10.1007/s00203-011-0682-0.
[27] HANKINS J S, DENROCHE H, MACKIE G A. Interactions of the RNA-Binding protein Hfq with cspA mRNA, encoding the major cold shock protein[J]. Journal of Bacteriology, 2010, 192(10): 2482-2490. DOI:10.1128/JB.01619-09.
[28] GIULIODORI A M, di PIETRO F, MARZI S, et al. The cspA mRNA is a thermosensor that modulates translation of the cold-shock protein CspA[J]. Molecular Cell, 2010, 37(1): 21-33. DOI:10.1016/ j.molcel.2009.11.033.
[29] UPPAL S, MAURYA S R, HIRE R S, et al. Posttranscriptional regulation of cspE in Escherichia coli: involvement of the short 5-untranslatedregion[J]. FEMS Microbiology Letters, 2008, 279(1):83-91. DOI:10.1111/j.1574-6968.2007.01009.x.
[30] TRUBETSKOY D, PROUX F, ALLEMAND F, et al. SrmB, a DEAD-box helicase involved in Escherichia coli ribosome assembly, is specifically targeted to 23S rRNA in vivo[J]. Nucleic Acids Research,2010, 37(19): 6540-6549. DOI:10.1093/nar/gkp685.
[31] 王辉, 丁协刚, 李世文, 等. 冷休克蛋白的生物学功能研究进展[J].中华临床医师杂志, 2015, 9(8): 1418-1423. DOI:10.3877/cma. j.issn.1674-0785.2015.08.030.
[32] VIDOVIC S, MANGALAPPALLI-IIIATHU A K, KORBER D R. Prolonged cold stress response of Escherichia coli O157 and the role of rpos[J]. International Journal of Food Microbiology, 2011, 146(2):163-169. DOI:10.1016/j.ijfoodmicro.
[33] 王晓杰, 王娜, 宋金丽, 等. 冷冻胁迫下金黄色葡萄球菌的亚致死及失活规律[J]. 食品科学, 2013, 34(19): 5-9. DOI:10.7506/spkx1002-6630-201319002.
[34] KOSEKI S, NAKAMURA N, SHIINA T. Comparison of desiccation tolerance among Listeria monocytogenes, Escherichia coli O157:H7,Salmonella enterica, and Cronobacter sakazakii in powdered infant formula[J]. Journal of Food Protection, 2015, 78(1): 104-110. DOI:10.4315/0362-028X.JFP-14-249.
[35] CHEN J, LEE M, MAO Y. Protective effect of exopolysaccharide colonic acid of Escherichia coli O157:H7 to osmotic and oxidative stress[J]. International Journal of Food Microbiology, 2004, 93(5):281-286. DOI:10.1016/j.ijfoodmicro.2003.12.004.
[36] TAMARU Y, TAKANI Y, YOSHIDA T, et al. Crucial role of extracellular polysaccharides in desiccation and freezing tolerance in the terrestrial cyanobac-terium Nostoc commune[J]. Applied and Environmental Microbiology, 2005, 71(11): 7327-7333. DOI:10.1128/ AEM.71.11.7327-7333.2005.
[37] ALPERT P. The limits and frontiers of desiccation-tolerant life[J]. Integrative and Comparative Biology, 2005, 45(5): 685-695. DOI:10.1093/icb/45.5.685.
[38] ARMANDO H G. Anhydrobiosis in bacteria: from physiology to applications[J]. Journal of Biosciences, 2011, 36(5): 939-950. DOI:10.1007/s12038-011-9107-0.
[39] URUKI T, OKU K, SAKURAI M. Thermodynamic, hydration and structuralcharacteristics of alpha, alpha-trehalose[J]. Frontiers in Bioscience, 2009, 14: 3523-3535. DOI:10.2735/3468.
[40] MCMAHON M A S, XU J, MOOR E. Environmental stress and antibiotic resistance in food-related pathogens[J]. Applied and Environmental Microbiology, 2007, 73(1): 211-217. DOI:10.1128/ AEM.00578-06.
[41] WOOD J M. Bacterial osmosensing transporters[J]. Methods in Enzymology, 2007, 428: 77-107. DOI:10.1016/S0076-6879(07)28005-X.
[42] ZHANG Q, YAN T. Correlation of intracellular trehalose concentration with desiccation resistance of soil Escherichia coli populations[J]. Applied and Environmental Microbiology, 2012,78(20): 7407-7413. DOI:10.1128/AEM.01904-12.
[43] FINN S, HÄNDLER K, CONDELL O, et al. ProP is required for the survival of desiccated Salmonella enterica serovar Typhimurim cells on a stainless stell surface[J]. Applied and Environmental Microbiology, 2013,79(14): 4376-4384. DOI:10.1128/AEM.00515-13.
[44] GRUADEV N, McCLELLAND M, PPRWOLLIK S, et al. Global transcriptional analysis of dehydrated Salmonella enterica serovar Typhimurium[J]. Applied and Environmental Microbiology, 2012,78(22): 7866-7875. DOI:10.1128/AEM.01822-12.
[45] LI H, BHASKARA A, MEGALIS C, et al. Transcriptomic analysis of Salmonella desiccation resistance[J]. Foodborne Pathogens and Disease, 2012, 9(12):1143-1151. DOI:10.1089/fpd.2012.1254.
[46] 李冠楠, 夏雪娟, 朱勇, 等. 抗菌肽的研究进展及其应用[J]. 动物营养学报, 2014, 26(1): 17-25. DOI:10.3969/j.issn.1006-267x.2014.01.003.
[47] ALEXANDER J, ABHYUDAY M, SURAJ S. Protein-based bioplastics and their antibacterial potential[J]. Journal of Applied Polymer Science, 2015, 132(18): 1-11. DOI:10.1002/app.41931.
[48] GUANÍ-GUERRA E, SANTOS-MENDOZA T, LUGO-REYES S O, et al. Antimicrobial peptides: general overview and clinical implications in human health and disease[J]. Clinical Immunology,2010, 135(1): 1-11. DOI:10.1016/j.clim.2009.12.004.
[49] PÁLFFY R. On the physiologyand pathophysiology of antimicrobial peptides[J]. Molecular Medicine, 2009, 15(1/2): 51-59. DOI:10.2119/ molmed.2008.00087.
[50] JOHANNA H. Breaking barriers-attack on innate immunedefences by omptin surface proteases of enterobacterial pathogens[J]. Innate Immunity, 2009, 15(2): 67-80. DOI:10.1177/1753425909102559.
[51] 刘晓露, 惠长野, 赵铁, 等. 大肠杆菌外膜蛋白酶T及其突变体的表达、复性及生物活性分析[J]. 微生物学报, 2011, 38(9): 1393-1399.
[52] HUI C Y, GUO Y, HE Q S, et al. Escherichia coli outer membrane protease OmpT confers resistance to urinary cationic peptides[J]. Microbiology and Immunology, 2010, 54(8): 452-459. DOI:10.1111/ j.1348-0421.2010.00238.x.
[53] 屈娅荣, 赵铁, 曹曦, 等. 大肠埃希菌外膜蛋白T水解人防御素-4作用[J]. 中国公共卫生, 2013, 29(5): 696-698. DOI:10.11847/ zgggws2013-29-05-24.
[54] CASTILLO A, LUCIA L M, ROBERSON D B, et al. Lactic acid sprays reduce bacterial pathogens on cold beef carcass surfaces and in subsequently produced ground beef[J]. Journal of Food Protection,2001, 64(1): 58-62.
[55] FOSTER J W. Escherichia coli acid resistance: tales of an amateur acidophile[J]. Nature Reviews Microbiology, 2004, 2(11): 898-907. DOI:10.1038/nrmicro1021.
[56] LU P, MA D, CHEN Y L, et al. L-glutamine provides acid resistance for Escherichia coli through enzymatic release of ammonia[J]. Cell Research, 2013, 23(5): 635-644. DOI:10.1038/cr.2013.13.
[57] THÜRMER A, VOIGT B, ANGELOV A, et al. Proteomic analysis of the extremely thermoacidophilic archaeon Picrophilus torridus at pH and temperature values close to its growth limit[J]. Bulletin of the Medical Library Association, 1978, 66(1): 61-63 DOI:10.1002/ pmic.201000829.
[58] MA D. Structure and mechanism of a glutamate-GABA antiporter[J]. Nature, 2012, 483: 632-636. DOI:10.1038/nature10917.
[59] XUANLIN T, LATIFI T, BOUGDOUR A, et al. The PhoP/PhoQ two-component system stabilizes the alternative sigma factor RpoS in Salmonella enterica[J]. Proceedings of the National Academy of Sciences, 2006, 103(36): 13503-13508. DOI:10.1073/ pnas.0606026103.
[60] 于延庆, 于志超, 李艳妮. 分子伴侣HdeA与HdeB的作用机制[J]. 中国生物化学与分子生物学报, 2014, 30(5): 441-446.
[61] ROYCE L A, BOGGESS E, FU Y, et al. Transcriptomic analysis of carboxylic acid challenge in Escherichia coli: beyond membrane damage[J]. PLoS ONE, 2014, 9(2): e89580. DOI:10.1371/journal. pone.0089580.
Progress in Research on Stress Response in Escherichia coli during Food Processing and Storage
SHI Hui, CHEN Zhuozhu, KAN Jianquan*
(College of Food Science, Southwest University, Chongqing 400715, China)
Escherichia coli can sense environmental signals and respond quickly to the changing environment. Therefore,during food processing and storage, the response of E. coli to physical and chemical stress enables them to survive and maintain virulence, which poses a great threat to food safety. This paper is focused on summarizing the molecular and physiological response of E. coli to common stress factors during food processing and storage and its application in the food industry, including heat shock, cold shock, desiccation, hyperosmotic stress, antimicrobial peptides and acid stress. The future research direction in this area is also discussed.
Escherichia coli; food processing and storage; stress factors; response mechanism
10.7506/spkx1002-6630-201609046
TS201.3
A
1002-6630(2016)09-0250-08
石慧, 陈卓逐, 阚建全. 大肠杆菌在食品加工贮藏中胁迫响应机制的研究进展[J]. 食品科学, 2016, 37(9): 250-257. DOI:10.7506/spkx1002-6630-201609046. http://www.spkx.net.cn
SHI Hui, CHEN Zhuozhu, KAN Jianquan. Progress in research on stress response in Escherichia coli during food processing and storage[J]. Food Science, 2016, 37(9): 250-257. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201609046. http://www.spkx.net.cn
2015-05-17
国家自然科学基金青年科学基金项目(31401567);中央高校基本科研业务费专项资金项目(XDJK2014B020);西南大学博士启动基金项目(SWU113041)
石慧(1986—),女,讲师,博士,研究方向为食品质量与安全。E-mail:shi_hui_1986@163.com
*通信作者:阚建全(1965—),男,教授,博士,研究方向为食品质量与安全、食品化学。E-mail:ganjq1965@163.com

