植物乳杆菌LPL10的体外益生特性研究
陈琼 甘祥武 黄魁英 赵乐怡 李学优 鲍志宁
摘要[目的]在筛选到一株食品源植物乳杆菌LPL10的基础上,通过对其耐酸性、耐胆盐、抑菌能力和产酸能力进行研究,确定其益生特性。[方法]采用平板活菌计数法测定LPL10的耐酸、耐胆盐性能,通过抑菌圈法评价菌株的抑菌能力,高效液相色谱法测定LPL10发酵产有机酸能力。[结果]植物乳杆菌LPL10具有良好的低酸耐受能力,在pH 3.5条件下培养24 h活菌数为1.2×108 cfu/mL,存活率为148%;LPL10受0.1%胆盐抑制影响较小,培养24 h后活菌数为3.60×108 cfu/mL,存活率为356%;植物乳杆菌LPL10对指示菌金黄色葡萄球菌、藤黄微球菌和绿脓杆菌均有良好的抑制作用;LPL10发酵上清液中产的主要有机酸为乳酸和乙酸,相对含量分别为20.33、25.26 mg/L。[结论]体外益生特性研究表明,植物乳杆菌LPL10可以作为潜在的益生性菌株。
关键词植物乳杆菌;耐酸;耐胆盐;抑菌;产酸能力
中图分类号TS201.3文献标识码A
文章编号0517-6611(2019)02-0156-03
doi:10.3969/j.issn.0517-6611.2019.02.047
乳酸菌是发酵糖类且主要产物为乳酸的一类革兰氏阳性、无芽孢、厌氧生长细菌的总称,它不仅能够增强机体免疫力和抵抗力,还能防止部分胃肠道疾病的发生[1-3]。作为一种重要的乳酸菌,植物乳杆菌属于乳杆菌科中的乳杆菌属,厌氧或兼性厌氧,该菌与其他乳酸菌的不同之处在于植物乳杆菌的活菌数比较高,能大量产酸,而且产出的酸性物质能够降解重金属。植物乳杆菌常见于肉类、奶油及很多蔬菜发酵制品中,能通过胃并定植于肠道发挥益生作用,诸如调节肠道菌群平衡、对致病菌有抑制作用、降低血清胆固醇含量和预防心血管疾病、缓解乳糖不耐症等。植物乳杆菌及其代谢产物作为微生态调节剂,可抑制人或动物体内常见的致病菌,在食品、饲料等领域受到广泛关注。要发挥益生作用,益生菌必须能够耐受人体胃肠道中胃酸和胆汁等不良环境[4-7]。鉴于此,笔者以植物乳杆菌LPL10为研究对象,分别测定其耐酸耐胆盐、抑菌及产酸特性,以期开发出1株潜在的益生性菌株。
1材料与方法
1.1材料
1.1.1菌种。
植物乳杆菌LPL10来源于农家酸豆角(已通过生化试验和16S rDNA序列分析方法鉴定);指示菌金黄色葡萄球菌SAU08、藤黄微球菌MLU02、绿脓杆菌PPY01来源于广东省微生物种质资源库。
1.1.2主要试剂及培养基。
胆盐:广东环凯微生物科技有限公司;有机酸标准品:Sigma;其他普通试剂均为国产分析纯。
LB培养基:蛋白胨10 g,酵母提取物5 g,氯化钠10 g,pH 7.4,配制1 L,固体培养基加入1.2%琼脂粉。
NA培养基:蛋白胨10 g,牛肉膏3 g,氯化钠5 g,pH 7.2~7.4,配制1 L,固体培养基加入1.2%琼脂粉。
MRS培养基:蛋白胨10 g,牛肉膏8 g,酵母膏粉4 g,葡萄糖20 g,磷酸氢二钾2 g,柠檬酸三氨2 g,乙酸钠5 g,硫酸镁200 mg,硫酸锰50 mg,吐温80 g,pH 6.2±0.2,配制1 L,固体培养基加入1.2%琼脂粉。
1.1.3主要仪器设备。显微镜:重庆奥特光学仪器有限公司;752N型紫外可见分光光度计:上海仪电分析仪器有限公司;生化培养箱:上海一恒科学仪器有限公司;PHS-3C型pH计:上海仪电科学仪器股份有限公司;PCR仪:Bio-Rad公司;高效液相色谱仪:岛津LA20液相色谱仪;低温冷冻离心机:Eppendorf 5427 R。
1.2方法
1.2.1耐酸性能研究。用7 mol/L的盐酸分别调节MRS培养基pH为2.5、3.0和3.5。将植物乳杆菌LPL10菌种活化后(菌液中菌的活菌数为8.1×107 cfu/mL),以2%的接种量分别接种于pH 2.5、3.0和3.5的MRS培养基,于37 ℃恒温培养箱中静置培养,并在0、2、24 h取样,稀释至合适梯度后涂布MRS培养基,培养24 h后计算活菌数。对照普通MRS培养基中涂布后的菌落数,计算菌的存活率。公式为存活率=N0/Nt×100%,其中N0表示低pH的活菌数,Nt表示普通MRS的活菌数。
1.2.2耐胆盐性能研究。将植物乳杆菌LPL10菌种活化后(菌液中菌的活菌数为1.01×108 cfu/mL),以2%的接种量接种于胆盐浓度分别为0.1%、0.3%和0.5%的MRS培养基中,于37 ℃恒温培养,并在0、2、24 h取样,稀释至合适梯度后涂布MRS培养基,培养24 h后计算活菌数。以普通MRS中涂布后的菌落数为对照,计算菌的存活率。公式为存活率=N0/Nt×100%,其中N0表示胆盐培养基的活菌数,Nt表示普通MRS的活菌数。
1.2.3抑菌试验。
1.2.3.1指示菌菌懸液的制备。选取金黄色葡萄球菌、藤黄微球菌、绿脓杆菌为指示菌,将斜面培养的3种指示菌用4~5 mL生理盐水洗脱下来,测其OD600并设置OD600=4.00±0.01。
1.2.3.2试验平板的制备。将3种指示菌培养基加热融化并冷却到40~50 ℃,然后按1 μL/mL的比例添加已调配好的指示菌菌悬液,摇匀;用灭过菌的移液管分别移取10 mL已调节好的各培养基到90 mm培养皿中,待其凝固后用灭过菌的打孔器(直径2.7 mm)打孔;各孔加入5 μL植物乳杆菌发酵上清液,于37 ℃恒温培养24 h,观察抑菌效果,并测量抑菌圈直径[8]。
1.2.4测定产酸能力。将植物乳杆菌LPL10菌种活化后,以2%的接种量接种于MRS培养基中,37 ℃静置培养48 h,发酵结束后取发酵液4 mL,离心取上清液,采用0.22 um过滤膜进行过滤。液相操作条件为Aminex HPX-87H色谱柱(300 mm×7.8 mm),线性梯度洗脱,进样量20 uL,示差显示器检测,流动相5 mmol/L硫酸,流速为0.6 mL/min,柱温65 ℃。采用面积外标法进行定量测定。
2结果与分析
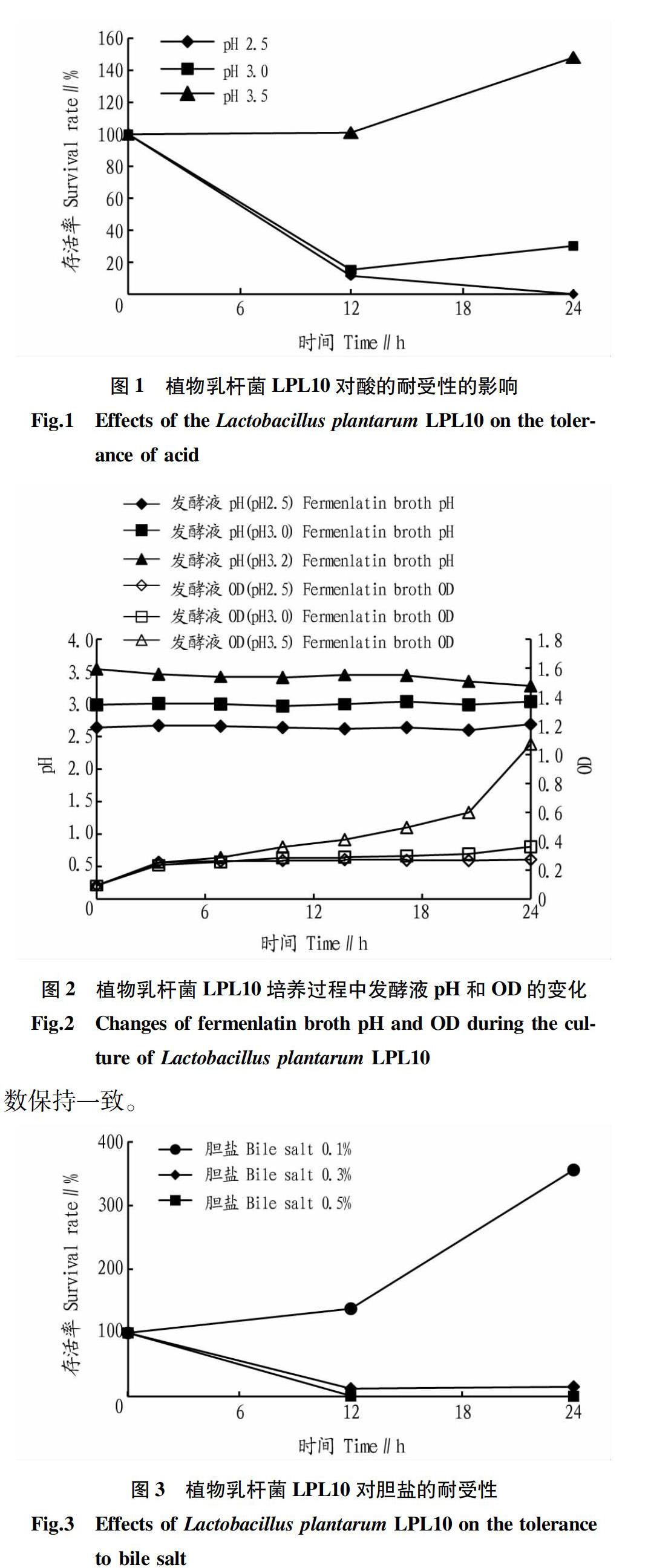
2.1耐酸性试验结果
人体胃酸pH主要维持在2.0~3.0,益生菌通过口服进入肠道需经过胃的酸性环境[8],因此耐酸性试验选取3个pH,分别为2.5、3.0和3.5。由图1和2可以看出,植物乳杆菌LPL10具有一定的耐酸能力。MRS培养基pH为2.5时,LPL10培养2 h活菌数依然保持在9.35×106 cfu/mL水平,但24 h后活菌数明显降低,生长受到抑制;在培养基pH 3.0条件下,LPL10培养2和24 h后,活菌数都与初始菌数保持在同一数量级上,说明LPL10已能较好的耐受酸的影响,并保持一定的生长率;pH为3.5时,LPL10的生长已不受抑制,培养24 h存活率达到148%,显示出良好的耐受性。
2.2耐胆盐试验结果
耐膽盐试验结果显示(图3和4),随着培养基胆盐浓度越高,LPL10存活率逐渐降低。在0.1%胆盐浓度下LPL10的生长受胆盐影响较小,培养2 h活菌数为1.39×108 cfu/mL,培养24 h后活菌数增长至3.60×108 cfu/mL,存活率达356%;在0.3%胆盐浓度下LPL10的生长已经受到较大的抑制,培养24 h存活率为15.3%,但活菌依然维持在107 cfu/mL水平,LPL10虽受到抑制,但也维持一定的生长率。不同胆盐浓度下发酵液pH及OD600与活菌数保持一致。
2.3抑菌试验结果
采用打孔法对植物乳杆菌LPL10的抑菌能力进行测定,抑菌圈直径越大,表示菌体的抑菌效果越好。试验结果显示,LPL10对金黄色葡萄球菌、藤黄微球菌、绿脓杆菌均有一定的抑制作用,其中对绿脓杆菌的抑制效果最明显,其抑菌圈直径为6.49 mm。由于植物乳杆菌产酸也具有一定的抑菌效果,还需确定LPL10是否具有产细菌素功能。
2.4产酸特性
产酸是乳酸菌的一个重要益生特性,产何种酸与产酸能力强弱对乳酸菌的应用具有指导作用[9]。该试验通过高效液相色谱法对LPL10发酵产有机酸能力进行了测定,图5和6分别是有机酸标准品和LPL10发酵上清液液相图。对两者的有机酸出峰时间进行比较,结果显示LPL10发酵上清液中主要有机酸为乳酸及乙酸,经过计算其浓度分别为20.33、25.26 mg/L(表1)。
3结论与讨论
植物乳杆菌是一种被广泛应用于食品、发酵、青贮等方面的益生菌。随着研究的深入,近年来植物乳杆菌也逐渐被用作肠道微生态改善制剂用于改善肠道微生态环境,因此对其各种益生能力的要求也逐渐提高。该研究中菌株LPL10为筛选于食品源的野生菌株,已经过生理生化、16S rDNA鉴定确定为植物乳杆菌,并通过体外耐酸耐胆盐、抑菌、产酸能力试验,对该株菌的益生特性进行了初步研究。耐酸试验中植物乳杆菌LPL10显示出良好的耐酸能力,能够耐受pH 3.5的酸性环境,但其在低酸环境中的稳定性还不够突出,后续还有较大的优化空间。在0.1%的胆盐浓度下,LPL10菌落的存活率达到100%以上。植物乳杆菌LPL10对常见的致病菌均有一定的抑制作用,其中对绿脓杆菌的抑制效果最明显。液相检测结果显示,菌株具有良好的产酸能力。LPL10在体外试验中显示出了良好的益生潜力,后续可进一步优化其相应特性。
参考文献
[1] 王水泉,包艳,董喜梅,等.植物乳杆菌的生理功能及应用[J].中国农业科技导报,2010,12(4):49-55.
[2] 靳志强,王延样.植物乳杆菌在人体肠道的益生特性[J].中国乳品工业,2007,35(9):30-34.
[3] 黄秀敏,张宜靖,李学优,等.植物乳杆菌发酵培养基的优化[J].安徽农业科学,2016,44(24):6-7,22.
[4] LIU Y W,LIONG M T,CHIEH T Y.New perspectives of Lactobacillus plantarum as a probiotic: The gutheartbrain axis[J]. J Microbiol,2018,56(9):601-613.
[5] 王春光,张雪,李达,等.酸菜来源植物乳杆菌的分离鉴定与耐受性研究[J].食品科技,2010,35(10):35-38.
[6] 唐雅茹,于上富,国立东,等.一株降胆固醇乳杆菌的筛选及其益生作用的研究[J].食品工业科技,2016,37(1):142-144,152.
[7] 侯颖,王维宇,牛明福,等.自然发酵泡菜汁中植物乳杆菌的分离鉴定与体外益生特性研究[J].动物营养学报,2017,29(10):3611-3619.
[8] 甘祥武,黄魁英,曹丁,等.3株植物乳杆菌LPL04、LPL05、LPL14的益生特性[J].食品科技,2017,42(12):2-5.
[9] 林龙镇,邹卫玲,李安章,等.产酸、耐酸乳酸菌的分离鉴定及益生特性[J].华南农业大学学报,2018,39(2):95-102.

