汉逊德巴利酵母菌在胃酸、肠胆盐环境的耐受性研究
肖新云,刘又嘉,邓艳玲,谭周进(湖南中医药大学,湖南 长沙 410208)
汉逊德巴利酵母菌在胃酸、肠胆盐环境的耐受性研究
肖新云,刘又嘉,邓艳玲,谭周进
(湖南中医药大学,湖南 长沙 410208)
摘 要:为探究汉逊德巴利酵母菌在酸性、胆盐环境及人工胃肠液下的存活情况,采用活菌计数法,分别在pH值1.0、1.5、2.0、2.5,胆盐浓度0.2%、0.3%、0.4%的PDA液体培养基,人工胃液作用0、2、4 h,以及人工肠液作用0、2、4、6、8、10 h环境下,测定汉逊德巴利酵母菌的活菌数。结果表明:耐酸试验中,该菌株在pH值1.0没有存活,pH值1.5、2.0、2.5活菌数与对照组比较下降明显(P<0.01);耐胆盐试验中,该菌株在0.4%的高胆盐浓度下仍然存活,活菌数随胆盐浓度增加而降低;人工胃液试验中,与0 h比较,2 h、4 h活菌数显著增加(P<0.01);人工肠液试验中,随着处理时间的延长,该菌株活菌数先升后降,但都比0 h活菌数增加。可见,汉逊德巴利酵母菌能够耐受较高的酸性环境和较高的胆盐环境,并在人工胃肠液环境下具有较高的存活能力,符合研制新型微生态制剂的条件。
关键词:汉逊德巴利酵母菌;耐酸;耐胆盐;人工胃液;人工肠液
当前,微生态制剂作为一种无毒副作用、可调节微生态平衡、发挥肠道益生功能的制剂正逐渐被研究和开发,双歧杆菌类、乳杆菌属、芽孢杆菌类和酵母菌属的多个菌株已作为微生态制剂应用于临床,治疗各种肠道疾病[1]。酵母菌是使用时间较长、效果明显的益生菌,具有促进营养物质的吸收、增强机体免疫力和抵抗力、改善肠道内菌群的分布等功效[2]。
胃肠道环境含有大量的胃酸、胆汁、微生物和一些酶类物质,它们共同构成一道天然的屏障,抵御外来微生物的定值和存活。益生菌是一类能维持肠道内菌群平衡、促进营养物质吸收、调节免疫系统的活体微生物[3],其发挥有益作用的关键在于能否抵御消化道内的不良环境以及是否具有附着于胃肠道的粘附能力[4]。课题组从实验动物肠道中分离鉴定出一株与治疗菌群失调腹泻疗效相关的汉逊德巴利酵母菌,为研究它的益生特性,通过人工模拟胃液、肠液环境,以菌株存活数为指标,设计了该菌株耐酸耐胆盐试验方案,以期为研制新型微生态制剂提供依据。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 汉逊德巴利酵母菌由课题组从实验动物小鼠肠道内容物中分离提取。
1.1.2 培养基 PDA液体和固体培养基[5]。
1.1.3 试剂与仪器 猪胆盐,胃蛋白酶(酶活力1∶10 000)、胰蛋白酶(酶活力1∶250),手提式压力蒸汽灭菌锅(浙江新丰医疗器械有限公司)、SHZ-82气浴恒温振荡器(太原仪诚实验室设备有限公司)和HH Bll·500-S电热恒温培养箱(上海博泰实验设备有限公司)。
1.2 试验方法
1.2.1 菌种活化 从4℃冰箱中取出斜面培养基保存的汉逊德巴利酵母菌,室温解冻后,接种于PDA斜面培养基进行活化,再将活化好的菌种接种到PDA液体培养基进行扩培。
1.2.2 耐酸试验 将活化增殖的菌株按10%量接种于不同pH值(1.0、1.5、2.0、2.5)的PDA液体培养基中,37℃摇床培养48 h,以自然pH值做对照,做活菌培养计数[6-7]。
1.2.3 耐胆盐试验 将活化的菌株按10%量接种于添加不同的浓度胆盐(0.2%、0.3%、0.4%)的PDA液体培养基37℃摇床培养48 h,以未添加胆盐PDA培养基做对照,做活菌培养计数[6-7]。
1.2.4 人工胃液配制 准确量取20 mL 1 mol/L盐酸,加蒸馏水和1 mol/L NaOH调节pH值分别至1.5、2.5 和3.5。然后按1 g/100 mL加入胃蛋白酶,充分溶解后用孔径0.22 μm的微孔滤膜过滤除菌,制得人工胃液备用[8]。
1.2.5 人工肠液配制 称取KH2PO43.4 g,加蒸馏水250 mL溶解,用1 mol/L NaOH调pH值至6.8,加水稀释至500 mL,再按0.1 g/L加入胰蛋白酶,充分溶解后用孔径0.22 μm的微孔滤膜过滤除菌,制得人工肠液备用[9]。
1.2.6 模拟胃肠液试验 将活化好的菌种按10%接种量分别接种于人工胃液和人工肠液中,混匀,37℃恒温振荡培养,人工胃液处理后分别于0、2、4 h取样,人工肠液分别于0、2、4、6、8、10 h取样。处理后菌液用无菌水做10倍梯度稀释,采用PDA固体培养基进行活菌计数[10-11]。
1.2.7 活菌培养计数 用无菌水做10倍稀释,耐酸组稀释至10-1、10-2,耐胆盐实验组稀释至10-3,对照组稀释至10-3,模拟胃液组稀释至10-4、10-5,模拟肠液组稀释至10-5、10-6。每支试管3次重复,每个稀释度2个重复,采用涂抹平板计数法,每个平板滴取0.1 mL进行无菌涂布,静置20 min后37℃倒置恒温培养48 h,计数最适菌数(菌落数在30~300个为宜),将结果换算成cfu/mL。
1.2.8 数据处理 根据公式(1)求出菌落数[5]。实验所得计量数据采用平均值±标准差(x±s)表示,数据采用SPSS17.0进行统计学分析,P<0.05有统计学意义。
每mL样品的菌数=同一稀释度几次重复的菌落平均数×10×稀释倍数 (1)
2 结果与分析
2.1 耐酸性试验
由表1可知,菌株在pH值1.0时没有存活,在pH值1.5时,菌株开始能够存活,而且随着酸度值的增加,活菌数也增加。pH值1.5、2.0、2.5与对照组比较均有统计学意义(P<0.01),说明酸性环境确实对汉逊德巴利酵母菌的生长有抑制作用。汉逊德巴利酵母菌在pH值1.5的酸性环境下能存活,也说明了该菌株能够耐受较高的酸性环境。
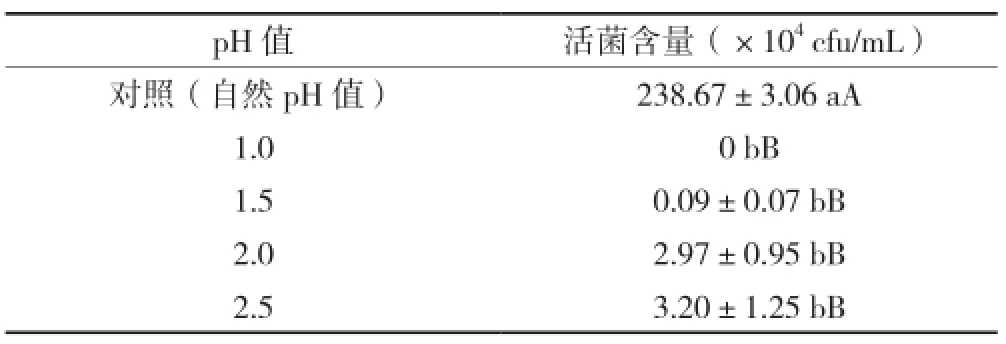
表1 汉逊德巴利酵母菌在酸性环境中的活菌数量
2.2 耐胆盐试验
由图1可知,随着胆盐浓度的提高,活菌含量减少,并与对照组0%比较都具有显著的统计学意义(P<0.01),说明胆盐环境不利于该菌株的生长。0.3%、0.4%胆盐浓度与0.2%胆盐浓度比较均有统计学意义,说明胆盐浓度越高对该菌株的生长越不利。该菌株在0.4%的高胆盐环境下能存活,提示该菌株能耐受较高的胆盐环境。

图1 胆盐浓度对汉逊德巴利酵母菌生长的影响
2.3 人工胃液处理汉逊德巴利酵母菌活菌数
由表2可知,经过2 h甚至4 h培养后,pH值1.5、2.5、3.5处理活菌数都较0 h增加,且具有显著的统计学差异(P<0.01),与2 h比较,pH值1.5、2.5、3.5在培养4 h后取样活菌数仍然在上升,其中pH值3.5人工胃液培养4 h较培养2h后活菌数显著增加,这说明汉逊德巴利酵母菌在人工胃液环境下活菌数不但没有减少,反而能适应性繁殖。
2.4 人工肠液处理汉逊德巴利酵母菌活菌数
由表3可知,随着人工肠液处理的时间不同,汉逊德巴利酵母菌的活菌含量也不相同(P<0.01)。其中与0 h比较,2、4、6、8、10 h都分别与之有统计学意义(P<0.05或P<0.01);与2 h比较,4 h和6 h活菌数增加显著;与4 h、6 h比较,8 h和10 h活菌数下降明显。总体上来看,活菌含量是先升后降,但都比初始活菌量要高,这充分说明该菌株能够存活并定值于肠道环境。

表2 不同pH值人工胃液处理对汉逊德巴利酵母菌生长的影
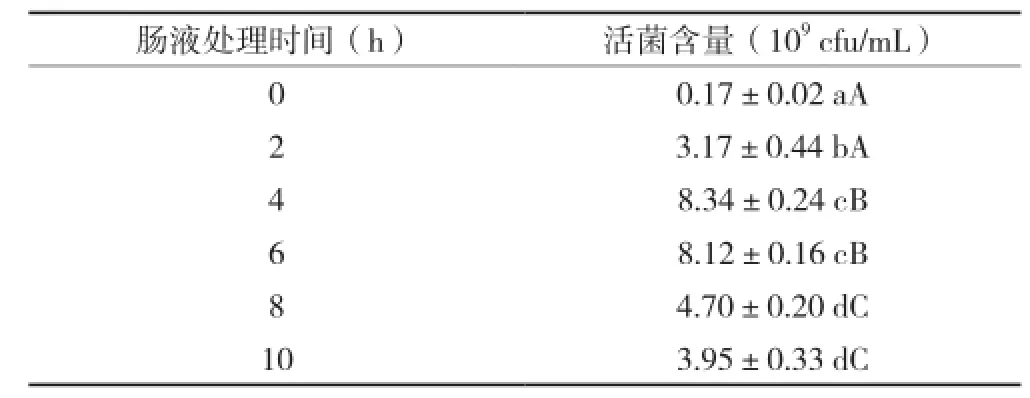
表3 人工肠液处理对汉逊德巴利酵母菌生长的影响
3 结论与讨论
胃肠道的杀菌作用,主要是低pH值和高胆汁盐酸。胃液的酸性环境可以激活胃蛋白酶原,从而杀死随食物进入胃内的细菌[12]。肝脏分泌到十二指肠中的高浓度的胆汁盐酸具有抗菌活性,它对细胞膜具有较强的破坏能力,同时胆盐能在小肠形成高渗透压环境,使微生物质壁分离,失水收缩。汉逊德巴利酵母菌是一种高耐盐酵母菌,具有很强的蛋白质和脂肪分解能力。目前对于其研究主要在于微生物发酵剂,如酒醅发酵、干酪发酵、腊肉脂肪水解等,用于提高产品的风味[13-15]。对于汉逊德巴利酵母菌在肠道的研究也有报道,发现该菌株是凡纳滨对虾、虹鳟、刺参等肠道内的优势菌种[16]。Kumura 等[17]在体外模仿肠环境对8种乳制品来源酵母菌的益生菌潜力进行评估,发现汉逊德巴利酵母具有一定的肠壁粘附能力和耐酸耐胆盐的能力,具有一定的益生菌开发价值,这也为该菌株开发功能性食品和微生态制剂提供了依据。
汉逊德巴利酵母菌要在肠道发挥益生功能,必须先能通过胃酸环境。一般胃液酸性环境约为3.0,空腹或食用酸性食品pH值可达1.5,食用碱性食品可达pH值4~5[8]。食物通过胃液的时间一般为1~2 h。从口腔到肠道这一过程中,益生菌首先要以活菌状态通过胃才有机会进入肠道[18]。人体和动物小肠中胆汁浓度大约在0.03%~0.30%范围内波动,汉逊德巴利酵母菌要在肠道内生存,必须能够耐受一定浓度的胆汁[19]。试验为了探究小鼠疗效相关肠道中分离出来的汉逊德巴利酵母菌能否在胃肠道环境中存活,据此设计了pH值1.0、1.5、2.0、2.5等4个酸性梯度和0.2%、0.3%、0.4%等3个胆盐浓度以及人工模拟了胃肠环境。结果发现,酸性环境、胆盐浓度对该菌株的生长具有抑制作用,但该菌株仍能在pH值1.5高酸性环境和0.4%的高胆盐环境下存活,说明该菌株能够耐受较高酸性和较高胆盐的环境。人工胃肠液环境下,该菌株不但没有出现抑制性生长的情况,反而能在人工胃肠液环境中适应性繁殖。由试验结果可知,汉逊德巴利酵母菌具有被开发功能食品和微生态制剂的可能。此外,为了更全面的研究其益生菌特性,可考虑开展温度对该菌株生长繁殖的影响以及该菌株的降胆固醇研究等,以更全面的评估该菌株的益生菌特性。
参考文献:
[1] 周雨霞,侯先志. 益生菌与肠道疾病[J]. 中国微生态学杂志,2006,18(2):147-148.
[2] 郭抗萧,周赛男,曾 奥,等. 酵母菌的微生态调节作用[J]. 中国微生态学杂志,2013,25(1):94-96.
[3] 袁秀丽,吕嘉枥,韩 迪,等. 益生菌制品的研究进展[J]. 中国乳品工业,2010,38(4):46-49.
[4] 汪 川,张朝武,孙晓帆,等. 人胃和肠道来源乳杆菌耐酸耐胆盐能力的初步研究[J].现代预防医学,2006,33(10):1792-1794.
[5] 赵 斌,何绍江. 微生物学实验[M]. 北京:科学出版社,2002.
[6] 王京京,徐海燕,汪孟娟,等. 戊糖片球菌的耐酸及耐胆盐能力研究[J]. 广东饲料,2014,23(8):24-25.
[7] 刘 慧,陈湘宁,李 晨,等. 藏灵菇酵母菌M3耐胃肠道逆环境特性及降胆固醇实验研究[J]. 中国农学通报,2009,25(15):60-63.
[8] 熊 涛,宋苏华,黄锦卿,等. 植物乳杆菌NCU116在模拟人体消化环境中的耐受力[J]. 食品科学,2011,32(11):114-117.
[9] 辛 羚,郭本恒,吴正钧. 3株乳杆菌在模拟消化环境中存活性能的研究[J]. 中国乳品工业,2005,33(5):15-17.
[10] 王京京,徐海燕,汪孟娟,等. 戊糖片球菌的耐酸及耐胆盐能力研究[J]. 广东饲料,2014,23(8):24-25.
[11] 包淋斌,郝向东,瞿明仁,等. pH、胃液、肠液、胆盐对强微乳粪肠球菌耐受性影响[J].江西农业大学学报,2015,35(3):563-567.
[12] 杨晓宇,张七斤,于晨龙,等. 不同来源乳酸菌的耐酸耐胆盐试验[J].动物医学进展,2014,35(2):73-77.
[13] 周瑞平,陈云宗,游 玲. 多粮浓香型白酒糟醅中的酵母区系的初步研究[J]. 粮酒科技,2010,(3):34-36.
[14] 王永丽,李晓东,姚春燕,等. 乳酸乳球菌与酵母菌混合培养时间的相互影响[J]. 中国乳品工业,2012,40(12):8-11.
[15] 陈 剑,蒋云升,闫婷婷. 发酵剂对兔肉脯游离脂肪酸变化的影响[J]. 食品科学,2014,35(11):174-178.
[16] 李 明,马悦欣,刘志明,等. 刺参机体酵母菌组成及其拮抗活性的研究[J]. 大连海洋大学学报,2012,27(5):436-438.
[17] Kumura H, Tanoue Y, Tsukahara M, et al. Screening of dairy yeast strains for probiotic applications[J]. Journal of Dairy Science, 2004,87(12):4050-4056.
[18] 王素英,王翠英,王 敏. 耐胆酸盐、降胆固醇乳酸菌的筛选[J].中国乳品工业,2004,32(2):14-16.
[19] 杨桂梅,张永红,苏 娜,等. 2株猪源益生性肠球菌对酸和胆盐及热的耐受性研究[J].北京农学院学报,2008,23(4):29-32.
(责任编辑:夏亚男)
中图分类号:R117
文献标识码:A
文章编号:1006-060X(2016)06-0006-03
DOI:10.16498/j.cnki.hnnykx.2016.06.003
收稿日期:2016-03-29
基金项目:国家自然科学基金(81573951);长沙市科技局项目(K1508025-21)
作者简介:肖新云(1990-),男,江西吉安县人,硕士研究生,主要从事中医药微生态学研究。
通讯作者:邓艳玲
Tolerance Experiment of Debaryomyces hansenii in the Environment of Gastric Acid or Intestinal Bile Salts
XIAO Xin-yun,LIU You-jia,DENG Yan-Lin,TAN Zhou-jin
(Hunan University of Chinese Medicine, Changsha 410208, PRC)
Abstract:To investigate the survival condition of Debaryomyces hansenii in the environment of acid, bile salt and artificial gastric intestinal juice, and provide the basis for development of new type of probiotics, using the method of surviving bacteria count, the number of Debaryomyces hansenii was detected under the condition of PDA liquid medium with pH value of 1.0, 1.5, 2.0 and 2.5, bile salt concentration of 0.2%, 0.3% and 0.4%, respectively, and also dealed with by the artifcial gastric juice of 0, 2, 4 h, artifcial intestinal juice of 0, 2, 4, 6, 8, 10 h. The results showed that in the acid test, the strain in pH 1.0 didn't survive, and the counts in pH 1.5, 2.0, 2.5 decreased signifcantly compared with control group (P< 0.01); in the bile salts resistance test, the strain under the high bile salt concentration of 0.4% stilled alive, viable count decreased with increasing salt concentration; in the artifcial gastric juice experiment, the living bacterium number of 2, 4 h increased compared with 0 h (P< 0.01); In the artifcial intestinal juice experiment, the strain increased at frst and lowered later but all the variable counts were more than 0 h. Therefore, Debaryomyces hansenii could tolerate high acidity and high bile salts environment, and high survivability in the artifcial gastric intestinal juice environment. It should be suitble for prodution of new type of probiotics.
Key words:Debaryomyces hansenii; acid-resisting; cholate tolerance; artifcial gastric juice; artifcial intestinal juice

