水杨酸、茉莉酸甲酯及超声波对北沙参愈伤组织生长及产香豆素的影响
苗晓燕,朱维红,张筱梅*,王 琳
(保定学院生化系,河北 保定 071000)
水杨酸、茉莉酸甲酯及超声波对北沙参愈伤组织生长及产香豆素的影响
苗晓燕,朱维红,张筱梅*,王 琳
(保定学院生化系,河北 保定 071000)
研究水杨酸(salicylic acid,SA)、茉莉酸甲酯(methyl jasmonate,MeJA)和超声波对北沙参愈伤组织生长的影响,并利用高效液相色谱法测定了经诱导处理后愈伤组织中香豆素(欧前胡素、异欧前胡素及补骨脂素为主要指标)含量的变化。结果表明:SA和MeJA均对北沙参愈伤组织的生长具有抑制作用,而一定时间的低强度超声波处理则能够促进北沙参愈伤组织生物量的增长;同时,结果表明此3 种诱导因子均能够不同程度地促进香豆素合成,即当SA质量浓度达到8 mg/L时,欧前胡素的含量达到最大值,为对照的3.8 倍;SA质量浓度为16 mg/L时,补骨脂素含量达最大值,为对照的1.70 倍;当SA质量浓度在28~30 mg/L之间时,异欧前胡素的含量达到最大值,此范围内总香豆素含量也达最大值,约为对照的2.33 倍;当MeJA浓度达400 µmol/L时,补骨脂素和异欧前胡素含量达到最大值,分别为对照的6.09 倍和5.53 倍,总香豆素含量也达最大值14.86 µg/g,为对照的5.11 倍;当超声波处理30 min时,愈伤组织中欧前胡素和异欧前胡素的含量达最大值5.51 µg/g和3.69 µg/g,分别为对照的5.15 倍和4.20 倍;总香豆素含量也达最大值11.90 µg/g,为对照的3.55 倍;而补骨脂素含量则在超声处理10 min后达到最大值3.60 µg/g,为对照的1.50 倍。综上,比较3 种诱导子对北沙参愈伤组织诱导处理后香豆素含量的变化发现,与SA和超声波相比,MeJA更能够有效地促进北沙参中次生代谢产物——香豆素的合成。
北沙参;香豆素;茉莉酸甲酯;水杨酸;超声波
北沙参为伞形科植物珊瑚菜(Glehniabo littoralis F.Schmidt ex Miq)的干燥根,别名莱阳沙参、莱阳参、辽沙参[1]。山东、河北、内蒙古、辽宁为其主产区。北沙参属养阴药,有养阴清肺、益胃生津之功效。目前临床上主要用于治疗肺热燥咳,热病伤津、劳嗽痰血等病症。经实验研究表明具有这一药理学活性的次生代谢产物的成分主要为香豆素类物质[2],该香豆素类物质具有止咳化痰[3]、抗突变[4]、抗菌[5]、抗肿瘤[6]和镇痛镇静[7]等作用。
野生北沙参是我国濒危植物之一,1999年被列为国家Ⅱ级重点保护野生植物[8]。目前市场上销售的均为人工栽培的北沙参,但由于近年来该药材生产只种不选,自留自用,种子种苗提纯和复壮工作均滞后,导致北沙参的品种退化,质量下降和疗效降低[9]。北沙参中的香豆素是一类由苯环与3 个直链碳连在一起为单元(C6~C3)构成的化合物,属于苯丙素类。从生物合成途径来看,由莽草酸通过苯丙氨酸和酪氨酸等芳香氨基酸,经脱氨、羟基化、耦合等反应步骤形成最终产物[10]。因此,通过调节代谢途径提高北沙参中香豆素的含量,并获得优质高产的北沙参种苗具有重要的理论和实际意义。
在植物次生代谢过程中,诱导子如水杨酸(salicylic acid,SA)、茉莉酸甲酯(methyl jasmonate,MeJA)、超声波等能作为一种特定的生化信号,快速、转移和选择性地诱导特定基因的表达,从而调节植物细胞次生代谢产物的合成[11-13],目前已在多种药用植物如丹参[14]、甘草[15]、紫草[16]、三七[17]等诱导中均能够提高相应次生代谢产物的量。而关于北沙参方面的报道尚未见到。因此本研究中,主要通过添加SA、MeJA及超声波处理3 种途径,对北沙参愈伤组织进行诱导,以探讨对其愈伤组织生长及香豆素合成代谢的影响,旨在为北沙参的优质种苗繁育以及次生代谢产物香豆素的大规模生产提供一定的理论和实验依据。
1 材料与方法
1.1 材料
北沙参愈伤组织[18]保定学院生化系细胞实验室诱导。
1.2 试剂与仪器
甲醇(色谱纯)、萘乙酸(1-naphthaleneacetic acid,NAA)、6-苄氨基嘌呤(6-benzylaminopurine,6-BA) 天津市大茂化学试剂厂;欧前胡素、异欧前胡素、补骨脂素标准品、SA、MeJA 中国药品生物制品检定所。
B3200S-T超声清洗器 必能信超声(上海)有限公司;LC-20AT高效液相色谱仪 日本岛津公司。
1.3 方法
1.3.1 SA诱导处理北沙参愈伤组织
取一定量的北沙参愈伤组织,接种至添加质量浓度为0、4、8、12、16、20、24、28、32 mg/L SA的培养基中(培养基配方:1/2 MS培养基+1.2 mg/L NAA+0.2 mg/L 6-BA+7 g/L琼脂+20 g/L蔗糖),25 ℃暗培养35 d,每个质量浓度设3 个重复。
1.3.2 MeJA诱导处理北沙参愈伤组织
取一定量的北沙参愈伤组织,接种至分别添加浓度为0、100、200、400、600、800、1 000 µmol/L MeJA的培养基中(培养基配方同上),25 ℃暗培养35 d,每个浓度设3 个重复。
1.3.3 超声波诱导处理北沙参愈伤组织
取一定量的北沙参愈伤组织,接入装有适量无菌水的三角瓶中,放入超声波清洗器中超声处理,处理时间分别为0、10、20、30、40、50 min,然后再接入上述培养基中,25 ℃暗培养35 d,每个时间设3 个重复。
1.3.4 愈伤组织生长量的测定
以愈伤组织培养35 d的鲜质量和干质量表示培养过程中的愈伤组织生长量。实验设3 次重复。从培养容器中取出北沙参愈伤组织,洗净后置于50 ℃烘箱中烘干至恒质量,称量得干质量。
愈伤组织生长量/g=收获量/g-接种量/g
1.3.5 高效液相色谱法(high performance liquid chromatography,HPLC)测定愈伤组织中香豆素含量
1.3.5.1 色谱条件
色谱柱:Promosil-C18柱(150 mm×4.6 mm,5 μm);柱温:30 ℃;流动相为甲醇-水(68∶32,V/V),梯度洗脱;流速:1.0 mL/min;检测波长:250 nm;进样量20 μL。
1.3.5.2 绘制标准曲线
分别精密称取干燥至恒质量的标准品补骨酯素、欧前胡素、异欧前胡素,置棕色量瓶中加甲醇超声波溶解后,制成补骨酯素0.117 mg/mL、欧前胡素0.13 mg/mL和异欧前胡素0.11 mg/mL的混合溶液,用0.45 μm滤膜过滤。将标准品混合溶液(按0.1 mg/mL计算)依次稀释,分别选择0.1、0.05、0.025、0.005、0.002 5、0.000 1 mg/mL这6 个质量浓度进样,每次精密吸取20 μL注入高效液相色谱仪,在上述色谱条件下检测峰面积。以峰面积(mV·min)为纵坐标,以进样质量浓度(mg/mL)为横坐标进行线性回归,绘制标准曲线,求得回归方程如下:补骨脂素:y = 206 317 040x+34 718(R2= 0.999 3),欧前胡素:y = 163 010 226x+10 382(R2= 0.999 6),异欧前胡素:y = 82 088 237 x+20 068(R2= 0.999 5)。
1.3.5.3 香豆素含量测定
准确称取1 g经不同处理干燥后并研磨成粉末的北沙参愈伤组织,置具塞离心管中,加12 mL乙醚,超声波处理30 min,4 000 r/min离心30 min,提取2 次,收集上清液,风干。用色谱甲醇超声20 s,溶解后定容至1 mL,12 000 r/min、4 ℃离心15 min,取上清液用0.45 μm滤膜过滤后进样分析。
2 结果与分析
2.1 香豆素色谱图

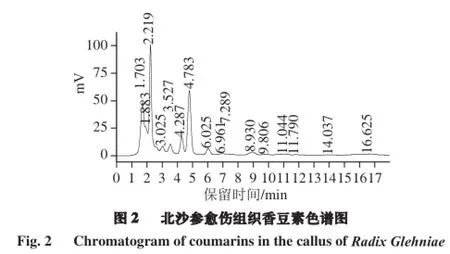
北沙参香豆素(以欧前胡素、异欧前胡素、补骨脂素为主要指标)标准品及愈伤组织香豆素HPLC色谱图如图1、2所示,图1中1~3依次为补骨脂素、欧前胡素、异欧前胡素的特征峰,该3 个特征峰分别在4.5、8.6 min及14.5 min左右出现。
2.2 SA对北沙参愈伤组织生长和香豆素含量的影响
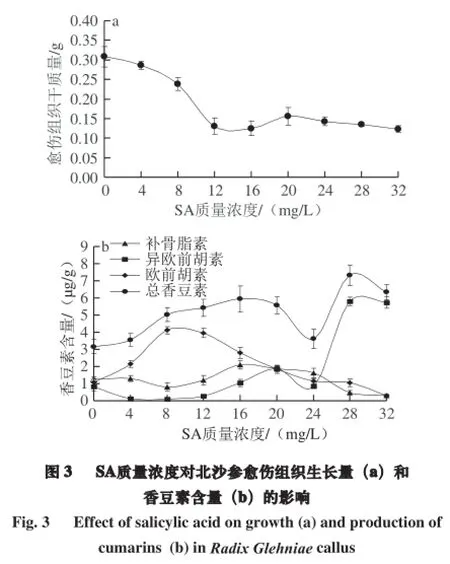
由图3a可知,随SA质量浓度增加,北沙参愈伤组织的干质量总体呈现逐渐下降的趋势。当SA质量浓度在0~8 mg/L之间时,愈伤组织生长量下降缓慢,当质量浓度达8~12 mg/L时,愈伤组织增长量急剧下降,之后趋于平缓。说明SA对北沙参愈伤组织生物量的增长具有一定的抑制作用,且随SA质量浓度的增加,这种抑制作用在逐渐增强,这与SA对红豆杉细胞的生长具有抑制作用相一致[19],说明一定质量浓度的SA对活细胞具有毒性,且毒性随质量浓度增加逐渐增强。
HPLC结果分析(图3b)表明:适宜质量浓度的SA对北沙参愈伤组织中欧前胡素、异欧前胡素和补骨脂素的合成均具有一定的促进作用,且随质量浓度升高呈现先升高后下降的趋势。当SA质量浓度达到8 mg/L时,欧前胡素的含量达到最大值4.11 µg/g,为对照的3.8 倍;SA质量浓度在28~30 mg/L之间时,异欧前胡素的含量达到最大值;而SA对补骨脂素的影响较小,即在质量浓度为16 mg/L时达最大值2.10 µg/g,为对照的1.70 倍;在SA质量浓度为28~30 mg/L之间时,总香豆素含量达到最大值,约为对照的2.33 倍。这一结果与前人的研究结果[20-22]相一致,即SA作为诱导子可诱导多种植物次生代谢物合成积累量的增加。分析原因可能是,香豆素次生代谢基础途径为苯丙烷代谢途径,一定质量浓度SA可以通过改变苯丙烷代谢途径中的关键酶活性,从而提高次生代谢产物的合成积累量[22-23]。
2.3 MeJA对北沙参愈伤组织生长和香豆素含量的影响
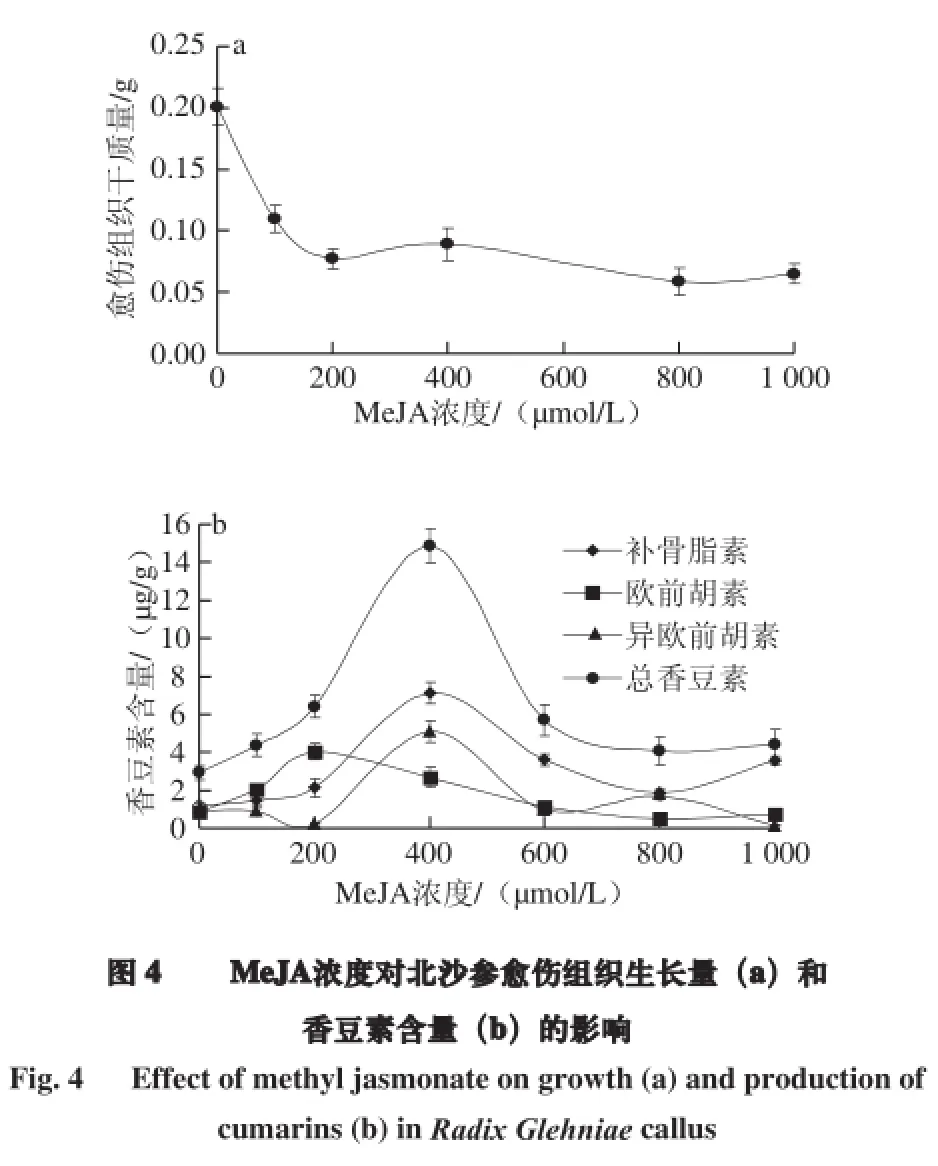
由图4a可知,随MeJA浓度升高,北沙参愈伤组织的干质量呈现逐渐下降的趋势,且褐化情况逐渐加重,说明MeJA对愈伤组织的生长有明显的抑制作用。HPLC测定结果(图4b)表明,3 种香豆素含量均随MeJA浓度的提高呈现先上升后下降的趋势,但与愈伤组织的生长并无明显的相关性。其中补骨脂素和异欧前胡素均在MeJA浓度达400 µmol/L时,含量达到最大值7.13 µg/g和5.07 µg/g,分别为对照的6.09 倍和5.53 倍;而欧前胡素则在MeJA浓度达200 µmol/L时,含量达到最大值4.03 µg/g,为对照的4.87 倍;总香豆素的含量则与补骨脂素和欧前胡素合成趋势一致,即在MeJA浓度达400 µmol/L时含量达到最大值14.86 µg/g,是对照的5.11 倍。说明MeJA既有抑制北沙参愈伤组织生长的作用,同时又具有诱导香豆素合成的作用,但浓度过高则又会抑制香豆素的合成,适宜的诱导浓度为400 µmol/L。这与罗建平等[24]进行的茉莉酸甲酯诱导怀槐悬浮细胞合成异黄酮的结论是一致的。原因可能是MeJA作为小分子物质调节植物次生代谢过程中相关基因的表达,诱导香豆素的合成[25]。
2.4 超声波时间对北沙参愈伤组织生长和香豆素含量的影响
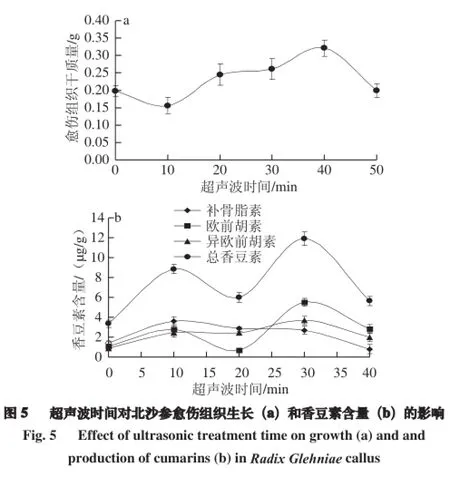
由图5a可知,随超声波处理时间延长,愈伤组织的干质量呈现先升高再下降的趋势,即经10~40 min时间内超声波处理,愈伤组织生长较快,35 d后收获,经40 min处理的愈伤组织增长量最大为0.32 g,为未经处理愈伤组织干质量的1.62 倍,且生长体积较大,结构疏松,颜色较浅。
HPLC测定结果(图5b)表明,超声波对欧前胡素和异欧前胡素均有一定的促进作用,即当超声波时间为30 min时,愈伤组织中欧前胡素和异欧前胡素的含量达最大值5.51 µg/g和3.69 µg/g,分别为对照的5.15 倍和4.20 倍。而补骨脂素则在超声波处理10 min时达到最大值3.60 µg/g,为对照的1.50 倍,之后趋于下降;总香豆素含量达11.90 µg/g,为对照的3.55 倍,此变化则与欧前胡素和异欧前胡素含量变化一致。说明一定时间低强度的超声波处理,能够促进北沙参愈伤组织生长和香豆素的合成,这可能是由于低强度的超声波处理使细胞膜和细胞器的形态发生变化,从而导致细胞代谢和膜通透性的改变[26-27],促进了愈伤组织的生长;而且超声波的机械刺激强化了生物转化过程中的传质和混合,提高了酶活性,使细胞内代谢反应更加旺盛,从而提高了代谢产物的合成量[28]。
3 结 论
利用植物愈伤组织或细胞悬浮培养可以生产用于预防和治疗疾病的植物次生代谢产物。近年来,这一领域的发展极为迅速,已经研究了400多种植物,从培养细胞中分离到600多种次级代谢产物[29],通过添加外源诱导子改变植物次生代谢途径,是植物提高次生代谢产物的有效方法之一。本实验研究中考察了SA、MeJA及超声波3 种诱导因子子对北沙参愈伤组织生长及香豆素合成的影响。结果表明,SA和MeJA对北沙参愈伤组织的生长均具有一定的抑制作用;而低强度的超声波则对北沙参愈伤组织的生长具有较明显的促进作用,且随超声波时间的延长呈现生长快速的特点,但时间过长也会抑制其生长量的增加。HPLC测定香豆素含量结果表明,SA、MeJA和超声波对香豆素均有一定的促进作用,当SA质量浓度在28~30 mg/L之间时,总香豆素含量达到最大值,约为对照的2.33 倍;当MeJA浓度达400 µmol/L时,总香豆素含量达到最大值14.86 µg/g,是对照的5.11 倍;当超声波处理30 min时,愈伤组织中欧前胡素和异欧前胡素的含量达最大值5.51 µg/g和3.69 µg/g,分别为处理前的5.15 倍和4.20 倍;而补骨脂素则在10 min超声处理后达到最大值3.60 µg/g,为对照的1.50 倍,总香豆素含量达11.9 µg/g,为对照的3.55 倍。综上,通过比较3 种诱导子对北沙参愈伤组织诱导处理后香豆素含量的变化发现,与SA和超声波相比,MeJA更能够有效地促进北沙参中次生代谢产物——香豆素的合成。而关于诱导子调控北沙参中香豆素合成的机理,以及如何更有效地协同利用诱导子促进北沙参中香豆素含量的提高,是后续实验中需要进一步解决的问题。
[1] 余椿生. 北沙参[J]. 食品与药品, 2005, 7(4): 43-44.
[2] 国家中医药管理局《中华本草》编辑委员会. 中华本草[M]. 上海:上海科学技术出版社, 1996: 955.
[3] 龚晓健, 李萍. 沙参提取物镇咳祛痰及免疫增强作用研究[J].中国现代应用药学, 2000, 17(4): 258-260. DOI:10.3969/ j.issn.1007-7693.2000.04.002.
[4] 王中民, 张永祥, 史美育, 等. 北沙参抗突变试验研究[J]. 上海中医药杂志, 1993(5): 47-48.
[5] MATSUURA H, SAXENA G, FARMER S W, et al. Antibacterial and antifungal polyine compounds from Glehnia littoralis ssp. leiocarpa[J]. Planta Medica, 1996, 62(3): 256-259.
[6] OKUYAMA T, TAKATA M, NISHINO H, et al. Studies on the antitumor-promoting activity of naturally occurring substances.II. Inhibition of tumor-promoter-enhanced phospholipid metabolism by umbelliferous materials[J]. Chemical and Pharmaceutical Bulletin,1990, 38(4): 1084-1086.
[7] OKUYAMA E, HASEGAWA Z, MATSUSHITA Z, et al. Analgesic components of glehnia root (Glehnia littoralis)[J]. Nature Medicine,1998, 52(6): 491-501.
[8] 李颖, 张钦德, 李庆德. 北沙参外植体消毒方法研究[J]. 安徽农业科学,2010, 38(5): 2336-2338. DOI:10.3969/j.issn.0517-6611.2010.05.049.
[9] 徐祝封, 张钦德, 李庆典, 等. 北沙参道地产区种子生产、种苗培育现状调查与分析[J]. 山东中医药大学学报, 2006, 30(6): 493-496. DOI:10.3969/j.issn.1007-659X.2006.06.026.
[10] 张新乐. 香豆素衍生物的合成及其生物活性研究[D]. 郑州: 郑州大学, 2012.
[11] 晏琼, 胡宗定, 吴建勇. 生物和非生物诱导子对丹参毛状根培养生产丹参酮的影响[J]. 中草药, 2006, 37(2): 262-265. DOI:10.3321/ j.issn:0253-2670.2006.02.039.
[12] VERPOORTE R, HEIJDEN R V D, HOGE J H C, et al. Plant cell biotechnology for the production of secondary metabolites[J]. Cheminform, 2010, 26(8): 2307-2310.
[13] ZHAO Jian, ZHU Weihua, QIU Hu. Selection of fungal elicitors to increase indole alkaloid accumulation in catharanthus roseus suspension cell culture[J]. Enzyme & Microbial Technology, 2001,28(7): 666-672.
[14] 焦蒙丽, 曹蓉蓉, 陈红艳, 等. 水杨酸对丹参培养细胞中迷迭香酸生物合成及其相关酶的影响[J]. 生物工程学报, 2012, 28(3): 320-328.
[15] 杨英, 郑辉, 李赟, 等. 茉莉酸甲酯与二氢茉莉酮酸甲酯对悬浮培养的甘草细胞生长和黄酮积累的影响[J]. 植物生理学报, 2008, 44(5):903-906.
[16] 葛锋, 陈朝银, 王晓东, 等. 超声波对新疆紫草悬浮培养细胞生长和紫草素合成的影响[J]. 过程工程学报, 2008, 8(1): 115-119.
[17] 朱宏涛, 李江, 李元, 等. 茉莉酸甲酯对三七组培苗中总皂苷含量的影响[J]. 西部林业科学, 2014(2): 72-78. DOI:10.3969/ j.issn.1672-8246.2014.02.012.
[18] 苗晓燕, 何富强, 张筱梅. 北沙参愈伤组织诱导及悬浮细胞培养研究[J]. 北方园艺, 2014(6): 104-106.
[19] 苗志奇, 未作君, 元英进. 水杨酸在紫杉醇生物合成中诱导作用的研究[J]. 生物工程学报, 2000, 16(4): 509-512. DOI:10.3321/ j.issn:1000-3061.2000.04.021.
[20] ZHAO Jian, DAVIS L C, VERPOORTE R. Elicitor signal transduction leading to production of plant secondary metabolites[J]. Biotechnology Advances, 2005, 23(4): 283-333.
[21] DONG Juane, WAN Guowei, LIANG Zongsuo. Accumulation of salicylic acid-induced phenolic compounds and raised activities of secondary metabolic and antioxidative enzymes in Salvia miltiorrhiza cell culture[J]. Journal of Biotechnology, 2010, 148: 99-104.
[22] CHEN Jianye, WEN Pengfei, KONG Weifu, et al. Effect of salicylic acid on phenylpropanoids and phenylalanine ammonia-lyase in harvested grape berries[J]. Postharvest Biology & Technology, 2006,40(1): 64-72.
[23] 董娟娥, 张康健, 梁宗锁. 植物次生代谢与调控[M]. 西安: 西北农林科技大学出版社, 2009: 155-157.
[24] 罗建平, 夏宁, 沈国栋. 茉莉酸甲酯、水杨酸和一氧化氮诱导怀槐悬浮细胞合成异黄酮及细胞结构变化[J]. 分子细胞生物学报, 2009,36(5): 438-441.
[25] 余龙江, 朱敏. 茉莉酸甲酯对中国红豆杉胚性细胞紫杉醇生物合成的影响[J]. 植物科学学报, 1999, 17(4): 371-374. DOI:10.3969/ j.issn.2095-0837.1999.04.015.
[26] MILLER M W, MILLER D L, BRAYMAN A A. A review of in vitro bio-effects of inertial ultrasonic cavitation from a mechanistic perspective[J]. Ultrasound in Medicine & Biology, 1996, 22(9):1131-1154.
[27] SINISTENA J V. Application of ultrasound to biotechnology: an overview[J]. Ultrasonics, 1992, 30(3): 180-185.
[28] 张姝, 余斐, 王传贵, 等. 超声波对红豆杉悬浮细胞生长及紫杉醇释放的研究[J]. 生物技术, 2001, 11(2): 14-17. DOI:10.3969/j.issn.1004-311X.2001.02.006.
[29] 于寒松, 于亚桐, 贾帅, 等. 利用悬浮细胞培养方法提高荞麦中总黄酮含量的研究[J]. 食品科学, 2009, 30(22): 37-39. DOI:10.3321/ j.issn:1002-6630.2009.22.004.
Effects of Salicylic Acid, Methyl Jasmonate and Ultrasound on the Production of Cumarins and Growth of Radix Glehniae Callus
MIAO Xiaoyan, ZHU Weihong, ZHANG Xiaomei*, WANG Lin
(Department of Biochemistry, Baoding University, Baoding 071000, China)
The effects of methyl jasmonate (MeJA), salicylic acid (SA) and ultrasonic treatment on the production of cumarins (imperatorin, isoimperatorin and psoraleae as measured by HPLC) and growth of callus tissue of Radix Glehniae were explored. The results showed that SA and MeJA could cause growth inhibition in callus tissue, while low-intensity ultrasound treatment for a certain time had a positive effect on callus vitality. Additionally, the production of cumarin could be promoted to different extents by all three factors. When the concentration of salicylic acid was 8 mg/L, the content of imperatorin reached its maximum level, which was 3.8 times higher than the control, but SA had only a marginal impact on psoralen. When the concentration of salicylic acid increased to 16 mg/L, the production of psoralen reached its maximum level, which was 1.7 times higher than the control. When the concentration of salicylic acid further rose to 28-30 mg/L,the maximum content of isoimperatorin and total cumarins was achieved showing a 2.33-fold increase compared with the control. The MeJA concentration of 400 µmol/L resulted in maximum production of psoralen and isoimperatorin, which was increased by 6.09 and 5.53 times in comparison with the control, respectively; meanwhile the maximum content of total cumarins was observed, which was 5.11 times higher than that of the control. After ultrasound treatment for 30 min,the production of imperatorin, isoimperatorin and total cumarins reached their maximum levels (5.51, 3.69 and 11.90 µg/g),which were 5.15, 4.20 and 3.55 times higher than those of the control, respectively; when ultrasonic treatment lasted 10 min,the maximum production of psoralen was found, which was 1.5 times higher than that of the control. In summary, compared with ultrasonic treatment and SA, MeJA could more effectively promote the production of coumarins in Radix Glehniae.
Radix Glehniae; cumarin; methyl jasmonate; salicylic acid; ultrasound
10.7506/spkx1002-6630-201609034
Q945.1
A
1002-6630(2016)09-0181-05
苗晓燕, 朱维红, 张筱梅, 等. 水杨酸、茉莉酸甲酯及超声波对北沙参愈伤组织生长及产香豆素的影响[J]. 食品科学,2016, 37(9): 181-185. DOI:10.7506/spkx1002-6630-201609034. http://www.spkx.net.cn
MIAO Xiaoyan, ZHU Weihong, ZHANG Xiaomei, et al. Effects of salicylic acid, methyl jasmonate and ultrasound on the production of cumarins and growth of Radix Glehniae callus[J]. Food Science, 2016, 37(9): 181-185. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201609034. http://www.spkx.net.cn
2015-06-22
保定学院重点基金资助项目(2010z03);河北省教育厅高等学校科学研究项目(Z2012007)
苗晓燕(1980—),女,副教授,硕士,研究方向为生物学。E-mail:miaoxiaoyan3205@126.com
*通信作者:张筱梅(1957—),女,教授,本科,研究方向为生物学。E-mail:zhxm06@163.com

