基于脂质代谢网络的虎杖抗呼吸道合胞病毒肺炎代谢组学研究
谢 彤 杜丽娜 徐建亚 沈存思 汪受传 单进军
(南京中医药大学中医儿科学研究所,江苏省儿童呼吸疾病(中医药)重点实验室,南京,210023)
基于脂质代谢网络的虎杖抗呼吸道合胞病毒肺炎代谢组学研究
谢彤杜丽娜徐建亚沈存思汪受传单进军
(南京中医药大学中医儿科学研究所,江苏省儿童呼吸疾病(中医药)重点实验室,南京,210023)
目的:探讨虎杖用于干预呼吸道合胞病毒(Respiratory Syncytial Virus,RSV)诱导BALB/c小鼠肺炎的脂质代谢网络的变化。方法:选取18只BALB/c小鼠,随机分为空白组、RSV肺炎组、虎杖组3组,RSV肺炎组、虎杖组滴鼻给予RSV病毒诱导产生肺炎,虎杖组灌胃给予虎杖提取物给予治疗,空白对照组灌胃给予生理盐水作为对照。实验结束,取血浆测定其血浆中的脂质代谢物质。建立基于高效液相-线性离子阱-静电场轨道杂交质谱(HPLC-LTQ-Orbitrap-MS)的脂质代谢组学技术,表征3组小鼠血浆中脂质代谢轮廓的变化,通过单因素方差分析筛选差异性化合物(P<0.0.5),并对其差异化合物进行结构确定,阐明其可能调节的脂质代谢网络。结果:多变量数据统计结果显示,3组小鼠的血浆脂质代谢轮廓区分明显,受调控的脂质分子主要为磷脂酰胆碱、三酰甘油成分和磷酸化神经酰胺。代谢通路分析结果显示,虎杖主要调节了磷脂代谢。结论:虎杖提取物通过调节磷脂代谢发挥抗RSV肺炎的作用。
脂质代谢组学;虎杖;呼吸道合胞病毒肺炎;液质联用
呼吸道合胞病毒(Respiratory Syncytial Virus,RSV)感染是小儿常见下呼吸道感染性疾病。研究数据表明,2005年世界范围内感染RSV的儿童超过3.38千万例,其中至少有6.6万~19.9万患儿死亡[1]。目前,对于RSV肺炎的治疗尚无理想安全的药物。中医药治疗小儿肺炎,疗效明显,无不良反应。
虎杖为蓼科植物虎杖(PolygonumCuspidatumSieb.et Zucc.)的干燥根茎和根,具有清热解毒、利湿活血、止咳化痰的功效。临床上通常作为配伍药物用于治疗小儿呼吸道感染性疾病。如南京中医药大学汪受传教授的清肺口服液,在麻黄杏仁甘草石膏汤的基础上加减药味,配伍虎杖,用于治疗小儿肺炎,疗效显著[2]。虎杖中的主要成分白藜芦醇、虎杖苷,属于非黄酮类多酚类化合物,现代药理学实验结果表明非黄酮类多酚化合物发挥抗氧化、免疫调节、抗喘等生物活性[3]。
脂质代谢组学是目前新兴的组学技术手段,许多疾病的发生发展与脂质代谢有着密不可分的联系。神经系统疾病如阿尔兹海默症患者体内缩醛磷脂(Plasmalogens)的代谢存在异常[4],肝脏代谢性疾病如对乙酰氨基酚诱导产生的肝毒性伴随着明显的肉毒碱水平异常[5]。近年来的研究也发现,呼吸系统疾病与脂质代谢存在密切联系[6]。由于与中医药具有相似的整体性,近年来代谢组学在中医药研究中越来越受到重视[7]。为了阐明虎杖对RSV感染的干预作用,我们通过建立脂质代谢组学分析测定方法,从脂质网络代谢角度阐明虎杖可能干预的机制。
1 材料
1.1仪器与试剂非靶标脂质成分的检测采用线性离子阱-高分辨静电场轨道杂交质谱(LTQ-Orbtraip XL,Thermo fisher,America),高效液相色谱仪(U3000,DIONEX,America),数据采集通过Thermo Xcalibur 2.2 SP1.48软件(Thermo fisher,America);高速冷冻离心机(Beckman,America);SpeedVac离心浓缩仪(Thermo fisher)。配制流动相和样品处理所用甲醇、乙腈均为质谱级(99.8%,Merck,Germany),脂质提取所用甲基叔丁基醚(Methyl tert-butyl ether,MTBE,ROE,America)、异丙醇为质谱级(99.8%,ROE,America),水为自制去离子水(Millipore,America)。
1.2动物、细胞和病毒清洁级BALB/c小鼠购自上海斯莱克实验动物有限责任公司,18只,雌性,体重16~18 g,许可证号为:SCXK(沪)2012-0002。人喉癌上皮细胞(Hep-2细胞)由中国科学院上海生命科学研究院细胞资源中心提供。呼吸道合胞病毒A亚型Log株由武汉国家典型培养物保藏中心提供。
2 方法
2.1药物的制备虎杖购自安徽亳州中药饮片厂,批号为111208。经南京中医药大学药学院刘圣金博士鉴定,符合2015年版《中华人民共和国药典》一部中相关规定。虎杖临床给药剂量为0.25 g/kg,按照体表面积换算为小鼠的给药剂量为2.25 g/kg,BALB/c小鼠的灌胃剂量为0.1 mL/10 g,因此虎杖的浓度为0.225 g/mL。
虎杖提取物采用水提醇沉的提取方法。虎杖40 g,400 mL蒸馏水煎煮2次,合并两次药液,减压浓缩至400 mL,放冷至40 ℃以下,缓慢加入乙醇使得含醇量达到70%,静置,滤过,减压回收乙醇至无醇味,定容至178 mL,即药材的生药量为0.225 g/mL。
2.2病毒扩增及动物实验病毒扩增参考文献[8]。18只BALB/c小鼠随机分成3组,正常组、RSV感染组、虎杖组,每组6只,适应环境7d后开始正式实验。RSV感染组和虎杖组滴鼻感染RSV病毒液100 TCID5050 μL/只,正常组滴鼻给予50 μL/只无血清DMEM高糖培养基。连续滴鼻3d,1次/d。虎杖组首次滴鼻感染2 h后灌胃给予虎杖提取液,连续6 d,1次/d。正常组合模型组每天等量给予生理盐水。实验结束后取血,用于脂质代谢组学研究,肺组织用于病理切片实验。
2.3脂质提取20 μL血浆加入225 μL预冷甲醇(含内标蛇床子素1.125 μg)沉淀蛋白,涡旋20 s,后用1 mL预冷的MTBE提取,涡旋20 s,后加入125 μL水使其分层,4 ℃ 12 500 r/min离心5 min,取上层富含脂溶性的脂质成分400 μL,于SpeedVac蒸空浓缩仪中挥干。挥干后的残余样品用甲醇/甲苯溶剂(v/v,9∶1)60 μL复溶,涡旋5 min,4 ℃ 20 000 r/min高速离心5 min后,取上清进样。
2.4色谱分离条件和质谱检测条件色谱分离条件:血浆中脂质成分的分离采用色谱柱Kinetex C18(2.1 mm×100 mm,2.6 μm),柱温设定为55 ℃。流动相为A为水/异丙醇(v/v,80/20)含5 mM甲酸铵和0.1%甲酸;流动相B为异丙醇/乙腈(v/v,90/10)含5 mM甲酸铵和0.1%甲酸。流速:0.3 mL/min;采用梯度洗脱分离血浆中的脂质分子:0—1 min,30% B;2—7 min,30%~80% B;7—23 min,80%~90% B;23—24 min,90% B;24—30 min,90%~10% B。
质谱检测参数:采用电喷雾电离离子源(Electrospray Ionization,ESI)对化合物进行雾化,喷雾电压:3.5kV;离子源温度:350 ℃;毛细管温度:350 ℃;鞘气流速:275 kPa;辅助气流速:104 kPa。脂质分子通过正离子模式检测。高分辨质谱的质量轴在使用前通过标准混合物调谐以使仪器达到正常状态。脂质代谢组学半定量数据的获取采用全扫描的扫描模式,扫描范围:m/z200~1 000,分辨率设定为30 000。脂质成分的定性分析采用高分辨的精确质量数,结合MSn碎裂分析。MSn质谱的触发方式为动态数据依赖分析模式(Data-dependent acquisition mode),选取上一级最高峰进行碰撞诱导碎裂解离(Collision Induced Dissociation,CID)碎片扫描,碰撞能量设定为30%。
2.5数据处理得到的原始数据采用Xcalibur 2.2软件进行峰对齐,通过内标归一化进行半定量,得到的数据矩阵导入SIMCA-P 13.0软件(Umetrics,Sweden)进行多变量统计分析。通过偏最小二乘-判别分析(Orthogonal Partial Least Squares-Discriminant Analysis,OPLS-DA)对空白组、RSV肺炎组和虎杖组进行模式识别和区分。通过SPSS 13.0进行单因素方差分析(One ANOVAs Analysis)确定差异性代谢物,得到的差异性代谢物通过高分辨的m/z值搜索数据库METLIN metabolite database(https://metlin.scripps.edu/index.php),确定其可能的归属,并通过碎裂途径确定差异代谢物的可能结构。最后查找KEGG数据库,分析虎杖干预RSV肺炎的脂质代谢通路,阐明其可能干预的机制。
3 结果
3.1肺组织病理检查肺组织样品进行苏木精-伊红染色,观察病理切片,结果显示,正常组小鼠肺组织内肺泡、肺内支气管分支及间质组成结构清晰;RSV肺炎模型组BALB/c小鼠表现出肺泡壁轻度气肿,并伴随充血,肺气肿表现为局部肺泡腔增大,肺泡壁变薄,毛细血管数量减少;虎杖组肺组织结构正常,结构清晰,同正常组相似,肺泡壁存在轻度气肿,伴随轻度充血。病理结果显示,RSV滴鼻诱导肺炎模型成功,而虎杖提取液能够该善RSV诱导的肺炎症状。

表1 小鼠RSV肺炎病理评分表(Mean±SD)
3.2脂质代谢组学方法的建立为了能够全面地测定血浆中的脂质成分,本实验优化了血浆样品的提取方法和色谱分离条件以及质谱检测条件,建立的脂质代谢组学分析方法,该方法能够检测到血浆中游离脂肪酸(Free Fatty Acids,FFAs)、磷脂酰胆碱(glycerophosphocholines,PCs)、磷脂酰乙醇胺(glycerophosphoethanolamines,PEs)、三酰甘油(triradylglycerols,TGs)、甘油二酯(diradylglycerols,DGs)、神经酰胺(ceramides,Cers)等脂质分子。图1为所建立的脂质代谢组学得总离子流图,通过图1可以发现游离脂肪酸主要集中在0~5 min内洗脱,溶血性磷脂酰胆碱(Lyso PCs)和溶血性磷脂酰乙醇胺(Lyso PEs)集中早5~13 min,磷脂酰胆碱和磷脂酰乙醇胺主要集中在13~20 min的时间内洗脱,而三酰甘油和甘油二酯主要集中在20~25 min的时间内洗脱。建立的脂质代谢方法能够较为全面的反映血浆中的主要脂质类成分,能够满足虎杖抗RSV肺炎脂质代谢网络调控的相关研究。
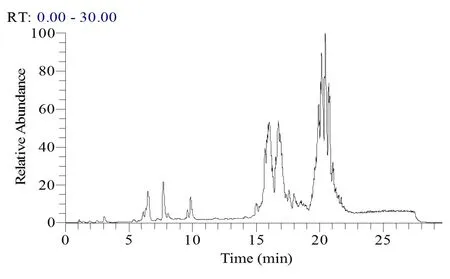
图1 脂质代谢组学总离子流图
3.3脂质代谢组学表征半定量数据所得矩阵建立偏最小二乘判别分析模型(OPLS-DA)用于区分3个实验组小鼠的脂质代谢轮廓图,模型的拟合参数R2X=0.872,R2Y=0.933,Q2=0.748,说明拟合得到的模型较好。OPLS-DA模型得分图见图2。结果显示,空白对照组、RSV肺炎模型组和虎杖组存在明显的区分,说明3组小鼠的血浆脂质代谢轮廓图存在显著差异。通过代谢组学结果能够更加直观、明确、综合的反映了虎杖对于RSV肺炎小鼠的干预作用。

图2 OPLS-DA得分图
3.4差异化合物的分析通过OPLS-DA载荷图和单因素方差分析找寻虎杖提取物可能调控的差异代谢物,共得到60个差异性的代谢产物,依据代谢产物的精确质量数查询METLIN metabolite database(https://metlin.scripps.edu/index.php)数据库,对差异性脂质分子进行结构归属,58个差异代谢产物中含有磷脂酰胆碱类/磷脂酰乙醇胺34个,三酰甘油类7个,神经酰胺类4个,神经鞘磷脂4个,未知化合物11个。进一步,根据碎裂途径,对化合物进行结构鉴定,得到溶血性磷脂酰胆碱7个、磷脂酰胆碱类脂质分子2个,三酰甘油类化合物2个以及磷酸化神经酰胺4个。单因素方差结果显示,模型组的各脂质类成分相对于空白组显著降低,而虎杖干预组则能够显著逆转脂质水平的降低(图3)。

图3 差异性化合物(*P<0.05,**P<0.01)
4 讨论
近年来的研究发现,贝拉康坦(猪肺中提取的表面活性物质)能够改善RSV患儿的细支气管炎临床症状[9]。细胞实验结果显示,肺泡表面活性物质的主要成分1-棕榈酰基-2-油酰基磷脂酰甘油(POPG)能够抑制RSV诱导产生的细胞炎性反应应答和免疫应答[10]。此外,通过RSV诱导棉鼠肺炎的实验发现,COX-2抑制剂能够显著抑制RSV诱导的棉鼠的肺炎,提示脂质递质参与了RSV的炎性反应[11]。以上研究结果均充分说明,脂质代谢参与了RSV诱导的肺炎。
本论文的研究结果发现有7个溶血性磷脂胆碱在模型RSV小鼠中表现出显著的降低,包括LysoPC(18∶1)和LysoPC(16∶0)。溶血性磷脂胆碱是肺组织表面活性物质的重要组成物质,此外,在炎性反应中具有重要的调节作用[12]。RSV肺炎模型组小鼠体内磷脂酰胆碱和溶血性磷脂酰胆碱的共同降低,提示可能代谢转化成相应的游离脂肪酸,并进一步引发机体产生一系列的酸中毒现象。通过脂质代谢数据发现,虎杖提取物能够逆转磷脂酰胆碱水平的降低,说明虎杖通过调节脂质代谢发挥保护作用。在我们的实验中,发现的另一类重要的脂质分子是磷酸化的神经酰胺,RSV肺炎模型组小鼠的磷酸化神经酰胺表现为显著降低。目前发现,具有生物活性的信号分子,磷酸化神经酰胺(Ceramide 1-phosphate,C1P)是一种调节细胞增殖和生长发育的重要鞘脂类活性代谢产物,具有促进细胞增殖、抑制细胞迁移、调节炎性反应等作用[13-14]。C1P参与了细胞的炎性反应应答,能够刺激胞质型磷脂酶A2(cytosolic phospholipase A2,cPLA2),进一步促进花生四烯酸和前列腺素的合成和释放[15]。本实验中,磷酸化神经酰胺在模型RSV小鼠组显著降低,而虎杖提取液能够逆转其水平的降低,说明虎杖可能通过干预磷酸化神经酰胺代谢发挥抗炎的作用。通过我们脂质代谢组学的实验结果,说明虎杖提取物可能对磷脂类代谢调控从而发挥其抗RSV的作用,这为临床治疗小儿RSV肺炎提供了药理学依据。
[1]Nair H,Nokes DJ,Gessner BD,et al.Global burden of acute lower respiratory infections due to respiratory syncytial virus in young children:a systematic review and meta-analysis[J].Lancet,2010,375(9725):1545-1555.
[2]汪受传,朱先康,韩新民,等.小儿病毒性肺炎中医证治规律的初步研究[J].中国医药学报,2003,18(12):729-731.
[3]樊慧婷,丁世兰,林洪生.中药虎杖的药理研究进展[J].中国中药杂志,2013,38(15):2545-2548.
[4]Brites P,Waterham HR,Wanders RJA.Functions and biosynthesis of plasmalogens in health and disease[J].Biochimica et Biophysica Acta(BBA)-Molecular and Cell Biology of Lipids,2004,1636(2):219-231.
[5]McGill MR,Li F,Sharpe MR,et al.Circulating acylcarnitines as biomarkers of mitochondrial dysfunction after acetaminophen overdose in mice and humans[J].Archives of toxicology,2014,88(2):391-401.
[6]杜丽娜,单进军,谢彤,等.代谢组学在儿科呼吸系统疾病中的应用[J].中华中医药杂志,2015,30(8):2941-2943.
[7]毛厌草,单进军,吴皓,等.代谢组学在中药及其复方领域中的研究进展[J].南京中医药大学学报,2014,30(2):197-200.
[8]杜丽娜,单进军,谢彤,等.基于液相质谱联用的黄芩水提液抗病毒效应的脂质组学研究[J].中华中医药杂志,2015,30(5):1728-1733.
[9]Tibby SM,Hatherill M,Wright SM,et al.Exogenous surfactant supplementation in infants with respiratory syncytial virus bronchiolitis[J].American journal of respiratory and critical care medicine,2000,162(4 Pt 1):1251-1256.
[10]Numata M,Chu HW,Dakhama A,et al.Pulmonary surfactant phosphatidylglycerol inhibits respiratory syncytial virus-induced inflammation and infection[J].Proceedings of the National Academy of Sciences of the United States of America,2010,107(1):320-325.
[11]Richardson JY,Ottolini MG,Pletneva L,et al.Respiratory syncytial virus(RSV)infection induces cyclooxygenase 2:a potential target for RSV therapy[J].Journal of immunology,2005,174(7):4356-4364.
[12]Cui L,Lee YH,Kumar Y,et al.Serum metabolome and lipidome changes in adult patients with primary dengue infection[J].PLoS neglected tropical diseases,2013,7(8):e2373.
[13]Simanshu DK,Kamlekar RK,Wijesinghe DS,et al.Non-vesicular trafficking by a ceramide-1-phosphate transfer protein regulates eicosanoids[J],Nature,2013,500(7463):463-467.
[14]Lim J,Kim Y,Heo J,Kim KH,et al.Priming with ceramide-1 phosphate promotes the therapeutic effect of mesenchymal stem/stromal cells on pulmonary artery hypertension[J].Biochemical and biophysical research communications,2016,473(1):35-41.
[15]Presa N,Gomez-Larrauri A,Rivera IG,et al.Regulation of cell migration and inflammation by ceramide 1-phosphate[J].Biochimica et biophysica acta,2016,1861(5):402-409.
(2016-09-09收稿责任编辑:洪志强)
Metabonomics Study on the Effect of Polygonum Cuspidatumon Anti-respiratory Syncytial Virus(RSV)Basing on Lipid Metabolism
Xie Tong,Du Lina,Xu Jianya,Shen Cunsi,Wang Shouchuan,Shan Jinjun
(Jiangsu Key Laboratory of Pediatric Respiratory Disease,Institute of Pediatrics,Nanjing UniversityofTraditionalChineseMedicine,Nanjing210023,China)
Objective:To observe the effect of Polygonum cuspidatum on the lipid metabolism changes of BALB/c mice caused by anti-respiratory syncytial virus.Methods:Eighteen BALB/c mice were grouped into three groups randomly,blank control group,RSV group,and Polygonum cuspidatem group.RSV group and Polygonum cuspidatem group were infected by RSV through nasal inhalation.Bland control group experienced intragastric administration of normal saline.Plasma were taken after the experiment to measure its lipid metabolism materials.And the lipids were extracted by Methyl tert-butyl ether(MTBE)and then were introduced into HPLC-LTQ-Orbitrap for lipidomic analysis.OPLS-DA model were calculated for cluster of the three groups,and discriminated lipids were detected by One Way ANOVA(P<0.05).The structure of the discriminated lipids were determined,explaining the regulation oflipid metabolism.Results:The score plot of the OPLS-DA model provided the obvious discrimination of the three groups,suggesting the lipid metabolism regulated were phosphatidylcholine,triacylglycerol and phosphorylated ceramide.The further One Way ANOVA analysis suggested that the levels of the lyso glycerophosphocholines(Lyso PCs)and phosphated ceramides were significantly decreased when RSV were inoculated intranasally,while the Polygonum cuspidatum can increased this changes.Conclusion:Polygonum cuspidatum potents the anti-RSV effect by regulating the lipid metabolism.
Lipidomic analysis;Polygonum cuspidatum;RSV Pneumonia;Liquid mass spectrometry
国家自然科学基金项目(编号:81303295,81373688);江苏省自然科学基金青年基金项目(编号:BK20130959);江苏省高校自然科学研究面上项目(编号:13KJB360005)
谢彤(1985—),南京中医药大学助理研究员,研究方向:代谢组学与中医药,E-mail:sunnyxyl1021@163.com
单进军(1979—),南京中医药大学副研究员,研究方向:代谢组学与中医药,E-mail:dfsjj@163.com
R285.5
A doi:10.3969/j.issn.1673-7202.2016.09.006

