葛根异黄酮对唾液淀粉酶及阴沟肠杆菌的抑制作用初探
梁 洁,李 琳,单 杨,唐汉军,3
(1中南大学隆平分院,长沙 410125; 2湖南省农业科学院作物淀粉化学与代谢组学创新团队,长沙 410125;3湖南省农产品加工研究所,长沙 410125)
葛根异黄酮对唾液淀粉酶及阴沟肠杆菌的抑制作用初探
梁洁1,2,李琳1,2,单杨1,3,唐汉军1,2,3
(1中南大学隆平分院,长沙410125;2湖南省农业科学院作物淀粉化学与代谢组学创新团队,长沙410125;3湖南省农产品加工研究所,长沙410125)
目的:揭示葛根异黄酮降血糖与减肥作用的机理。方法:以乙醇回流提取法分离提取不同地域的野葛和粉葛葛根异黄酮类;AOAC法和高效液相色谱法分析营养成分;以唾液淀粉酶和阴沟肠杆菌构建试验评价体系,用比色法测定葛根提取物(PREE)添加的抑制活性。结果:野葛与粉葛的基本营养没有显著的差异,但异黄酮成分的含量和组成差异显著;PREE对唾液淀粉酶的半抑制浓度(IC50)是0.31~1.14mg/mL、对阴沟肠杆菌的IC50为0.49~0.56mg/mL。随着PREE浓度的增加,唾液淀粉酶活性减弱,阴沟肠杆菌的增殖速率降低。结论:葛根异黄酮对唾液淀粉酶活性和阴沟肠杆菌的增殖均具有抑制效果,直接影响糖代谢的初始阶段而发挥降血糖、减肥作用。
葛根异黄酮;唾液淀粉酶;阴沟肠杆菌;抑制作用
唾液淀粉酶(Salivaamylase)是由唾液腺分泌的一种水解酶,是α-淀粉酶的一种,可以随机地切断淀粉、糖原、寡聚或多聚糖分子内的α-1,4-糖苷键,产生麦芽糖、低聚糖和葡萄糖等。食物进入胃后,唾液淀粉酶还可继续作用,直至胃内容物pH值变为4.8以下的酸性后反应才终止。全吉淑等人[1]研究表明,大豆异黄酮类物质具有α-淀粉酶活性抑制作用,对改善非胰岛素依赖型糖尿病症状、防止血糖升高有利。
阴沟肠杆菌(Enterobactercloacae)广泛存在于大自然中,在人与动物的粪便、土壤、各类植物中均可检出,是肠道常住菌种之一,但也可成为条件致病菌。阴沟肠杆菌已成为引起医院肺部感染的重要病原菌之一[2],也是较为常见的细菌,常引起肺部感染、败血症和尿路感染,也是造成肥胖的直接元凶之一[3],近年来由于阴沟肠杆菌的耐药性问题日趋严重,使临床感染治疗面临潜在威胁[4]。
葛根的主要功能成分是异黄酮类化合物,主要有葛根素、3-羟基葛根素、3-甲氧基葛根素、葛根素-木糖苷、大豆苷元、大豆苷、芒柄花素、染料木苷、染料木素等[5],已确认有48种,其中葛根素是本属植物的特有成分。已知植物中,葛植物的异黄酮种类最多、含量高[6]。葛根异黄酮可以提高人畜的免疫力、治疗缺血性中风[7]、缺血性视网膜病变和视网膜黄斑病[8],改善骨质代谢[9,10],具有显著的抗抑郁作用[11],治疗丛集性头痛,副作用轻微[12],可降低血糖、血脂,治疗心脑血管疾病,对治疗肥胖有一定的作用[13]。
关于葛根异黄酮作用机理的研究报告还不多,本研究为揭示葛根异黄酮降血糖与减肥作用的机理,以湖南省不同地域栽培的粉葛和野葛的葛根提取物(PREE)为试验材料,构建首先参与糖代谢的唾液淀粉酶及肠道常住菌种阴沟肠杆菌的in vitro评价体系,初步探讨了PREE对唾液淀粉酶活性及阴沟肠杆菌的抑制作用。
1 材料与方法
1.1试验材料
使用2012年12月在湖南省武陵源山区采集的1个野葛,以及在麻阳县、桑植县、冷水江市3个地域采集的2年生栽培粉葛的葛根作为试验材料,实验编号分别为Kudzu-A(野葛根)、Kudzu-B(麻阳粉葛根)、Kudzu-C(桑植粉葛根)、Kudzu-D(冷水江粉葛根)。将采集的4种鲜葛根,充分洗净后切成约2 mm厚薄片,在105℃条件下常压烘干,粉碎至100目以上,贮存于干燥器中,作为分析样品和功能成分的提取原料。
试验试剂:膳食纤维分析用酶制剂盒(日本和光制药公司);葛根素、大豆苷、大豆苷元等标准物(日本和光制药公司);阴沟肠杆菌种(中国普通微生物菌种保藏管理中心提供);人唾液淀粉酶(美国Sigma公司);蛋白胨、牛肉浸取物(上海盛思生化科技有限公司);色谱纯级乙腈;无水乙醇;其他分析用试剂都是国产分析纯级。高纯度脱脂淀粉是本研究团队调制的样品。
1.2主要仪器设备
GFL-70电热烘箱,天津市莱玻特瑞仪器设备有限公司;RE 5298A旋转蒸发器,上海亚荣生化仪器厂;FD-ID-80冷冻干燥机,北京博医康实验仪器有限公司的;LP-10ATVP高效液相色谱仪,日本岛津制作所;SP-756紫外分光光度计,上海光谱仪器有限公司;LDZX-50KBS立式压力蒸汽灭菌锅,上海申安医疗器械厂;QHZ-98A全温度振荡培养箱,太仓市华美生化仪器厂洁净工作台,上海博迅实业有限公司。
1.3实验方法
1.3.1营养成分分析以干燥粉末为分析样品,采用AOAC法[14-17]测定。凯氏定氮法测定粗蛋白质含量;索氏提取法测定粗脂肪含量;Prosky-AOAC法测定膳食纤维含量;常压电热灰化法测定灰分含量;糖分含量由(1)式计算:
糖分(%)=100-(水分+粗蛋白质+粗脂肪+膳食纤维+灰分)
(1)
1.3.2葛根提取物的制备取100g葛根干粉末,加70%乙醇500mL,在100℃加热回溜装置上,回溜提取1h后,用G4砂芯抽滤器过滤。收集残渣,加70%乙醇500mL,在100℃加热回溜装置上,回溜提取30min后,用G4或G5砂芯抽滤器过滤。残渣再重复1次回溜提取,集合3次的滤液,在真空浓缩机上浓缩至500mL左右。浓缩液用液氮冻结后,冻干处理,最终获得20g左右的葛根提取物粉末(PREE)。
1.3.3异黄酮含量测定精确称取PREE粉末10mg,加70%乙醇5mL,沸水浴10min,充分溶解后,用70%乙醇定容至10mL。溶液用亲水性过滤器(0.45μm目径)过滤后,作为高效液相色谱分析样品。分析条件[18]:层析柱为Cosmosil 5 C18-AR-II (4.6mm×250mm),流动相是10%乙腈水溶液(含0.1%甲酸)(A液)和35%乙腈水溶液(含0.1%甲酸)(B液)。B液梯度为0~60min:0~80%;60~70min:80%;70~85min:80%~100%;85~90min:100%。总流速1mL/min,柱温25℃,检测波长260nm。
1.3.4淀粉的酶解反应条件试验(1)淀粉溶液调制:称取100mg脱脂淀粉置于带盖试管中,加入3mL水,沸水浴15min,冷却至室温,再加入5mL灭菌水混匀,加入NaoH溶液(1mol/L)1mL,混合均匀后静置10min,再加入HCl(1mol/L)溶液1mL中和,混匀后45℃保存备用。(2)唾液淀粉酶溶液配制:称取唾液淀粉酶粉剂于灭菌带盖试管中,在洁净台中加入0.05mmol/L灭菌磷酸钾缓冲液(pH=6.0)完全溶解,配制成20U/mL的酶溶液,分装到1.5mL的小离心管,密封好放到-40℃保存备用。(3)酶的用量试验:预备灭菌带盖试管5支,各取上述淀粉溶液0.1mL,加0.05mmol/L灭菌磷酸钾缓冲液(pH=6.0)0.4~0.33mL,再分别加上述唾液淀粉酶溶液0、10、30、50、70μL,在37℃震荡水浴锅中反应30min,沸水浴5min停止反应。加入95%的乙醇1.5mL,搅拌均匀,静置30min后,离心分离(5℃,8 000×g,5min)。采用苯酚硫酸法测定上清液的总糖含量,判断合适的酶用量。(4)反应时间的试验:预备灭菌带盖试管6支,各取上述淀粉溶液0.1mL,加0.05mmol/L灭菌磷酸钾缓冲液(pH=6.0)0.35mL,再加上述唾液淀粉酶溶液50μL,在37℃震荡水浴锅中分别反应10、20、30、40、50、60min,沸水浴5min停止反应。加入95%的乙醇1.5mL,搅拌均匀,静置30min后,离心分离(5℃,8 000×g,5min)。采用苯酚硫酸法测定上清液的总糖含量,判断合适的反应时间。
1.3.5唾液淀粉酶的活性抑制试验(1)葛根粗提物溶液的配制:取PREE粉末0.5g,加入70%乙醇溶液5mL,水浴加热15min充分溶解,用70%乙醇定容至10mL。实验时进一步用70%乙醇稀释,配制成10、20、30、40、50 mg/mL的PREE梯度溶液,作为分析用试剂。(2)酶活性抑制试验:取上述淀粉溶液0.1mL,加0.05mol/L灭菌磷酸钾缓冲液(pH=6.0) 0.3mL,混合均匀,按照表1分组加入试剂,在37℃震荡水浴锅中反应30min,沸水浴5min停止反应,加入95%乙醇1.5mL,搅拌均匀,静置30min后,离心分离(5℃,8 000×g,5min)。采用苯酚硫酸法测定各组上清液的总糖含量。淀粉的酶解率(%)由(D-B)/C*100计算得出,并根据淀粉的酶解率与反应液PREE浓度的线性回归方程求出半抑制浓度(IC50)。

表1 实验组别
1.3.6阴沟肠杆菌的增殖培养试验按照中国普通微生物菌种保藏管理中心提供的操作步骤和培养条件将菌种培养恢复。取LB液体培养基20mL,加0.1mL菌悬液,在37℃条件下震荡培养。在5、20、30h处,取0.5mL菌悬液测定660 nm的吸光度值。同时取0.1mL菌悬液,用生理盐水稀释104~108倍后,取稀释菌悬液0.1mL涂布于LB固体平板培养基,在37℃条件下培养24h后,计测菌落数。确认菌落数与吸光度值的线性回归关系。
1.3.7阴沟肠杆菌的增殖抑制试验按上述液体培养法预培养5h的菌液作为试验菌液。分4组取18mL液体培养基于50mL灭菌三角瓶中,按照表2分别加入试剂,在37℃条件下震荡培养7h后,取0.5mL菌悬液测定660nm的吸光度值。菌的增殖率(%)=D/C*100,并根据增殖率(%)与培养基PREE浓度的线性回归方程求出PREE的IC50。

表2 试验组别
1.3.8试验数据处理采用Excel(2007)处理数据。
2 结果与分析
2.1葛根的营养成分
表3结果显示,4个样品的粗蛋白、粗脂肪、可溶性膳食纤维的含量都不高,品种间的差异较小。灰分含量3.4%~6.1%,Kudzu-D最高,整体上与甘薯、土豆等根菜类的含量类似[19,20]。Kudzu-A、B、C的不溶性膳食纤维含量12.4%~15.7%,品种间的差异不大,但Kudzu-D的膳食纤维含量达57.0%,远高于其他样品,这或许是品种的特性,也可能是采样地点的小环境条件造成的,需要求证。
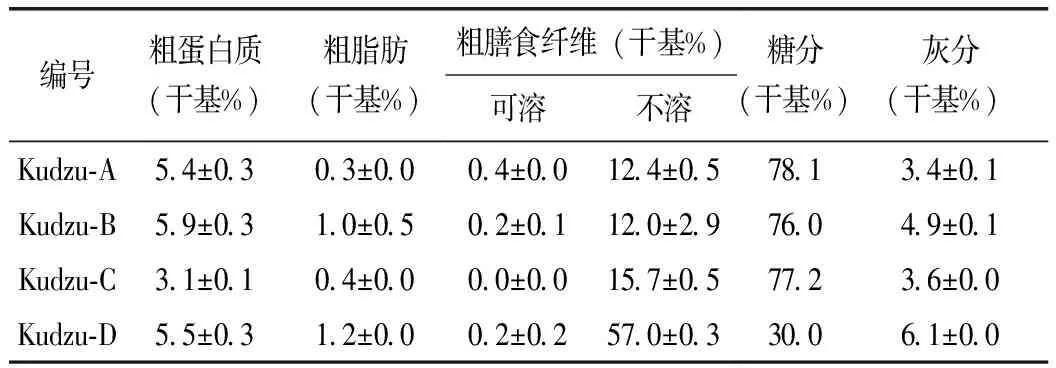
表3 葛根的营养成分
注:糖分(%)=100-(粗蛋白质+粗脂肪+粗膳食纤维+灰分)
2.2葛根粗提物的主要异黄酮成分
由表4可知,野葛Kudzu-A的葛根素、大豆苷、大豆苷元含量均最高,特别是葛根素含量与大豆苷和大豆苷元之和相当,与从前的分析结果类似[21,22]。3个栽培品种的各种异黄酮含量表示了一定差异,有的甚至有显著差异,但3种异黄酮的总和值(总异黄酮含量)差异不大,7.5%~8.6%,约是野葛Kudzu-A的1/2。
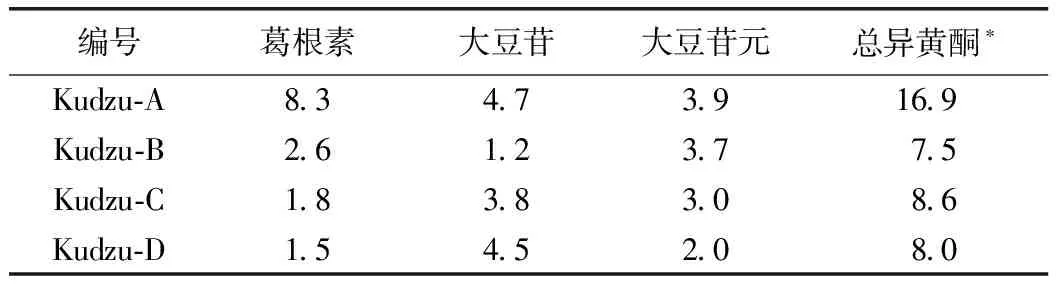
表4 葛根粗提物(PREE)的异黄酮含量 单位:%
注:*总异黄酮(%)=葛根素(%)+大豆苷(%)+大豆苷元(%)
2.3唾液淀粉酶活性抑制作用
由图1可知,30min之前水解速度直线上升,之后显示了明确的拐点,40min后淀粉几乎被完全分解,所以,在本反应条件下,唾液淀粉酶活性抑制试验的反应时间定为30min以内比较适宜。
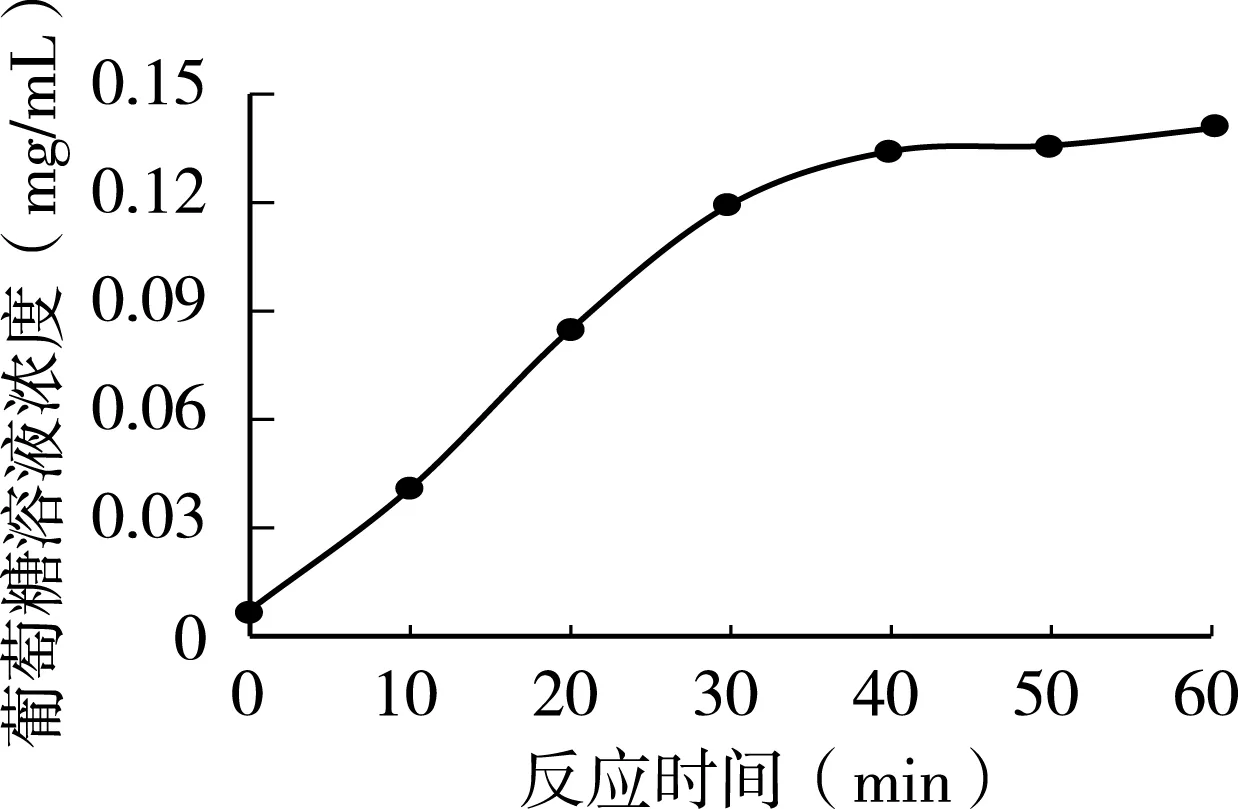
图1 淀粉水解与反应时间的变化
图2显示,反应液的PREE浓度与淀粉的分解率之间呈现很好的线性关系,4种PREE对唾液淀粉酶活性都具有显著的抑制作用。野葛Kudzu-A在2mg/mL以下浓度时表现了最强的抑制效果,但浓度大于2mg/mL后,对唾液淀粉酶活性的抑制效果与3个栽培粉葛的表现相近,说明高浓度下反映不出不同品种来源PREE的差异,因此,评价试验的PREE添加浓度在2mg/mL以下为宜。
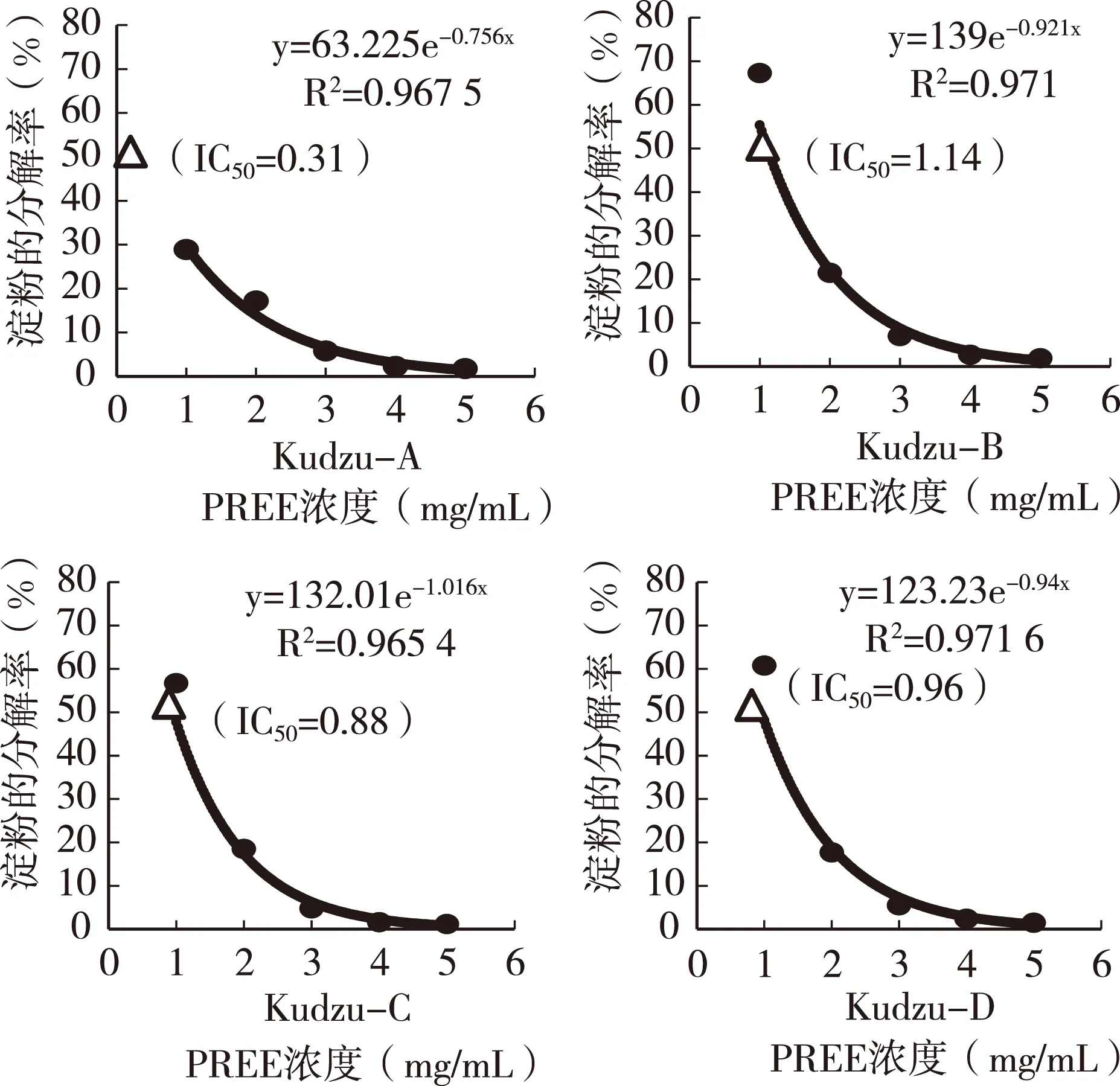
图2 PREE对唾液淀粉酶的抑制作用
根据其趋势线方程计算出IC50,Kudzu-A 0.31 mg/mL最低、Kudzu-B 1.14 mg/mL最高,Kudzu-C 0.88mg/mL、Iudzu-D 0.96mg/mL。IC50与各种单一异黄酮之间呈现较低的相关性,甚至没有,但与总异黄酮含量之间呈现了显著的负相关性(图3)。
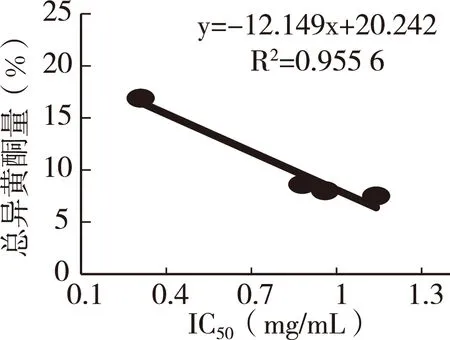
图3 总异黄酮量与IC50的关系
2.4阴沟肠杆菌增殖抑制作用
图4显示,阴沟肠杆菌的增殖开始呈线性上升,20h后,增殖达到顶峰,而后出现死亡和减少的趋势,因此在本培养条件下,阴沟肠杆菌增殖抑制试验的培养时间定为20h以内比较适宜。图5结果显示,阴沟肠杆菌的增殖数(菌落数)与培养菌液吸光度值之间有显著的线性回归关系,说明将菌液吸光度值作为阴沟肠杆菌的增殖指标是可行的,可以缩短和简化增殖抑制评价试验工作。
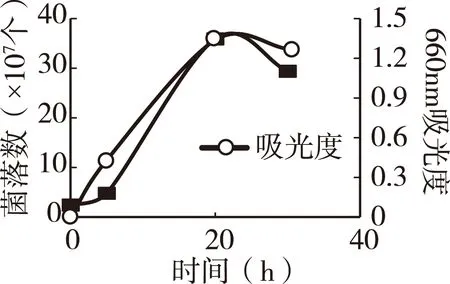
图4阴沟肠杆菌的培养试验
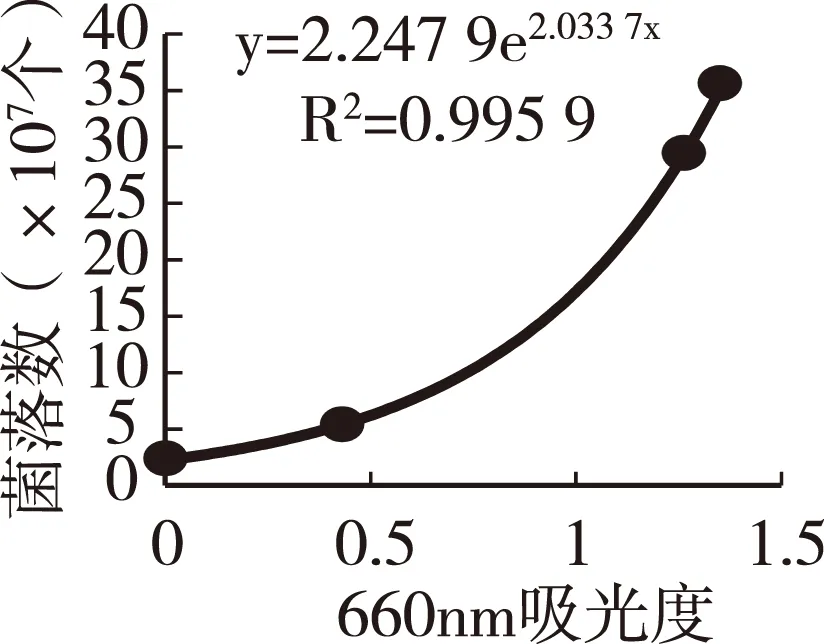
图5菌落数与菌液吸光度值的线性关系
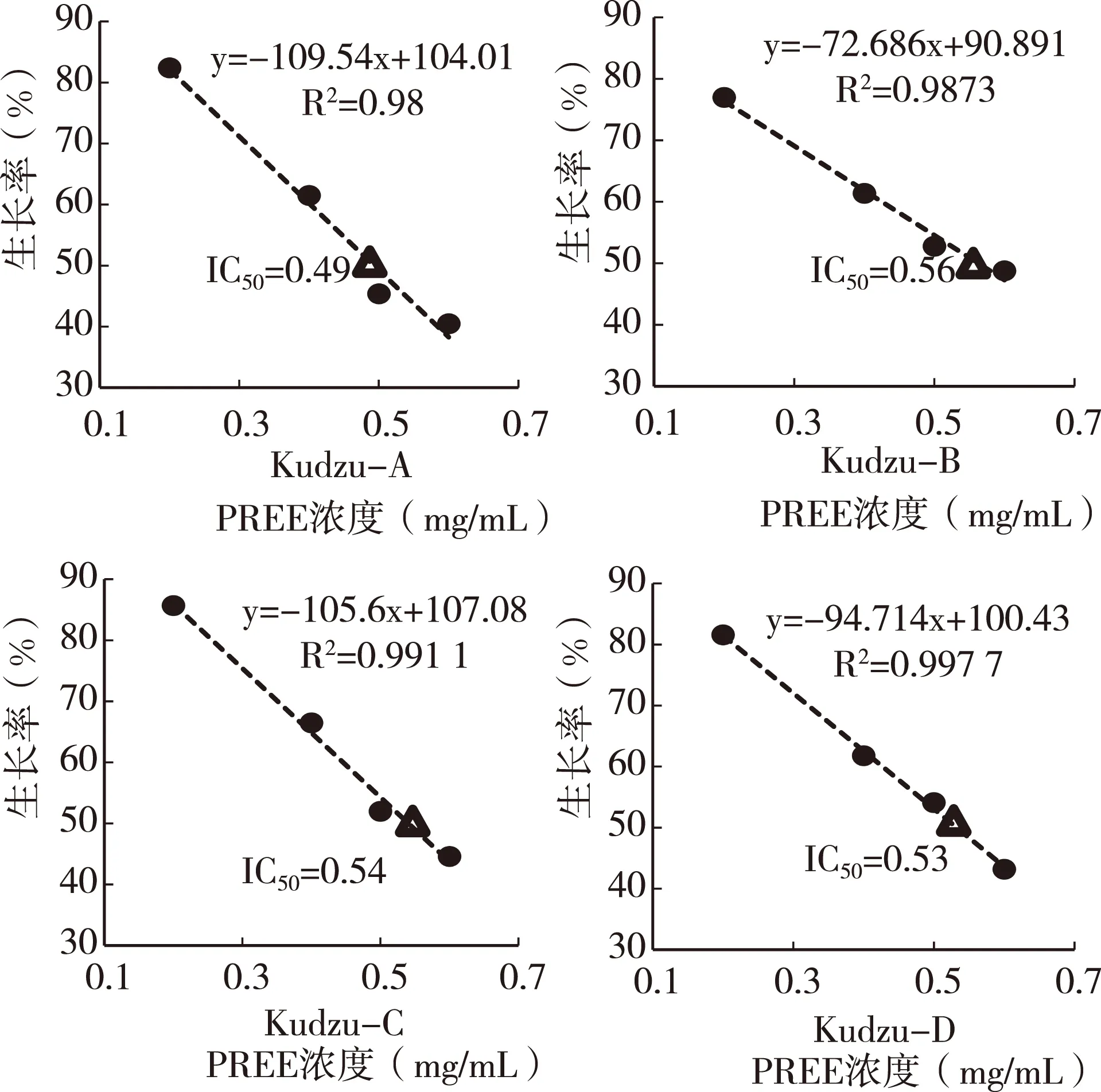
图6 PREE对阴沟肠杆菌增殖的抑制作用
图6可知,4种PREE都显示了显著的抑制效果。随培养基PREE浓度的增高,阴沟肠杆菌增殖速度下降最快的是添加野葛Kudzu-A的试验,最慢的为Kudzu-B,Kudzu-C与D几乎相同。根据其趋势线方程计算出IC50,Kudzu-A为0.49 mg/mL、Kudzu-B 0.56 mg/mL、Kudzu-C 0.54 mg/mL、Kudzu-D 0.53 mg/mL。IC50与总异黄酮含量之间呈现了较高的负相关性(图7),与唾液淀粉酶活性抑制结果相似,因此可推断葛根异黄酮抑制唾液淀粉酶活性与阴沟肠杆菌增殖需要各种异黄酮协同作用,预示着异黄酮组成也是重要因素。
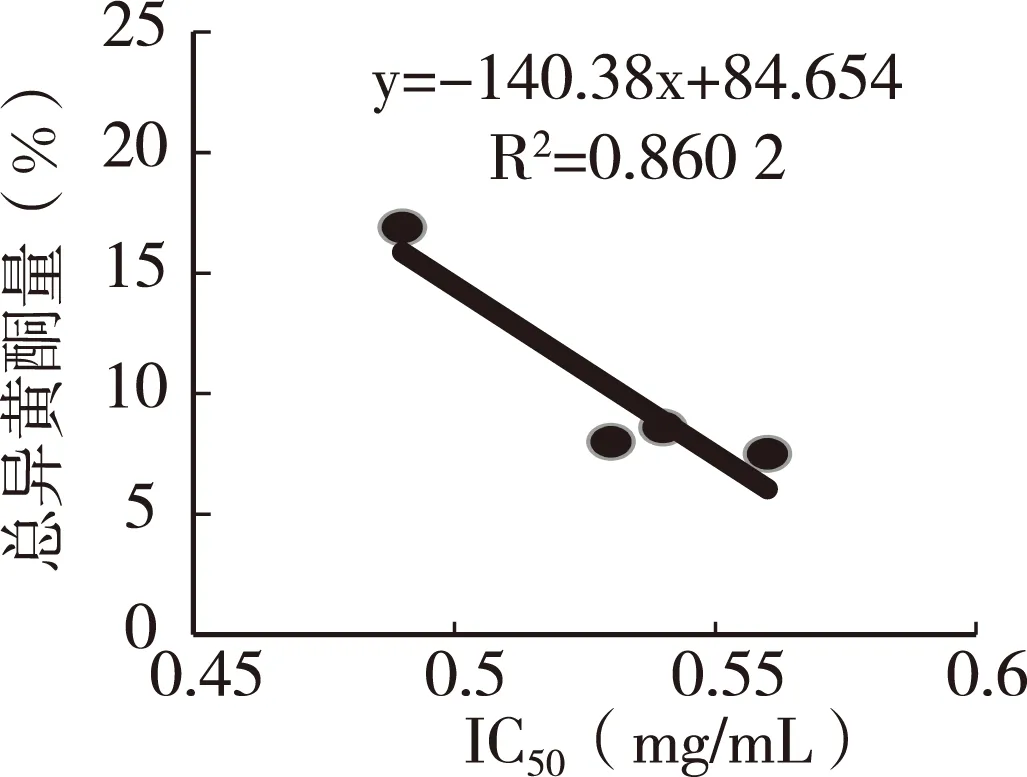
图7 IC50与总异黄酮含量的关系
3 结论
通过以上结果分析,可得出如下结论:
(1)野葛与粉葛的基本营养成分没有显著的差异,但异黄酮成分的含量和组成差异显著,反映了种间、地域间、生长时间产生的不同。(2)本研究构建的人唾液淀粉酶活性试验方法和阴沟肠杆菌增殖培养试验作为探讨葛根异黄酮作用机理的评价体系是可行的,具有操作方便、重复性高、效率较好、不需高端设备等特点,适合于一般实验条件推广应用。(3)在1mg/mL基质浓度、2U/mL酶浓度下,酶解反应时间不能超过30min,异黄酮添加浓度小于2mg/mL为宜。(4)葛根异黄酮对唾液淀粉酶活性和阴沟肠杆菌的增殖均具有抑制效果,且与组成物整体浓度之间呈现显著的正相关,表明葛根异黄酮类物质在降血糖、预防肥胖上的功效作用首先是通过直接影响糖代谢的途径实现的。(5)葛根异黄酮的种类与组成也可能是重要因素。今后需要开展高纯度单一成分、成分配伍等详细试验,异黄酮阻碍唾液淀粉酶的方式,以及阴沟肠杆菌的应答模式等研究工作。◇
[1]全吉淑,尹学哲.大豆异黄酮对 α—葡萄糖苷酶和 α—淀粉酶的抑制作用[J].延边大学医学学报,2001,24(4):239-242.
[2]Keller R,Pedroso M Z,Ritchmann R,et al.Occurrence of virulence-associated properties inEnterobacter cloacae[J].Infection and Immunity,1998,66(2):645-649.
[3]Fei N,Zhao L.An opportunistic pathogen isolated from the gut of an obese human causes obesity in germfree mice[J].The ISME Journal,2013,7(4):880-884.
[4]周光,等.临床阴沟肠杆菌感染的分布与耐药特性研究[J].中华医院感染学杂志,2006,16(3):340-342.
[5]王爱梅.葛根异黄酮对更年期大鼠学习记忆及抗氧化作用的研究[J].中国现代药物应用,2009,3(24):68-69.
[6]刘永录,赵引娣,杨会池.葛根保健作用的化学及药理学基础研究近况[J].河北中医,2008,30(4):435-437.
[7]Tan Y,Liu M,Wu B.Puerarin for acute ischaemic stroke[J].The Cochrane Library,2008.
[8]XUAN B O,et al.Improvement of ocular blood flow and retinal functions with puerarin analogs[J].Journal of Ocular Pharmacology and Therapeutics,1999,15(3):207-216.
[9]Tanaka T,Tang H,Yu F,et al.Kudzu (Pueraria lobata) vine ethanol extracts improve ovariectomy-induced bone loss in female mice[J].Journal of Agricultural and Food Chemistry,2011,59(24):13230-13237.
[10]罗显禄.葛根异黄酮对去卵巢大鼠的抗骨质疏松作用及其机制[J].中国生化药物杂志,2012,33(3):262-264.
[11]王海岭,师天元.葛根异黄酮抗抑郁作用的实验研究[J].中国实验方剂学杂志,2012,18(21):268-271.
[12]Sewell R A.Response of cluster headache to kudzu[J].Headache:The Journal of Head and Face Pain,2009,49(1):98-105.
[13]Kamiya T,Sameshima-Kamiya M,Nagamine R,et al.The crude extract from puerariae flower exerts antiobesity and antifatty liver effects in high-fat diet-induced obese mice[J].Evidence-Based Complementary and Alternative Medicine,2012.
[14]张木华.食品分析[M].北京:中国轻工业出版社,2010.
[15]张闯,唐汉军,李琳,等.复合型葛根保健茶的研制[J].食品与机械,2013,3:238-241.
[16]Ando H,et al.Food Components in Fractions of Quinoa Seed[J].Food Science and Technology Research,2002,8(1):80-84.
[17]李林静,唐汉军,李高阳,等.甘薯营养成分及淀粉理化特性研究[J].食品与机械,2014,4:54-58.
[18]李琳,唐汉军,单杨.栽培粉葛藤蔓的营养成分特性及其安全性评价[J].食品与机械,2014,3:64-68.
[19]林子龙,等.不同甘薯品种农艺性状及营养成分差异[J].安徽农学通报,2014,20(18):31-34.
[20]王洪云,孙健,钮福祥,等.甘薯的功能成分及其药用价值[J].中国食物与营养,2013,19(12):59-62.
[21]王晓玲,温普红.葛根提取物中异黄酮的测定[J].宝鸡文理学院学报:自然科学版,2000,20(2):114-115.
[22]Wong K H,et al.Kudzu root:traditional uses and potential medicinal benefits in diabetes and cardiovascular diseases[J].Journal of Ethnopharmacology,2011,134(3):584-607.
(责任编辑李婷婷)
Inhibition Effect of Isoflavones from Kudzu Root on Saliva amylase and Enterobacter cloacae
LIANG Jie1,2,LI Lin1,2,SHAN Yang1,3,TANG Han-jun1,2,3
(1Longping Branch Graduate School,Central South University,Changsha 410125,China;2Research Team of Crop Starch Chemistry and Metabonomics,Hunan Academy of Agricultural Sciences,Changsha 410125,China;3Hunan Agricultural Product Processing Institute,Changsha 410125,China)

isoflavones from kudzu root;Salivaamylase;Enterobactercloacae;inhibition effect
湖南省农业科学院作物淀粉化学与代谢组学创新团队平台建设项目(项目编号:2014TD06)。
梁洁(1991—),女,在读硕士研究生,研究方向:作物淀粉化学与代谢组学。
唐汉军(1964—),男,博士,副研究员,研究方向:作物淀粉化学与代谢组学。

