G蛋白β3亚单位基因多态性与奥氮平所致体重增加的相关性☆
张文跃祁小飞鲍晨曦易正辉朱强杨忠魏英马俊峰陆忠桃
G蛋白β3亚单位基因多态性与奥氮平所致体重增加的相关性☆
张文跃*祁小飞Δ鲍晨曦※易正辉※朱强*杨忠◎魏英◎马俊峰*陆忠桃*
目的探讨G蛋白β3亚单位(G-protein β3 subunit,GNB3)基因C825T多态性与精神分裂症患者使用奥氮平治疗过程中体重增加的关系。方法对90例首次住院的精神分裂症患者予奥氮平治疗12周,监测治疗前后的体重、体重指数(body mass index,BMI)变化,并检测患者GNB3基因C825T多态性,分析基因多态性与体重变化的相关性。结果治疗后患者体重、BMI增加有统计学意义(均P<0.01)。TT基因型者治疗后的增重率(weight gain rate,WGR)及BMI增加较CC基因型者更明显(均P<0.01),携T等位基因(TT型+CT型)者治疗后的WGR及BMI增加较非携T等位基因(CC型)者更明显(均P<0.01)。治疗后WGR≥7%者GNB3基因C825T基因型分布(CC型15.69%,CT型54.90%,TT型29.41%)与WGR<7%者(CC型38.46%,CT型43.59%,TT型17.95%)差异有统计学意义(P<0.05),WGR≥7%者T等位基因频率(63.33%)高于WGR<7%者(39.74%)(P<0.05)。多因素线性回归显示TT基因型(以CC型为参照)影响奥氮平治疗后的体重变化(β=1.83,标准化β=0.29,P<0.01)。结论 GNB3基因C825T多态性与奥氮平所致的体重增加有关。
G蛋白β3亚单位基因单核苷酸多态性奥氮平体重增加
大样本临床研究[1-2]及meta分析[3-4]均证实,奥氮平是最容易导致体重增加的抗精神病药。作为一种复杂的临床现象,体重异常增加与环境及遗传等诸多因素均有关[5]。各患者服用奥氮平后体重变化有较大差异[2],提示遗传因素可能在其中起重要作用。G蛋白作为膜受体和效应蛋白之间信息传递的中介,参与许多重要的生理过程,包括脂肪形成及代谢等。实验研究发现G蛋白β3亚单位(G-protein β3 subunit,GNB3)基因C825T多态性能影响脂肪的分解与增生[6-7]。临床流行病学调查证实GNB3基因C825T多态性与单纯性肥胖的发生有关[8-9]。故奥氮平所致的体重增加是否也与GNB3基因C825T多态性有关值得关注。国外有少量这方面的研究[10-12],但结果不一。因此,本研究以中国苏南地区汉族精神分裂症患者为对象,就GNB3基因C825T多态性与奥氮平所致体重增加的相关性进行探索。
1 对象与方法
1.1研究对象 来自2012年10月至2015年10月江苏省太仓市第三人民医院精神科和江苏省常熟市第三人民医院精神科首次住院的精神分裂症患者。入组标准:①符合《国际疾病与相关健康问题统计分类第10版》(International Statistical Classification of Diseases and Related Health Problems 10th Revision,ICD-10)精神分裂症的诊断标准,阳性与阴性症状量表(positive and negative syndrome scale,PANSS)总分≥60分,病程<5年;②汉族,来自江苏省苏南地区,年龄18~60岁,性别不限,相互间无血缘关系;③首次住院治疗,住院前未用过抗精神病药,或门诊间断服用过除奥氮平及氯氮平之外的其他抗精神病药,且住院时已经停药2月以上;④体重指数(body mass index,BMI)<25 kg/m2,血糖、血脂、心电图检查正常。排除标准:①拒食、暴食等异常饮食者;②有高血压、冠心病、糖尿病或相应疾患家族史,有其他系统性疾病史;③合并酒精或物质滥用;④妊娠者;⑤近2周内有输血史。
共收集患者106例,其中16例未完成GNB3基因C825T多态性检测,最终90例患者纳入分析。患者男性53例,女性37例,年龄23~49岁,平均(35.64±10.3)岁,病程3~60月,中位数24.5月。有既往门诊间断服药史者42例,其中使用利培酮12例,喹硫平10例,奋乃静8例,阿立哌唑7例,舒必利5例。本研究获医院伦理委员会同意,患者或家属知情同意,并签署知情同意书。
1.2研究方法
1.2.1临床治疗 患者均单一使用奥氮平(美国礼来公司产再普乐或江苏豪森公司产欧兰宁)治疗12周,以5 mg起始,7 d内加到治疗量15~20 mg,日均治疗量(18.92±2.46)mg。治疗期间酌情加用安坦或苯二氮䓬类药物,不合用其他抗精神病药及情感稳定剂。治疗期间所有患者按医院制定的普通食谱进食,并定期参加工娱活动。
1.2.2临床评定 自编一般情况调查表,记录患者年龄、性别、病程、服药剂量等。入组时和治疗12周后测量血压、身高、体重,计算BMI和增重率(weight gain rate,WGR),其中WGR=(治疗后体重-治疗前体重)/治疗前体重×100%,以WGR≥7%计为有临床意义的体重增加。用PANSS量表评定临床症状,治疗前及治疗12周后各评定1次,计算减分率=(治疗前总分-治疗后总分)/治疗前总分×100%,减分率>25%为治疗有效。
1.2.3实验室检查 入组后次日和治疗12周后各取患者空腹肘静脉血2 mL,分离血清,用上海科华公司产卓越400型全自动生化仪测空腹血糖(fasting blood glucose,FBG)、甘油三酯(triglyceride,TG)、胆固醇(cholesterol,CHOL)、高密度脂蛋白(high density lipoprotein,HDL)、低密度脂蛋白(low density lipoprotein,LDL)、载脂蛋白A(apolipoprotein A,ApoA)、载脂蛋白B(apolipoprotein B,ApoB)水平。
1.2.4GNB3基因C825T多态性检测采集患者肘静脉血5 mL,乙二胺四乙酸抗凝,送苏州大学附属第一医院江苏省血液研究所进行GNB3基因C825T多态性检测。取450 μL血样,用Promaga DNA提取试剂盒提取DNA。以提取的DNA为模板进行PCR扩增反应,上游引物序列为5'-GCTGCCCAGGTCTGATCCCC-3',下游引物序列为5'-TGGGGAGGGTCCTTCCAGC-3'(上海生工生物科技有限公司)。PCR反应体系50 μL:10×Buffer 5 μL,25 mmol/L的MgCl25 μL,dNTPs 2 μL,上下游引物各2.5 μL,Hotstar Taq 0.5 μL,模板DNA 1 μL,无菌去离子水补至50 μL。反应条件:95℃预变性5 min,95℃变性30 s,50℃复性30 s,72℃延伸30 s,35个循环后72℃延伸7 min,4℃终止反应。PCR扩增产物用2%琼脂糖凝胶电泳鉴定,条带单一者送测序。应用美国ABI 3730XL自动DNA测序仪进行GNB3基因C825T多态性检测。
1.3统计学方法 应用SPSS 17.0进行统计分析。基因型Hardy-Weinberg平衡定律检验采用χ2检验。患者血压、BMI、FBG和血脂等指标为正态分布,治疗前后比较用配对t检验;患者WGR及BMI、FBG和血脂等指标的变化值为非正态分布,用中位数(下四分位数,上四分位数)[M(QL,QU)]描述,携T与非携T等位基因者间比较用Mann-Whitney U检验,不同基因型者间比较用Kruskal-Wallis H检验(两两比较用Mann-Whitney U检验,检验水准α调整为0.017,取调整后P值);WGR≥7%患者与WGR<7%患者基因型、等位基因分布等组间比较采用χ2检验。以治疗前后体重变化为因变量,年龄、性别、病程、基础BMI、奥氮平日剂量、服药与否、基因型(以CC型为参照)、治疗前PANSS总分及其治疗后变化为自变量,用多因素线性回归分析体重变化的影响因素,逐步法筛选变量。检验水准α为0.05,双侧检验。
2 结果
2.1治疗前后临床及生化指标变化 治疗后患者PANSS总分减分明显(t=24.45,P<0.01),有效率为86.67%(78/90)。患者体重(t=-10.88,P<0.01)及BMI(t=-11.17,P<0.01)增加,体重变化-7~20 kg,中位数4.75(2.00,8.00)kg,BMI变化-2.51~7.09 kg/m2,中位数 1.70(0.78,2.88)kg/m2。治疗后 FBG(t=-2.95,P<0.01)、TG(t=-6.99,P<0.01)、CHOL(t=-4.50,P<0.01)、LDL(t=-4.61,P<0.01)、ApoB(t=-3.64,P<0.01)水平也均有明显上升。收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)、HDL和ApoA则较治疗前无明显变化(均P>0.05)。见表1。
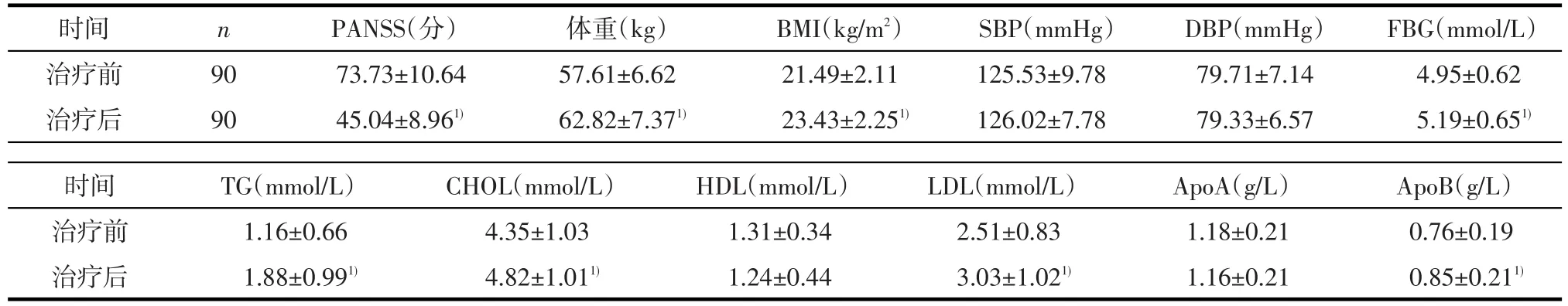
表1 治疗前后患者各临床及生化指标(x±s)
2.2GNB3基因C825T多态性检测结果 患者中GNB3基因C825T野生纯合子CC型23例(25.56%),突变杂合子CT型45例(50%),突变纯合子TT型22例(24.44%)。基因型的分布符合Hardy-Weinberg平衡定律(χ2=0.44,P=0.81),具有群体代表性。
2.3各基因多态性患者临床及生化指标变化 治疗前,不同基因型患者间性别分布、服药与否、基础BMI等临床指标差异无统计学意义(均P>0.05)。治疗后,各基因型患者间的WGR(χ2=14.70,P<0.01)及BMI变化值(χ2=14.69,P<0.01)、FBG变化值(χ2=8.06,P=0.02)、TG变化值(χ2=9.40,P= 0.01)、LDL变化值(χ2=9.81,P<0.01)差异有统计学意义。其中TT型患者WGR(Z=-3.71,P<0.01)及BMI变化值(Z=-3.70,P<0.01)、FBG变化值(Z=-2.61,P=0.03)、TG变化值(Z=-3.04,P<0.01)、LDL变化值(Z=-2.94,P=0.01)高于CC型;CT型患者 WGR(Z=-2.91,P=0.01)及 BMI变 化 值(Z=-2.93,P=0.01)高于CC型,其余指标变化的差异无统计学意义(P>0.05);TT型患者LDL变化值高于CT型患者(Z=-2.93,P=0.01),其余指标变化差异也无统计学意义(P>0.05)。见表2。治疗后,携T等位基因(TT型+CT型)者较非携T等位基因(CC型)者的 WGR(Z=-3.58,P<0.01)及 BMI(Z=-3.59,P<0.01)、TG(Z=-2.24,P=0.03)变化更明显。见表2。

表2 不同基因型患者及携T等位基因与非携T等位基因患者一般资料及临床、生化指标变化[n,(x±s)或M(QL,Qu)]
2.4不同增重组基因型、等位基因频率分布 治疗后,有51例患者WGR≥7%,39例WGR<7%。WGR≥7%组及<7%组间性别、年龄、病程、既往服药与否、入组后奥氮平日均治疗剂量差异无统计学意义(均P>0.05),但WGR≥7%组基础BMI低于WGR<7%组(t=-2.80,P<0.01)。见表3。WGR≥7%组与<7%组间基因型分布差异有统计学意义(χ2=6.19,P=0.04),WGR≥7%组T等位基因频率高于WGR<7%组(χ2=5.18,P=0.02),OR=1.99(95% CI:1.10~3.60)。见表3。
2.5体重变化的线性回归分析 多因素线性回归分析显示,TT基因型(以CC型为参照)对增重影响最明显(β=1.83,标准化β=0.29,P<0.01),其次为基础BMI(β=-0.51,标准化β=-2.40,P=0.02)及PANSS减分值(β=0.60,标准化β=1.47,P=0.03)。

表3 WGR≥7%组与WGR<7%组一般资料及基因型、等位基因分布[(x±s)或n(%)]
3 讨论
本研究显示精神分裂症患者在奥氮平治疗12周后体重明显增加,并伴有糖脂代谢的异常变化,与既往的研究结果[13]相一致。其中TT基因型者治疗后的WGR及BMI变化较CC基因型者显著;携T等位基因者治疗后的WGR及BMI变化也较非携T等位基因者明显;T等位基因较C等位基因有更高的增重风险(OR=1.99)。该结果表明GNB3基因C825T多态性可能与奥氮平治疗导致体重增加有关。控制基础BMI等其他因素对服药后体重变化的影响[14-15],本研究多因素线性回归分析发现TT基因型对体重增加的影响最明显。该结果证实GNB3基因C825T多态性可能是奥氮平治疗所致体重增加的危险基因。
既往认为奥氮平所致的体重增加,与其阻断中枢神经系统组胺1受体、5-羟色胺2C受体等,产生镇静及食欲刺激作用有关[13]。而近年来遗传因素在抗精神病药相关体重增加中的作用日益受到关注[5]。GNB3位于染色体12p13,第10外显子825位点存在C→T突变,引起G蛋白β3亚单位结构改变和Giα2亚单位过表达,促进脂肪细胞增生、降低儿茶酚胺脂肪分解效应[6-7],是体重异常增加或肥胖的易感基因[8-9]。SIFFERT等[8]提出GNB3基因C825T是一个节俭基因,在食物不足时节约能量以适应恶劣环境,食物充足、少运动等环境时则是体重增加或肥胖的危险因素。结合以上理论及奥氮平药理特性,以及本研究中患者服药后体重变化的差异,推测GNB3 C825T多态性有可能是奥氮平所致体重增加的危险基因。UJIKE等[10]对164例日本精神分裂症患者予联用奥氮平治疗,发现GNB3 C825T等位基因与18周后的体重增加有关,和本研究的结果相一致。但BISHOP等[11]对42例美国精神分裂症患者进行研究,未发现GNB3 C825T多态性与换用奥氮平治疗6周后的增重存在相关;PARK等[12]对79例同样换药的韩国精神分裂症患者进行为期3个月的观察,也得到阴性结果。上述研究结果不一可能与研究对象特征、样本量、观察时间及种族的差异有关。文献报道服用奥氮平致增重在前2~4月最明显[16]。故本研究采取12周的观察时间,并以首次住院的精神分裂症患者为对象单药治疗,尽可能控制混杂因素,结果应更具可靠性,支持GNB3 C825T多态性是奥氮平所致体重增加危险基因的假设。
综上所述,本研究初步表明GNB3基因C825T多态性与苏南汉族精神分裂症患者使用奥氮平治疗过程中的体重增加有关,为相关的预警及干预提供了一些有益线索。本研究不足之处在于:①研究的样本量不大,未能根据性别等因素进行分层分析;②研究人群局限于苏南地区,而不同地域间可能有遗传学背景差异;③部分患者在入组前有其他抗精神病药使用史;④未控制其他一些可能影响体重的因素,如吸烟状况[15]等。故今后研究还需扩大样本量、控制各类混杂因素,以进一步验证GNB3基因C825T多态性与奥氮平治疗所致体重增加的关系。
[1]KAHN RS,FLEISCHHACKER WW,BOTER H,et al.Effectiveness of antipsychotic drugs in first-episode schizophrenia and schizophreniform disorder:an open randomised clinical trail[J].Lancet,2008,371(9618):1085-1097.
[2]BUSHE CJ,SLOOFF CJ,HADDAD PM,et al.Weight change from 3-year observational date:finding from the worldwide schizophrenia outpatient health outcomes database[J].J Clin Psychiatry,2012,73(6):e749-e755.
[3]LEUCHT S,CIPRIANI A,SPINELI L,et al.Comparative efficacy and tolerability of 15 antipsychotic drugs in schizophrenia:a multiple-treatmentsmeta-analysis[J].Lancet,2013,382(9896):951-962.
[4]ALMAMDIL NB,LIU Y,MURRAY ML,et al.Weight gain and other metabolic adverse effects associated with atypical antipsychotic treatment of children and adolescents:a systematic reviewandmeta-analysis[J].PediatrDrugs,2013,15(2):139-150.
[5]RYU S,HUH IS,CHO EY,et al.Association study of 60 candidate genes with antipsychotic-induced weight gain in schizophrenia patients[J].Pharmacopsychiatry,2016,49(2):51-56.
[6]HAUNER H,ROHRIG K,SIFFERT W.Effect of the G-protein beta3 subunit 825T allele on adipogenesis and lipolysis in cultured human preadipocytes and adipocytes[J].Horm Metab Res,2002,34(9):475-480.
[7]RYDEN M,FAULDS G,HOFFSTEDT J,et al.Effect of the(C825T)G beta(3)polymorphism on adrenoceptor-mediated lipolysis in human fat cell[J].Diabetes,2002,51(5):1601-1608.[8]SIFFERT W,FORSTER P,JOCKEL KH,et al.Worldwide ethnic distribution of G protein beta3 subunit 825T allele and its association with obesity in Caucasian,Chinese,and Black African individuals[J].J Am Soc Nephrol,1999,10(9):1921-1930.[9]STEFAN N,STUMVOLL M,MACHICAO F,et al.C825T polymorphism of the G protein beta3 subunit is associated with obesity but not with insulin sensitivity[J].Obse Res,2004,12(4):679-683.
[10]UJIKE H,NOMURA A,MORITA Y,et al.Multiple genetic factors in olanzapine-induced weight gain in schizophrenia patients:a cohort study[J].J Clin Psychiatry,2008,69(9):1416-1422.
[11]BISHOP JR,ELLINGROD VL,MOLINE J,et al.Pilot study of G-protein beta3 subunit gene(C825T)polymorphism and clinical response to olanzapine or olanzapine-related weight gain in persons with schizophrenia[J].Med Sci Monit,2006,12(2):BR47-BR50.
[12]PARK YM,CHUNG YC,LEE SH,et al.G-protein beta3 subunit gene 825C/T polymorphism is not associated with olanzapine-induced weight gain in Korean schizophrenic patients[J]. Psychiatry Invest,2009,6(1):39-43.
[13]MOTESHAFI H,ZHORNITSKY S,BRUNELLE S,et al.Comparing tolerability of olanzapine in schizophrenia and affective disorders:a meta-analysis[J].Drug Saf,2012,35(10):819-836.
[14]LEE SY,PARK MH,PATKAR AA,et al.A retrospective comparison of BMI changes and the potential risk factors among schizophrenic inpatients treated with aripiprazole,olanzapine,quetiapine or risperidone[J].Prog Neuropsychopharmacol Biol Psychiatry,2011,35(2):490-496.
[15]SUBRAMANIAM M,LAM M,GUO ME,et al.Body mass index,obesity,and psychopathology in patients with schizophrenia[J].J Clin Psychopharmacol,2014,34(1):40-46.
[16]MILLEN BA,CAMPBELL GM,BEASLEY CM,et al.Weight changes over time in adults treated with the oral or depot formulations of olanzapine:a pooled analysis of 86 clinical trials[J].J Psychopharmacol,2011,25(5):639-645.
(责任编辑:肖雅妮)
Association study between G-protein β3 subunit gene polymorphism and olanzapine-induced weight gain.
ZHANG Wenyue,QI Xiaofei,BAO Chenxi,YI Zhenghui,ZHU Qiang,YANG Zhong,WEI Ying,MA Junfeng,LU Zhongtao.Department of Psychiatry,The Third People's Hospital of Taicang,No.101 Dongcang South Road,Taicang,Jiangsu 215400,China.Tel:0512-53576312.
Objective To explore the relationship between G-protein β3 subunit(GNB3)gene C825T polymorphism and the weight gain of schizophrenics treated with olanzapine.Methods Ninety schizophrenics of first time hospitalization were collected and treated with olanzapine for 12 weeks.The changes of body weight and body mass index(BMI)were detected before and after 12-week olanzapine treatment.TheGNB3gene C825T polymorphism in patients was determined by polymerase chain reaction(PCR)and DNA sequencing technique.The correlation ofGNB3gene C825T polymorphism and change of clinical parameters was analyzed.Results Body weight and BMI in patients were all increased significantly after treatment(allP<0.01).Weight gain rate(WGR)and increase of BMI in the TT genotype group were higher than those in the CC genotype group(allP<0.01).WGR and increase of BMI in the T-allele carrier(TT and CT genotypes)were higher than those in the T-allele non-carrier(CC genotype)(allP<0.01).There was significant difference in distribution of genotypes between WGR≥7%group(CC 15.69%,CT 54.90%,TT 29.41%)and WGR<7%group(CC 38.46%,CT 43.59%,TT 17.95%)(P<0.05).The frequency of T-allele in the WGR≥7%group(63.33%)was higher than that in the WGR<7%group(39.74%)(P<0.05).Multi-variable linear regression indicated that TT genotype(contrasted with CC genotype)was an influential factor for change of body weight after treatment with olanzapine(β=1.83,standardizedβ=0.29,P<0.01).Conclusions TheGNB3gene C825T polymorphism is associated with olanzapine-induced weight gain.
G-protein β3 subunit Single nucleotide polymorphism Olanzapine Weight gain
R749.3;R971+.4
A
10.3969/j.issn.1002-0152.2016.08.002
☆国家自然科学基金面上项目(编号:81171272);苏州市2012科技发展计划(应用基础研究-医疗卫生)项目(编号:SYSD2012037);太仓市2012应用基础研究计划项目(编号:TJ1202);太仓市卫生人才计划培养项目
*江苏省太仓市第三人民医院精神科(太仓215400)
△苏州大学附属第一医院江苏省血液研究所
※上海交通大学医学院精神卫生中心
◎江苏省常熟市第三人民医院精神科
(E-mail:zhangwenyuedr@sina.com)
(2016-04-22)

