氧气-离子液体预处理对麦草酶解效率的影响
陈德坤 陈嘉川 杨桂花 王 强 贾廷鹏 刘姗姗
(齐鲁工业大学制浆造纸科学与技术教育部重点实验室,山东济南,250353)
·麦草预处理·
氧气-离子液体预处理对麦草酶解效率的影响
陈德坤陈嘉川*杨桂花王强贾廷鹏刘姗姗
(齐鲁工业大学制浆造纸科学与技术教育部重点实验室,山东济南,250353)
以麦草为原料,探讨了氧气(O2)-离子液体(1-乙基-3-甲基咪唑醋酸盐,[Emim]Ac)预处理工艺条件,以期提高麦草的酶解效率。结果显示,较适宜的O2-[Emim]Ac预处理条件为:固液比1∶1.5,氧压0.4 MPa,温度130℃,处理时间6 h。在此条件下,经过O2-[Emim]Ac预处理的麦草酶解(酶解条件为:纤维素酶用量30 U/g原料,酶解时间72 h)还原糖得率为65.1%,高于未经预处理麦草酶解还原糖得率5倍以上。扫描电镜、X射线衍射和红外光谱分析表明,O2-[Emim]Ac预处理后麦草纤维表面粗糙,孔隙增加,结构疏松,结晶度降低12.6%。
麦草;离子液体;氧气;酶解
近10年来寻找可再生的替代能源成为世界各国的研究热点[1]。生物质能源已经成为世界排位仅次于煤炭、石油和天然气的第四大能源。研究发展生物质能源产业,符合我国资源环境和谐发展的战略目标。木质纤维素可转化为可发酵糖(如葡萄糖和木糖),从而被认为是有前途的生物质燃料和生物基产品材料。纤维素是木质纤维原料的主要组分,可通过纤维素酶水解为葡萄糖。但酶解反应受孔隙率、纤维可及度、纤维比表面积、纤维素结晶度和木素含量的影响[2-3],因此,纤维素酶水解前需要进行预处理以降低纤维素的结晶度和提高纤维的孔隙率。不同的预处理方法可用于提高纤维素材料的孔隙率,其中稀酸法[4]或碱法[5]是最常用的,同时蒸汽爆破[6]、氨蒸汽爆破[7]、湿氧法[8]、臭氧法等[9]具有较大的发展潜力,但这些方法需要的设备成本较高,能耗也较高。因此,探寻提高生物质利用效率、降低预处理成本的方法和技术是目前科学研究的热点。
2002年,Swatloski等人[10]发现纤维素无需活化即可直接溶解在离子液体1-丁基-3-甲基咪唑氯盐([Bmim]Cl)中,为纤维素的溶剂体系开辟了一个新领域。离子液体是有机盐,由于其高的热稳定性和不挥发性,与易挥发和不稳定的有机溶剂相比,离子液体成为具有吸引力的溶剂。随着对离子液体的深化研究,已发现多种离子液体可溶解纤维素。基于现有的研究报道,离子液体1-乙基-3-甲基咪唑醋酸盐([Emim]Ac)是纤维素较好的溶剂[11-12],其特点是无毒、无腐烛性、常温下呈液态、黏度低、对纤维素溶解能力较强,因此其在纤维素溶解加工及制备纤维素纤维方面具有较好的应用前景。本实验选用氧气(O2)-离子液体([Emim]Ac)对麦草进行预处理,优化预处理工艺条件,以提高麦草酶解效率。通过扫描电镜、X射线衍射和红外光谱分析,探索预处理前后麦草的化学结构和结晶度变化,旨在为生物质的转化利用提供理论指导。
1 实 验
1.1原料
麦草取自山东省济南市郊区,收集之后,研磨成粉末(40~60目),在恒温干燥箱内干燥备用。离子液体[Emim]Ac由成捷化学有限公司提供(上海)。商业用纤维素酶,购自雅客生物科技公司。
1.2O2-[Emim]Ac预处理
取2 g绝干麦草粉放入反应釜中,加入离子液体[Emim]Ac,固液比为1∶1.5,搅拌均匀。再向反应釜中加入不同压力的O2,在不同条件下预处理麦草。反应过程中,反应釜不断旋转,保证反应的均匀性。反应结束后,加水终止反应,并用去离子水过滤,回收麦草。回收的麦草放置于恒温干燥箱内烘干备用。
1.3酶解工艺
分别称取0.2 g反应前后麦草粉于两个25 mL锥形瓶中,加入pH值4.8的缓冲液,加入纤维素酶,酶用量为30 U/g原料,在45℃和120 r/min下的恒温振荡锅中进行酶解,在规定时间内分别移取各个时间段的酶解液,离心,取上清液,用DNS法检测其还原糖含量。
1.4原料分析
(1)水分含量测定:参照GB/T2677.2—1993造纸原料水分的测定。
(2)灰分含量测定:参照GB/T2677.3—1993造纸原料灰分的测定。
(3)综纤维素含量测定:按照GB/T2677.进行苯醇抽提;参照GB/T2677.10—1995造纸原料灰分的测定。
(4)Klason木素含量测定:参照GB/T2677.8—1994造纸原料酸不溶木素的测定;酸溶木素的测定采用Klason木素测定的水解滤液,用730紫外分光光度计测定滤液的吸光值,吸光系数取110 L/(g·cm),经计算得到。
(5)聚戊糖含量测定:参照GB/T2677.9—1994造纸原料聚戊糖的测定。
(6)纤维素含量为综纤维素减去聚戊糖的含量。
1.5葡萄糖标准曲线的绘制
图1为葡萄糖标准曲线。以下实验均采用该标准方程计算葡萄糖含量:y=0.0742x+0043,相关系数R=0.9988。式中,y为葡萄糖含量,mg/mL;x为吸光度。

图1 葡萄糖标准曲线
1.6分析方法
纤维形貌观察用FEI公司的Quanta 200环境扫描电子显微镜;纤维素结晶度测定采用德国布鲁克AXS公司的D8-ADVANCE射线衍射仪;还原糖测定采用美国安捷伦公司的DR/4000V分光光度计;红外光谱检测采用日本岛津公司的IRPrestige-21傅里叶红外光谱仪。
2 结果与讨论
2.1单因素实验
实验探讨了O2-[Emim]Ac预处理麦草过程中各参数对酶解效率的影响,并优化了单因素预处理条件。
2.1.1氧压
取绝干麦草粉2 g,按固液比1∶1.5加入离子液体[Emim]Ac,在处理温度120℃和处理时间6 h的条件下,改变氧压,探讨了不同氧压预处理下麦草酶解还原糖得率,氧压对麦草酶解还原糖得率的影响见图2。
图2中数据显示,随着预处理氧压的增加,麦草酶解还原糖得率出现先升高后平缓下降的趋势。当预处理氧压从0.2 MPa增加到0.4 MPa时,麦草酶解还原糖得率提高幅度较大,当预处理氧压为0.6 MPa时,麦草酶解还原糖得率增加缓慢。因此,较适宜的预处理氧压为0.4 MPa。

图2 氧压对麦草酶解还原糖得率的影响
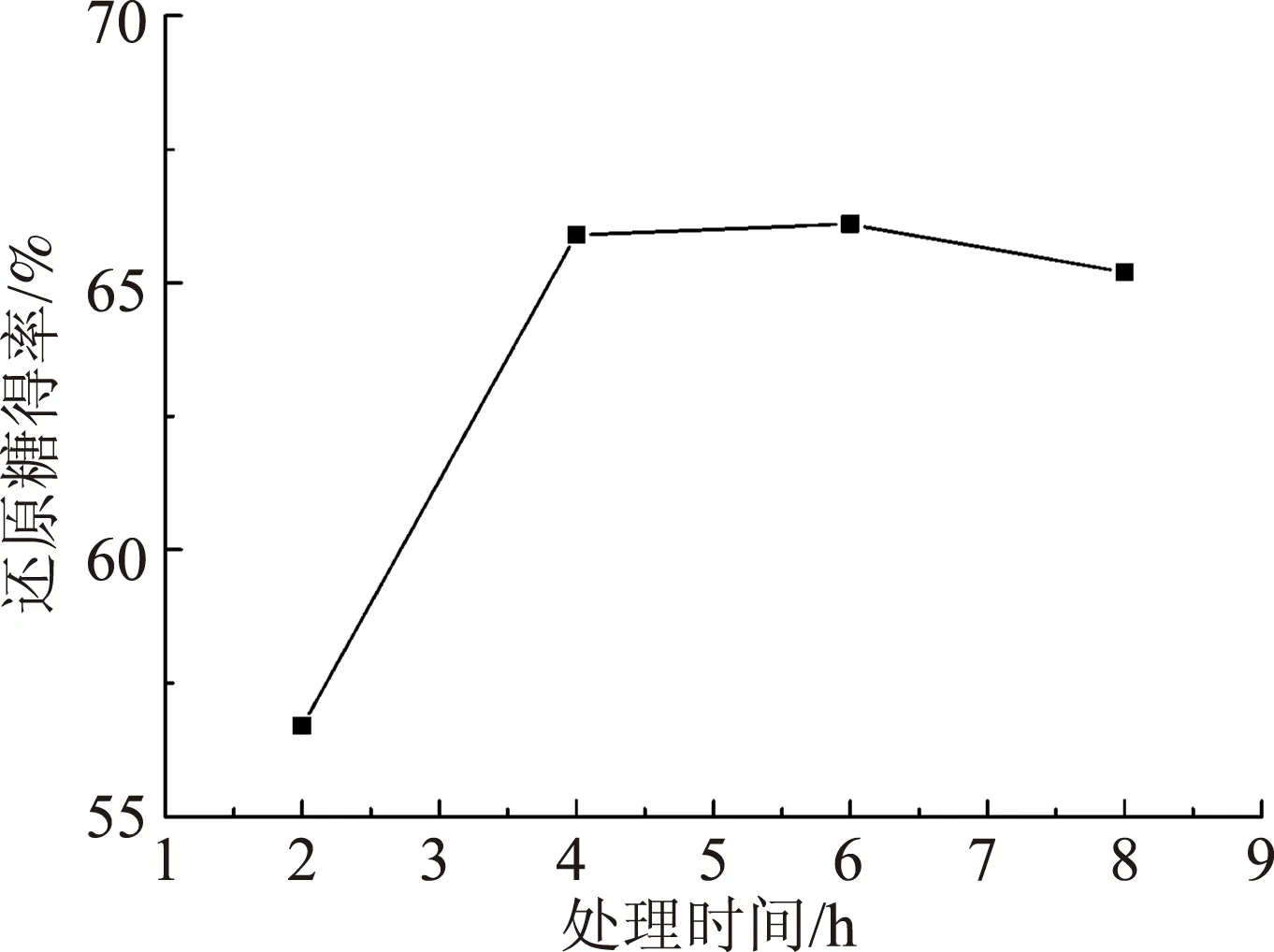
图3 处理时间对麦草酶解还原糖得率的影响
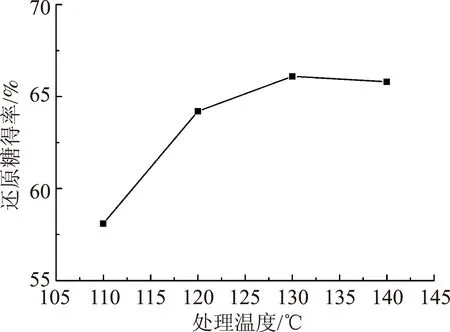
图4 处理温度对麦草酶解还原糖得率的影响
2.1.2处理时间
取绝干麦草粉2 g,按固液比1∶1.5加入离子液体[Emim]Ac,在预处理氧压0.4 MPa和温度120℃的条件下,改变预处理时间,探讨了不同预处理时间下麦草酶解还原糖的得率,预处理时间对麦草酶解还原糖得率的影响见图3。
从图3可以看出,在预处理时间2~4 h范围内时,酶解还原糖得率显著增加,4~6 h范围增加缓慢,当预处理时间超过6 h后,酶解还原糖得率有所降低,而且预处理底物颜色较深,因此处理时间不宜过长,6 h较适宜。
2.1.3处理温度
取绝干麦草粉2 g,按固液比1∶1.5加入离子液体,在氧压0.4 MPa和处理时间4 h的条件,改变处理温度,探讨了不同处理温度下麦草酶解还原糖的得率,处理温度对麦草酶解还原糖得率的影响见图4。
图4中数据表明,在110~130℃范围内,酶解还原糖得率增加明显,当处理温度为140℃时,酶解还原糖得率变化缓慢,因此,较适宜的处理温度为130℃。
实验结果表明,O2-[Emim]Ac预处理麦草较适宜条件为:氧压0.4 MPa,处理温度130℃,处理时间6 h。
2.2预处理对麦草各组分的影响
实验探讨了O2-[Emim]Ac预处理对麦草各组分及酶解还原糖得率的影响,结果见表1。

表1 预处理对麦草组分及酶解还原糖得率的影响 %
注氧压0.4 MPa,处理时间6 h,处理温度130℃。
由表1可知,麦草经O2-[Emim]Ac预处理后,纤维素含量由41.4%上升到61.2%,增加幅度为47.8%,半纤维素含量由23.6%下降到17.4%,降低幅度为26.2%,木素含量降低了35.1%。预处理后的麦草在纤维素酶用量30 U/g原料、酶解时间72 h条件下,酶解还原糖得率增加到65.1%,高于未经预处理的麦草酶解还原糖得率5倍多。在GONG[13]的研究中,单独碱处理麦草,当碱用量为4%时,酶水解率仅为39.9%,O2-[Emim]Ac预处理方法相对单独碱处理较大提高了麦草酶解效率。在预处理过程中由于采用了弱碱性离子液体和相对较低的温度(130℃),有效避免了纤维素的碱性水解和剥皮反应,使大部分高聚糖在预处理过程中保留下来。在O2氛围下,氧分子从碱性状态木素的酚氧负离子脱去电子,产生酚氧自由基,氧分子变成负离子自由基,然后进行一系列反应,木素发生降解。在反应体系中氧的负离子自由基可以转化成为一系列含氧活性反应因子,它们的存在是提高木素脱除的重要因素[14]。同时该反应是在一个弱碱环境下进行的,木素结构破坏的程度较小,因此较好的实现了木素与纤维素、半纤维素的分离。对于半纤维素而言,由于其具有分枝结构、大分子聚合度低、聚集态呈无定形等特征,相对于纤维素较易降解。O2-[Emim]Ac预处理脱除部分木素后,离子液体[Emim]Ac处理使其结晶度大大降低,无定形区增大,预处理后的麦草纤维暴露出更大的表面积,这些因素共同促进了酶解速率,使麦草酶解还原糖得率大幅提高。
2.3预处理前后麦草纤维表面形貌变化
预处理前后麦草纤维表面形貌变化见图5。
由图5可见,未经预处理的麦草纤维结构致密,表面覆盖有不规则的蜡质层,纤维表面较为光滑。而经O2-[Emim]Ac预处理后,麦草纤维表面出现粗糙、凹凸不平、多孔、疏松等现象,原因可能是O2氛围下,离子液体[Emim]Ac更加容易破坏纤维素内部氢键[15],有利于离子液体溶解麦草纤维,从而增加后续纤维素酶与麦草纤维的接触面积,提高酶解效率。

图5 预处理前后麦草纤维表面形貌变化
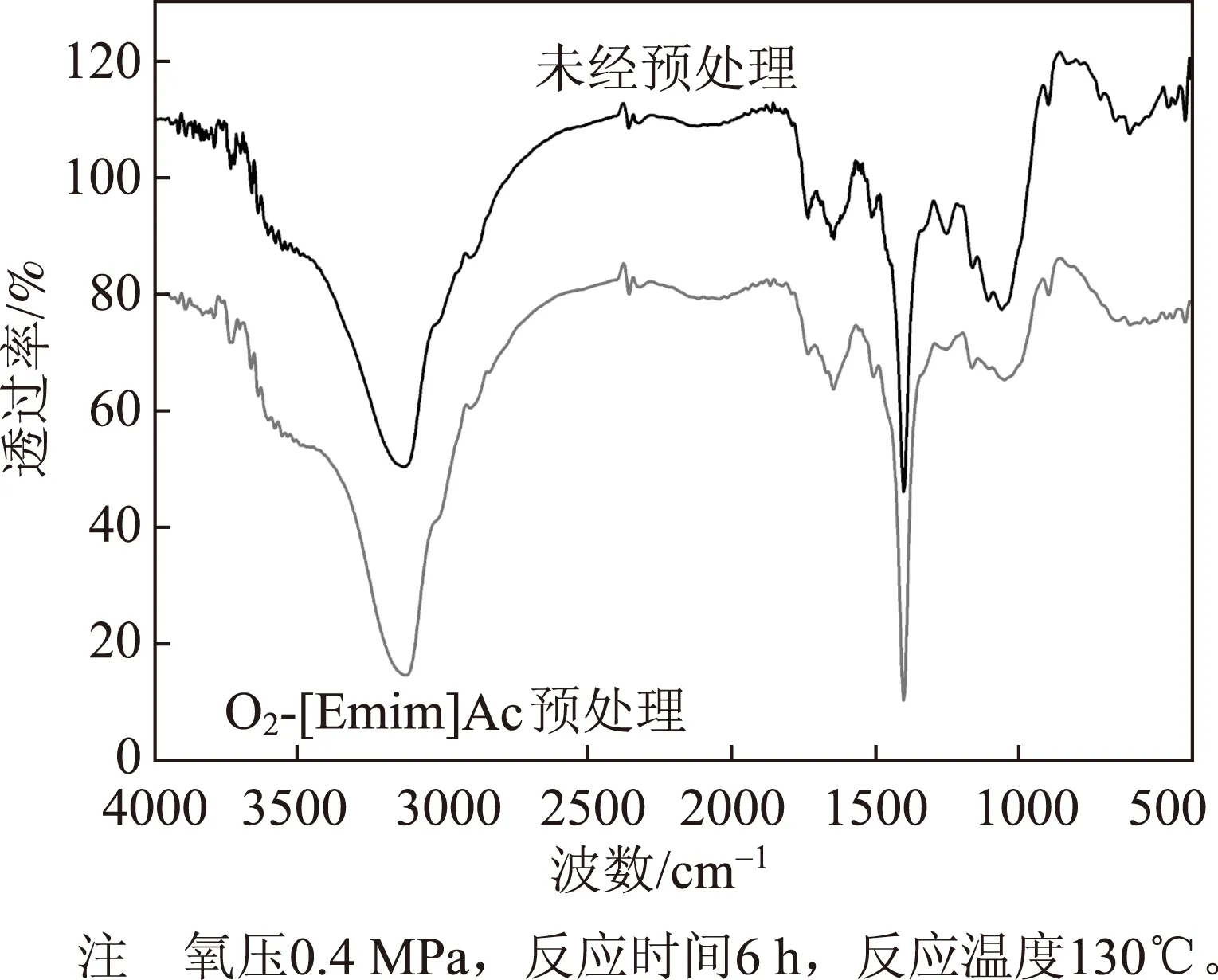
图6 预处理前后麦草的FT-IR谱图

吸收峰波数/cm-1基团振动说明3400~3500O—H伸展(氢键)振动3100~3400O—H伸展(氢键)振动2900C—H伸展振动1636H—O—H变形振动(吸附水)1596苯环伸展振动(木素)1506苯环伸展振动(木素)1426CH2剪(纤维素)、CH3弯曲(木素)、CO伸展振动(木素)1370芳环OH弯曲1319O—H平面内形变(纤维素)1282CO伸缩振动1160C—O—C不对称伸展振动(纤维素和半纤维素)1110O—H缔合光带(纤维素和半纤维素)1060C—O伸展振动(纤维素和半纤维素)1034CO伸展振动(纤维素、半纤维素和木素)898异头碳(C1)振动664OH面外弯曲
2.4傅里叶红外光谱(FT-IR)检测
利用FT-IR对预处理前后的麦草进行定性分析,FT-IR谱图见图6,麦草中各功能基团对应红外吸收峰值见表2。
由表2可知,3400、2900、1160 cm-1处分别代表纤维素分子中O—H伸缩振动、C—H伸缩振动、及C—O—C不对称伸缩振动,为纤维素的特征吸收峰,观察预处理前后麦草FT-IR谱图发现,在这三处仍有明显的吸收峰,只是峰的强度略有不同,这说明纤维素在反应过程中没有发生衍生化反应。在木素的苯环特征峰1596、1506和1426 cm-1处,吸收峰强度显著下降,这表明在预处理过程中,木素结构中的苯环发生了开裂。这可能是因为无论是自由基还是单线态氧,都具有强亲电性,而在木素结构中,苯环电子云密度大,且多与侧链形成π-π、P-π共轭,因此更容易发生反应造成价键断裂,使得木素降解成碎片[16]。木素的脱除有助于麦草纤维暴露出更大的表面积,利于后续酶解的进行。
2.5预处理对纤维素结晶度的影响
纤维结晶区是纤维分子间通过规则的氢键排列连接,总体表现出晶体的特征,计算纤维素结晶度的方法主要包括:X射线衍射、红外光谱法以及拉曼光谱法等,较常见的计算方法是利用X射线衍射,对纤维素Ⅰ结晶度用Segal经验法[17]计算。
式中,CI为结晶度;I002为纤维素结晶区衍射峰的衍射强度;Iam为无定形区衍射强度(对纤维素Ⅰ,2θ=18°)。
预处理前后麦草纤维的结晶度变化见图7。
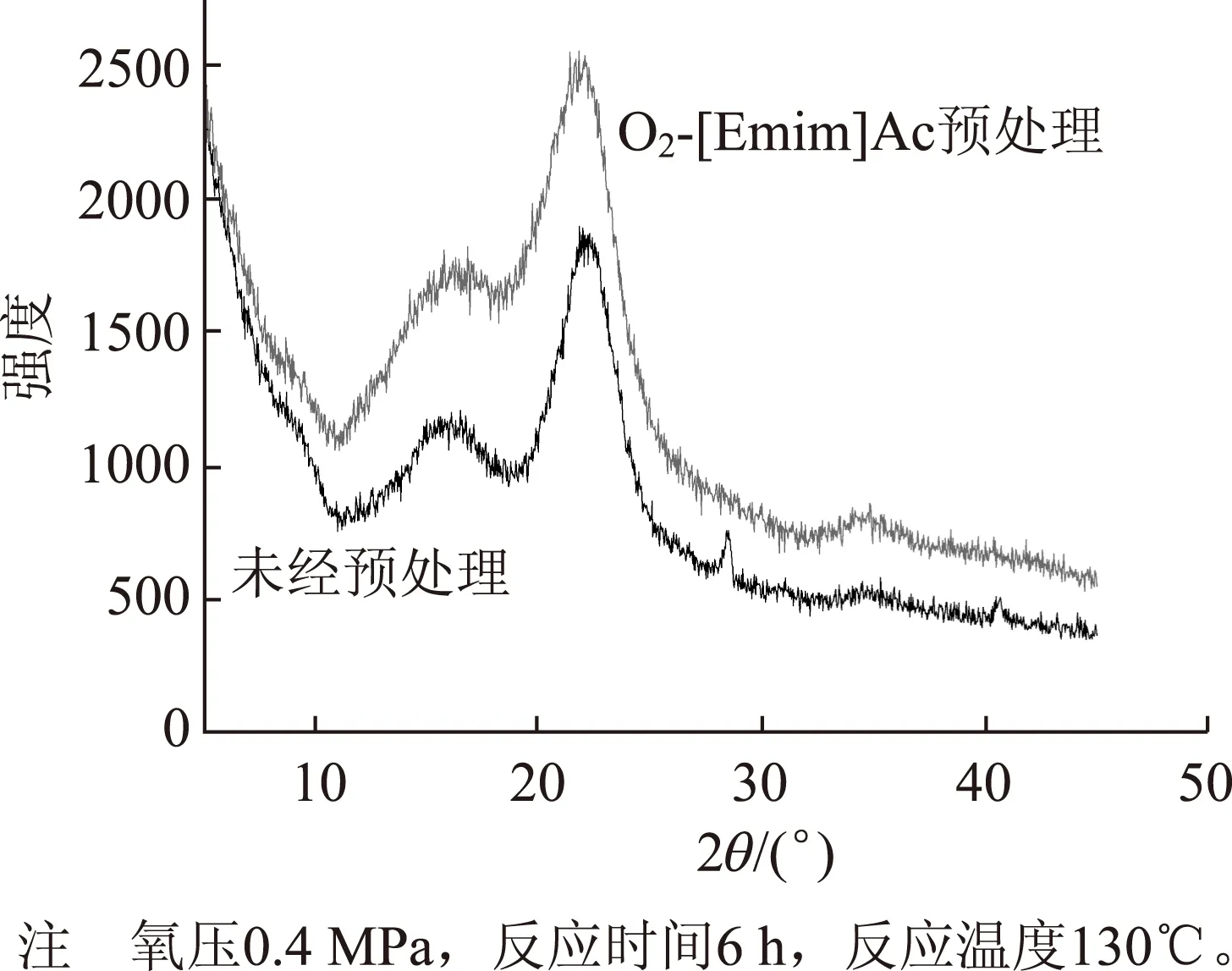
图7 预处理前后麦草纤维的结晶度变化
纤维素的结晶度是指纤维素构成的结晶区占纤维素整体的百分率,它反映纤维素聚集时形成结晶的程度[18]。由图7可知,未经预处理的麦草纤维结晶度为44.49%,经O2-[Emim]Ac预处理后麦草纤维结晶度为31.88%,结晶度降低了12.61%,纤维素结晶度的降低有利于纤维素酶水解,这也是预处理后麦草纤维酶水解效率提高的原因。
3 结 论
以麦草为原料,探讨了氧气(O2)-离子液体(1-乙基-3-甲基咪唑醋酸盐,[Emim]Ac)预处理工艺条件对麦草酶解效率的影响。
(1)在固液比1∶1.5条件下,O2-[Emim]Ac预处理麦草较适宜的条件为:处理温度130℃,氧压0.4 MPa,处理时间6 h。
(2)在温度130℃,氧压0.4 MPa,处理时间6 h的条件下预处理后,麦草酶解的还原糖得率为65.1%,高于未经预处理麦草酶解还原糖得率的5倍多。
(3)经O2-[Emim]Ac预处理后麦草纤维表面粗糙、多孔、疏松,纤维素结晶度降低了12.61%,纤维的可及度的提高和纤维结晶度的降低均有利于后续麦草纤维酶水解效率,进而表现出较高的酶解性能。
[1]Bemdesa G, Hoogwijkb M, Vail Den Broekc R. The contribution of biomass in the future global energy supply a review of 1 7 studies[J]. Biomass and Bioenergy, 2003, 25: 1.
[2]Mosier N, Elander R, Holtzapple M, et al. Features of promising technologies for pretreatment of lignocellulosic biomass[J]. Bioresour & Technol, 2005, 96: 673.
[3]Hendriks, Zeeman G. Pretreatments to enhance the digestibility of lignocellulosic biomass[J]. Bioresour & Technol, 2009, 100: 10.
[4]CAO Xiu-hua, RUAN Qi-cheng, LIN Hai-hong, et al. Progress of pretreatment of lognocellulosic materials for bioethanol production[J]. Plant Fiber Sciences in China, 2010(5): 293.
曹秀华, 阮奇城, 林海红, 等. 纤维燃料乙醇预处理技术研究进展[J]. 中国麻业科学, 2010(5): 293.
[5]ZHANG Xin, LIU Yan. Advance of Lignocelluloses Pretreatment Technology[J]. Journal of Cellulose Science and Technology, 2005(2): 54.
张鑫, 刘岩. 木质纤维原料预处理技术的研究进展[J]. 纤维素科技与技术, 2005(2): 54.
[6]MENG Zhuo, ZHENG Zheng, YANG Shi-guan, et al. Status Quo of Research on Pretreatment of Lignocellulose[J]. Sichuan Environment, 2007(4): 113.
孟卓, 郑正, 杨世关, 等. 木质纤维素原料预处理技术研究近况[J]. 四川环境, 2007(4): 113.
[7]Kim T H, Lee Y Y. Pretreatment and fractionation of corn stover by ammoniarecyle percolation process[J]. Bioresource Technology, 2005, 96(18): 2007.
[8]ZHAO Lü, LI Zhi-guang, LI Hui-yong, et al. Research Progress on Pretreatment Technologies of Lignocellulose[J]. Chemistry & Bioengineering, 2007, 24(5): 5.
赵律, 李志光, 李辉勇, 等. 木质纤维素预处理技术研究进展[J]. Chemistry & bioengineering, 2007, 24(5): 5.
[9]Stiether H, Ahmad S R, Ota M, et al. Effect of steam explosion pretreatment on pore size and enzymatic hydrolysis of poplar[J]. Applied Chenistry Biotechnology, 1978, 28: 296.
[10]Swatloski R P, Spear S K. Dissolution of cellulose with ionic Iiquids[J]. J. Am.Chem. Soc., 2002, 124(18): 4974.
[11]Hermanutz F, Gahr F, Uerdingen E, et al. New Developments in Dissolving and Processing of Cellulose in Ionic Liquids[J]. Macromol Symp, 2008, 262(1): 23.
[12]LI Feng-feng, CHEN Jia-chuan, PANG Zhi-qiang, et al. Influnece of Ionic Liquids Treatment on Enzymatic Bleaching Properties of Pulp[J]. Chemistry and Industry of Forest Products, 2015, 35(4): 79.
李凤凤, 陈嘉川, 庞志强, 等. 离子液体预处理对纸浆酶漂效果的研究[J]. 林产化学与工业, 2015, 35(4): 79.
[13]GONG Hai-yong. Enzymatic Hydrolysis of Wheat Straw Under Pretreatment of Ionic Liquid and Alkali Extraction[D]. Xi’an: Shaanxi University of Science & Technology, 2011.
巩海永. 碱-离子液体【BMIM】C1预处理对麦草酶水解糖化的影响研究[D]. 西安: 陕西科技大学, 2011.
[14]LI Feng-feng, CHEN Jia-chuan, ZHANG Zhi-li, et al. Solubility of Poplar Power in 1-Ethyl-3-methyl Imidazole Acelate[J]. Chemistry and Industry of Forest Products, 2015, 35(5): 22.
李凤凤, 陈嘉川, 张志礼, 等. 杨木粉在EmimAC离子液体中溶解性能的研究[J]. 林产化学与工业, 2015, 35(5): 22.
[15]Zhang Zhili, Chen Jiachuan, LI Feng-feng, et al. Study on Recovery Performance of Recycled Plant Fiber[J]. Paper and Paper Making, 2015, 34(3): 39.
张志礼, 陈嘉川, 李凤凤, 等. 再生植物纤维性能恢复的研究进展[J]. 纸和造纸, 2015, 34(3): 39.
[16]Zhang Zhili, Chen Jiachuan, Pang Zhiqiang, et al. Ionic Liquids as a New Platform for Fiber Brittleness Removal[J]. BioResources, 2015, 10(4): 6565.
[17]LIN Chun-xiang, ZHAN Huai-yu, LIU Ming-hua, et al. Homogeneous Graft Copolymerization of Cellulose Using an Ionic Liquid as a Reaction Medium[J]. China Pulp & Paper, 2009, 28(2): 32.
林春香, 詹怀宇, 刘明华, 等. 纤维素在离子液体中的均相接枝共聚[J]. 中国造纸, 2009, 28(2): 32.
[18]XU Yong-jian, WANG Jiao. Application of Ionic Liquids in the Pulp and Paper and the Cellulose Industries[J]. China Pulp & Paper, 2011, 30(6): 58.

(责任编辑:常青)
Improving Enzymatic Hydrolysis Efficiency of Wheat Straw by Oxygen-ionic Liquid [Emim]Ac Pretreatment
CHEN De-kunCHEN Jia-chuan*YANG Gui-huaWANG QiangJIA Ting-pengLIU Shan-shan
(KeyLabofPaperScienceandTechnologyofMinistryofEducation,QiluUniversityofTechnology,Ji’nan,ShandongProvince, 250353)
(*E-mail: chenjc@qlu.edu.cn)
The combined pretreatment of oxygen and ionic liquid [Emim]Ac to improve the enzymatic hydrolysis efficiency of wheat straw was investigated in this paper. Results showed that the optimal conditions were: ratio of solid to liquid 1∶1.5, oxygen pressure 0.4 MPa, temperature 130 ℃ and treatment time 6 h. Under such conditions, the reducing sugar yield of 65.1% was obtained at cellulase dosage of 30 U/g and enzymatic hydrolysis time 72 h, which was 5 times higher than the unpretreated raw material. Characterization of the treated wheat straw by SEM, XRD and FT-IR analysis showed that its surface became rough and porous, and the crystallinity decreased by 12.6%.
wheat straw; ionicoliquid; oxygen; enzymatic hydrolysis
陈德坤先生,在读硕士研究生;主要从事生物质资源化方面的研究。
2016- 01- 07(修改稿)
本课题得到国家自然科学基金(31270626,31270627,31370580,31470602)、山东省重大科技专项(2014ZZCX09101,2015ZDZX-09002)、泰山学者工程专项经费的资助。
陈嘉川先生,E-mail:chenjc@qlu.edu.cn。
TS721+.1
ADOI:10.11980/j.issn.0254- 508X.2016.06.007

