ESM-1乳腺癌组织中的表达及其临床意义
颜蕴文,徐晓军,陈 樱,张素梅,汪 渊,张敬杰
ESM-1乳腺癌组织中的表达及其临床意义
颜蕴文1,徐晓军1,陈 樱1,张素梅2,汪 渊2,张敬杰1
目的 研究内皮细胞特异性分子-1(ESM-1)作为敏感的分子标志物对乳腺癌预后的预测及复发的判断。方法
乳腺癌;分子标志物;内皮细胞特异性分子;预后
近些年来随着人们生活水平的提高,乳腺癌目前已经成为了女性最为常见的恶性肿瘤,多年来医学科研工作者一直致力于早期发现乳腺癌患者在长期随访过程中发生的转移复发,预测患者的长期预后的分子标志物,其中包括内皮细胞特异性分子-1(endothelial cell specific molecule-1,ESM-1),1996年克隆于人脐静脉内皮细胞cDNA文库,由法国巴士德研究所Lassalle et al[1-2]发现,其编码的蛋白质主要在血管内皮细胞表达,因此被称为ESM-1。既往利用组织芯片的方法大规模地检测ESM-1的表达,研究[3-5]显示ESM-1在许多类型的恶性肿瘤中都呈过表达,例如乳腺癌、甲状腺癌、肺癌、卵巢癌、肾癌和恶性淋巴瘤等,并且表达水平和疾病严重程度呈正相关性。该研究检测133例乳腺癌患者癌组织和癌旁组织ESM-1的表达,分析其临床意义。
1 材料与方法
1.1 病例资料 该实验是一项回顾性分析,入组患者均来源于安徽医科大学第一附属医院乳腺外科住院患者。共计133例。年龄29~68岁,中位年龄45岁。这些患者在2009年7月~2014年7月入住我科并接受乳腺癌根治性手术治疗,包括改良根治、保乳或者再造手术。这些患者在术前均未接受过新辅助化疗。所有的患者经病理证实为浸润性导管癌或导管内癌。良性对照取自10例良性乳腺疾病患者正常腺体组织,且组织取材于良性肿瘤患者,取材和病灶之间间隔1 cm。
1.2 切片准备 乳腺癌癌标本来源于2009年7月~2014年7月安徽医科大学第一附属医院乳腺外科手术切除的乳腺癌患者,同时取手术切除的切缘正常乳腺组织作为对照。标本经10%福尔马林固定后石蜡包埋,Leica切片机进行连续切片于均匀涂布了多聚赖氨酸的载玻片上,切片厚度约4 μm,将切片放入45℃漂烘仪内进行展片,待蜡片展平后进行裱片,然后将切片放置于60℃温箱3~5 h,使切片牢固粘贴于载玻片上,室温保存待检。
1.3 试验方法及流程 免疫组织化学染色法检测乳腺癌组织和正常乳腺组织中ESM-1蛋白的表达。石蜡切片放在80℃温箱中烤片(过夜),趁热入二甲苯Ⅰ浸泡10~15 min后置入二甲苯Ⅱ再次浸泡10~15 min,捞出切片置入无水乙醇(1~2 min)后再次浸入95%酒精(1~2 min)。将切片置于自来水冲洗,再用蒸馏水冲洗,小心置入0.01 mol/L柠檬酸缓冲液煮沸10 min修复抗原。玻片冷却后用PBS(pH 7.4)洗3遍,每次5 min,将玻片边上小心擦干后置入3%H2O2室温孵育10 min,取出再次PBS洗3遍,每次5 min,用于去多余的血清。在切片上加鼠抗人ESM-1单克隆抗体作为一抗,4℃孵育过夜。第2天取出玻片在37℃温箱中复温15~30 min,PBS洗3遍,每次5 min,加通用二抗,37℃孵育15 min,后再次PBS洗3遍,每次5 min,玻片上加HRP标记的链亲和素,37℃孵育15 min后PBS洗3遍,每次5 min,取适量DAB显色液滴加到切片上,显色10~15 min,显微镜下观察着色情况,以控制显色时间,后使用自来水冲洗,苏木精复染20~60 s,迅速取出置于自来水冲洗并放于自来水中返蓝5 min,用95%酒精10 min、100%酒精10 min脱水,二甲苯Ⅱ(透明),二甲苯Ⅰ(时间不定,镜下观察),最后看准标本位置在切片上滴加适量的中性树脂,盖上盖玻片封片(不要有气泡)。
1.4 结果判读 免疫组化结果使用NikonE800显微镜拍照观察。阴性对照组用磷酸盐缓冲液(PBS)代替一抗。结果判断:由两位高年资病理科医师进行双盲独立读片。阳性信号为棕褐色颗粒,用图像分析系统采集显微镜下图像。以细胞质出现黄色~棕黄色染色颗粒为阳性。以半定量方法进行判定。染色强度分级:(-)~(+)分为无表达;(┼┼)~(┼┼┼)为弱表达~阳性表达。
1.5 随访 随访区间是从患者治疗结束后开始直至患者死亡。因为非疾病因素引起的死亡,不纳入研究范围。随访时间为20~84个月,中位随访时间为46个月。随访采用电话随访方式,随访率达91%(121/133)。
1.6 统计学处理 使用SPSS 15.0软件进行分析,采用χ2检验比较分类数据。P<0.05为差异有统计学意义。
2 结果
2.1 ESM-1在不同乳腺病变的表达情况 ESM-1
蛋白在乳腺癌组织的癌细胞和血管内皮细胞表达,主要定位于癌细胞和血管内皮细胞的细胞质,少量定位于细胞核。阳性显影为棕黄色沉积。ESM-1强阳性表达可见于正常乳腺的上皮,在乳腺导管内癌的表达稍弱,在浸润性导管癌的表达最弱。见图1。
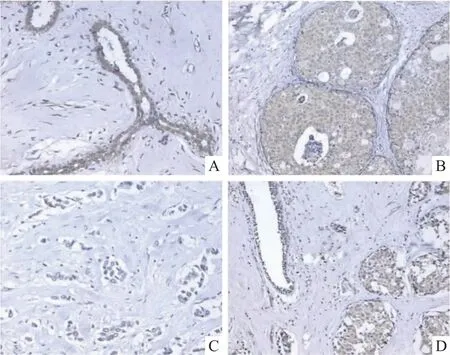
图1 ESM-1在正常乳腺组织和乳腺癌组织中的表达情况
2.2 入组患者随访结果 133例患者中,121例有效随访,这些患者1、3、5年的生存率分别为93%、87%、82%。这些患者也被分为ESM-1高表达组和不表达组。在高表达组中患者的1、3、5年生存率分别是100%、93%、88%。这组数据也说明了ESM-1的表达往往预示着患者有好的预后,可望成为一个新的分子标志物用于预测乳腺癌患者的生存。ESM-1低表达则往往预示着患者肿瘤的生物学行为差,对生存有着潜在的不良影响。见图2。
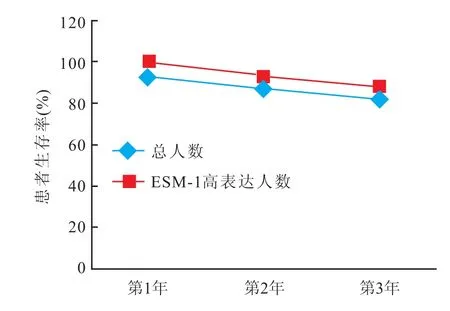
图2 患者生存率变化曲线
2.3 ESM-1的表达与临床常用肿瘤评价指标的关系 结果显示ESM-1的表达和乳腺癌的一些临床常用评价肿瘤的高危因素指标有相关性,肿瘤ø<2 cm组、2~5 cm组及>5 cm组间两两比较结果显示,ø<2 cm者ESM-1高表达率高于肿瘤ø2~5 cm者,且高于ø>5 cm组,仅有趋势,差异无统计学意义,人类表皮生长因子受体2(HER-2)高表达患者与低表达患者组间ESM-1表达差异有统计学意义(P<0.05)。有4例患者受体状况不祥,癌组织雌激素受体(ER)及孕激素受体(PR)阴性者ESM-1蛋白高表达率较ER及PR阳性者有降低的趋势,但差异无统计学意义;随着淋巴结转移及其数目的增加,ESM-1蛋白高表达率呈下降趋势,且差异有统计学意义(P<0.05);随着组织学分级的增高,ESM-1蛋白高表达率有降低趋势,但差异仅有趋势,差异无统计学意义,有待扩大样本量进一步分析。见表1。
3 讨论
乳腺癌是女性最常见的恶性肿瘤之一,发病率逐年增高,目前已占女性恶性肿瘤第一位,早期诊断的乳腺癌患者大部分都接受手术治疗,但是仍然有相当一部分患者会出现局部复发或远处转移。怎样在早期利用分子标志物的检测去筛出这一部分有复发转移倾向的患者,从而早期发现并进行治疗干预,是乳腺癌治疗中一个重要课题。既往研究[3,5]已经证实ESM-1在多种肿瘤发生、发展中的重要性,本研究对133例乳腺癌患者的标本进行了ESM-1的检测,显示ESM-1的表达与多种乳腺癌相关临床指标有相关性,特别是反应肿瘤负荷的指标如肿块大小、淋巴结转移数目等,对于肿瘤侵袭性指标如HER-2的表达亦有明显相关。入组患者中位随访46个月,最短20个月,最长84个月。ESM-1高表达患者生存率较总人群明显提高,这就表明了ESM-1低表达患者或许在随访过程中可以制定更严密的随访方案,通过增加随访频率或者检查项目早期发现可疑转移,从而提高患者总生存期及无病生存期。

表1 ESM-1在乳腺癌组织中的表达(n)
ESM-1表达调控受很多因素的影响,ESM-1合成和分泌受炎症细胞因子(如TNF-α和IL-1)[2]和血管内皮生成因子(如VEGF)[6-7]的调节,在肾癌中,ESM-1表达和VEGF表达水平相关[8],VEGF诱导ESM-1分泌,并且VEGF抗体剂量依赖性地抑制VEGF诱导的ESM-1表达[3]。ESM-1表达可以作为肿瘤内皮组织血管侵袭的标志物,可能参与肝细胞肝癌的进展[4,9]。以上结果均从不同角度说明ESM-1在许多肿瘤中高表达,并且其表达量和肿瘤恶性程度以及血管生成有关,ESM-1的高表达使肿瘤恶性程度和转移潜能增加。但是在对ESM-1与胃癌和结肠癌关系的研究中却显示与上述不一致的结果[10-11]。在结肠癌和胃癌组织中,ESM-1的表达量与正常结肠组织和胃组织比较呈明显降低,在本研究中也是同样的结论,乳腺组织中ESM-1的表达往往预示着良好的预后,而ESM-1在乳腺肿瘤中的作用机制尚不明确。
本研究表明,ESM-1在乳腺癌组织表达水平与患者的生存相关。临床常用于判断乳腺癌预后的相关因素,例如腋窝的转移、HER-2的扩增状况等,均代表着预后不佳,而这两者又与ESM-1的低表达有相关性,且差异有统计学意义,反之ESM-1的高表达预示着患者的预后佳。因此,ESM-1可能代表乳腺癌随访的一个新的分子标志物,或成为今后研发抗癌药品的新靶点。但鉴于ESM-1在乳腺癌发生、发展中的作用和机制尚不清楚。有必要对ESM-1在乳腺癌发生发展中发挥的作用进行进一步的实验探索,从而有更多的手段监管好乳腺癌患者的随访,有效延长患者的生存。
[1] Lassalle P,Molet S,Janin A,et al.ESM-1 is a novel human endothelial cell-specific molecule expressed in lung and regulated by cytokines[J].J Biol Chem,1996,271(34):20458-64.
[2] Bechard D,Gentina T,Delehedde M,et al.Endocan is a novel chondroitin sulfate/dermatan sulfate proteoglycan that promotes hepatocyte growth factor/scatter factor mitogenic activity[J].J Biol Chem,2001,276(51):48341-9.
[3] Grigoriu B D,Depontieu F,Scherpereel A,et al.Endocan expression and relationship with survival in human non-small cell lung cancer[J].Clin Cancer Res,2006,12(15):4575-82.
[4] Kang Y H,Ji N Y,Lee C I,et al.ESM-1 silencing decreased cell survival,migration,and invasion and modulated cell cycle progression in hepatocellular carcinoma[J].Amino Acids,2011,40(3):1003-13.
[5] Maurage C A,Adam E,Minéo J F,et al.Endocan expression and localization in human glioblastomas[J].J Neuropathol Exp Neurol,2009,68(6):633-41.
[6] Scherpereel A,Gentina T,Grigoriu B,et al.Overexpression of endocan induces tumor formation[J].Cancer Res,2003,63(18):6084-9.
[7] Abid M R,Yi X,Yano K,et al.Vascular endocan is preferentially expressed in tumor endothelium[J].Microvasc Res,2006,72(3):136-45.
[8] Aitkenhead M,Wang S J,Nakatsu M N,et al.Identification of endothelial cell genes expressed in an in vitro model of angiogenesis:induction of ESM-1,(beta)ig-h3,and NrCAM[J].Microvasc Res,2002,63(2):159-71.
[9] Chen L Y,Liu X,Wang S L,et al.Over-expression of the Endocan gene in endothelial cells from hepatocellular carcinoma is associated with angiogenesis and tumour invasion[J].J Int Med Res,2010,38(2):498-510.
[10]Kang Y H,Ji N Y,Han S R,et al.ESM-1 regulates cell growth and metastatic process through activation of NF-κB in colorectal cancer[J].Cell Signal,2012,24(10):1940-9.
[11]Lv Z,Fan Y,Chen H,et al.Endothelial cellspecific molecule-1:a potential serum marker for gastric cancer[J].Tumour Biol,2014,35(10):10497-502.
The expression and significance of ESM-1 in breast cancer tissues
Yan Yunwen,Xu Xiaojun,Chen Ying,et al
(Dept of Breast Surgery,The First Affiliated Hospital of Anhui Medical University,Hefei 230022)
Objective To investigate the endothelial cells specificity molecular-1(ESM-1)as a sensitive molecular markers to predict the prognosis and recurrence of breast cancer.Methods 133 cases of patients with breast cancer was selected.The expression of ESM-1 in breast cancer tissues and normal breast tissue were detected to analyze the correlation between endocan and the biological behaviors and prognosis of breast cancer.Results The results demonstrated that ESM-1 level was down-regulated in breast cancer tissue compared to normal breast tissue.Correlation analysis demonstrated that there were significant positive correlations between ESM-1 expression and survival rate,and HER-2 expression level and lymph node metastasis,the difference was statistically significant(P<0.05).Conclusion ESM-1 could act as a bio-marker in the diagnosis and prognosis judgment in breast cancer patients.ESM-1 high expression might be a predictor for prognosis.
breast cancer;bio-marker;ESM-1;prognosis
R 737.9
A
1000-1492(2016)08-1167-04
时间:2016-6-22 14:44:58
http://www.cnki.net/kcms/detail/34.1065.R.20160622.1444.042.html
2016-05-17 接收
国家自然科学基金(编号:81201907)
1安徽医科大学第一附属医院乳腺外科,合肥 230022
2安徽医科大学分子生物学实验室,合肥 230032
颜蕴文,女,博士研究生;
张敬杰,男,主任医师,责任作者,E-mail:13956948654@ yeah.net
选取133例乳腺癌患者石蜡标本,进行癌组织和癌旁组织切片,采用免疫组化法研究ESM-1蛋白的表达,分析ESM-1与肿瘤生物学行为及患者预后之间的关系。结果 ESM-1的表达在乳腺癌组织中弱,而在癌旁组织中强;在分期早的肿瘤中表达高于分期晚的肿瘤。ESM-1和乳腺癌的预后有着密切的关系,在腋窝转移阳性患者中ESM-1表达低于腋窝阴性患者且差异有统计学意义(P<0.05),人类表皮生长因子受体2(HER-2)过表达患者中ESM-1的表达低于HER-2无扩增患者,差异有统计学意义(P<0.05),其他相关因素差异无统计学意义。结论 ESM-1可以成为判断乳腺癌患者预后的一个分子标志物,ESM-1在组织中的高表达往往预示着该患者有较好的预后和长期的生存。

