益气活血通络方对高糖诱导的人脐静脉内皮细胞炎性因子表达的影响
王 芹,申国明,王 浩,何 莹,尤良震,叶 树,王 柳,姚永传
(1.安徽中医药大学中西医结合临床学院,安徽 合肥 230038;2.安徽中医药大学研究生院,安徽 合肥 230038)
·实验研究·
益气活血通络方对高糖诱导的人脐静脉内皮细胞炎性因子表达的影响
王芹1,申国明2,王浩1,何莹1,尤良震1,叶树1,王柳1,姚永传1
(1.安徽中医药大学中西医结合临床学院,安徽 合肥230038;2.安徽中医药大学研究生院,安徽 合肥230038)
目的研究益气活血通络方含药血清对高糖诱导的人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)炎性因子白细胞介素-1β(interleukin-1 beta, IL-1β)、肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α)、单核细胞趋化蛋白-1(monocyte chemoattractant protein-1, MCP-1)及金属基质蛋白酶-1(metal matrix proteinase-1, MMP-1)表达的影响,探讨益气活血通络方对脐静脉内皮细胞的保护作用。方法选择SD大鼠30只,中药灌胃,制备含药血清。体外培养HUVECs,MTT法检测不同时间点、不同浓度葡萄糖对细胞存活率的影响;将HUVECs随机分为5组,即空白对照组,模型组,益气活血通络方低、中、高浓度组,高糖刺激后,分别加入不同浓度益气活血通络方含药血清干预,收集上清及细胞,ELISA法检测IL-6的表达,Western Blot法测定IL-1β、TNF-α、MCP-1及MMP-1蛋白的表达。结果细胞培养48 h 后,33.3 mmol/L高糖组(模型组)细胞活力显著降低(P<0.05);高糖刺激可引起IL-6、IL-1β、TNF-α、MCP-1及MMP-1蛋白的高表达(P<0.05),益气活血通络方含药血清显著抑制IL-6、IL-1β、TNF-α、MCP-1及MMP-1蛋白的高表达(P<0.05)。结论益气活血通络方可抑制炎性因子的高表达,对高糖损伤的HUVECs有一定的保护作用。
糖尿病周围神经病变;益气活血通络方;人脐静脉内皮细胞;高糖;炎性因子
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是糖尿病所致神经病变中最常见的一种,患病率达到50%以上[1]。DPN的存在不但影响患者的生活质量,而且增加糖尿病患者足溃疡、坏疽、截肢的危险性,已成为导致糖尿病患者丧失劳动能力的主要原因之一。众多研究表明,DPN的发病机制非常复杂,与多种因素有关[2]。而炎症机制与DPN的联系紧密,在DPN的发生发展进程中起着重要作用[3]。已有研究[4]表明,DPN患者血清炎性因子(如白细胞介素、肿瘤坏死因子)水平有所增加。近年来,中医药治疗DPN得到了越来越广泛的认可,同时取得了较大的突破[5]。本课题组的前期研究结果[6-7]表明,益气活血通络方(原名芪归糖痛宁颗粒)可明显降低糖尿病大鼠炎性因子的水平,对DPN大鼠具有保护作用。DPN发病中神经供血障碍是造成周围神经损伤的一个重要因素[8],长期高血糖等因素刺激毛细血管管壁,使给予周围神经供血的毛细血管基底膜增厚,血管内皮细胞增生,血管逐渐透明变性,从而使糖化蛋白沉积,血管管腔狭窄,使其运输血氧能力下降,逐渐导致神经细胞缺血低氧,造成严重的周围神经慢性损害。一项近期的临床研究显示,DPN与血管病变密切相关[9],也提示它们存在共同的供血障碍机制。本研究观察益气活血通络方含药血清对高糖诱导的人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)炎性因子表达的影响,从蛋白表达水平探讨益气活血通络方对脐静脉内皮细胞保护作用的机制。
1 材料
1.1动物与细胞株SPF级雄性SD大鼠30只,体质量(275±25)g,由安徽医科大学实验动物中心提供,生产许可证号为SCXK(皖)2011-002。HUVECs购自复旦IBS细胞资源中心。
1.2药物与试剂益气活血通络方(黄芪30 g,鸡血藤15 g,当归、生地黄、葛根各12 g,威灵仙、延胡索各9 g,等):由安徽中医药大学第一附属医院制剂中心提供,批号 20151111。低糖DMEM培养基:美国HyClone公司;胎牛血清:德国Serana公司;胰蛋白酶:美国Sigma公司;白细胞介素-6(interleukin-6, IL-6)ELISA试剂盒:上海谷研实业有限公司;兔抗人白细胞介素-1β(interleukin-1 beta, IL-1β)、肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α)、金属基质蛋白酶-1(metal matrix proteinase-1, MMP-1)、单核细胞趋化因子-1(monocyte chemoattractant protein-1, MCP-1)抗体:英国Abcam公司;辣根过氧化物酶标记羊抗兔IgG:北京中杉金桥生物技术有限公司;D-葡萄糖、蛋白裂解液:北京Solarbio公司;BCA蛋白定量试剂盒:上海BestBio公司;MTT:Biosharp公司;DMSO:美国Sigma公司。
1.3仪器3111型-恒温CO2培养箱:美国Thermo公司;3K15-高速冷冻离心机:德国Sigma公司;SW-CJ系列洁净工作台(AIRTECH):江苏省苏州安泰空气技术有限公司;Multiskan MK2 型酶标仪:芬兰Labsystem公司;CX21FS1型光学显微镜:日本奥林巴斯公司;垂直板电泳装置:美国BIO-RAD公司;Protein simple FCM凝胶成像系统。
2 方法
2.1含药血清的制备取雄性SD大鼠30只,将其随机分为两组,分别为对照血清组和益气活血通络方含药血清组,每组15只。对照组灌胃生理盐水10 mL/kg,益气活血通络方含药血清组灌胃中药复方,以成人等效剂量的10倍给药,每次给药量为11.14 g/kg(以成人临床用药量×动物等效剂量比值×血清稀释度为参考给药量)。连续7 d,每天灌胃2次,间隔8 h,第7天上午灌胃2次,间隔2 h。于末次给药1 h后,腹腔注射3.5%水合氯醛进行麻醉,无菌条件下腹主动脉取血,室温静置1 h,3 000 r/min、15 min离心分离血清,56 ℃,30 min灭活,0.22 μm微孔滤膜过滤,1 mL无菌EP管分装后于-80 ℃保存备用。
2.2HUVECs的培养HUVECs用DMEM培养基(加有10%胎牛血清和终浓度皆为100 U/mL的青霉素及链霉素)置37 ℃、5% CO2培养箱中培养至融合状态,再用0.25%胰蛋白酶消化传代。采用培养的第2~4代内皮细胞,按每孔2×105个细胞左右接种于96孔或6孔微量反应板中继续培养,待贴壁后进行后续实验。
2.3MTT法检测不同浓度葡萄糖对细胞的影响细胞接种于96孔板后,置于恒温培养箱继续培养24 h,之后换用无血清的低糖DMEM培养液,使细胞处于静止状态,24 h后弃去DMEM培养液,然后随机分组加入不同浓度葡萄糖培养基继续培养。实验分5组:①葡萄糖浓度5.55 mmol/L;②葡萄糖浓度11.1 mmol/L;③葡萄糖浓度22.2 mmol/L;④葡萄糖浓度33.3 mmol/L;⑤葡萄糖浓度44.4 mmol/L。每组内分为3个时间点(12、24、48 h),每个时间点设6个复孔。细胞用不同浓度的葡萄糖培养基分别培养12、24、48 h后,每孔加入5 mg/mL的MTT溶液20 μL,继续培养4 h后小心吸取上清,弃之,每孔加入DMSO 150 μL,振荡10 min使结晶充分溶解,在酶标仪上于490 nm波长处检测各组吸光度(optical density, OD)值。细胞存活率=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
2.4分组及干预将HUVECs细胞悬液以2×105/mL浓度接种于6孔板中,加入含10% FBS的DMEM培养液在37 ℃、5% CO2培养箱中培养24 h,弃去上清液,换用无血清的低糖DMEM培养液培养24 h,使细胞处于静止状态。将细胞分为5组,即空白对照组,高糖模型组,益气活血通络方低、中、高浓度组,每组样本5个复孔。各组分别接受相应的干预方法。①空白对照组:培养液葡萄糖浓度为5.55 mmol/L,含空白对照组大鼠血清浓度15%,加入一定量的甘露醇平衡渗透压;②高糖模型组:培养液葡萄糖浓度为33.3 mmol/L,含空白对照组大鼠血清浓度为15%;③益气活血通络方低浓度组:培养液葡萄糖浓度为33.3 mmol/L,含药血清浓度为5%,空白对照组大鼠血清浓度为10%;④益气活血通络方中浓度组:培养液葡萄糖浓度为33.3 mmol/L,含药血清浓度为10%,空白对照组大鼠血清浓度5%;⑤益气活血通络方高浓度组:培养液葡萄糖浓度为33.3 mmol/L,含药血清浓度15%。于37 ℃、5% CO2培养箱中培养24 h后收集细胞。
2.5检测指标和方法收集细胞上清液,3 000 r/min离心10 min,取上清液,按ELISA试剂盒说明书检测IL-6的含量。收集细胞,加入含PMSF的细胞裂解液裂解细胞,收集细胞蛋白样品,蛋白浓度由BCA法检测,制备好的蛋白样品置-80 ℃冰箱保存备用。每泳道上样4 μL,经SDS-PAGE电泳后,电转膜至PVDF膜,室温封闭2 h,TBST洗涤3次,每次10 min,分别加入1∶500兔抗人IL-1β、TNF-α、MCP-1一抗及1∶1 000兔抗人MMP-1一抗,4 ℃摇床过夜,加入辣根过氧化物酶标记的羊抗兔二抗(1∶20 000),置室温作用2 h,TBST洗涤3次,每次10 min,滴入SuperSignal West Femto高灵敏度化学发光底物显影1 min,放入凝胶成像系统中进行拍照,用凝胶图像处理系统分析目标条带。
3 结果
3.1不同浓度葡萄糖作用不同时间对细胞活力的影响高糖会造成HUVECs的损伤,影响内皮细胞的生长活性,结果显示,11.1、22.2 mmol/L葡萄糖组细胞存活率在12~48 h内随培养时间的延长逐渐增高;33.3、44.4 mmol/L葡萄糖组细胞存活率在12~48 h内随培养时间的延长逐渐降低,且均呈时间-浓度依赖趋势。与同时间点空白对照组(5.55 mmol/L)相比,高糖组的细胞活力均明显下降(P<0.05);细胞培养48 h后,33.3 mmol/L葡萄糖组细胞存活率趋于50%,活力显著降低(P<0.01)。见表1。

表1 不同浓度葡萄糖作用不同时间对HUVECs细胞存活率的影响
注:与5.55 mmol/L葡萄糖组比较,*P<0.05;与33.3 mmol/L葡萄糖组比较,#P<0.05。
3.2ELISA法检测的各组HUVECs中IL-6表达水平比较用高糖刺激HUVECs后,可引起IL-6蛋白的高表达,与空白对照组比较,差异具有统计学意义(P<0.05)。与高糖模型组比较,益气活血通络方含药血清高浓度组可抑制IL-6蛋白的高表达(P<0.05)。见表2。

表2 益气活血通络方对高糖培养HUVECs中IL-6表达的影响
注:与高糖模型组比较,*P<0.05。
3.3Western Blot法检测的各组HUVECs中IL-1β、TNF-α、MCP-1及MMP-1表达水平比较用高糖刺激HUVECs后,引起IL-1β、TNF-α、MCP-1及MMP-1蛋白的高表达,与空白对照组比较,差异具有统计学意义(P<0.05)。与高糖模型组比较,含药血清显著抑制IL-1β、TNF-α、MCP-1及MMP-1蛋白的高表达,其中益气活血通络方低浓度对TNF-α、MCP-1表达,中浓度对IL-1β、TNF-α、MCP-1表达,高浓度对IL-1β、TNF-α、MCP-1、MMP-1表达的抑制作用均具有统计学意义(P<0.05)。见表3、图1。

表3 益气活血通络方对脐静脉内皮细胞IL-1β、TNF-α、MCP-1及MMP-1蛋白表达的影响
注:与空白对照组比较,*P<0.05;与高糖模型组比较,#P<0.05。
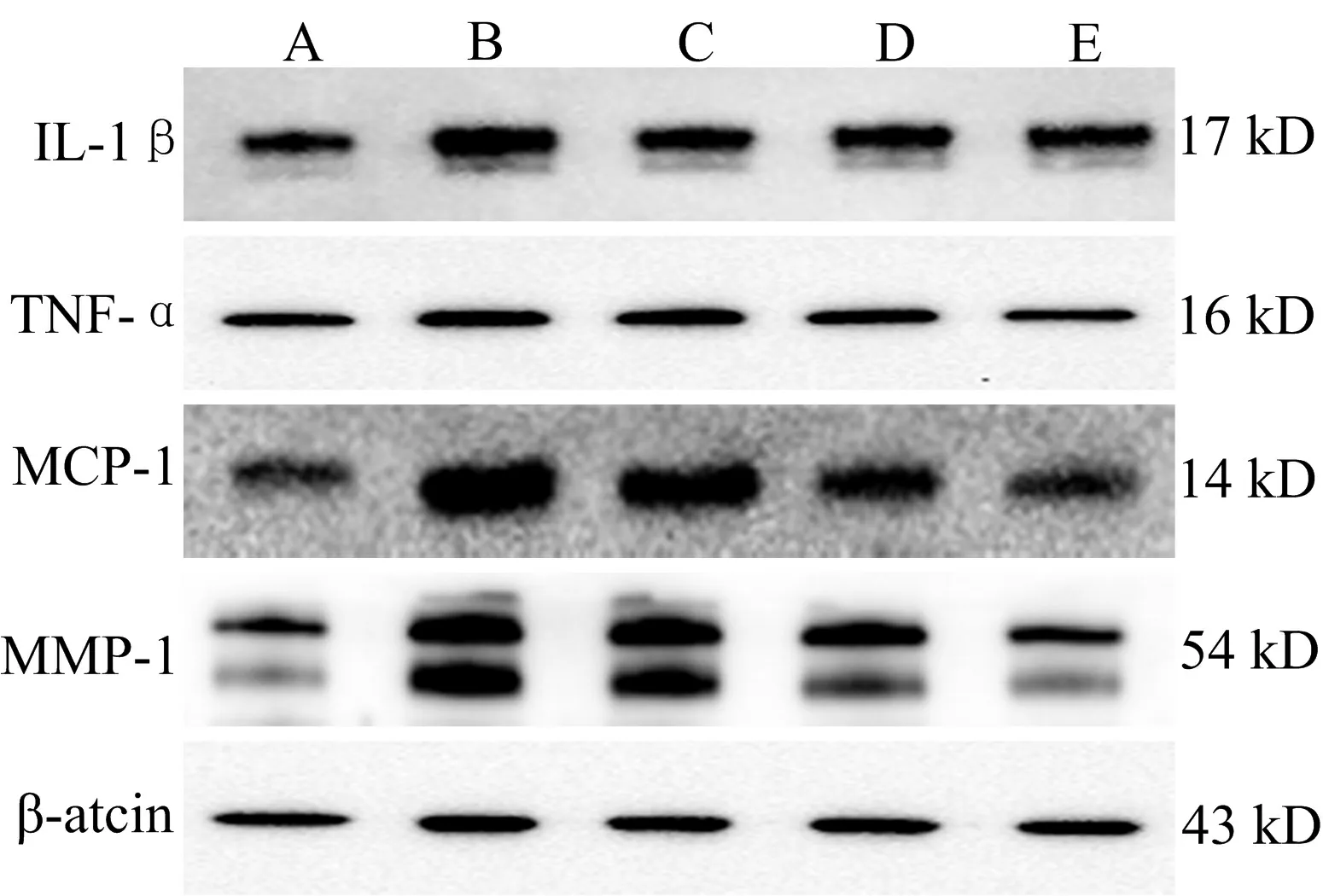
注:A.空白对照组;B.高糖模型组;C.益气活血通络方低浓度组;D.益气活血通络方中浓度组;E.益气活血通络方高浓度组。
图1益气活血通络方对高糖培养的HUVECs中IL-1β、
TNF-α、MCP-1及MMP-1表达的影响(Western blot法)
4 讨论
内皮细胞损伤、炎症机制在DPN的发生和发展中起着极为重要的作用。在DPN的发生、发展过程中,慢性炎性反应持续存在,一系列细胞因子,包括IL-1β、IL-6、TNF-α、MCP-1等,和蛋白酶(如基质金属蛋白酶类)通过直接或间接的方式在周围神经损伤与修复中发挥着极其复杂的作用,最终炎性信号通路激活,引发炎性级联反应,影响炎症的发生发展及预后,与糖尿病慢性并发症的发生发展及预后密切相关[10-12]。由于DPN发生发展过程中免疫和炎性反应贯穿始终,周围神经受损后,轴突出现变性,炎性反应和急性期反应过程中出现各种血浆蛋白和炎性细胞因子水平的变化[13],IL-1β、IL-6、TNF-α等细胞因子表达上调,一方面启动炎性级联反应,激活核转录因子,诱导细胞调亡[14];而另一方面炎性因子又可以刺激神经细胞启动自我保护机制,刺激胶质细胞分泌神经营养因子等,促进轴突修复[15]。MCP-1在绝大多数细胞包括系膜细胞和单核细胞中均有表达,对单核及巨噬细胞具有很强的趋化活性。既往研究[16-17]表明,在糖尿病周围神经病变患者的尿液及血液中,MCP-1的表达水平均明显增高,高水平的MCP-1能够诱导炎性细胞在组织的浸润,从而引起周围神经的损害。基质金属蛋白酶是参与细胞外基质代谢的一类重要的蛋白分解酶之一,在基质降解的过程起着重要的作用,而MMP-1可能参与相关组织细胞外基质的改建,使一系列组织重塑,研究[18]表明,糖尿病患者体内,MMP-1的表达显著升高。本项目组以HUVECs为研究对象,结果发现高糖刺激HUVECs,能诱导炎性因子和蛋白酶生成增多。
在病理、病机等方面,炎性反应与血瘀证之间都存在着密切的关系,在疾病的发生发展过程中,炎性因子体现出与血瘀证的相关性。孙丰雷等[19]研究显示,炎性反应参与糖尿病患者血瘀证的形成,活血化瘀方药可通过调节炎性因子水平起到防治糖尿病及其并发症的作用。袁肇凯等[20]研究证明,血瘀证与血管内皮细胞黏附分子的表达密切相关。还有一些与血瘀证相关的内皮因子,虽不直接参加炎性反应,但也可以间接影响炎性因子的释放,从而间接产生炎性反应。有研究[21]表明,益气活血通络中药能够有效抑制炎性因子的分泌。项目组选择一种治疗DPN的中药益气活血通络方,本方由黄芪、当归、生地黄、延胡索、葛根、鸡血藤、威灵仙组成。现代药理研究发现,黄芪可降低血糖,改善血液流变性和微循环,抗感染,增加免疫功能;当归、生地黄水煎液对多种致炎剂引起的急慢性炎症均有显著的抑制作用,其中生地黄水提取物能使外周血T淋巴细胞显著增加;鸡血藤具有改善血流动力学、调节免疫、升高白细胞等作用。本实验结果发现,体外培养的HUVECs在高糖条件下48 h,细胞活力明显下降,炎性因子的表达明显增多,而益气活血通络方各浓度组均能明显下调HUVECs炎性因子(IL-6、IL-1β、TNF-α、MCP-1)和蛋白酶MMP-1的高表达,且高浓度组效果更显著。结果表明益气活血通络方可以通过抑制炎性因子和蛋白酶的表达,从而减少内皮细胞的损伤以及各种炎性反应的发生,这可能是其保护脐静脉内皮细胞的作用机制之一。
[1]American Diabetes Association. Standards of medical care in diabetes-2016: Summary of Revisions[J]. Diabetes Care,2016,39 (1): S4-S5.
[2]Singh R, Kishore L, Kaur N. Diabetic peripheral neuropathy: current perspective and future directions[J]. Pharmacol Res,2014,80(5): 21-35.
[3]Pop-Busui R, Ang L, Holmes C, et al. Inflammation as a therapeutic target for diabetic neuropathies[J]. Curr Diab Rep, 2016,16(3): 29.
[4]Doupis J, Lyons TE, Wu S, et al. Microvascular reactivity and inflammatory cytokines in painful and painless peripheral diabetic neuropathy[J]. J Clin Endocrinol Metab,2009,94(6): 57-63.
[5]Chen W, Zhang Y, Li X, et al. Chinese herbal medicine for diabetic peripheral neuropathy[J]. Cochrane Database Syst Rev,2013,10(6):77-96.
[6]李道卫,申国明,王浩,等.芪归糖痛宁颗粒调节炎性因子预防糖尿病周围神经病变的机制研究[J].安徽中医药大学学报,2015,34 (5):61-64.
[7]季文博,高家荣,姜辉,等.芪归糖痛宁颗粒对糖尿病周围神经病变大鼠的保护作用[J].中药药理与临床,2012,28(6):113-115.
[8]Ergul A. Endothelin-1 and diabetic complications: focus on the vasculature[J]. Pharmacol Res,2011,63(6): 477-482.
[9]Kärvestedt L,Martensson E, Grill V, et al. Peripheral sensory neuropathy associates with micro- or macroangiopathy: results from a population-based study of type 2 diabetic patients in Sweden[J]. Diabetes Care,2009,32(2): 317-322.
[10]Gregor MF, Hotamisligil GS. Inflammatory mechanisms in obesity[J]. Annu Rev Immunol, 2011,29(3): 415-445.
[11]Greenfield JR, Campbell LV. Relationship between inflammation, insulin resistance and type 2 diabetes:cause or effect[J]. Curr Diabetes Rev,2006,2(2): 195-211.
[12]Muniandy S, Qvist R, Yan GO, et al.The oxidative stress of hyperglycemia and the inflammatory process in endothelial cells[J]. Med Invest,2009,56(1-2): 6-10.
[13]Chen P, Piao X, Bonaldo P. Role of macrophages in Wallerian degeneration and axonal regeneration after peripheral nerve injury[J]. Acta Neuropathol,2015,130(5):605-618.
[14]Liu YP, Lin HI, Tzeng SF. Tumor necrosis factor-alpha and interleukin-18 modulate neuronal cell fate in embryonic neural progenitor culture[J]. Brain Res,2005,1054(2): 152-158.
[15]Hristova M, Aloe L. Metabolic syndrome: neurotrophic hypothesis[J]. Med Hypotheses, 2006,66(3):545-549.
[16]Dworacka M, Iskakova S, Krzyzagórska, et al. Alpha-lipoic acid modifies circulating angiogenic factors in patients with type 2 diabetes mellitus[J]. Diabetes Res Clin Pract,2015,107(2):273-279.
[17]Michalowska WG, Adamcewicz G, Wender M. Impact of cytokines on the pathomechanism of diabetic and alcoholic neuropathies[J]. Folia Neuropathol,2007,45(2):78-81.
[18]Tahrani AA, Zeng W, Shakher J, et al. Cutaneous structural and biochemical correlates of foot complications in high-risk diabetes[J]. Diabetes Care,2012,35(9):1913-1918.
[19]孙丰雷,郎江明,魏爱生,等.糖尿病血瘀证病人血清IL-6和sIL2R水平的研究[J].中西医结合心脑血管病杂志, 2004,12(2):683-684.
[20]袁肇凯,黄献平,谭波,等.冠心病血瘀证血管内皮细胞功能的检测分析[J].中国中西医结合杂志,2006,26(5):407-410.
[21]杨扬,刘冬梅,田风胜,等.活血通络中药的抗炎机制探讨[J].中西医结合心脑血管病杂志,2013,11(11):1372-1373.
[22]方朝晖,赵进东.芪归糖痛宁颗粒治疗糖尿病周围神经病变临床观察[J].中医药临床杂志,2012,24(2):126-128.
[23]范丽红,舒仪琼.芪归糖痛宁颗粒治疗糖尿病周围神经病变的疗效观察[J].陕西中医学院学报, 2014,37(1):26-28.
[24]张心怡.芪归糖痛宁颗粒治疗糖尿病性周围神经病变的临床观察和研究[D].合肥:安徽中医药大学,2014.
Effect of Yiqihuoxuetongluo Prescription on Expression of High Glucose-induced Inflammatory Factors in Human Umbilical Vein Endothelial Cells
WANGQin1,SHENGuo-ming2,WANGHao1,HEYing1,YOULiang-zhen1,YEShu1,WANGLiu1,YAOYong-chuan1
(1.ClinicalSchoolofIntegratedTraditionalChineseandWesternMedicine,AnhuiUniversityofChineseMedicine,AnhuiHefei230038,China; 2.GraduateSchoolofAnhuiUniversityofChineseMedicine,AnhuiHefei230038,China)
ObjectiveTo observe the effect of serum containing Yiqihuoxuetongluo Prescription on the expression of high glucose-induced inflammatory factors, interleukin-1β (IL-1β), tumor necrosis factor-α (TNF-α), monocyte chemoattractant protein-1 (MCP-1), and metal matrix proteinase-1 (MMP-1), in human umbilical vein endothelial cells (HUVECs), as well as the protective effect of Yiqihuoxuetongluo Prescription on HUVECs. MethodsA total of 30 Sprague-Dawley rats were treated with Yiqihuoxuetongluo Prescription by gavage to prepare the serum containing Yiqihuoxuetongluo Prescription. HUVECs were culturedinvitro, and the MTT method was used to investigate the influence of various concentrations of glucose on the survival rate of cells at different time points. HUVECs were randomly divided into blank control group, model group, and low-, medium-, and high-dose Yiqihuoxuetongluo Prescription groups. After high glucose stimulation, serum containing Yiqihuoxuetongluo Prescription of various concentrations was added, and the supernatant and cells were collected. ELISA was used to measure the expression of interleukin-6 (IL-6), and Western blot was used to measure the expression of IL-1β, TNF-α, MCP-1, and MMP-1. ResultsAfter 48 hours of cell culture, the 33.3 mmol/L high glucose group (model group) showed a significant reduction in cell viability (P<0.05). High glucose stimulation caused high expression of IL-6, IL-1β, TNF-α, MCP-1, and MMP-1 (P<0.05), and serum containing Yiqihuoxuetongluo Prescription significantly inhibited the high expression of IL-6, IL-1β, TNF-α, MCP-1, and MMP-1 (P<0.05). ConclusionYiqihuoxuetongluo Prescription can inhibit the high expression of inflammatory factors and has a certain protective effect against high glucose damage in HUVECs.
Diabetic peripheral neuropathy; Yiqihuoxuetongluo Prescription; Human umbilical vein endothelial cell; High glucose; Inflammatory factor
国家自然科学基金项目(81273646)
王芹(1990-),女,硕士研究生
申国明,shengm_66@163.com
R587.2;R285.5[DOI]10.3969/j.issn.2095-7246.2016.05.020
2016-05-31;编辑:姚实林)

