HSQC-TOCSY技术对罗汉果甜苷类化合物结构解析的应用
韦英亮,潘杨桂,张思敏
(广西壮族自治区分析测试研究中心,广西 南宁 530022)
HSQC-TOCSY技术对罗汉果甜苷类化合物结构解析的应用
韦英亮,潘杨桂,张思敏
(广西壮族自治区分析测试研究中心,广西 南宁 530022)
探讨了采用HSQC-TOCSY技术,并结合1H-1H COSY、HSQC、HMBC等二维谱技术对罗汉果甜苷V(Mogroside V)的13C、1H化学位移进行归属的方法。结合1H-1H COSY、HSQC、HMBC等二维谱技术,HSQC-TOCSY技术可以方便快捷地对罗汉果甜苷类化合物的13C、1H化学位移进行明确归属。
HSQC-TOCSY;罗汉果甜苷;结构解析;2D NMR
二维HSQC-TOCSY(Heteronuclear Single Quantum Coherence-Total Correaltion Spectroscopy)实验是一种混合反演实验,由初始的HSQC(heteronuclear singular quantum correlation)脉 冲 和 随 后 的TOCSY(total correlation spectroscopy)混合脉冲序列组成。同核TOCSY所用的脉冲序列为90°Φ-t1-tm检测[1]。根据同核Hartmann Hahn机理,TOCOSY实验中的混合脉冲序列也可用于异核接力相关试验,混合时间的长短决定相关传递的键的数目。混合期可以是单个脉冲,也可以是组合脉冲。在采集之前插入一个各向同性的混合序列(MLEV、WALTZ或DIPSI)[2]。第一步,通过1J(CH)磁化首先从X核(13C或者15N)转移至直接键合的质子核。第二步,通过J(HH),该磁化逐步贯穿整个耦合的核自旋网络。该实验在任何配备反式探头的光谱仪都容易实现。
应用HSQC-TOCSY技术,只要自旋系统内有一个氢和一个碳的NMR信号与其他系统不重叠,就有可能将各个不同的自旋系统区别开,并对谱线进行归属。当复杂分子具有若干独立的自旋系统而在某些区域里谱峰严重重叠时,该方法可较好地分辨各个不同自旋系统内的氢核。罗汉果甜苷类化合物甙元部分多为四环三萜结构,而糖基部分往往具有多个糖单元,由于各个自旋系统间的化学位移接近,这类化合物的NMR图谱、谱峰重叠,难以解析,给结构鉴定带来了很大的困难。之前罗汉果甜苷糖基部分结构确定常用NOE差谱[3-5],此类化合物的13C、1H化学位移尚未得到明确归属。
1 实验部分
1.1 样品
罗汉果甜苷V (Mogroside V type structure),是从葫芦科植物罗汉果的新鲜果实(Siraitia grosvenorii)中分离得到的葫芦烷型四环三萜皂甙,分子式为C60H102O29,结构式为罗汉果醇-3-O-(β-D-葡萄吡喃糖基(1-6)-β-D-葡萄吡喃糖基)-24-O-(β-D-葡萄糖吡喃糖基(1-2)-β-D-葡萄糖吡喃糖基(1-6)-β-D-葡萄糖吡喃糖基,糖基部分由5个葡萄吡喃糖基组成。分子结构见图1。
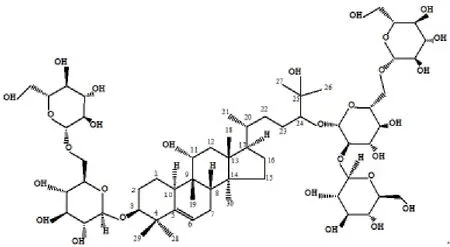
图1 罗汉果甜苷V结构式Fig.1 The structure of Mogroside V
1.2 核磁共振试验
Bruker AV-600超导核磁共振仪,600.13MHz(1H)和150.95MHz(13C),将待测样品溶解在氘代吡啶,以四甲基硅烷(TMS)作内标,于室温下用Φ5mm反相探头(TXI)进行测定。
HSQC-TOCSY实验:采用的数据矩阵为512× 1024,F1和F2维均采用余弦窗函数,零填充至1024×1024进行FT变换,常规2D图谱相敏方式相位校正。混合时间采用120ms,每个t1累加64次。
2 结果与讨论
利用1HNMR、13CNMR、HSQC、HMBC、1H-1H COSY初步确定了基本结构,但是其糖部分无法正确归属CH信号,因而测试HSQC-TOCSY谱。
2.11HNMR
1HNMR谱图显示,低场区观察到5个糖的端基质子信号δ5.52(1H,d,J=7.74Hz)、δ5.17(1H,d,J=7.74Hz)、δ4.92(1H,d,J=7.26Hz)、δ4.87(1H,d,J=7.68Hz)、δ4.82(1H,d,J=7.74Hz),耦合常数显示5个糖基构型均为β构型;1个双键质子信号δ5.48(1H,d,J=5.58Hz);δ4.57~δ3.91为环质子信号,共显示有30个质子信号。但是δ4.57~δ3.91信号重叠比较严重,不易区分;δ3.76~δ2.20为甙元环上各质子信号,信号分离效果好,没有相互重叠,但是δ2.15~δ1.61信号又产生重叠。高场区观察到6个甲基质子信号δ1.52(3H,s)、δ1.47(3H,s)、δ1.34(6H,s)、δ1.10(3H,s)、δ1.09(3H,s)、δ0.92(6H,d,J=8.28 Hz)。
2.213CNMR和 DEPT (Distortionless ehancement by Polarization Transfer)
13CNMR谱图显示60个碳信号。双键碳信号δ144.33(C)和δ118.39(CH)分别归属于甙元的C5和C6位碳信号;δ106.96(CH)、δ105.36(CH)、δ105.32(CH)、δ104.80(CH)、δ103.73(CH)为5个糖的端基信号;δ82.00~δ62.51之间有25个糖环连氧碳信号,其中δ70.23(CH2)和δ70.13(CH2)显示糖基之间存在2个6-1连接信号,δ82.00(CH)显示存在1个2-1连接信号;δ87.48(CH)和δ92.27(CH)是甙元苷化位置特征,分别归属于甙元的C3和C24位碳信号。
2.31H-1H COSY (1H-1H correlation spectroscopy)
从δ5.52(1H,d,J=7.74Hz)与δ4.11相 关,δ5.17(1H,d,J=7.74Hz)与δ4.07相关,δ4.92(1H,d,J=7.26Hz)与δ4.21相关,δ4.87(1H,d,J=7.68Hz)与δ4.04相关,δ4.82(1H,d,J=7.74Hz)与δ3.93相关,初步确定5个糖环1,2位化学位移,由于各个糖环上质子信号重叠较为严重,要进一步确定连接顺序较为困难。
2.4 HSQC(Heteronuclear Single Quantum Coherence)
借助HSQC中 5个糖的端基质子信号,δ5.52(1H,d,J=7.74Hz)与δ105.36(CH)相关,δ5.17(1H,d,J=7.74Hz)与δ105.32(CH)相 关,δ4.92(1H,d,J=7.26Hz)与δ103.73(CH)相关,δ4.87(1H,d,J=7.68Hz)与δ104.80(CH)相 关,δ4.82(1H,d,J=7.74Hz)与δ106.96(CH)相关。烯氢δ5.48(1H,d,J=7.5.58Hz)与烯碳δ118.38(CH)相关,δ4.91(1H,d,J=8.85Hz)、δ4.78(1H,d,J=11.63Hz)、δ4.36(4H,m)以及δ3.98(3H,m)与δ70.23(CH2)和δ70.13(CH2)相 关;δ4.53(3H,m)、δ4.36(4H,m) 与 δ63.52CH2)、δ62.69CH2)、δ62.51CH2)相关;δ4.11与δ72.45相 关,δ4.07与δ71.42相关,δ4.21与δ82.00相关,δ4.04与δ75.21相关,δ3.93与δ78.00相关。
2.5 HMBC(Heteronuclear Multiple Bond Correlation)
δ5.51(1H,d,J=7.74Hz)与δ82.00(CH)远程相关,与碳谱存在1个2-1连接信号[δ82.00(CH)]相印证。δ5.17(1H,d,J=7.74Hz)与δ70.13(CH2)远程相关,与碳谱存在2个6-1连接信号其中1个为δ70.13(CH2)相印证,同时端基质子δ5.17(1H,d,J=7.74Hz)还与环上3位碳δ78.68远程相关。端基质子δ4.92(1H,d,J=7.74Hz)与24位碳原子δ92.27远程相关。δ4.87(1H,d,J=7.68Hz)与δ70.23(CH2)远程相关,印证了碳谱另外的1个6-1连接信号δ4.82(1H,d,J=7.74Hz)与3位碳δ87.48(CH)远程相关。
利 用1HNMR、13CNMR、1H-1H COSY、HSQC、HMBC等技术初步确定了基本结构,但是其5个葡萄糖分子如何连接与分配,以及其环上的CH信号无法正确归属,因而测试HSQC-TOCSY谱。
2.6 HSQC-TOCSY(Heteronuclear Single Quantum Coherence-Total Correaltion Spectroscopy)
2.6.1 3-位取代糖环结构分析
HSQC-TOCSY谱中,以甙元C-3为起点,内侧糖端基δ106.96与端基氢δ4.82(1H,d,J=7.74Hz)的相关峰出发,沿碳谱和氢谱方向做直线从低场往高场。碳谱方向有δ 106.96、δ78.42、δ77.21、δ75.20、δ70.23;由此得出3位两个葡萄糖以6-1方式进行连接。氢谱方向有δ4.82、δ4.19、δ4.08、δ3.93。末端糖端基δ105.32与端基氢δ5.17(1H,d,J=7.74Hz)的相关峰出发,沿碳谱和氢谱方向做直线从低场往高场,碳谱方向有δ 105.32、δ78.50、δ78.21、δ75.92、δ71.64;氢谱方向有δ5.17、δ4.26、δ4.18、δ3.96。
2.6.2 24-位取代糖环结构分析
HSQC-TOCSY谱中,以甙元C-24为起点,内侧糖端基δ103.7(Glc`-C-1)与端基氢δ4.92(1H,d,J=7.62Hz,Glc`-H-1)的相关峰出发,沿碳谱和氢谱方向做直线从低场往高场,碳谱方向有δ103.73、δ82.00、δ78.68、δ77.94、δ70.13,由此可以确定24位末端两个葡萄糖的连接顺序分别为2-1和6-1方式;氢谱方向有δ4.26、δ2、δ3.98。末端(6-1)糖端基δ105.36与端基氢δ5.52(1H,d,J=7.74Hz)的相关峰出发沿碳谱和氢谱方向做直线从低场往高场,碳谱方向有δ105.36、δ78.46、δ78.32、δ76.39、δ72.45,氢谱方向有δ4.27、δ4.08。末端糖端基(2-1)δ104.80与端基氢δ4.86(1H,d,J=7.62Hz,Glc`-H-1)的相关峰出发,沿碳谱和氢谱方向做直线从低场往高场,碳谱方向有δ104.80、δ78.32、δ78.00、δ75.32、δ71.42,氢谱方向有δ4.27、δ4.08。罗汉果甜苷V 糖环部分HSQC-TOCSY谱见图2,糖环HSQC-TOCSY耦合关系见表1,13C、1H化学位移归属见表2。

图2 罗汉果甜苷V 糖环部分HSQC-TOCSY谱Fig.2 The HSQC-TOCSY spectrum of Mogroside V glycosyl
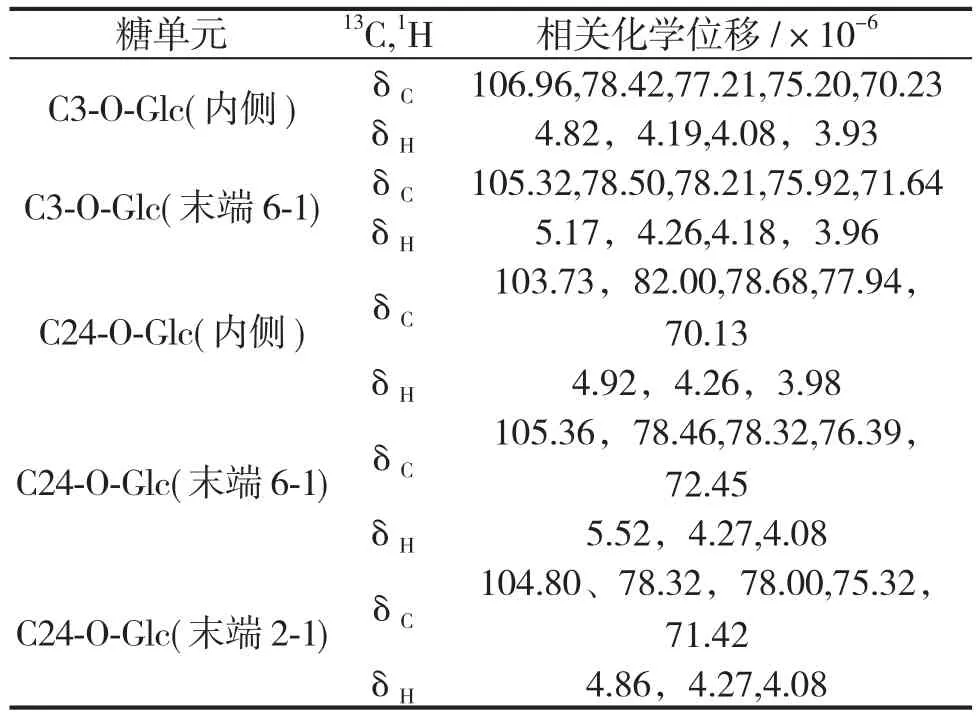
表1 罗汉果甜苷V糖基HSQC-TOCSY耦合关系Table1 HSQC-TOCSY coupling relationship spetrum of Mogroside V glycosyl
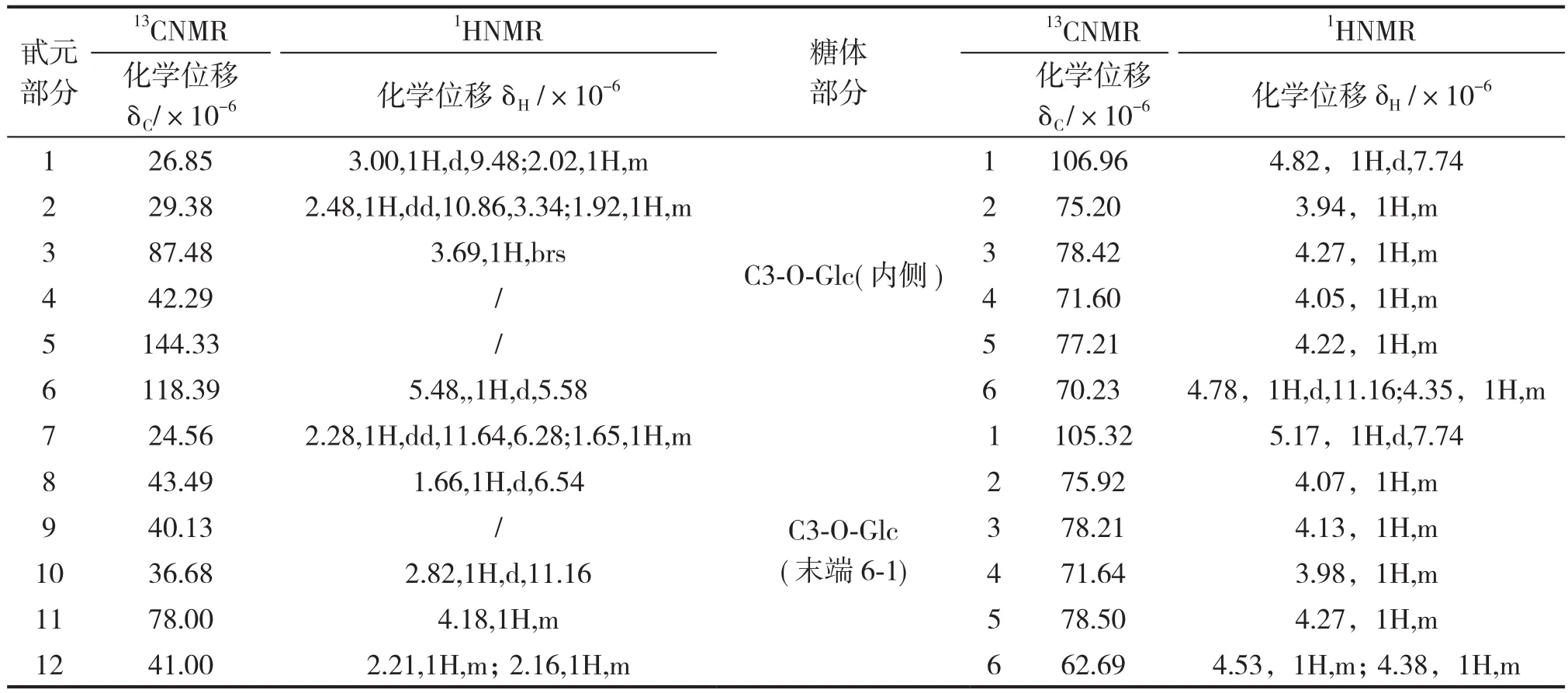
表2 罗汉果甜苷V1H、13C化学位移归属Table 11H,13C chemical shift assignment to Mogroside V
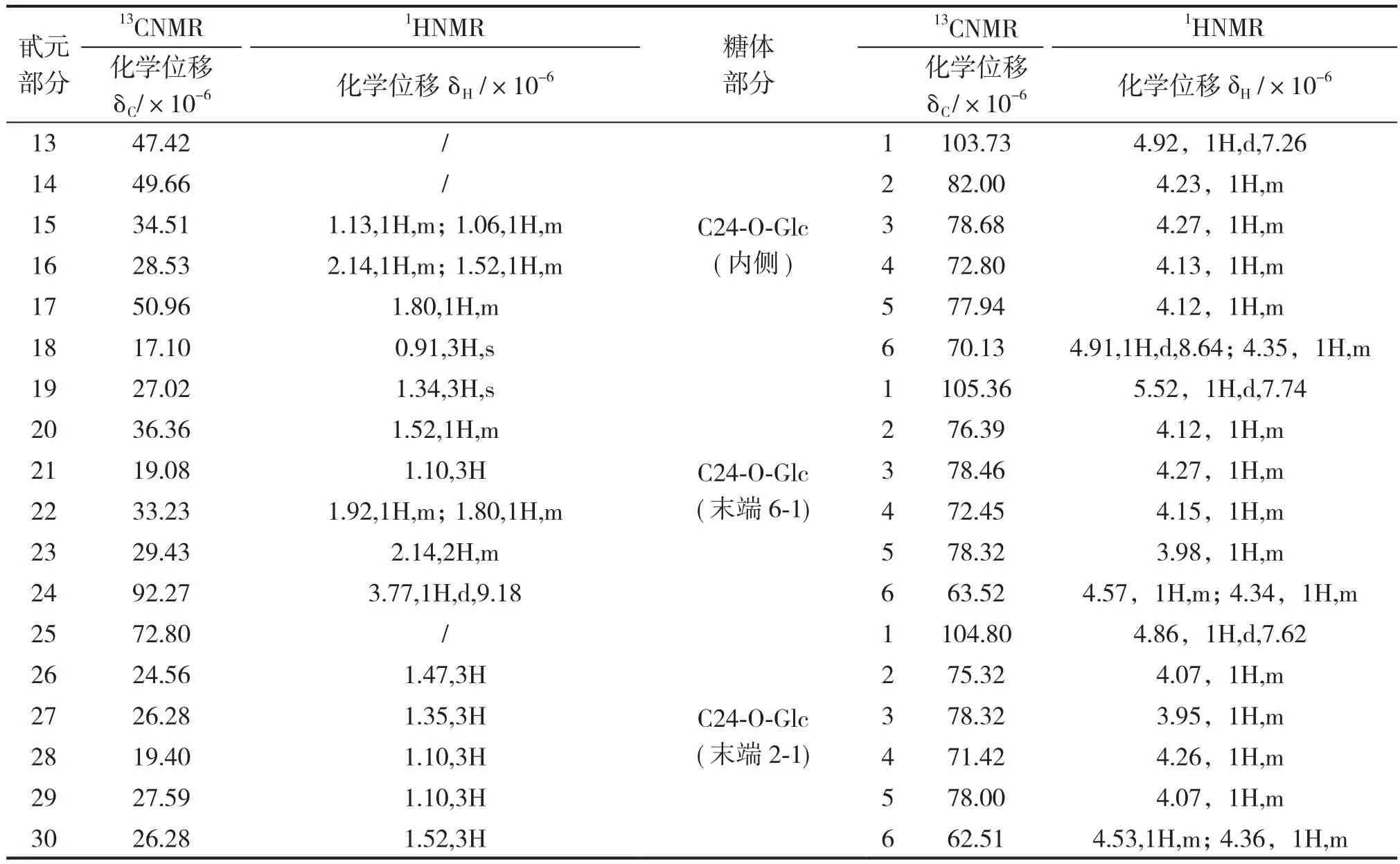
甙元部分13CNMR1HNMR化学位移δC/×10-6化学位移δH/×10-613CNMR1HNMR 糖体部分 化学位移δC/×10-6化学位移δH/×10-613 47.42 /1 103.73 4.92,1H,d,7.26 14 49.66 / 2 82.00 4.23,1H,m 15 34.51 1.13,1H,m;1.06,1H,m 3 78.68 4.27,1H,m 16 28.53 2.14,1H,m;1.52,1H,m 4 72.80 4.13,1H,m 17 50.96 1.80,1H,m 5 77.94 4.12,1H,m 18 17.10 0.91,3H,s 6 70.13 4.91,1H,d,8.64;4.35,1H,m 19 27.02 1.34,3H,s C24-O-Glc(内侧)1 105.36 5.52,1H,d,7.74 20 36.36 1.52,1H,m 2 76.39 4.12,1H,m 21 19.08 1.10,3H 3 78.46 4.27,1H,m 22 33.23 1.92,1H,m;1.80,1H,m 4 72.45 4.15,1H,m 23 29.43 2.14,2H,m 5 78.32 3.98,1H,m 24 92.27 3.77,1H,d,9.18 6 63.52 4.57,1H,m;4.34,1H,m 25 72.80 / C24-O-Glc(末端6-1)1 104.80 4.86,1H,d,7.62 26 24.56 1.47,3H 2 75.32 4.07,1H,m 27 26.28 1.35,3H 3 78.32 3.95,1H,m 28 19.40 1.10,3H 4 71.42 4.26,1H,m 29 27.59 1.10,3H 5 78.00 4.07,1H,m 30 26.28 1.52,3H 6 62.51 4.53,1H,m;4.36,1H,m C24-O-Glc(末端2-1)
3 结论
罗汉果甜苷类化合物多为含多个糖的化合物,且糖的种类多为单一的葡萄糖,因此糖质子化学位移重叠特别严重,但是每个糖单元的端基氢和端基碳的NMR信号与其他系统不重叠,应用HSQCTOCSY技术,就能相对简单地将各个不同的自旋系统区别开,并对谱线进行归属。但由于TOCSY实验不能揭示标量偶合核之间磁矢量的传递过程,得到的谱图不能区分直接或接力两种相关峰[6],因此,有必要测定13C-1H相关谱(HSQC或HMBC),对比两谱可以区分直接或接力两种相关峰。应用HSQCTOCSY,再结合1H-1HCOSY、HSQC和HMBC实验,就可以对每个自旋系统内的氢核和碳核进行全归属[7]。HSQC-TOCSY技术为确定单个糖环内质子的化学位移提供了更多信息,能有效解决一维谱图中碳氢峰交叉重叠的问题,运用HSQC-TOCSY技术结合其他2D NMR技术,能够较好地对罗汉果甜苷类化合物进行1H、13C化学位移明确归属。由于实验HSQC-TOCSY在任何配备反式探头的光谱仪就能实现,因此HSQC-TOCSY技术作为解决独立直旋系统中复杂分子结构的有力手段,将会被广泛使用。
[1] BRAUNSEHWEILER L,ERNET R R. Coherence transfer by isotropicmixing:application to proton correlation spectroscopy[J].J.Magn Reson,1983(53): 521-528.
[2] BAX A,DAVIS D G. MLEV-17-based two-dimensional homonuclear magnetization transfer spectroscopy homonuelear magnetization transfer spectroscopy[J].J.Magn Reson, 1983(65): 355-360.
[3] MATSUMOTO K ,KASAI R ,OHTANI K, et al. Minocucurbitaneglycoside from fruits of Siraitia grosvemrrii (Cucurtaceae)[J]. Chem Pharm Bull, 1990(38): 2030-2032.
[4] KASAI R, NIE Ru-Lin, NASHI K, et al. Sweet cucurbtitaneglycosides from fruits of siraitua(chi-zi luo han-guo) a Chinese folk mediine[J]. Agric Biol Chem., 1989(53): 3347-3349.
[5] 斯建勇,陈迪华,常琦,等.罗汉果中三萜甙的分离和结构测定[J].植物学报,1996,38(6):489-494.
[6] 李文,丛悦,姜涛,等. HSQC-TOSY技术在黄酮苷类中的应用[J].中药研究与信息,2005(10):16-18.
[7] 王强,刘二伟,王磊,等.HSQC-TOCSY技术对一种多糖三萜皂苷应用解析[J].波谱学杂志,2013,30(3): 387-397.
Application of HSQC-TOCSY Technology to Structure Analysis of Mogrosides
WEI Ying-liang, PAN Yang-gui, ZHANG Si-min
(Guangxi Zhuang Autonomous Region Analysis and Tes ting Research Center, Nanning 530022, China)
Combined with H-H cosy, HSQC, HMBC two-dimensional spectrum technology, HSQC-TOCSY technology were used to explore the13C and1H chemical shifts of the mogroside V. The13C,1H chemical shifts of mogrosides had clear attribution by HSQCTOCSY technology, two-dimensional H-H COSY, HSQC and HMBC spectrum technology.
HSQC-TOCSY; mogroside V; structure analysis; 2D NMR
环保与三废利用
O 652
A
1671-9905(2016)10-0049-04
广西壮族自治区直属公益性科研院所基本科研业务费专项资助(2013ACZ07)
韦英亮(1982-),女,工程师,主要研究方向:有机分析。E-mail:wyl3903895@163.com.
2016-08-01

