猪传染性胸膜肺炎放线杆菌血清6型PCR方法的建立及初步应用
李海利,徐引弟,朱文豪,张青娴,游一,郎利敏,王克领,张立宪,侯自花
(河南省农业科学院畜牧兽医研究所,河南郑州450002)
猪传染性胸膜肺炎放线杆菌血清6型PCR方法的建立及初步应用
李海利,徐引弟,朱文豪,张青娴,游一,郎利敏,王克领,张立宪,侯自花
(河南省农业科学院畜牧兽医研究所,河南郑州450002)
为了建立猪传染性胸膜肺炎放线杆菌血清6型分子鉴定方法,本研究根据胸膜肺炎放线杆菌从编码荚膜多糖的碱基序列设计1对引物,扩增特异性的720 bp核酸片段。结果表明,以APP为模板,均能扩增出与预期一致的1条720 bp核酸片段,所得PCR产物经测序,与GenBank已发表的胸膜肺炎放线杆菌血清型6型的同源性达99%以上。本研究建立了PCR检测猪传染性胸膜肺炎放线杆菌血清6型分子鉴定方法,该方法的建立为猪传染性胸膜肺炎放线杆菌病的诊断和防治及鉴定提供了基础。
猪传染性胸膜肺炎;放线杆菌;血清6型
猪传染性胸膜肺炎(Porcine contagious pleuropneumonia,PCP)是由胸膜肺炎放线杆菌(Actinobacillus pleuropneumoniae,APP)引起的猪的一种高度接触性致死性的呼吸道传染病,居于呼吸道疾病的首位[1]。世界各地均有发生,以欧、美州、中国等各国流行[2-3]。本病的主要临床特征为纤维素性肺炎、出血性肺炎、坏死性肺炎、胸腔积液、心包炎等,多成最急性或急性病程而迅速致死。各种年龄的猪只均可感染,以断奶猪和育成猪多发。规模化和集约化猪场,一旦发生本病很难彻底根除和净化,给养殖户造成重大的经济损失[4]。进年来,世界各地均加强了呼吸道疾病的防控措施,尤其是对APP的研究,在病原学、流行病学、血清学、诊断、疫苗和免疫预防等方面均取得了较大的进展。根据APP在生长过程中是否需要辅酶Ⅰ,将APP分为依赖生长因子NAD的生物Ⅰ型和不依赖生长因子NAD的生物Ⅱ型,Ⅰ型比Ⅱ型毒力强。Ⅰ型又分为12个血清型,其中5型又分为a、b两个亚型,Ⅱ型有2个血清型。各个血清型之间无交叉保护或有很弱的交叉保护。各个血清型都可引起发病,但不同血清型的毒力有明显差异。临床中1、3、5、6、9和11六种血清型毒力最强,发病率也较高,常常引起较高的死亡率和严重的经济损失[5-8]。本试验对APP血清6型PCR程序和分子鉴定进行了研究,为APP的分子血清型诊断、流行病学调查及防控提供依据。
1材料与方法
1.1DNA回收试剂盒,TaqDNA聚合酶、dNTP、MgCl2、2×Buffer、NAD等,购自宝生物工程(大连)有限公司。APPⅠ型至12型阳性血清,购自中国兽医药品监察所。脑心浸液琼脂(含10%犊牛血清和100 μg/mL NAD),购自青岛海博生物技术有限公司。
1.2菌株把临床分离保存的菌株从-80℃的冰箱中取出,用75%酒精脱脂棉球擦净安培瓶,用火焰加热器顶端,滴少量无菌水使之破裂,用无菌镊子敲下已破裂的顶端。接种于脑心浸液琼脂(含10%犊牛血清和100 μg/mL NAD)平板上,置于体积分数为5%CO2培养箱中培养24 h,提取单菌落进行纯化培养。
1.3细菌血清型鉴定取纯培养的细菌,制备适宜浓度的细菌菌悬液,与不同血清型APP标准阳性血清进行平板凝集试验,观察凝集现象,确定分离菌的血清型。
1.4PCR分子鉴定(1)APP基因组提取及模板制备:将胸膜肺炎放线杆菌接种于脑心浸液琼脂(含10%犊牛血清和100 μg/mL NAD)平板上,置于体积分数为10%CO2培养箱中培养24 h,按细菌基因组提取试剂盒(LifeFeng Cat#DK622-01)进行DNA的提取;(2)PCR引物:从编码荚膜多糖的碱基序列设计引物。上游引物5′-AGTATGGCAATCAGTCGATTCAT-3′,下游引物3′-CGTAATCGGAAACGCCATTCTC-5′。预期扩增片段为720 bp;(3)PCR反应条件的优化:①最适模板用量的确立:分别以5、10、15、20、25、30、35、40、45、50、55、60 ng DNA为模板,进行PCR扩增反应,确定最佳的模板用量;②最适引物用量的确立:在50 μL PCR反应体系中分别加入不同用量的引物,上下游引物(25 pmol/μL)分别加0.5、0.7、1.0、1.2、1.4、1.6、1.8、2.0 μL,进行PCR扩增反应,确定最佳的引物用量;③最适退火温度的确立:PCR反应的退火温度分别取50、51、52、53、54、55、56、57、58、59、60℃,进行PCR扩增反应,确定最佳的退火温度;(3)PCR扩增反应条件:根据上面试验确定的最适模板用量为30 ng 0.5 μL,最适引物用量为1.4 μL(25 pmol/μL),最适退火温度为56℃,确定的PCR反应体系为:反应总体积为50 μL,无菌超纯水37.2 μL,2×Buffer(Mg+)5.0 μL,dNTPS 4.0 μL(2.5 mmol/μL),上游引物1.4 μL(25 pmol/μL),下游引物1.4 μL(25 pmol/μL),Taq enzyme 0.5 μL(5 U/μL),模板0.5μL。PCR扩增程序为:95℃预变性3 min,94℃变性1 min,56℃退火1 min,72℃延伸1 min,32个循环,最后72℃延伸10 min;(4)PCR扩增产物的检测及回收:取5 μL扩增产物和5 μL Loading Buffer混匀,加到含EB的1.5%的琼脂糖凝胶中,120 V,电泳25 min,在凝胶成像仪中观察(图1)。用(UNIQ-10)柱式DNA胶回收试剂盒(上海生工生物工程技术服务有限公司)回收胸膜肺炎放线杆菌PCR扩增产物;(5)PCR产物的连接:将回收的PCR产物分别与pUCm-T载体按T-载体PCR产物克隆试剂盒(上海生工生物工程技术服务有限公司)方法连接;(6)大肠杆菌感受态细胞的制备、连接产物的转化及蓝白斑筛选:应用一步法制备高效感受态细胞试剂盒(上海生工生物工程技术服务有限公司)方法操作;(7)质粒DNA的提取、酶切鉴定及阳性克隆测序:按照质粒DNA提取试剂盒(上海生工生物工程技术服务有限公司)进行操作,将上一步酶切鉴定的阳性克隆重组质粒,送上海生工生物工程技术服务有限公司测序。用Applied Biosystems(3730XL)测序仪测序。
1.5临床应用应用本试验建立的PCR检测方法供检测临床送检的疑似分离病料18份,对阳性扩增产物进行序列测定。
2结果与分析
2.1细菌血清型菌株的纯培养物分别与Ⅰ型~12型APP标准阳性血清进行平板凝集试验,结果发现,分离到的15株菌均与标准6型阳性血清呈现明显的凝集现象,与其他标准阳性血清和生理盐水对照均不发生凝集反应。凝集试验结果表明,分离到的15株菌均为胸膜肺炎放线杆菌血清6型。
2.2PCR产物的检测、克隆及测序PCR产物经凝胶电泳,然后在凝胶成像仪中观察(图1)。
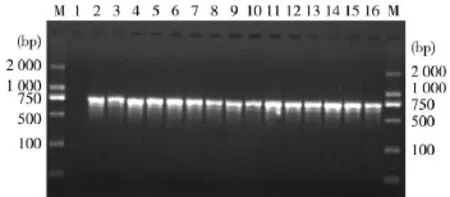
图1猪胸膜肺炎放线杆菌PCR产物电泳结果
从图1可以看出,以APP为模板,均能扩增出与预期一致的1条720 bp核酸片段,而猪肺炎支原体没有扩增出该片段。
所得PCR产物经测序,与GenBank已发表的胸膜肺炎放线杆菌血清型6型的同源性达99%以上。
2.3临床应用应用本研究建立的PCR检测方法检测临床送检的疑似分离病料16份,结果显示,检出的阳性样品9份(图2),将阳性样品的PCR扩增产物克隆后序列分析显示均为猪传染性胸膜肺炎放线杆菌6型。
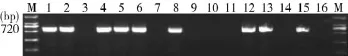
图2临床样品检测
3讨论
PCP以突然发病、纤维素性肺炎、肺部出血、胸腔积液、局部肺部坏死和肺炎为主要特征。该病在猪群暴发后,引起猪只生长缓慢、饲料报酬降低等。目前,该病是引起猪呼吸道疾病最主要的疾病之一,给养猪业造成严重的经济损失。用药后,容易产生耐药性,停药后往往容易复发,带菌猪会成为再次感染的传染源。疫苗免疫是控制此病的首选,但APP血清型较多,各个血清型之间没有或有较弱的交叉保护,这给本病的防控带来了困难。并且每一个疫苗并不能保护所有的血清型。所以开展各个地区的流行病学调查,摸清各个地区的流行情况和主要血清型,制备适合当地的血清型疫苗,可以有效的预防和控制本病的传播和流行。
[1]Dayao D A,Gibson J S,Blackall P J,et al.Antimicrobial resistance in bacteria associated with porcine respiratory disease in Australia[J].Vet Microbiol,2014,171(1-2):232-235.
[2]Tobias T J,Klinkenberg D,Bouma A,et al.A cohort study on Actinobacillus pleuropneumoniae colonisation in suckling piglets[J]. Prev Vet Med,2014,114(3-4):223-230.
[3]Yoo A N,Cha S B,Shin M K,et al.Serotypes and antimicrobial resistance patterns of the recent Korean Actinobacillus pleuropneumoniae isolates[J].Vet Rec,2014,174(9):223.
[4]Shin M K,Kang M L,Jung M H,et al.Induction of protective immune responses against challenge of Actinobacillus pleuropneumoniae by oral administration with Saccharomyces cerevisiae expressing Apx toxins in pigs[J].Vet Immunol Immunopathol,2013,151(1-2):132-139.
[5]Seo K W,Kim S H,Park J,et al.Nasal immunization with major epitope-containing ApxIIA toxin fragment induces protective immunity against challenge infection with Actinobacillus pleuropneumoniae in a murine model[J].Vet Immunol Immunopathol,2013,151(1-2):102-112.
[6]Oh Y,Ha Y,Han K,et al.Expression of leucocyte function-associated antigen-1 and intercellular adhesion molecule-1 in the lungs of pigs infected with Actinobacillus pleuropneumoniae[J].J Comp Pathol,2013,148(2-3):259-265.
[7]Li L,Sun C,Yang F,et al.Identification of proteins of Propionibacterium acnes for use as vaccine candidates to prevent infection by the pig pathogen Actinobacillus pleuropneumoniae[J].Vaccine,2013,31(45):5269-5275.
[8]Vanni M,Merenda M,Barigazzi G,et al.Antimicrobial resistance of Actinobacillus pleuropneumoniae isolated from swine[J].Vet Microbiol,2012,156(1-2):172-177.
Actinobacillus pleuropneumoniaeserotype6 PCR program optimization and molecular identification
LI Hai-li,XU Yin-di,ZHU Wen-hao,ZHANG Qing-xian,YOU Yi,LANG Li-min,WANG Ke-ling,ZHANG Li-xian,HOU Zi-hua
(Animal Husbandry and Veterinary Research Institute,Henan Academy of Agricultural Sciences,Zhengzhou 450002,China)
In order to establish a method for the identification of Actinobacillus pleuropneumoniae serotype 6,a pair of primers was designed according to the APP from the nucleotide sequence encoding the capsular polysaccharide for the 720 bp amplification of 720 bp specific nucleic acid fragment.The results showed that the APP as a template,could be amplified in line with expectations of the 720 bp fragment.The PCR products were then sequenced,and had a homology of 99%with the sequences published in GenBank of APP serotype 6.The establishment of this method provides a basis for diagnosis and prevention and identification of porcine Actinobacillus pleuropneumoniae.
Porcine contagious pleuropneumonia;Actinobacillus pleuropneumoniae;Serotype 6
S852.61+9
A
0529-6005(2016)08-0038-02
2015-04-15
河南省农业科学院优秀青年科技基金(2013YQ22,河南省农业科学院自主创新基金(2015CX12);河南省农业科学院博士科研启动基金(2013BQ03)
李海利(1982-),男,助理研究员,博士,主要从事动物传染病临床诊断及防控研究工作,E-mail:haili8693@sina.com

