人Cosmc胞外段蛋白在昆虫细胞Sf-9中的表达与纯化研究①
谢秋玲 陶 悦 张小秦 莫 茜 金燕樑
(上海交通大学医学院附属上海儿童医学中心风湿免疫科,上海200127)
人Cosmc胞外段蛋白在昆虫细胞Sf-9中的表达与纯化研究①
谢秋玲陶悦张小秦莫茜金燕樑
(上海交通大学医学院附属上海儿童医学中心风湿免疫科,上海200127)
目的:利用昆虫细胞Bac-to-Bac杆状病毒表达系统表达人Cosmc 胞外段蛋白,为体外研究Cosmc蛋白的结构和功能奠定基础,同时也为O-连接糖基化及相关疾病的研究提供思路。方法:采用Bac-to-Bac系统,构建重组转移质粒pFastBac1-Cosmc extracellular domain(pFastBac1- Cosmc ED),转化到含穿梭载体Bacmid的感受态细胞DH10Bac中,通过蓝白斑筛选和PCR鉴定,获得重组转座子rBacmid-Cosmc ED。在脂质体介导下,重组病毒感染Sf-9无血清细胞,在Sf-9中表达Cosmc 胞外段蛋白,由于Cosmc N端加有昆虫细胞信号肽HBM(Honey Bee Melittin)且不含有跨膜段,所以Cosmc胞外段蛋白表达后分泌到培养基上清中,通过SDS-PAGE和Western blot对表达产物进行检测,并通过Ni-NTA亲和层析柱对其进行纯化分析。结果:SDS-PAGE和Western blot分析显示得到一条分子量约为33 kD的特异性条带,与目的蛋白大小相符,质谱结果进一步证明所得蛋白为Cosmc胞外段蛋白。结论:Sf-9细胞中可成功表达Cosmc胞外段蛋白,为进一步研究Cosmc的结构和功能奠定基础。
人Cosmc 胞外段;昆虫细胞;杆状病毒表达系统;表达纯化
蛋白质的糖基化方式主要有两种:N-连接和O-连接[1]。其中,黏蛋白型O-聚糖的合成是在高尔基体中由一系列糖基转移酶催化而成[2]。C1GALT1作为O-糖基化的关键酶,可催化半乳糖Gal从UDP-Gal转移到Tn抗原(GalNAc α1-O-Ser/Thr-)上从而形成T抗原(Core 1 Galβ1,3 Gal NAc -α-O-Ser/Thr)。在哺乳动物细胞中,有活性的C1GALT1的形成需要其分子伴侣Cosmc(即C1GALT1C1)的共表达[3]。内质网是Cosmc发挥功能的主要场所[4]。在内质网内,Cosmc与C1GALT1结合从而促进C1GALT1正确折叠并形成有活性的二聚体,当各种原因导致Cosmc缺乏或功能异常时,C1GALT1则由于不能正确折叠而积聚于内质网中,错误折叠的C1GALT1会发生凝集,形成无酶活性的二聚体并与GRP78等蛋白分子形成低聚复合物而被转运出内质网,在胞浆中进入蛋白酶体途径降解从而失去生理功能[5]。Cosmc在一定程度上可以使已发生错误折叠的C1GALT1蛋白重新正确折叠而恢复酶的活性。因此,Cosmc作为C1GALT1特异性的分子伴侣,在内质网内发挥着无可替代的调控功能[6]。
近年来,随着研究的深入,研究者发现Cosmc与涉及糖基化异常的相关疾病如Tn综合征、肿瘤、IgA肾病(IgAN)等的发生有关[7]。 Tn综合征是一种累及血液系统的罕见的自身免疫性疾病,由于Cosmc功能异常导致C1GALT1活性降低,最终导致血细胞表面Tn抗原的表达所致。 研究证实,在该病患者中Cosmc基因存在自体突变:c.202C>T、c.393T>A、c.454G>A,其中c.202C>T、c.393T>A两位点的突变均可导致Cosmc的表达及功能异常[8]。 此外,Cosmc异常与肿瘤的发生也有关系。当Cosmc出现基因突变或表观遗传学改变时,Cosmc功能失活,细胞膜蛋白不能正常糖基化,从而表达Tn抗原,Tn抗原或唾液酸化的Tn抗原水平升高诱发肿瘤[9]。在关于IgAN的研究中发现外周血B淋巴细胞中Cosmc的表达量降低可导致IgA1铰链区半乳糖基化异常[10]。活性的降低,进而导致IgA1铰链区半乳糖基化异常[10,11]。糖基化异常的IgA1易于自身聚集或者与相应的抗体IgA和IgG结合形成大分子复合物而不能通过正常代谢途径被清除,以致其在血液循环中的数量大幅增加,最终沉积于皮肤、胃肠道,以及肾小球毛细血管等组织脏器,从而出现相应的临床症状[11-14]。
总结以上的研究,我们发现Cosmc的功能异常与多种涉及O-糖基化的自身免疫性疾病的发生有关,但是由于对Cosmc结构和功能的认识有限,使其在疾病中的具体机制仍不清楚。本研究旨在利用杆状病毒表达系统在体外单独表达Cosmc蛋白,从而为针对Cosmc的结构、功能以及与C1GALT1的相互作用研究奠定基础,同时也为涉及O-糖基化的相关自身免疫性疾病的研究以及治疗提供新的切入点和策略依据。
1 材料与方法
1.1材料
1.1.1细胞株和质粒pcDNA3.1(+)-Cosmc合成于南京金斯瑞生物科技有限公司,E.coliDH5α,E.coliDH10Bac和质粒pFastBac1以及Sf-9昆虫细胞购自Invitrogen公司。
1.1.2主要试剂构建重组病毒主要用酶:BamHⅠ、Xho Ⅰ、T4DNA连接酶、Ex-Taq酶等购自TaKaRa公司;质粒小提试剂盒/切胶回收试剂盒/PCR产物回收试剂盒等购自天根生化科技有限公司;转染试剂(Cellfectin® Ⅱreagent)、Grace′s培养基、无血清昆虫培养基Sf-900ⅡSFM等为Invitrogen公司产品;Anti-HisIgG购自北京全式金生物技术有限公司;Anti-CosmcIgG购自Abcam公司,X-gal、AmpicilinNa、IPTG为Sigma公司产品;PVDF膜购自GEHealthcare,标记HRP的羊抗鼠、羊抗兔二抗购自CellSignalingTechnology公司;Westernblot显色剂购自Milipore公司;引物CosmcF/CosmcR、M13F/M13R由生工生物工程(上海)有限公司合成。
1.2方法
1.2.1重组杆状病毒转移载体pFastBac1-CosmcED的构建以购自南京金斯瑞生物科技有限公司的质粒pcDNA3.1(+)-Cosmc为模板进行PCR反应,引物为Cosmc-F/Cosmc-R(引物序列见表1)。上游引物含有BamHⅠ酶切位点(*GGAATTCC*),下游引物含有XhoⅠ酶切位点(*CCGCTC-GAG*),其中*标记的是保护碱基和酶切位点,利用该对引物扩增出来的PCR产物含有BamHⅠ和XhoⅠ酶切位点。PCR反应完成后,电泳鉴定并对PCR产物进行回收,得到的纯化产物用BamHⅠ和XhoⅠ进行双酶切, 与同样经双酶切处理后的pFastBac1质粒,在16℃连接2h,连接产物转化至E.coliDH5α感受态细胞中,得到转移载体pFastBac1-CosmcED(Cosmc-ED指Cosmc胞外段序列,碱基序列从第79位碱基C至957位碱基A,长度为879bp;相对应的蛋白序列则从第27位氨基酸H(组氨酸)至第318位氨基酸D(天冬氨酸),大小约33kD,GenBank序列号为NP_689905.1)。
1.2.2重组杆状病毒穿梭载体rBacmid-CosmcED的构建和鉴定将得到的重组质粒pFastBac1-CosmcED转化E.coliDH10Bac感受态细胞(含有经修饰的杆状病毒Bacmid),在含有40μg/mlIPTG、100μg/mlX-gal、50μg/ml卡那霉素、7μg/ml庆大霉素及10μg/ml四环素的平板上培养48h后,挑取发生转座作用生成的白色菌落,扩大培养后提取重组病毒rBacmid-CosmcEDDNA,以重组病毒DNA为模板,利用Bacmid上的特异性引物M13F/M13R和/或基因特异性的上下游引物CosmcF/CosmcR进行PCR鉴定(M13F和M13R为重组病毒上的特异性引物,引物序列见表1)。
1.2.3重组杆状病毒的获得蛋白表达分析从P3代病毒转染细胞开始,因此需要获得P3代病毒。用纯化的重组病毒rBacmid-CosmcEDDNA转染Sf-9细胞。在6孔板上每孔种植8×105个Sf-9细胞,Grace′s培养基2ml,室温培养15min,使细胞贴壁,然后利用Cellfectin® Ⅱreagent(8μl)将重组病毒DNA(1μg)转染至Sf-9细胞中。27℃培养3~5h后,移走转染混合液,在每孔重新加入2ml无血清昆虫细胞培养基Sf-900 ⅡSFM,置于27℃继续培养,并密切观察细胞形态变化。待细胞发生病毒感染变化时(约72h),500r/min离心5min,P1代病毒主要存在于上清中。 接种病毒液所需体积的计算方法:在6孔板中每孔加入2ml悬浮细胞(2×106cells/well),室温下 贴壁1h;然后假定MOI= 0.1(MOI指每个细胞中病毒颗粒的数目,变化范围为0.05~0.1)且接种病毒的滴度为1×106pfu/ml,需要加入的病毒接种液:病毒接种液(ml)=(MOI× 细胞数)/接种病毒滴度,即每孔中需加入200μl接种病毒溶液。因此,将200μlP1代病毒接种到Sf-9细胞后,在27℃培养箱培养细胞72h;72h后,500r/min离心5min收集上清,即得到P2代扩增病毒溶液,用同样方法得到P3代病毒,病毒于4℃避光保存。
1.2.4重组蛋白CosmcED的Westernblot检测选择对数生长期Sf-9细胞(活细胞率 > 90%),加入无血清培养基将细胞浓度调至2×106ml-1,取适量上述制备的P3代病毒溶液感染Sf-9细胞,27℃振荡培养至细胞出现病毒感染变化(约72h)时,3 500r/min、4℃离心30min收集细胞培养液上清,以含有P1、P2、P3代病毒的细胞培养液上清作对照,进行SDS-PAGE电泳;电泳结束后将凝胶上的蛋白用湿转法(200mA恒流100min)转至PVDF膜上;转膜后用5%脱脂奶粉封闭1h(室温,轻微振荡);然后与一抗(分别使用Anti-HisIgG、Anti-CosmcIgG)稀释液室温下孵育1h;洗涤4次,每次5min(洗涤液:1×PBS+ 0.1%Tween-20 );再分别与标记HRP的羊抗鼠二抗、羊抗兔二抗稀释液室温下孵育40min;再洗涤4次,每次间隔5min;最后加显色液,Biotek酶标仪显色分析。
1.2.5重组蛋白CosmcED的Ni-NTA柱纯化及鉴定P3代病毒溶液感染Sf-9细胞72h后,保留适量全细胞样品(Wholecell);4℃、3 500r/min离心30min收集含有目的蛋白的细胞培养液上清并留样(Supernatant),将收集到的上清与平衡好的Ni-NTA胶在4℃混合30min;将混合液上样于空的层析柱中(留样Flowthrough);用10倍柱体积的低浓度咪唑(40mmol/LIMD,Bindingbuffer) 洗脱非特异性结合的杂蛋白,保留适量洗脱液(Washing);最后用3倍柱体积的高浓度咪唑(250mmol/LIMD,Elutionbuffer)洗脱目的蛋白,收集目的蛋白并留样(Elution)。上述保留样品加4×LDSloadingbuffer并于95℃煮沸10min后,上样于10%的SDS-PAGE胶进行电泳鉴定蛋白纯度,并将纯化后的单蛋白条带切胶并进行质谱分析。
2 结果
2.1重组转移载体pFastBac1-CosmcED的构建以质粒pcDNA3.1(+)-Cosmc为模板,进行PCR扩增,经琼脂糖凝胶电泳检测得到位于750~1 000bp的DNA片段(图1), 与预期目的基因CosmcED片段872bp加保护碱基和酶切位点的大小吻合。将经纯化、酶切的基因CosmcED与经同样处理的载体pFastBac1质粒连接后转化感受态宿主E.coliDH5α,挑取PCR鉴定阳性的菌落提取质粒,后进行测序分析,测序结果表明CosmcED基因成功插入载体pFastBac1质粒中。
2.2 重组穿梭载体rBacmid-CosmcED的构建将重组转移质粒pFastBac1-CosmcED转化至E.coliDH10Bac感受态细胞中, 筛选出3个发生转座的白色菌落扩大培养后提取重组病毒DNA,并以重组病毒DNA为模板,CosmcF/CosmcR、CosmcF/M13R、M13F/Cosmc R 3对引物分别进行PCR 扩增鉴定(见图2),结果显示:泳道1为Cosmc阳性对照;泳道、2、3、4使用目的基因特异性上下游引物Cosmc F/Cosmc R,扩增得到的片段大小为879 bp,与目的基因大小相符;泳道5、6、7使用引物M13F/Cosmc R,与Cosmc ED片段加Bacmid上的3′序列的大小一致;泳道8、9、10使用Cosmc F/M13R,泳道8 PCR失败,其余泳道所得片段与Cosmc ED片段加Bacmid上的5′序列的大小一致;证明Cosmc ED 基因片段已转座到Bacmid上。
表1引物序列
Tab.1Primer sequence
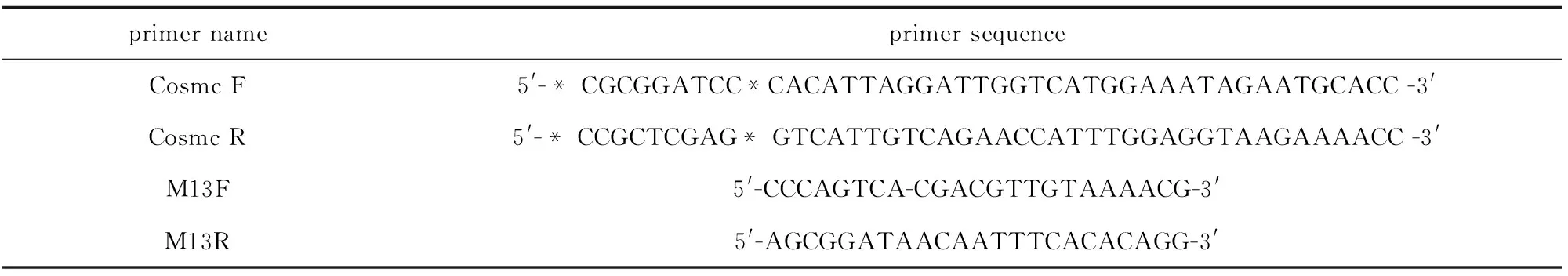
primernameprimersequenceCosmcF5'-*CGCGGATCC*CACATTAGGATTGGTCATGGAAATAGAATGCACC-3'CosmcR5'-*CCGCTCGAG*GTCATTGTCAGAACCATTTGGAGGTAAGAAAACC-3'M13F5'-CCCAGTCA-CGACGTTGTAAAACG-3'M13R5'-AGCGGATAACAATTTCACACAGG-3'
Note:M13F/M13R:Specific forward/reverse primer of recombinant Bacmid.
2.3重组杆状病毒的获得将重组病毒DNA转染至Sf-9细胞,可见被转染的Sf-9细胞出现如下病毒感染现象:转染<24 h,细胞体积逐渐增大约25%~50% ,尤其是细胞核增大明显;转染24~72 h,细胞停止生长,胞浆内出现较多囊泡、颗粒,细胞从平板上脱落;转染>72 h,细胞开始溶解、坏死,证明重组病毒DNA成功转染Sf-9(图3),并获得重组杆状病毒。

图1 Cosmc ED基因片段的扩增Fig.1 Fragment Cosmc ED amplified by PCRNote: M.DL 5 000 DNA marker;1.Amplified Cosmc ED.
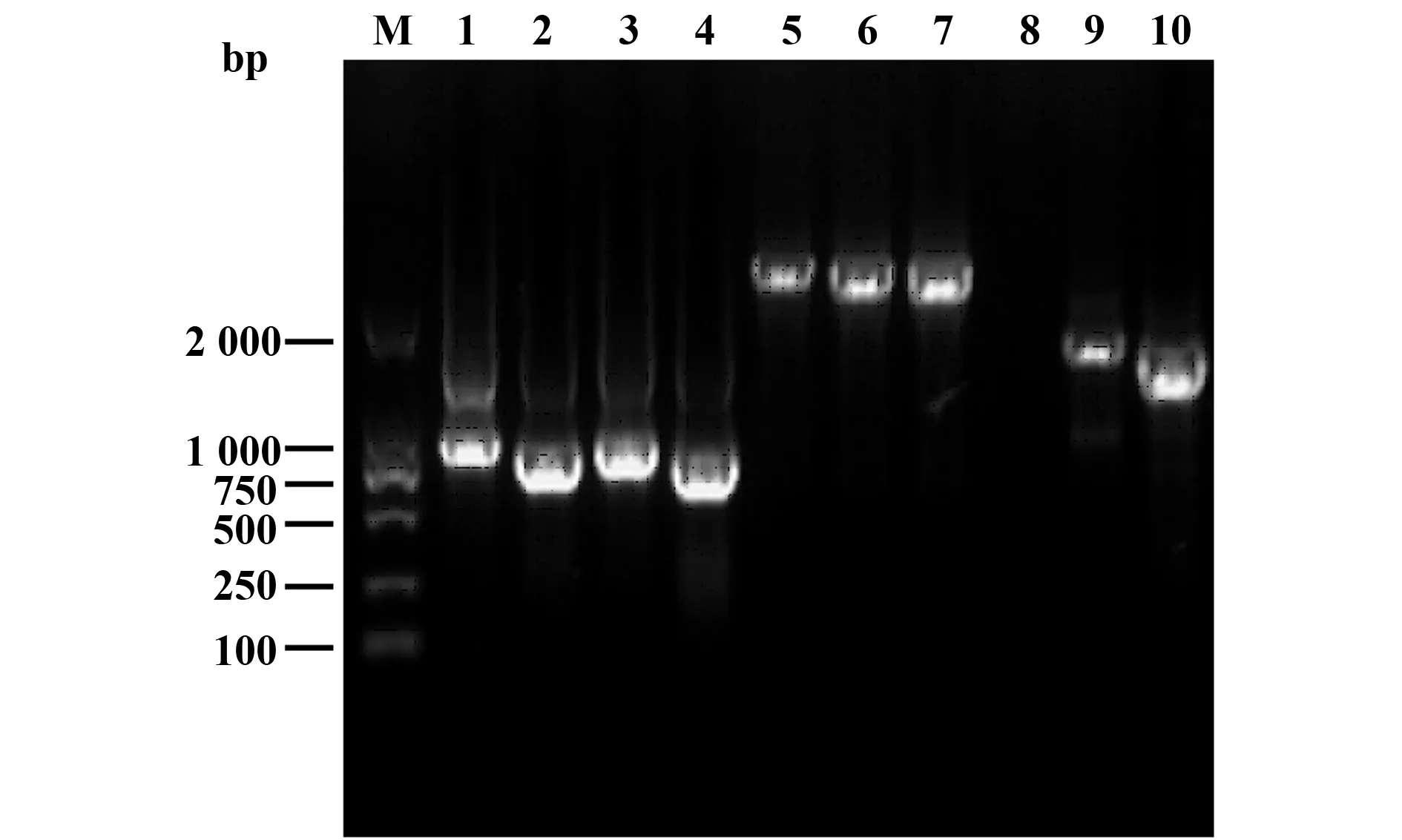
图2 重组穿梭载体rBacmid-Cosmc ED的鉴定Fig.2 Identification of rBacmid-Cosmc ED Note: M.DL 2000 DNA marker;1.Cosmc positive control;2-4.Products amplified by primers of Cosmc F and Cosmc R;5-7.Products amplified by primers of M13F and Cosmc R;8-10.Products amplified by primers of M13R and Cosmc F.
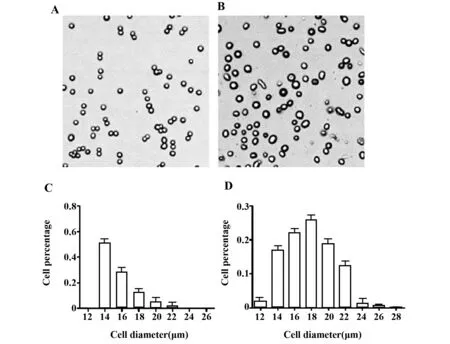
图3 rBacmid-Cosmc ED转染前后,Sf-9细胞的形态及大小比较Fig.3 Comparison of morphology and size of Sf-9 cells before and after transfection with rBacmid-Cosmc ED Note: A.Normal Sf-9 cells;B.Sf-9 cells transfected with rBacmid-Cosmc ED for 72 h;C.Histogram of the cell diameter of normal Sf-9 cells;D.Histogram of the cell diameter of Sf-9 cells after transfection.

图4 Cosmc-ED蛋白的Western blot分析Fig.4 Western blot analysis of Cosmc-ED proteinNote: P1-P4.P1/P2/P3/P4 viral stock supernatant;Proteins in the supernatant were separated on a 10% SDS-PAGE gel under both non-reducing (left panel) and reducing (right panel) conditions.After being transferred to the PVDF membrane,the Cosmc-ED protein was probed with anti-His (A) and anti-Cosmc (B) antibody,respectively.
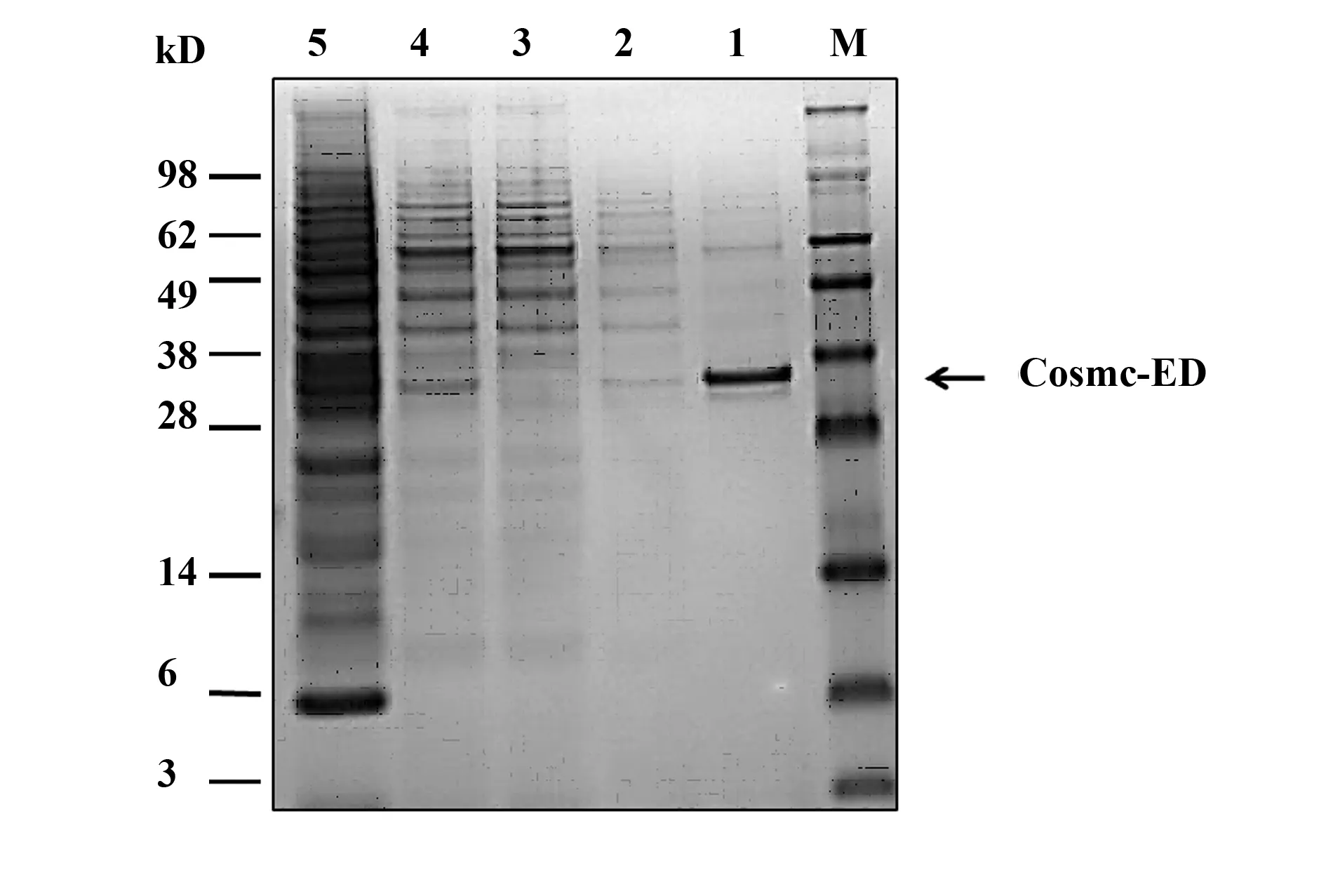
图5 Cosmc-ED蛋白纯化后的SDS-PAGE分析Fig.5 SDS-PAGE analysis of Cosmc-ED protein afterpurificationNote: M.Protein marker;1.Elution;2.Washing;3.Flow through;4.Supernatant;5.Whole cell.
2.4Western blot检测Cosmc ED蛋白的表达取适量重组病毒感染无血清培养的Sf-9细胞,72 h后离心收集细胞培养液上清, 以含有P1、P2、P3代病毒的细胞培养液上清作对照,分别用Anti-His IgG(图4A)、Anti-Cosmc IgG(图4B) 的抗体对其进行Western blot检测,结果显示,P1中并没有检测到目的条带,P2中条带微弱,P3、P4代病毒感染细胞的上清在33 kD处有一条带,而且大约在2倍分子量的位置处有高聚物的形成。Cosmc 胞外段蛋白是一个分子量约为33 kD的单聚体蛋白,而杆状病毒表达系统具备蛋白质翻译后加工和修饰能力,因此我们推断33 kD处为Cosmc 胞外段蛋白,而约2倍分子量位置处的条带可能是Cosmc 胞外段蛋白随意折叠形成的二聚体。Western blot的结果证明我们构建的重组病毒正确且目的蛋白在昆虫细胞Sf-9中得到了特异性表达。
2.5Cosmc ED蛋白的Ni-NTA柱纯化及鉴定用无血清培养基培养Sf-9细胞,在对数生长期(2×106cells/ml) 时进行重组病毒的感染, 72 h后收集培养上清,采用Ni-NTA柱纯化蛋白,经低浓度咪唑洗脱非特异性蛋白,经高浓度咪唑洗脱目的蛋白。收集每一步的洗脱液进行电泳,可见纯化后的蛋白在33 kD处有一条单带(图5),且纯化后的目的蛋白纯度较高,经蛋白定量测得昆虫细胞表达的目的蛋白量约为2.76 g/ml培养上清。将图5中的单一条带切胶并进行质谱分析,质谱结果显示所测蛋白与Cosmc氨基酸的覆盖率达60%以上,进一步证明纯化后的蛋白为Cosmc 胞外段蛋白。
3 讨论
Cosmc是2002年由Ju等[3]首先报道的一种蛋白质分子,它是一种由318个氨基酸组成的Ⅱ型跨膜蛋白,蛋白相对分子量约为36.4 kD,包括3个区域,分别为位于胞浆区的短N端,跨膜区的螺旋结构以及细胞质外的长C端。Cosmc的跨膜结构域(Transmembrane domain,TMD)中含有18个氨基酸,该结构域为Cosmc定位于内质网中所必需,当该结构域中一个半胱氨酸残基发生突变时可阻止Cosmc同源二聚体中二硫键的形成以及其在内质网的定位[4]。Cosmc仅特异性调节脊椎动物体内的C1GALT1且Cosmc在脊椎动物体内高度保守;而非脊椎动物体内不存在Cosmc,其体内C1GALT1通过Cosmc非依赖的调节途径来正常发挥活性[15,16]。
Cosmc蛋白本身是一个含有二硫键的膜蛋白,含有糖基化等翻译后修饰。之前我们曾尝试在大肠杆菌中表达人Cosmc,但并未得到理想的表达效果。而杆状病毒表达系统因具有宿主范围广、表达量高、加工修饰系统完备、使用安全等优点而被人们广泛应用。本研究利用Bac-to-Bac杆状病毒表达系统在昆虫细胞Sf-9中成功表达并纯化了Cosmc胞外段蛋白。但是,Western blot的结果显示在目的蛋白大小2倍的位置处出现类似于二聚体等高聚物的形成,而且实验中获得的Cosmc胞外段蛋白很容易沉淀。可能的原因是Cosmc胞外段蛋白进行体外表达时,由于跨膜区二硫键的缺失,导致其无法定位于内质网而分泌到上清液中,引起其结构的不稳定,进而出现Cosmc胞外端随意折叠成杂乱的二聚体结构,这导致其结构的更不稳定,因此容易聚集形成沉淀。此外,研究表明Cosmc与C1GALT1在哺乳动物细胞中共表达,表明两者之间存在物理空间关联性。因此,体外单独表达Cosmc 也可能是其结构不稳定的原因。虽然本研究在体外成功表达了Cosmc胞外段蛋白,但关于该胞外段蛋白的稳定性及功能还需要进一步的探索,这也将成为我们下一步工作的重点,从而为相关疾病的研究奠定前期基础。
[1]Surman M,Janik M.cAMP cascade in regulation of protein glycosylation[J].Postepy Biochem,2014,60(3):305-312.
[2]Tran DT,Ten Hagen KG.Mucin-type O-glycosylation during development[J].J Biological Chem,2013,288(10):6921-6929.
[3]Ju T,Cummings RD.A unique molecular chaperone Cosmc required for activity of the mammalian core 1 beta 3-galactosyltransferase[J].Proc Natl Acad Sci USA,2002,99(26):16613-16618.[4]Sun Q,Ju T,Cummings RD.The transmembrane domain of the molecular chaperone Cosmc directs its localization to the endoplasmic reticulum[J].J Biological Chem,2011,286(13):11529-11542.
[5]Ju T,Aryal RP,Stowell CJ,etal.Regulation of protein O-glycosylation by the endoplasmic reticulum-localized molecular chaperone Cosmc[J].J Cell Biol,2008,182(3):531-542.
[6]Narimatsu Y,Ikehara Y,Iwasaki H,etal.Immunocytochemical analysis for intracellular dynamics of C1GalT associated with molecular chaperone,Cosmc[J].Biochemical Biophysical Res Communications,2008,366(1):199-205.
[7]Ju T,Wang Y,Aryal RP,etal.Tn and sialyl-Tn antigens,aberrant O-glycomics as human disease markers[J].Proteomics Clin Applications,2013,7(9-10):618-631.
[8]Ju T,Cummings RD.Protein glycosylation:chaperone mutation in Tn syndrome[J].Nature,2005,437(7063):1252.
[9]Ju T,Aryal RP,Kudelka MR,etal.The Cosmc connection to the Tn antigen in cancer[J].Cancer biomarkers :section A of Disease markers,2014,14(1):63-81.
[10]Qin W,Zhou Q,Yang LC,etal.Peripheral B lymphocyte beta1,3-galactosyltransferase and chaperone expression in immunoglobulin A nephropathy[J].J Int Med,2005,258(5):467-477.
[11]Kokubo T,Hiki Y,Iwase H,etal.Evidence for involvement of IgA1 hinge glycopeptide in the IgA1-IgA1 interaction in IgA nephropathy[J].J Am Soc Nephrol,1997,8(6):915-919.
[12]Novak J,Moldoveanu Z,Renfrow MB,etal.IgA nephropathy and henoch-schoenlein purpura nephritis:aberrant glycosylation of IgA1,formation of IgA1-containing immune complexes,and activation of mesangial cells[J].Contrib Nephrol,2007,157:134-138.
[13]Berthoux F,Suzuki H,Thibaudin L,etal.Autoantibodies targeting galactose-deficient IgA1 associate with progression of IgA nephropathy[J].J Am Society Nephrol,2012,23(9):1579-1587.
[14]Trnka P.Henoch-schonlein purpura in children[J].J Paediatr Child Health,2013,49(12):995-1003.
[15]Ju T,Zheng Q,Cummings RD.Identification of core 1 O-glycan T-synthase from Caenorhabditis elegans[J].Glycobiology,2006,16(10):947-958.
[16]Staudacher E.Mucin-Type O-Glycosylation in Invertebrates[J].Molecules,2015,20(6):10622-10640.
[收稿2016-02-03]
(编辑许四平)
Expression and purification of recombinant human Cosmc extracellular domain in Sf-9 insect cells
XIE Qiu-Ling,TAO Yue,ZHANG Xiao-Qin,MO Xi,JIN Yan-Liang.
Department of Rheumatology,Shanghai Children′s Medical Center Affiliated to Shanghai Jiaotong University School of Medicine,Shanghai 200127,China
Objective:In the present study,Bac-to-Bac baculovirus expression system was used to obtain recombinant human Cosmc extracellular domain protein,which can lay the foundation for the research about the structure and function of Cosmc protein in vitro,and simultaneously provide ideas for the research of O-glycosylation and related diseases.Methods: The Cosmc extracellular domain (Cosmc-ED) gene was cloned into a transfer vector pFastBac1 to form the recombinant donor plasmid pFastBac1-Cosmc ED,which was transformed into competent cells DH10Bac.By using blue-white selection and PCR analysis,we could obtain recombinant shuttle vector rBacmid-Cosmc ED.Then,the recombinant gene DNA of rBacmid-Cosmc ED was used to transfect Sf-9 mediated by cationic lipid formulation,and the recombinant baculovirus bacmid was obtained,which was further used to infect the serum-free cell Sf-9 to express Cosmc-ED in the supernatant.Then the protein of interest was detected by SDS-PAGE and Western blot and purified with Ni-NTA affinity column.Results: SDS-PAGE and Western blot analysis showed a specific band about 33 kD,consistent with the interest protein.Mass spectrometry results further prove that the protein was Cosmc extracellular domain protein.Conclusion: Human Cosmc-ED protein can be successfully expressed in Sf-9 insect cells and laid basis for subsequent studies.
Human Cosmc extracellular domain;Insect cells;Baculovirus expression system (BEVS);Expression and purification
10.3969/j.issn.1000-484X.2016.10.021
①本文受上海市浦东新区科技发展基金创新资金资助(No. PKJ2012-Y51)。
谢秋玲(1990年-),女,硕士,主要从事过敏性紫癜发病机制的研究。
及指导教师:金燕樑(1964年-),男,博士,教授,硕士生导师,主要从事儿童风湿性疾病的研究,E-mail:jinyanliang2000@163.com。
R392.11
A
1000-484X(2016)10-1507-06