单核巨噬细胞极化在慢性活动性乙型肝炎中的表达及意义①
杨江华 林 敏 孙 静 梁曼曼 王文节
(皖南医学院弋矶山医院感染性疾病科,芜湖241001)
单核巨噬细胞极化在慢性活动性乙型肝炎中的表达及意义①
杨江华林敏孙静梁曼曼王文节
(皖南医学院弋矶山医院感染性疾病科,芜湖241001)
目的:研究慢性活动性乙型肝炎患者单核巨噬细胞的数量与功能变化。方法:随机选择51例慢性乙型肝炎患者(其中轻中度20例,重度31例)以及正常对照13例。采用Percoll分层液分离PBMCs,以CD14标记单核细胞,流式细胞仪检测PBMCs表面分子CD80、CD86、HLA-DR、CD163的表达;ELISA检测血清细胞因子IL-10、IL-12与IL-23的水平;免疫组织化学染色检测CD68在肝脏的分布。 结果:轻中度慢性乙型肝炎组、重度慢性乙型肝炎组CD80表达水平低于对照组。慢性乙型肝炎患者外周血单核细胞CD86的表达低于对照组,其中重度组与对照组比较有统计学差异(P<0.01)。慢性乙型肝炎患者HLA-DR的表达低于对照组,其中轻中度组与重度慢性乙型肝炎组间HLA-DR的表达水平差异有统计学意义(P<0.01)。此外,慢性乙型肝炎患者外周血单核细胞CD163的表达明显高于对照组(P<0.01)。慢性乙型肝炎患者肝脏汇管区CD68阳性细胞浸润增加,汇管区增大(P<0.05)。轻中度慢性乙型肝炎组、重度慢性乙型肝炎组与对照组血清IL-10表达水平之间两两比较差异显著,均具有统计学意义(P<0.01)。结论:慢性乙型肝炎患者巨噬细胞参与肝脏病变的发生,外周血中单核细胞存在M1型/M2型平衡失调,向M2型极化的现象,可能参与其慢性化发展。
单核细胞;巨噬细胞;极化;乙型肝炎
据全国人群血清流行病学调查显示,我国乙型肝炎表面抗原携带者约为9 300万人,其中慢性乙型肝炎患者高达2 000多万[1]。此外,每年乙型病毒性肝炎的新发感染者达10万之多。慢性乙型肝炎的发病机制尚未完全明了,研究认为,HBV感染后所造成的机体免疫功能低下是导致感染慢性化的因素之一。慢性乙型肝炎引起的肝细胞病变主要取决于机体的免疫应答,尤其是细胞免疫应答,而细胞免疫应答是由单核巨噬细胞所介导[2]。
单核巨噬细胞在各种微环境中,经不同刺激物的诱导与调节可差异性地发生活化,向M1型或M2型单核巨噬细胞分化的过程称之为极化(Polarization)[3]。近年来,单核巨噬细胞极化在多种疾病的发生中受到很大的关注[4]。M1型细胞的特点表现为:激活后自身抗原呈递能力提高,大量促炎因子如TNF-α、IL-1、IL-12、IL-23、NO的释放;表达大量的HLA-DR、CD80和CD86分子等; M1型巨噬细胞可作为效应细胞参与Th1型免疫应答,对细胞内感染的病原体有杀伤作用[3]。M2 型细胞的特点是:能够高表达 CD23、CD163等;特征性地高表达 IL-10 和低表达 IL-12[5];主要是抑制 T 细胞增殖及机体的免疫应答,有助于病原体的免疫逃逸。
为此,本研究分析单核巨噬细胞在慢性乙型肝炎患者中的免疫表型和分泌特点等特性,确定其极化类型,从而了解其在慢性乙型肝炎发病中的意义。
1 材料与方法
1.1材料
1.1.1临床资料以皖南医学院弋矶山医院2013年11月~2014年11月收治的51例慢性乙型肝炎患者为研究组,其中轻中度慢性乙型肝炎20例,重度慢性乙型肝炎31例,诊断符合中华医学会传染病与寄生虫病学分会和全国病毒性肝炎学术会议联合修订的病毒性肝炎诊断和分型标准[6]。所有患者住院前6个月内均未接受过干扰素、拉米夫定等抗病毒药物或免疫调节剂治疗,排除合并其他嗜肝病毒以及EB病毒、巨细胞病毒、艾滋病病毒等其他病毒感染或传染性疾病,排除其他自身免疫相关的疾病,排除高血压、冠心病、糖尿病等其他基础性疾病,并排除3个月内输血史。同时取13例正常人作为对照组。
1.1.2仪器和试剂Percoll为Sigma公司产品。FITC标记的抗CD14、PE-Cy5标记的抗CD80、PE-Cy5标记的抗CD86、APC标记的抗HLA-DR抗体、APC标记的抗CD163抗体以及同型对照抗体为美国eBioscience公司产品。免疫组化抗人CD68抗体为福建迈新公司产品。人血清细胞因子IL-10、IL-12与IL-23检测试剂由美国Adlitteram Diagnostic Laboratories公司提供。FC500 MPL流式细胞仪为美国BECKMAN COULTER公司产品。
1.2方法
1.2.1Percoll分离PBMCs所有51例慢性乙型肝炎患者和13例健康体检者均抽取清晨空腹静脉血5 ml于肝素抗凝管中,并向离心管内加入5 ml 60%的Percoll分层液,在上中层液体交界处可见乳白色混浊的薄薄的白膜层,即PBMCs。分别加入24孔培养板,每孔5×106细胞,37℃,5%CO2培养2 h后吸取培养上清,用RPMI1640轻轻洗涤培养孔3次以去除非贴壁细胞,收集贴壁细胞。
1.2.2CD14阳性单核细胞表面分子的检测取贴壁细胞,每管1×105-6/100 μl个细胞。分别加入FITC标记的抗CD14、PE-Cy5标记的抗CD80、PE-Cy5标记的抗CD86、APC标记的抗HLA-DR抗体、APC标记的抗CD163抗体以及同型对照抗体各2 μl于标本管中,室温孵育20~30 min,振荡混匀、洗涤,重新悬浮细胞,上流式细胞仪检测。
1.2.3细胞因子检测血清细胞因子IL-10、IL-12与IL-23均采用ELISA双抗体夹心法检测,操作按照说明书。采用美国伯乐550型酶标仪测OD值,结果统计分析。
1.2.4免疫组织化学染色检测CD68在肝脏的分布对部分病例行超声引导下肝脏穿刺病理学检测。取石蜡包埋的肝脏穿刺组织,石蜡切片脱蜡、水化;3%H2O2室温孵育5~10 min;蒸馏水冲洗,PBS浸泡5 min,山羊血清封闭,室温孵育10 min;滴加10 μl的抗人CD68抗体,37℃孵育2 h;滴加生物素标记二抗,37℃孵育10~30 min;滴加辣根酶标记链霉卵白素,37℃孵育10~30 min,DAB显色;在高倍视野(×400) 下,计数肝脏肝窦区及汇管区染色细胞数。
2 结果
2.1一般资料在检测的64例标本中,健康对照组13例,其中男性8例,女性5例,平均年龄(44.62±5.58)岁;轻中度慢性乙型肝炎组20例,其中男性13例,女性7例,平均年龄(45.75±6.90)岁;重度慢性乙型肝炎组31例,其中男性21例,女性10例,平均年龄(50.35±6.47)岁。相关实验室检查结果见表1。
2.2慢性乙型肝炎患者肝脏CD68阳性巨噬细胞的数量免疫组化染色肝脏组织如图1所示,慢性乙型肝炎患者随着病情的加重肝脏汇管区炎症细胞浸润增多,汇管区增大。CD68阳性细胞在重度患者中数量为(48.0±6.3)个,以汇管区为主,多于轻中度患者(24.7±5.1)个(P<0.05)以及正常肝脏组织(16.0±5.1)个。由此提示,单核巨噬细胞参与慢性乙型肝炎肝脏病变的发展,随着炎症反应程度加重,局部浸润增多。
表1各组实验室检查数据
Tab.1Laboratory data of each group
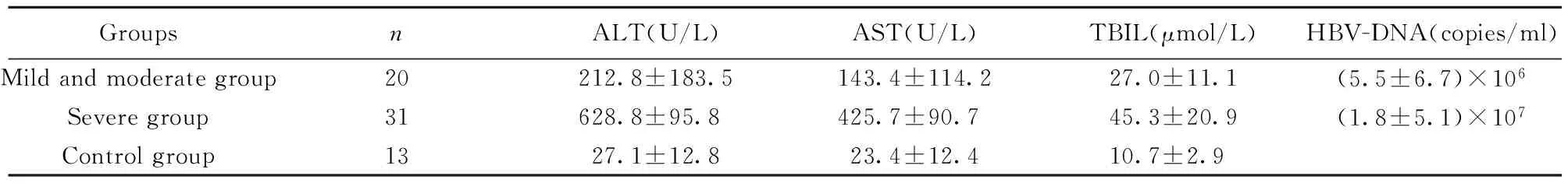
GroupsnALT(U/L)AST(U/L)TBIL(μmol/L)HBV-DNA(copies/ml)Mildandmoderategroup20212.8±183.5143.4±114.227.0±11.1(5.5±6.7)×106Severegroup31628.8±95.8425.7±90.745.3±20.9(1.8±5.1)×107Controlgroup1327.1±12.823.4±12.410.7±2.9
表2肝炎组和对照组单核细胞表面标记物水平
Tab.2Level of surface markers on mononuclear cells

GroupsnCD80(%)CD86(%)HLA-DR(%)CD163(%)Mildandmoderategroup2054.02±5.659.38±4.5146.19±8.702)26.47±8.08Severegroup3142.32±5.144.06±1.031)34.68±5.5949.01±4.95Controlgroup1366.32±1.5419.92±3.2063.38±7.3814.82±2.233)
Note:Compared with control group,1)P<0.001;compared with severe group,2)P<0.01;compared with mild-moderate group,3)P<0.001.

图1 CD68阳性细胞在各组肝组织中的表达(×400)Fig.1 Expression of CD68 positive cells in liver tissue of three groups(×400)
表3肝炎组和对照组血清细胞因子水平
Tab.3Level of serum cytokines between hepatitis B group and control group
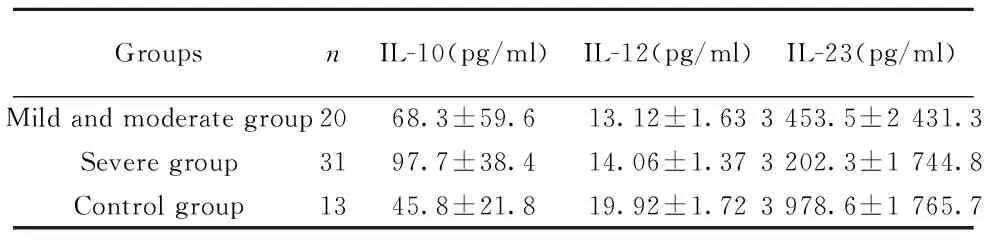
GroupsnIL-10(pg/ml)IL-12(pg/ml)IL-23(pg/ml)Mildandmoderategroup2068.3±59.613.12±1.633453.5±2431.3Severegroup3197.7±38.414.06±1.373202.3±1744.8Controlgroup1345.8±21.819.92±1.723978.6±1765.7
2.3慢性乙型肝炎患者外周血单核细胞表型的表达特点流式细胞仪检测外周血CD14阳性单核细胞表面分子表达(表2),结果显示轻中度慢性乙型肝炎组、重度慢性乙型肝炎组CD80表达水平低于对照组,但统计学无差异。慢性乙型肝炎患者外周血单核细胞CD86的表达明显低于健康对照组,其中重度组与对照组比较有统计学差异(P<0.01)。慢性乙型肝炎患者HLA-DR的表达低于对照组,其中轻中度慢性乙型肝炎组与重度慢性乙型肝炎组间HLA-DR的表达水平差异有统计学意义(P<0.01)。此外,慢性乙型肝炎患者外周血单核细胞CD163的表达明显高于对照组(P<0.01)。数据显示,慢性乙型肝炎患者外周血M1型单核细胞(CD80、CD86和HLA-DR)的数量明显低于对照组;M2型单核细胞(CD163)的数量增加,随着乙型肝炎炎症程度的变化而变化。
2.4慢性乙型肝炎患者血清IL-10、IL-12与IL-23水平比较三组间血清细胞因子IL-10、IL-12与IL-23水平(见表3),轻中度慢性乙型肝炎组、重度慢性乙型肝炎组与对照组血清IL-10表达水平之间两两比较差异显著,均具有统计学意义(P<0.01)。慢性乙型肝炎组IL-12与IL-23均低于正常对照组,但统计学无差异。
3 讨论
在正常生理情况下,机体外周血中M1型单核细胞与M2型单核细胞处于相互抑制、相互转化的动态平衡状态。慢性乙型肝炎引起的肝细胞病变主要取决于机体的免疫应答,尤其是细胞免疫应答,一旦上述平衡被打破,M1型单核细胞向M2型单核细胞发生漂移,机体的细胞免疫功能将受到抑制,导致HBV感染的慢性化[7]。
为观察慢性乙型肝炎感染过程中,单核巨噬细胞在外周血以及肝脏组织中的数量以及功能变化,在本实验中我们对慢性乙型肝炎患者按照轻中度、重度进行了分类,同时选取健康者作为对照,以明确外周血单核细胞M1型与M2型表面标记物表达水平的变化及其在慢性乙型肝炎发生、发展过程中的作用,了解慢性乙肝患者的免疫状态及慢性乙型肝炎的发病机制。研究结果显示,慢性乙型肝炎患者肝脏汇管区炎症细胞浸润增加, CD68阳性巨噬细胞在重度患者肝细胞中及汇管区表达数量为(48.0±6.3)个,多于轻中度患者(24.7±5.1)个(P<0.05),以及正常汇管区(16.0±5.1)。由此表明单核巨噬细胞参与慢性乙型肝炎肝脏病变的发生。
在外周血中,本实验以CD80、CD86、HLA-DR的表达水平代表M1型单核细胞的功能状况,以CD163的表达水平代表M2型单核细胞的功能状况,观察慢性乙型肝炎患者外周血单核细胞CD80、CD86、HLA-DR、CD163的表达水平。结果显示,慢性乙型肝炎患者外周血单核细胞CD163的表达明显高于健康体检者外周血单核细胞CD163的表达,差异具有统计学意义;且轻中度慢性乙型肝炎、重度慢性乙型肝炎组间差异也具有统计学意义,随着肝炎在宿主体内的发生发展,CD163的表达水平逐渐升高。CD80和CD86作为表达在抗原递呈细胞上重要的协同刺激分子,两者既有相似之处又有区别,各自都在免疫应答过程中起到非常重要的作用。因此,我们用流式细胞仪检测了慢性乙型肝炎患者及健康体检者外周血单核细胞CD80和CD86的表达。结果显示,慢性乙型肝炎患者外周血单核细胞CD80和CD86的表达明显低于对照组外周血单核细胞CD80和CD86的表达,其中CD86差异具有统计学意义。CD80、CD86表达水平的下降提示了慢性乙型肝炎患者在抗原递呈功能上存在着异常与缺陷,这可能是引起乙型肝炎病毒慢性感染的重要因素之一[7]。人体外周血单核细胞HLA-DR的表达水平能够反映出机体的免疫功能状态,在机体的免疫应答和调节过程中发挥了重要作用[8]。目前有许多临床证据表明,HLA-DR与乙肝病毒感染有关,在本实验中,我们用流式细胞仪检测了慢性乙型肝炎患者及健康体检者外周血单核细胞HLA-DR的表达,结果显示,慢性乙型肝炎患者外周血单核细胞HLA-DR的表达明显低于健康体检者外周血单核细胞HLA-DR的表达,差异具有统计学意义。HLA-DR作为单核细胞活化标志之一,其表达水平的升高提示单核细胞的活化,从而拥有更强的抗原递呈能力,如果HLA-DR表达水平降低则提示单核细胞活化不足或缺陷[8]。
本研究测定慢性乙型肝炎患者及正常对照组血清细胞因子,以 IL-12、IL-23水平代表 M1型细胞,以IL-10 的水平代表M2型细胞,结果显示,慢性乙型肝炎患者IL-12、IL-23 的水平低于正常对照组,其中IL-10在两组间差异具有统计学意义。由此显示:慢性乙型肝炎患者体内存在 M1/M2失衡,其中M1型细胞功能抑制,M2型细胞功能增强,其与慢性乙型肝炎的发生、发展有关。在日本血吸虫慢性感染过程中,通过自身抗原选择性诱导M1型巨噬细胞向M2型分化,抑制机体全身及局部免疫应答,参与感染的慢性化及肝纤维化的发生、发展[9,10]。
在持续性HBV慢性感染的过程中,慢性乙型肝炎患者外周血单核细胞CD80、CD86、HLA-DR、CD163的表达水平以及分泌细胞因子均发生了变化,同时肝脏巨噬细胞数量增加,参与肝脏炎症病变。本实验以CD80、CD86、HLA-DR的表达水平代表M1型单核细胞的功能状况,以CD163的表达水平代表M2型单核细胞的功能状况,从而直观地反映出慢性乙型肝炎患者外周血中存在着单核细胞极化,为我们进一步了解慢性乙型肝炎的发生、发展,免疫病理状态提供了理论基础和实验依据。此外,本研究提示我们可以通过适当干预单核细胞极化中的某些关键步骤,扭转单核细胞已经偏移的极化失衡,将有可能恢复单核细胞的免疫活性和功能,为从免疫学角度来预防和治疗慢性肝炎开辟一条新的道路[11]。
[1]梁晓峰,陈园生,王晓军,等.中国3 岁以上人群乙型肝炎血清流行病学研究[J].中华流行病学杂志,2005,26(9):655-658.
[2]Kurose K,Albar SM,Yamamoto K,etal.Production of antibody to hepatitis B surface antigen(anti-HBs) by murine hepatitis B virus carriers:neonatal tolerance versus antigen presentation by dendritic cell[J].Immunology,1997,92(4):494-500.
[3]Gordon S,Martinez FO.Alternative activation of macrophages:mechanism and functions[J].Immunity,2010,32(5):593-604.
[4]Liu YC,Zou XB,Chai YF,etal.Macrophage polarization in inflammatory diseases[J].Int J Biol Sci,2014,10(5):520-529.
[5]Martinez FO,Helming L,Gordon S.Alternative activation of macrophages:an immunologic functional perspective.Annu Rev Immunol,2009,27:451-483.
[6]中华医学会传染病与寄生虫病学分会和肝病学分会.病毒性肝炎防治方案[J].中华传染病杂志,2001,19(1):56-62.
[7]Xu D,Fu J,Zhang H,etal.Circulation and liver resident CD4+CD25+regulatory T cells actively influence the antiviral immune response and disease progression in patients with hepatitis B[J].J Immunol,2006,177(1):739-747.
[8]Wang FS.Current status and prospects of studies on human genetics alleles associated with hepatitis B virus infection[J].World J Gastroenterol,2003,9(4):641-644.
[9]Xu J,Zhang H,Chen L,etal.Schistosoma japonicum infection induces macrophage polarization[J].J Biomed Res,2014,28(4):299-308.
[10]Zhu J,Xu Z,Chen X,etal.Parasitic antigens alter macrophage polarization during Schistosoma japonicum infection in mice[J].Parasit Vectors,2014,7:122.
[11]Chen P,Bonaldo P.Role of macrophage polarization in tumor angiogenesis and vessel normalization:implications for new anticancer therapies[J].Int Rev Cell Mol Biol,2013,301:1-35.
[收稿2015-12-02修回2016-02-19]
(编辑张晓舟)
Expression and significance of monocyte-macrophage polarization in chronic active hepatitis B patients
YANG Jiang-Hua,LIN Ming,SUN Jing,LIANG Man-Man,WANG Wen-Jie.
Department of Infectious Diseases,Yijishan Hospital,Wannan Medical College,Wuhu 241001,China
Objective:To research the number and function of monocyte-macrophages in patients with chronic active hepatitis B.Methods: The 51 chronic viral hepatitis B(CHB) patients were selected randomly,which consisted of 20 cases of mild-moderate,31 cases of severe group and 13 cases of healthy controls.PBMCs were separated by percoll.Monocytes were tagged by CD14,the molecules CD80,CD86,HLA-DR and CD163 were detected by flow cytometry which expressed on the surface of PBMCs.Serum cytokine were detected for IL-10,IL-12 and IL-23 by ELISA.The distribution of CD68 was detected in the liver by immunohistochemical staining.Results: The expressions of CD80 for all chronic hepatitis B patients were lower than the controls respectively,no matter mild-moderate or even severe group.Similarly,the HBV patients expressed lower level of CD86 in the peripheral blood mononuclear cells when compared with the control group.Furthermore,there was statistically difference between the levels of CD86 in severe group compared with control group (P<0.01).As the expression of CD80 and CD86,the levels of HLA-DR in the patents had also declined when compared with controls.While the HLA-DR levels in both the mild-moderate HBV hepatitis groups were statistically significant higher than the severe group (P<0.01).Different from the above all,the expression of CD163 in all chronic HBV hepatitis was higher than the control group.The CD68 positive cells in chronic HBV patients were observed and infiltrated increasingly in portal area and hepatic lobules (P<0.05).There were statistically significant differences of IL-10 levels between the mild-moderate group,severe group and the control group,respectively (P<0.01).Conclusion: Macrophages have participated in the pathological lesions of liver in CHB patients,among peripheral blood mononuclear cells,the phenomena of imbalance between type M1/M2 and polarization to type M2 have been observed,which participated in the development of the chronicity of CHB.
Mononuclear cell;Macrophages cell;Polarization;Viral hepatitis B
10.3969/j.issn.1000-484X.2016.10.020
①本文为国家自然科学基金主任基金(81141083)和安徽省高校省级自然科学研究项目(KJ2014A271)。
杨江华(1972年-),男,博士,副主任医师,主要从事病原体慢性感染的免疫学机制研究,E-mail:yjhpath@163.com。
R39.3
A
1000-484X(2016)10-1503-04