Smad7基因质粒转染骨髓间充质干细胞在体外对肝星状细胞TGF-β1信号传导的影响①
苏冬娜 吴诗品
(深圳市人民医院感染内科,深圳518020)
Smad7基因质粒转染骨髓间充质干细胞在体外对肝星状细胞TGF-β1信号传导的影响①
苏冬娜吴诗品
(深圳市人民医院感染内科,深圳518020)
目的:探讨Smad7基因质粒转染骨髓间充质干细胞(Smad7-EGFP-BMSCs)在体外抑制肝纤维化的机制。方法:分离、纯化大鼠BMSCs并经Smad7基因腺病毒质粒(Ad-Smad7-EGFP)转染建立Smad7-EGFP-BMSCs。实验将大鼠肝星状细胞HSC-T6分为A组、B组、C组和D组,分别与Smad7-EGFP-BMSCs、BMSCs、Smad7质粒及PBS进行共同培养72 h,采用ELISA测定培养液中Smad7和TGF-β1的表达,采用Western印迹法和RT-PCR法测定细胞Smad7、TGF-β1、Col Ⅰ、α-SMA蛋白和mRNA的表达,采用流式细胞术测定细胞凋亡情况。结果:(1)ELISA结果显示,B组、C组和D组培养液TGF-β1蛋白水平较A组显著降低(P<0.01),而Smad7 蛋白水平较A组显著升高(P<0.01);D组TGF-β1 蛋白水平较B组和C组显著降低(P<0.01),而Smad7 蛋白水平较B组和C组显著升高(P<0.01);(2)Western印迹法和PCR结果显示,B组、C组和D组TGF-β1、ColⅠ和α-SMA 蛋白和mRNA表达水平较A组显著降低(P<0.01),而Smad7 蛋白和mRNA表达水平较A组显著升高(P<0.01);D组TGF-β1、ColⅠ、α-SMA蛋白和mRNA表达水平较B组和C组显著降低(P<0.01),而Smad7 蛋白和mRNA表达水平较B组和C组显著升高(P<0.01);(3)流式细胞仪检测结果显示,B组、C组和D组HSC-T6细胞凋亡率较A组显著升高(P<0.01),而D组细胞凋亡率较B组和C组显著升高(P<0.01)。结论:Smad7基因质粒转染骨髓间充质干细胞可通过作用肝星状细胞TGF-β1信号转导通路以及促进星状细胞凋亡而具有抗肝纤维化的作用。
Smad7;骨髓间充质干细胞;肝星状细胞;TGF-β1信号通路;细胞凋亡
肝硬化是各种慢性肝病发展的晚期阶段,具有发病率高、治疗疗效差及死亡率高的特点,我国是肝硬化的高发国家,研究肝硬化治疗方法十分迫切。肝纤维化(Hepatic fibrosis,HF)是慢性肝病进展至肝硬化的重要阶段,以细胞外基质(Extra cellular matrix,ECM)过度沉积为主要病理特征[1,2]。肝星状细胞(Hepatic stellate cell,HSC)的激活是公认的肝纤维化形成中心环节[3]。肝星状细胞通过产生和分泌大量胶原蛋白破坏肝基质代谢的平衡,由胶原蛋白组成的胶原纤维积聚在肝基质中,导致慢性肝病和肝癌等肝脏疾病的纤维化病变[4]。而转化生长因子(Transforming growth factor-beta1,TGF-β1)通过其下游Smads等信号分子促进大鼠肝星状细胞活化、增殖,从而在肝纤维化发生发展的进程中发挥重要作用[5,6]。而Smad7是TGF-β1信号转导途径的主要抑制性蛋白,是抗纤维化作用的重要信号分子。骨髓间充质干细胞(Bone marrow mesenchymal stem cells,BMSCs)是一种具有自我更新、多向分化潜能的多能干细胞,具有多种免疫调节能力,可促进肝细胞再生、转分化为肝细胞和抑制肝纤维化,可部分恢复肝功能逆转肝硬化,是除了肝移植手术外从根本上治疗肝硬化的有效途径[7]。本研究以体外培养的大鼠肝星状细胞株HSC-T6为实验对象,观察Smad7基因质粒转染BMSCs(Smad7-EGFP-BMSCs)对HSC-T6的作用,探讨其是否可通过阻断TGF-β1信号通路而具有靶向抗纤维化的作用。
1 材料与方法
1.1实验材料
1.1.1实验动物及细胞系Wistar大鼠,雄性,2周龄,体重30~40 g,由中山大学实验动物中心提供,动物合格证号为SCXK(粤)2011-0029。肝星状细胞系HSC-T6,为SV40转染SD大鼠HSC,购自中国医学科学院肿瘤细胞库。
1.1.2主要试剂Smad7基因腺病毒质粒(Ad-Smad7-EGFP)和腺病毒质粒(Ad-eGFP),由本实验室构建;anti-CD29-PE、anti-CD34-FITC、anti-CD45-PE、anti-CD90-FITC、anti-RT1A-PE和anti-RT1B-FITC单克隆抗体,购自美国Dako公司;TRIZOL试剂、PrimeScriptTMRT reagent Kit及TaKaRa SYBR® Premix Ex TaqTMⅡ试剂盒,均购于TaKaRa公司,Smad7及β-actin抗体均购于Abcam公司;DMEM培养基、胰酶,购自美国Invitrogen公司;胎牛血清,购自北京索莱宝科技公司;细胞裂解液、ECL Prime 蛋白印迹试剂,购自美国Thermo公司;BCA蛋白定量试剂盒,购自美国Pierce公司;PVDF膜,购自美国Millipore公司;鼠抗人Smad7、TGF-β1、胶原蛋白Ⅰ(CollagenⅠ,ColⅠ)、α-肌动蛋白(alpha-smooth muscle actin,α-SMA)和β-actin一抗,购自美国CST公司;辣根过氧化物酶(HRP)标记二抗,购自北京中杉公司;大鼠Smad7、TGF-β1定量ELISA试剂盒,购自北京环亚泰克生物公司;细胞凋亡检测试剂盒,购自南京凯基生物科技公司。
1.1.3主要试验仪器恒温细胞培养箱,购自美国Revco CO公司;Epics Altra流式细胞仪,购自美国Beckman Coulter公司;荧光倒置显微镜,购自日本Olympus公司;EXL808全自动酶标仪,购自美国Bio-Tek公司;ABI 7500 Real Time PCR System,购自美国ABI公司。
1.2实验方法
1.2.1HSC细胞培养和传代从液氮中取出HSC-T6细胞株迅速复苏后转入塑料培养瓶中(1×105个/ml),用含10%胎牛血清、1%青霉素和链霉素混合液的DMEM培养基于5%CO2、37℃的恒温培养箱培养。当细胞生长接近于铺满整个瓶底时,用含0.25%胰酶消化细胞,传代,取第3代生长良好的细胞用于实验。
1.2.2大鼠BMSCs的分离、纯化和鉴定2周龄SD大鼠脱臼处死,于75%医用酒精中浸泡10 min,在无菌条件下取胫骨和股骨,切除两段骨骺,用DMEM培养液冲洗骨髓,制成单细胞悬液,采用贴壁法在DEMEM培养液中培养和纯化。选取生长良好的第3代BMSCs进行实验。将BMSCs分别加入Anti-CD29-PE、anti-CD34-FITC、anti-CD45-PE、anti-CD90-FITC、anti-RT1A-PE和anti-RT1B-FITC单克隆抗体,避光反应并洗涤后才有流式细胞仪检测分析检测细胞所标记的荧光长度以确定其表型和纯度。体外间充质干细胞定向分化成骨细胞和脂肪细胞并鉴定。
1.2.3大鼠Smad7-EGFP-BMSCs的建立取第三代BMSCs,以1×106个/ml细胞浓度接种至培养板,待细胞融合率至70%时,每孔加入不同病毒感染复数(Multiplicity of Infection,MOI)的Ad-Smad7-eGFP(以Ad-eGFP和PBS作为对照)和Lipofecta-mine2000转染试剂进行转染,10 h后换液,48 h后加入新霉素进行筛选,荧光倒置显微镜检测病毒的转染率。以细胞内表达绿色荧光蛋白(Green fluorescent protein,GFP)表示感染成功。以感染效率高(>90%)、转染值(MOI)低确定最佳感染条件。以Smad7慢病毒质粒在最佳条件进对BMSCs进行转染,转染成功后建立Smad7-EGFP-BMSCs基因工程干细胞,分别采用Western印迹法和PCR法测定Smad7蛋白和mRNA含量。
1.2.4Smad7-EGFP-BMSCs抗纤维化体外机制的研究取第三代处于对数生长期的HSC-T6细胞经0.25%胰酶消化,将细胞密度调整至1×106个/ml后接种于96孔板,实验分为A组、B组、C组和D组,分别与Smad7-EGFP-BMSCs(1×104ml-1)、BMSCs(1×104ml-1)、Smad7质粒及同体积PBS进行培养。
1.2.4.1ELISA测定上清液Smad7和TGF-β1的表达每组设6个复孔,各组培养72 h后收集各组细胞上清液,采用ELISA法测定上清液Smad7、TGF-β1蛋白的表达。酶标包被板设置标准品孔、待测样本孔和空白对照孔,分别加入标准品10 μl,待测样本10 μl,37℃下孵化30 min,洗板,加入酶标工作液,洗板3次,分别加入显色剂A 和B ,37℃避光显色15 min,加入终止液以终止反应,立即采用酶标仪测定A值,计算样本中Smad7和TGF-β1蛋白浓度。
1.2.4.2Western印迹法测定细胞Smad7、TGF-β1、Col Ⅰ 和α-SMA蛋白每组设6个复孔,培养72 h后收集HSC-T6细胞,采用细胞裂解液提取总蛋白,BCA蛋白定量试剂盒测定各组Smad7、TGF-β1、Col Ⅰ 和α-SMA蛋白浓度。按蛋白量40 μg/孔进行10%SDS-PAGE凝胶电泳(80 V 20 min,150 V 约1.5 h),转膜(400 mA 2 h)至0.45 μm的PVDF膜,于5%脱脂奶粉室温封闭1 h,加入1∶1 000稀释的一抗,4℃过夜,TBST缓冲液洗膜(5min×3次),加1∶5 000稀释的二抗,室温孵育1 h,TBST缓冲液充分洗膜,应用ECL Prime 蛋白印迹试剂进行化学发光显色,X片曝光显影。用美国UVP公司Lab Works软件对Western条带进行定量分析,读取积分光密度值。
1.2.4.3qRT-PCR法测定细胞Smad7、TGF-β1、ColⅠ和α-SMAmRNA每组6个复孔,培养72 h后收集HSC-T6细胞,加入TRIZOL裂解液裂解细胞后提取总RNA,酶标仪测定浓度及纯度。应用TaKaRa逆转录试剂盒PrimeScriptTMRT reagent Kit,严格按照说明书将提取的RNA逆转录为cDNA。根据NCBI-GenBank ColⅠ基因序列,利用Primer 5.0 软件设计引物序列(见表1)。并应用TaKaRa SYBR® Premix Ex TaqTMⅡ试剂盒,进行PCR体系的扩增及反应。反应体系为50 μl: 10×PCR Buffer 5 μl,10 μmol/L dNTP 1 μl,模板1 μl,上游和下游引物各1 μl,0.5 μl 2 U/μl Taq DNA聚合酶(含Mg2+),加入ddH2O至50 μl。PCR 反应条件为:94℃预变性5 min,94℃30 s,退火55℃ 45 s,72℃ 60 s,反应35个循环,72℃延展10 min。
表1引物序列及产物长度
Tab.1Primer sequences and product lengths

NamePrimersequencesProductlength(bp)Smad75'-TTCCTCCGCTGAAACAGGG-3'2205'-CCTCCCAGTATGCCACCAC-3'TGF-β15'-TGCTAATGGTGGACCGCAA-3'1125'-CACTGCTTCCCGAATGTCTG-3'Col-I5'-TACAGCACGCTTGTGGATG-3'2565'-TTGAGTTTGGGTTGTTGGTC-3'α-MSA5'-CTGTTCCGCCATCCTTCAT-3'1755'-CCGTGATCTCCTTCTGCATT-3'β-actin5'-CCGTGATCTCCTTCTGCATT-3'2685'-TGTGGACTTGGGAGAGGACT-3'
1.2.5细胞凋亡的测定每组设6个复孔,培养72 h后0.25%胰酶消化收集细胞,离心沉淀细胞,用预冷磷酸盐缓冲液重悬细胞,调整细胞密度为1×105个/ml,采用细胞凋亡检测试剂盒进行测定。取300 μl细胞悬液,加入5 μl膜联蛋白V(Annexin V)-FITC、5 μl碘化丙啶(PI)标记,室温避光反应5 min,采用流式细胞仪分析各组HSC-T6细胞的凋亡情况。绿色荧光FITC通道检测Annexin V-FITC,红色荧光通道检测PI,每个标本测定10 000个细胞,测定速率为50~60个/min。

2 结果
2.1最佳转染条件确认转染48 h后在荧光倒置显微镜下可观察到各组细胞均表达GFP。不同MOI(0、5、10、30、50、100)进行转染HSC-T6细胞经培养,随着MOI增加,HSC-T6细胞荧光表达增强,MOI=10时可见绿色荧光信号,但是MOI从10增至30时细胞生长抑制明显加重,因而最佳MOI为10。HSC-T6细胞经Ad-Smad7-eGFP转染成功后Smad7蛋白和mRNA表达水平显著升高。
2.2各组培养液Smad7和TGF-β1的水平ELISA结果显示,B组、C组和D组培养液TGF-β1蛋白水平较A组显著降低(P<0.01),而Smad7蛋白水平较A组显著升高(P<0.01);D组TGF-β1 蛋白水平较B组和C组显著降低(P<0.01),而Smad7蛋白水平较B组和C组显著升高(P<0.01),具体见表2。
表2各组培养液Smad7、TGF-β1水平的比较(n=6)
Tab.2Comparison of Smad7 and TGF-β1 in culture medium (n=6)
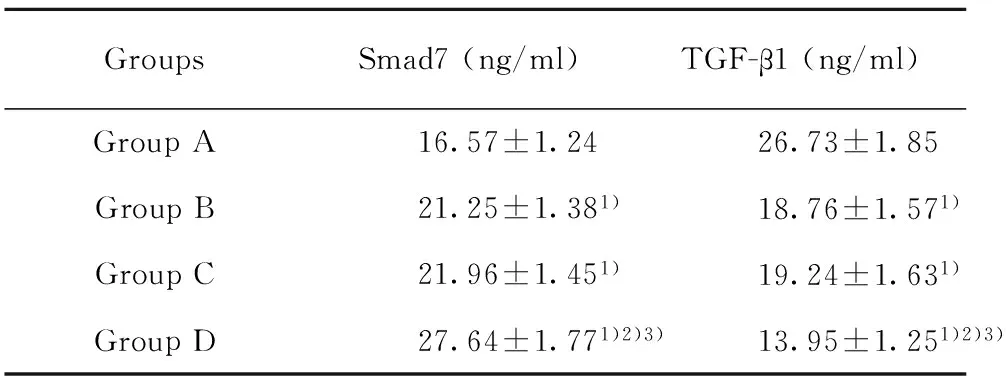
GroupsSmad7(ng/ml)TGF-β1(ng/ml)GroupA16.57±1.2426.73±1.85GroupB21.25±1.381)18.76±1.571)GroupC21.96±1.451)19.24±1.631)GroupD27.64±1.771)2)3)13.95±1.251)2)3)
Note:Compared with group A,1)P<0.01;compared with group B,2)P<0.01;compared with group C,3)P<0.01.
表3各组培养液Smad7、TGF-β1、ColⅠ和α-SMA蛋白表达水平的比较(n=6)
Tab.3Comparison of Smad7, TGF-β1, ColⅠ,and α-MSA in cultured cells (n=6)
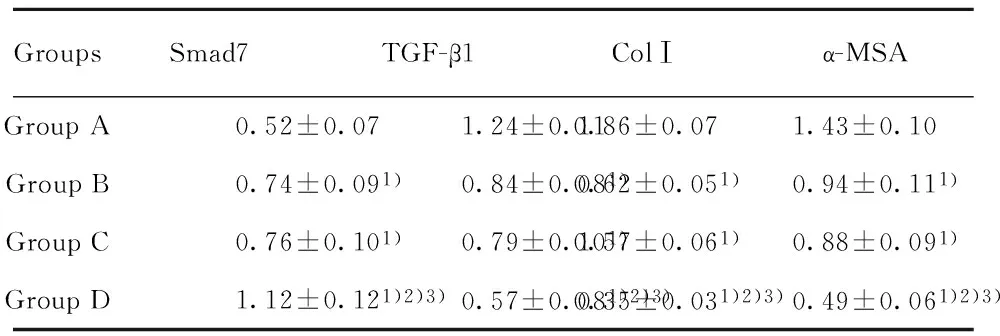
GroupsSmad7TGF-β1ColⅠα-MSAGroupA0.52±0.071.24±0.110.86±0.071.43±0.10GroupB0.74±0.091)0.84±0.081)0.62±0.051)0.94±0.111)GroupC0.76±0.101)0.79±0.101)0.57±0.061)0.88±0.091)GroupD1.12±0.121)2)3)0.57±0.081)2)3)0.35±0.031)2)3)0.49±0.061)2)3)
Note:Compared with group A,1)P<0.01;compared with group B,2)P<0.01;compared with group C,3)P<0.01.
2.3各组细胞Smad7、TGF-β1、ColⅠ和α-SMA 蛋白的表达PCR结果显示,B组、C组和D组TGF-β1、ColⅠ和α-SMA 蛋白表达水平较A组显著降低(P<0.01),而Smad7 蛋白表达水平较A组显著升高(P<0.01);D组TGF-β1、ColⅠ和α-SMA 蛋白表达水平较B组和C组显著降低(P<0.01),而Smad7 蛋白表达水平较B组和C组显著升高(P<0.01),具体见表3。
2.4各组细胞Smad7、TGF-β1、ColⅠ和α-SMA mRNA的表达PCR结果显示,B组、C组和D组TGF-β1、ColⅠ和α-SMA mRNA表达水平较A组显著降低(P<0.01),而Smad7 mRNA表达水平较A组显著升高(P<0.01);D组TGF-β1、ColⅠ和α-SMA mRNA表达水平较B组和C组显著降低(P<0.01),而Smad7 mRNA表达水平较B组和C组显著升高(P<0.01),具体见表4。
2.5各组细胞凋亡情况的比较流式细胞术检测结果显示,B组、C组和D组HSC-T6细胞凋亡率较A组显著升高(P<0.01),而D组细胞凋亡率较B组和C组显著降低(P<0.01),具体见表5。
表4各组细胞Smad7、TGF-β1、ColⅠ和α-SMA mRNA表达水平的比较(n=6)
Tab.4Comparison of mRNA level of Smad7,TGF-β1,ColⅠ,and α-MSA in cultured cells (n=6)
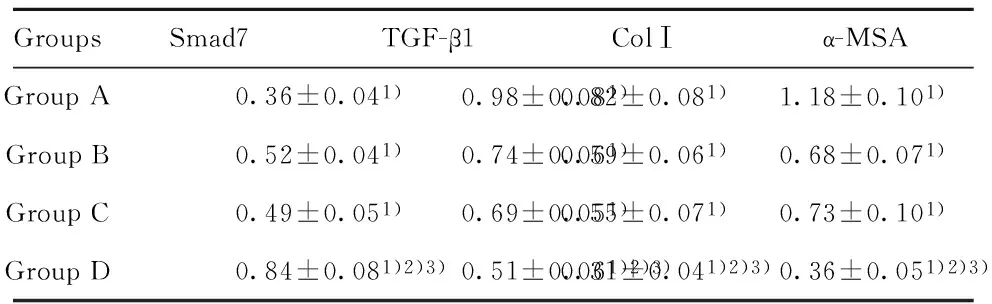
GroupsSmad7TGF-β1ColⅠα-MSAGroupA0.36±0.041)0.98±0.081)0.82±0.081)1.18±0.101)GroupB0.52±0.041)0.74±0.061)0.59±0.061)0.68±0.071)GroupC0.49±0.051)0.69±0.051)0.55±0.071)0.73±0.101)GroupD0.84±0.081)2)3)0.51±0.061)2)3)0.31±0.041)2)3)0.36±0.051)2)3)
Note:Compared with group A,1)P<0.01;compared with group B,2)P<0.01;compared with group C,3)P<0.01.
表5Smad7-EGFP-BMSCs对HSC-T6细胞凋亡的影响(n=6)
Tab.5Impact of Smad7-EGFP-BMSCs on apoptosis of HSC-T6 cells (n=6)

GroupsSmad7GroupA1.87±0.541)GroupB4.83±0.731)GroupC5.22±0.851)GroupD9.48±1.481)2)3)
Note:Compared with group A, 1)P<0.01;compared with group B,2)P<0.01;compared with group C,3)P<0.01.
3 讨论
肝硬化是一种以弥漫性纤维化的肝组织、再生结节和假小叶为特点的慢性疾病,机制至今尚不完全明确。肝纤维化是肝脏受到各种慢性损伤后的自我修复反应,主要表现为EMA的过量合成与沉积。目前普遍认为HSC 是肝脏分泌ECM的主要细胞,HSC 激活是肝纤维化形成的中心环节[8]。正常情况下肝星状细胞处于静息状态,仅合成少量胶原。但是在肝脏疾病过程中,肝星状细胞被激活,分泌大量ColⅠ形成EMA,并特异性表达α-SMA,同时ECM降解减少,最终导致肝纤维化[9]。HSC是肝纤维化基质中ColⅠ的主要来源[10],因此抑制肝星状细胞生成ColⅠ是抑制肝纤维化形成的关键环节[11,12]。
TGF-β1是目前发现的最强的促纤维化因子,它与细胞表面受体结合后可通过TGF-β1/Smads途径传递活化信号,进而促进HSC表型转变、增殖及ECM的合成[13]。Smads蛋白是唯一的TGF-β1受体后信使分子,TGF-β1通过其Ⅰ型和Ⅱ型受体完成信号转导,以激活其下游Smads信号分子的磷酸化,随后引起核转位,进而调控基因的表达。Smads家族中Smad2~4、Smad6和Smad7参与TGF-β的信号转导[14],其中Smad7 是TGF-β1/Smad信号传导途径中重要的负性调节因子,可阻止Smad2、Smad3 的磷酸化,从而对TGF-β1/Smad信号通路发挥负性调控[15]。
BMSCs是一种具有自我更新、多向分化潜能的多能干细胞,可分化为多种骨骼及附属器官组织,参与机体的多项功能调节[16]。最新研究表明,BMSCs是一种免疫特许细胞,自身不表达主要组织相容性复合体及其他共刺激分子,具有对自然杀伤细胞及细胞毒性T细胞的逃逸功能,在骨髓抑制的替代治疗中有很大的应用前景[17]。有研究显示通过静脉注射或体外灌注BMSCs可以提高爆发性肝功能衰竭小鼠存活率[18],另有研究显示BMSCs可改善肝衰竭大鼠的免疫功能和肝脏组织炎性反应坏死状态,促进肝功能的恢复[19],但是其机制却仍未有定论。
本研究结果显示,Smad7-EGFP-BMSCs可降低HSC-T6细胞分泌TGF-β1蛋白水平(P<0.01),而增加Smad7蛋白水平(P<0.01);Smad7-EGFP-BMSCs可降低HSC-T6细胞表达TGF-β1、ColⅠ和α-SMA蛋白和mRNA水平(P<0.01),而增加Smad7蛋白和mRNA水平(P<0.01);Smad7-EGFP-BMSCske促进HSC-T6细胞凋亡(P<0.01)。并且Smad7-EGFP-BMSCs对HSC-T6细胞的上述作用较单独BMSC或Smad7质粒作用更强,这可能与Smad7-EGFP-BMSCs同时发挥BMSCs和Smad7质粒作用因此抗肝纤维化作用更强有关。
总之,Smad7基因质粒转染骨髓间充质干细胞可通过作用肝星状细胞TGF-β1信号转导通路以及促进肝星状细胞凋亡而具有抗肝纤维化的作用。
[1]Koller T,Kollerova J,Huorka M,etal.Noninvasive scoring algorithm to identify significant liver fibrosis among treatment-naïve chronic hepatitis C patients [J].Eur J Gastroenterol Hepatol,2014,26(10):1108-1115.
[2]Fuchs BC,Hoshida Y,Fujii T,etal.Epidermal growth factor receptor inhibition attenuates liver fibrosis and development of hepatocellular carcinoma [J].Hepatology,2014,59(4):1577-1590.
[3]Ghosh AK,Quaggin SE,Vaughan DE.The molecular basis of outraged Fibrosis:potential therapeutic approaches [J].J Exp Biol Med,2013,238(5):461-481.
[4]Yin C,Evason KJ,Asahina K,etal.Hepatic stellate cells in liver development,regeneration,and cancer [J].J Clin Invest,2013,123(5):1902-1910.
[5]王雅蕊,李俊,黄成,等.姜黄素对大鼠肝星状细胞中TGF-β调节的NADPH氧化酶4的激活及Smad信号通路的影响[J].安徽医科大学学报,2015,50(3):319-323.
[6]冯佳,向阳,夏燕,等.益气养阴方对大鼠肺纤维化的干预作用及对Smad2、Smad7蛋白的影响[J].中国免疫学杂志,2015,31(3):334-338.
[7]Ma S,Zhong D,Chen H,etal.The immunomodulatory effect of bone marrow stromal cells (BMSCs) on interleukin(IL)-23/IL-17-mediated ischemic stroke in mice[J].J Neuro-immunol,2013,257(1-2):28-35.
[8]Friedman SL.The mechanisms of hepatic fibrogenesis [J].Gastroenterology,2008,134(6):1655-1669.
[9]Liu Y,Munker S,Mullenbach R,etal.IL-13 Signaling in liver fibrogenesis [J].J Front Immunol,2012,3:116.
[10]Brenner DA,Kisseleva T,Scholten D,etal.The origin of myofibroblasts in liver fibrosis [J].J Fibrogenesis Tissue Repair,2012,5 (S1):17.
[11]Lekkerkerker AN,Aarbiou J,van Es T,etal.The cellular players in lung fibrosis [J].Curr Pharm Des,2012,18(27):4093-4102.
[12]陈厚文,郭梦丹,陈琦,等.TNF-α和IL-13对人肺成纤维细胞胶原蛋白生成的影响[J].中国细胞生物学学报,2011,33(6):667-673.
[13]Liu RM,Gaston Pravia KA.Oxidative stress and glutathione in TGF-beta mediated fibrogenesis [J].J Free Radic Biol Med,2010,48(1): 1-15.
[14]Zhao TT,Zhang HJ,Lu XG,etal.Chai huang-Yishen granule inhibits diabetic kidney disease in rats through blocking TGF-β/Smad3 signaling [J].PLoS One,2014,9(3):e90807.
[15]Moro T,Shimoyama Y,Kushida M,etal.Glycyrrhizin and its metabolite inhibit Smad3-mediated type I collagen gene transcription and suppress experimental murine liver fibrosis [J].Life Sci,2008,83(15-16):531-539.
[16]Alempijevic T,Stulic M,Popovic D,etal.The role of fecal calprotectin in assessment of hepatic encephalopathy in patients with liver cirrhosis [J].Acta Gastroenterol Belg,2014,77(3):302-305.
[17]郭春辉,韩兰秀,万美容,等.失代偿性肝硬化患者骨髓间充质干细胞对自体淋巴细胞增殖的影响及机制研究[J].中华实验和临床病毒学杂志,2015,29(2):100-102.
[18]Parekkadan B,Van Poll D,Suganuma K,etal.Mesenchymal stem cell-derived molecules reverse fulminant hepatic failure [J].PLoS One,2007,2(9):e941.
[19]周锐,周元平,郑玲,等.骨髓间充质干细胞移植对大鼠爆发性肝功能衰竭治疗作用的初步观察[J].中华传染病杂志,2012,30(2):85-89.
[收稿2015-12-03]
(编辑张晓舟)
Effect of Smad7 gene modified BMSCs to TGF-β signal conduction in hepatic stellate cells
SU Dong-Na,WU Shi-Pin.
Department of Infetious Disease,Shenzhen People′s Hospital,Shenzhen 518020,China
Objective:To investigate the mechanism of Smad7 gene modified bone marrow mesenchymal stem cells(Smad7-BMSCs)to prevent hepatic fibrosis in vitro.Methods: Smad7-EGFP-BMSCs were established by isolating and purifying BMSCs of rats,and transfecting Ad-Smad7-EGFP.HSC-T6 were divided into Group A,Group B,Group C and Group D,which were respectively incubated with Smad7-EGFP-BMSCs,BMSCs,Smad7 plasmid and PBS for 72 hours.The level of Smad7and TGF-β1protein in the culture solution was determined by ELISA.The expression of mRNA and protein of Smad7,TGF-β1,Col Ⅰ and α-SMA in the hepatic stellate cells were respectively determined by Western blot and RT-PCR.Cellular apoptosis was determined by flow cytometry.Results: (1)The results of ELISA showed that the level of TGF-β1 protein decreased(P<0.01) but the level of Smad7 protein increased (P<0.01) in Group B,Group C and Group D compared with Group A;the level of TGF-β1 protein decreased(P<0.01) but the level of Smad7 protein increased (P<0.01) in Group D compared with Group B and Group C.(2)The results of Western blot and RT-PCR showed that the level of mRNA and protein of Smad7,TGF-β1,Col Ⅰ and α-SMA decreased(P<0.01) but the level of mRNA and protein of Smad7 protein increased (P<0.01) in Group B,Group C and Group D compared with Group A;the level of mRNA and protein of Smad7,TGF-β1,Col Ⅰ and α-SMA decreased(P<0.01) but the level of mRNA and protein of Smad7 protein increased (P<0.01) in Group D compared with Group B and Group C.(3)The results of flow cytometry showed that the rate of cellular apoptosis decreased(P<0.01),but the level of Smad7 protein increased (P<0.01) in Group B,Group C and Group D compared with Group A;the rate of cellular apoptosis decreased(P<0.01)in Group D compared with Group B and Group C.Conclusion: Smad7-BMSCs can have the effect of anti-hepatic fibrosis by affecting TGF-β1 signal pathway and promoting cellular apoptosis in hepatic stellate cells.
Smad7;BMSCs;Hepatic stellate cells;TGF-β1 signal pathway;Cellular apoptosis
10.3969/j.issn.1000-484X.2016.10.007
苏冬娜(1977年-),女,硕士,主治医师,主要从事病毒性肝炎的发病机制研究,E-mail:sudona@qq.com。
及指导教师:吴诗品(1963年-),男,博士,主任医师,主要从事肝硬化的干细胞治疗研究。
R392
A
1000-484X(2016)10-1441-05
①本文为深圳市科创委立项课题(JCYJ20140416122812003)。