化疗序贯EGFR-TKI治疗EGFR-TKI获得性耐药晚期NSCLC患者的临床观察
王紫润, 戈 伟
(武汉大学人民医院肿瘤Ⅱ科,武汉 430060; *通讯作者,E-mail:gewei514@126.com)
化疗序贯EGFR-TKI治疗EGFR-TKI获得性耐药晚期NSCLC患者的临床观察
王紫润, 戈伟*
(武汉大学人民医院肿瘤Ⅱ科,武汉430060;*通讯作者,E-mail:gewei514@126.com)
目的观察EGFR-TKI获得性耐药的晚期非小细胞肺癌(NSCLC)患者化疗后序贯应用EGFR-TKI药物的临床疗效及不良反应。方法回顾性分析武汉大学人民医院179例一线应用EGFR-TKI药物获得性耐药的EGFR突变阳性的晚期非小细胞肺癌患者,其中化疗序贯EGFR-TKI组(CE组)80例和单纯化疗组(C组)99例,比较两组的客观缓解率、疾病控制率和不良反应。 结果CE组和C组的客观缓解率分别为23.8%和12.1%(P=0.041);疾病控制率分别为78.8%和53.5%(P=0.001);两组不良反应发生率除皮疹(36.3%vs7.0%,P=0.001)外,白细胞减少、中性粒细胞减少、贫血、腹泻、恶心、呕吐、肝功能异常均无统计学差异(P>0.05)。 结论与单纯化疗比较,化疗序贯EGFR-TKI可为EGFR-TKI获得性耐药的晚期NSCLC患者带来更好的临床疗效,且不良反应可耐受。
非小细胞肺癌;EGFR-TKI;获得性耐药;化疗;
肺癌目前在全球是致死率最高的恶性肿瘤,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)约占85%,绝大多数患者发现肺癌时已处于中晚期[1]。一直以来以铂类为主的双药化疗方案在晚期NSCLC治疗中有着不可替代的位置,但其所带来的生存获益已达到平台期[2]。随着分子靶向药物的问世,表皮生长因子受体抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitors,EGFR-TKI)给EGFR基因突变阳性的NSCLC患者带来了希望。在一线用药中,其疗效优于传统双药化疗,且不良反应耐受[3]。
一代EGFR-TKI药物主要包括吉非替尼、厄洛替尼和埃克替尼。尽管其对部分EGFR突变阳性NSCLC患者的客观反应率(ORR)、疾病控制率(DCR)及疾病无进展生存期(PFS)有所提高,但大多数患者在持续用药10-14个月会出现TKI耐药,最终导致治疗失败,出现疾病进展[4]。EGFR-TKI获得性耐药即EGFR突变阳性患者在EGFR-TKI药物初治有效后单一治疗中出现疾病进展,标准由Jackman等[5]在2010年所提出。肿瘤进展后传统的治疗方案是停止EGFR-TKI药物并开始新的化疗或支持治疗。但有研究表明,获得性耐药中存在异质性肿瘤类型,其中一部分仍对EGFR-TKI敏感。当获得性耐药的患者停止使用TKI药物,肿瘤生长可能加速,再给予EGFR-TKI药物时肿瘤生长抑制[6]。EGFR-TKI耐药进展后患者的治疗及预后是目前临床亟待解决的问题,但目前尚缺乏最佳治疗模式。因此,本研究回顾性分析我院179例获得性EGFR-TKI耐药的中晚期NSCLC患者应用单纯化疗和化疗序贯EGFR-TKI治疗的临床疗效和不良反应,具体情况如下。
1 资料与方法
1.1研究对象
收集2011-01~2015-01武汉大学人民医院连续收治的晚期非小细胞肺癌患者的临床资料。
1.2纳入标准
①经细胞学或组织病理学检查确诊为NSCLC;②临床分期为ⅢB期或Ⅳ期;③接受EGFR基因突变检测且均为敏感突变类型;④既往一线接受EGFR-TKI制剂治疗并产生耐药(以Jackman提出的耐药标准为依据);⑤至少有1个可测量病灶;⑥体力状况评分(PS)≤2分;⑦EGFR-TKI耐药后至少接受2周期的化疗。
1.3研究方法
回顾性分析所收集患者的临床资料,包括年龄、性别、吸烟状况、PS评分、TNM分期、病理类型、EGFR突变类型、EGFR-TKI药物的选择、疾病进展时间、末次随访时间、死亡时间。
1.4治疗方法
单纯化疗组的患者在获得性耐药后停用EGFR-TKI药物,仅给予以铂类为基础的双药标准化疗方案。序贯治疗组的患者在获得性耐药后给予化疗序贯EGFR-TKI药物,化疗方案同单纯化疗组,直至肿瘤进展或出现不可耐受的不良反应为止。两组患者均接受至少2周期(21 d为1个周期)的治疗。
1.5疗效评价指标
根据WHO实体瘤的疗效评价准则,近期疗效指标:完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、稳定(stable disease,SD)、进展(progression,PD)、客观缓解率(objective response rate,ORR)、疾病控制率(disease control rate,DCR)。
1.6统计学方法
采用SPSS19.0软件对收集的数据进行分析。各组间临床特征、治疗疗效及不良反应的比较采用χ2检验。
2 结果
2.1纳入患者的临床特征
共查询到179例EGFR基因突变阳性患者在一线应用TKI药物后产生耐药,平均使用EGFR-TKI药物时间10.2个月,其中19号、21号和少见敏感突变分别为92例(51.4%)、74例(41.4%)和13例(7.2%)。随后这179例患者均接受以铂类为基础的双药联合化疗。其中80例患者化疗后序贯EGFR-TKI药物(吉非替尼、厄洛替尼、埃克替尼)治疗,即为CE组;99例患者停止使用EGFR-TKI药物治疗,即为C组。两组患者临床特征比较无明显差异(见表1)。
表1两组患者临床特征比较(例)
Table 1Comparison of clinical characteristics between two groups(cases)
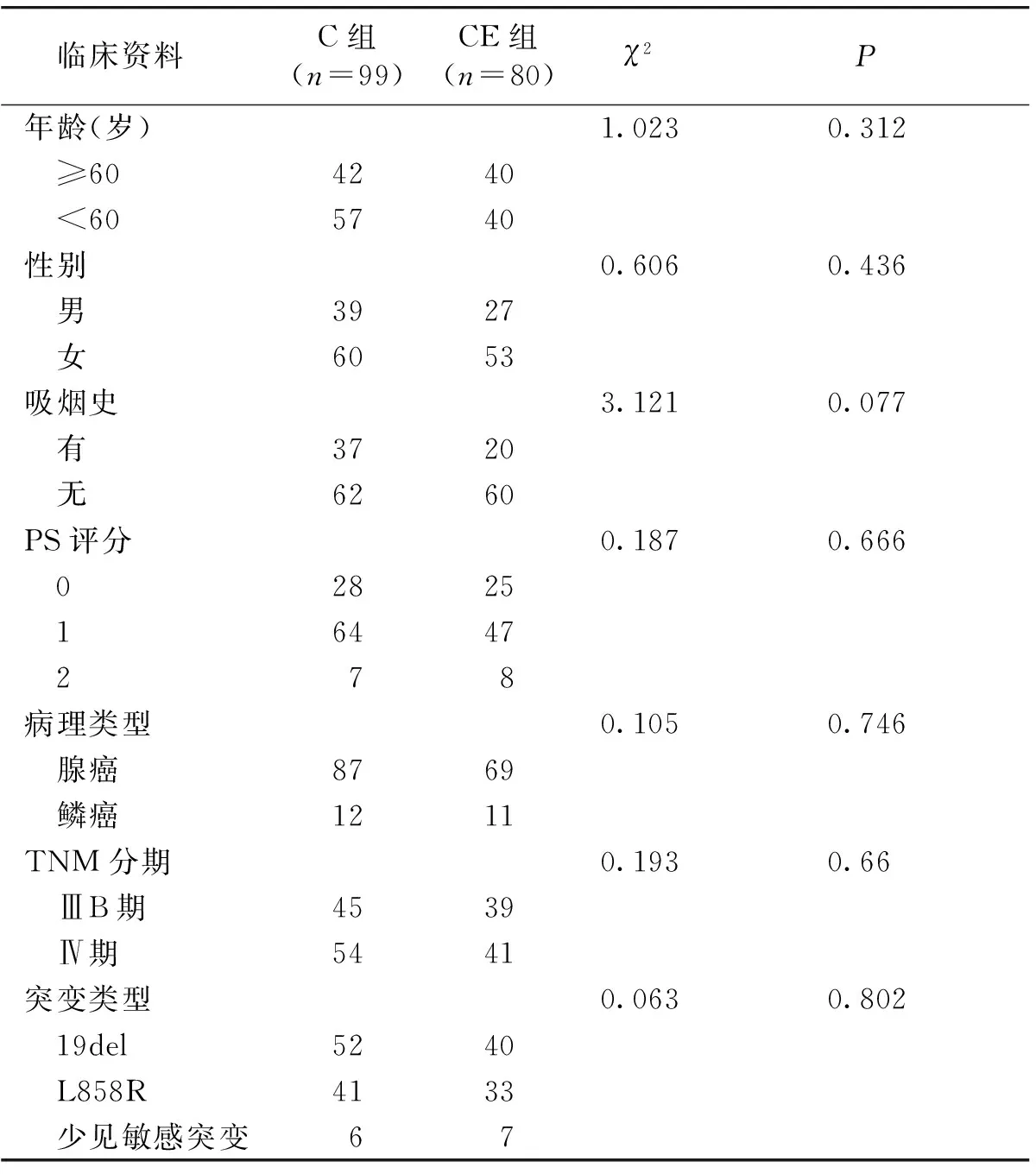
临床资料 C组(n=99)CE组(n=80)χ2P年龄(岁)1.0230.312 ≥604240 <605740性别0.6060.436 男3927 女6053吸烟史3.1210.077 有3720 无6260PS评分0.1870.666 02825 16447 278病理类型0.1050.746 腺癌8769 鳞癌1211TNM分期0.1930.66 ⅢB期4539 Ⅳ期5441突变类型0.0630.802 19del5240 L858R4133 少见敏感突变67
2.2治疗疗效
所有患者均接受2周期以上治疗,两组患者的SD差异无统计学意义,但CE组的客观缓解率(23.8%)高于C组(12.1%),且差异有统计学意义(P=0.041);CE组的疾病控制率(78.8%)也高于C组(53.5%),且差异有统计学意义(P=0.001,见表2)。
表2两组患者近期疗效比较
Table 2Comparison of short-term response bwteen two groups
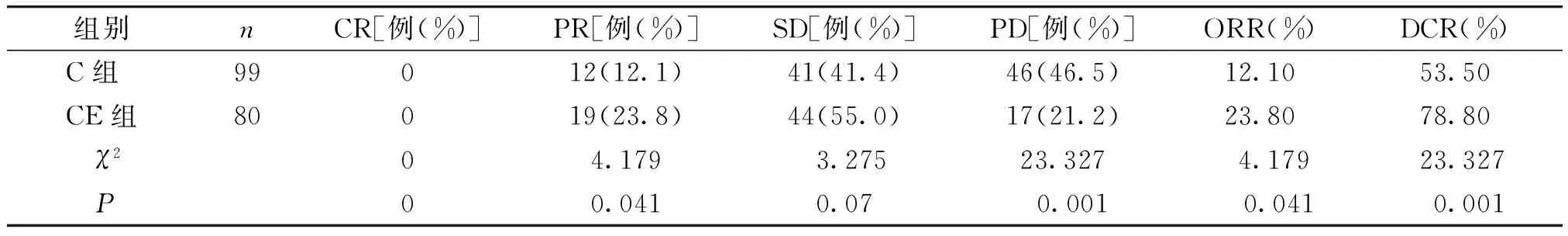
组别nCR[例(%)]PR[例(%)]SD[例(%)]PD[例(%)]ORR(%)DCR(%)C组99012(12.1)41(41.4)46(46.5)12.1053.50CE组80019(23.8)44(55.0)17(21.2)23.8078.80 χ204.1793.27523.327 4.17923.327 P00.0410.070.001 0.041 0.001
2.3不良反应
两组主要毒性反应包括血液学毒性(白细胞减少、中性粒细胞减少、贫血)、胃肠道反应(腹泻、恶心、呕吐)、肝功能异常和皮疹。其中C组的皮疹发生率显著低于CE组(7.0%vs36.3%),且差异有显著统计学意义(P<0.001),CE组中白细胞减少(38.6%vs36.4%)、中性粒细胞减少(28.3%vs26.3%)、贫血(15.1%vs12.1%)、腹泻(18.8%vs14.1%)、恶心呕吐(25.0%vs22.2%)、肝功能异常(20.0%vs15.2%)的发生率均高于C组,但两组间差异无统计学意义(见表3)。
表3两组患者不良反应比较例(%)
Table 3Ccomparison of adverse effects between two groups cases(%)

不良反应C组(n=99)CE组(n=80)ⅠⅡⅢⅣⅠⅡⅢⅣχ2P皮疹5(5.0)2(2.0)0 0 17(21.3)9(11.3)3(3.8) 0 22.674 0.001腹泻9(9.1)4(4.0) 1(1.0) 0 10(12.5)4(5.0)1(1.3) 0 0.6920.603恶心、呕吐17(17.1)5(5.1) 0 0 15(18.7)5(6.3)0 0 0.0760.663白细胞减少23(23.2)9(9.1) 3(3.0) 1(1.0)20(25.0)7(8.8)3(3.8) 1(1.3)0.1080.743中性粒细胞减少18(18.2)6(6.1) 1(1.0) 1(1.0)15(18.8)6(7.5)1(1.3) 1(1.3)0.1380.711贫血7(7.1)4(4.0) 1(1.0) 0 6(7.5)4(5.0)1(1.3) 1(1.3)0.3160.574肝功能异常10(10.1)5(5.1) 0 0 10(12.5)6(7.5)0 0 0.7260.494
3 讨论
虽然许多EGFR突变患者在疾病初治时对EGFR-TKI药物表现出良好的反应性,但最终因为耐药而导致疾病进展。目前有关TKI耐药的机制有多种说法,主要包括:EGFR二次点突变(T790M、D761Y、T854A、L747S等)、MET基因扩增、EGFR突变基因丢失或拷贝数下降、NSCLC向小细胞肺癌的组织学转变等[4]。最常见的获得性耐药机制是在ATP结合位点的T790M发生突变,研究发现约50%的TKI获得性耐药患者存在T790M突变,即酪氨酸激酶活化区790位点的苏氨酸(T)被蛋氨酸(M)取代,进而削弱TKI药物与EGFR催化区域内的ATP位点结合[7]。目前正在研究的三代EGFR-TKI药物(AZD9291,Rocilectinib)主要针对EGFR敏感突变及T790M耐药突变,并在Ⅰ期临床研究中获得可观疗效[8,9]。
EGFR-TKI耐药的治疗策略主要包括:停用TKI药物、继续TKI治疗、TKI+局部治疗、TKI+化疗、TKI+其他分子靶向治疗等[4]。研究发现TKI耐药患者停用TKI药物后可增加肿瘤爆发风险,Nishino等[6]通过对应用吉非替尼治疗后进展的NSCLC患者进行回顾性分析发现,进展后继续应用TKI患者的中位生存期较停药患者显著延长(33.8个月vs26.5个月,P=0.035),Chen等[10]对227例TKI耐药后停止治疗的NSCLC患者进行回顾性分析发现,肿瘤爆发组较无肿瘤爆发组患者的OS缩短(16.6个月vs21.6个月),且差异有统计学意义(P<0.002)。这可能是由于耐药后的患者体内仍存在对TKI敏感的肿瘤细胞,在继续应用TKI后可持续获益。由此可见,TKI耐药后停药可增加肿瘤爆发的风险,从而缩短患者生存期。
针对EGFR-TKI耐药的非小细胞肺癌患者,化疗是治疗肿瘤耐药细胞的一种治疗方法。2015年NCCN指南对于EGFR-TKI耐药后有多部位转移症状的NSCLC患者推荐给予化疗联合TKI或不联合TKI治疗[11],然而在临床中,TKI药物联合化疗在一线TKI耐药后的NSLCL患者治疗中的疗效一直备受争议。这是由于EGFR-TKI可诱导肿瘤细胞停滞在G1期,影响细胞周期特异性化疗药物的疗效。IMPRESS研究提示一线应用吉非替尼进展后继续应用吉非替尼联合化疗较单用化疗患者的PFS(5.4个月vs5.4个月,P=0.273)、ORR(34.1%vs31.6%,P=0.76)及DCR(78.8%vs84.2%,P=0.31)并无获益[12]。这一结果并不支持一线TKI耐药后患者应用化疗同步TKI治疗,但化疗序贯EGFR-TKI治疗能否给这类患者带来获益呢?
本研究通过对我院179例EGFR-TKI耐药患者进行回顾性分析发现,耐药后应用化疗序贯TKI治疗较单纯化疗组在客观缓解率(23.8%vs12.1%,P=0.041)和疾病控制率(78.8%vs53.5%,P=0.001)上都有所提高,且差异有统计学意义,不良反应除皮疹外均无显著差异。由此可见化疗序贯EGFR-TKI药物可使EGFR-TKI耐药的晚期非小细胞患者获得临床获益且安全性较好。Li等[13]通过对36例患者的回顾性研究也发现化疗序贯EGFR-TKI和化疗组的客观缓解率分别为7.4%和0(P=0.557)、疾病控制率分别为81.5%和44.4%(P=0.046)、中位无进展生存期分别为3.3个月和2.5个月(P=0.587)。两组间的不良反应率无显著性差异(P>0.05)。这与本研究所得结果部分一致。由于本研究针对患者远期疗效评价仍在随访中,结果尚未成熟,故在本文中尚未提及,因此序贯治疗此类患者所获得的远期疗效仍需进一步的研究。
虽然化疗序贯EGFR-TKI治疗能给EGFR-TKI耐药患者带来部分临床疗效,但由于耐药患者中大部分都存在相关基因突变,根据耐药分子的机制选择相应的治疗模式可能会给患者带来更大的生存获益。研究发现,非小细胞肺癌患者耐药后在治疗过程中其机制亦在发生不断改变[4]。因此,对于EGFR基因突变阳性的患者,在耐药后再次活检,根据其耐药机制研究相应靶点药物对于其后续治疗有极大的指导意义。
综上所述,化疗序贯EGFR-TKI较单纯化疗可给EGFR-TKI获得性耐药的晚期NSCLC患者带来更好的临床疗效,且不良反应可耐受。未来针对EGFR基因耐药的患者需要更深入研究其相应靶点来提高治疗疗效。
[1]Siegel RL,Miller KD,Jemal A.Cancer statistics,2015[J].CA Cancer J Clin,2015,65(1):5-29.
[2]Fennell DA,Summers Y,Cadranel J,etal.Cisplatin in the modern era: The backbone of first-line chemotherapy for non-small cell lung cancer[J]. Cancer Treat Rev, 2016,44:42-50.
[3]曹飞飞,张琳琳,王双等.EGFR-TKI与化疗比较一线治疗非小细胞肺癌疗效的meta分析[J].中国肺癌杂志,2015,18(3):146-154.
[4]Forde PM,Ettinger DS.Managing acquired resistance in EGFR-mutated non-small cell lung cancer[J].Clin Adv Hematol Oncol,2015,13(8):528-532.
[5]Jackman D,Pao W,Riely GJ,etal.Clinical definition of acquired resistance to epidermal growth factor receptor tyrosine kinase inhibitors in non-small-cell lung cancer[J].J Clin Oncol,2010,28(2):357-360.
[6]Nishino K,Imamura F,Morita S,etal.A retrospective analysis of 335 Japanese lung cancer patients who responded to initial gefitinib treatment[J].Lung Cancer,2013,82(2):299-304.
[7]Sueoka-Aragane N,Katakami N,Satouchi M,etal.Monitoring EGFR T790M with plasma DNA from lung cancer patients in a prospective observational study[J].Cancer Sci,2016,107(2):162-167.
[8]Janne PA,Yang JC,Kim DW,etal.AZD9291 in EGFR inhibitor-resistant non-small-cell lung cancer[J].N Engl J Med,2015,372(18):1689-1699.
[9]Sequist LV,Soria JC,Goldman JW,etal. Rociletinib in EGFR-mutated non-small-cell lung cancer[J].N Engl J Med,2015,372(18):1700-1709.
[10]Chen HJ,Yan HH,Yang JJ,etal.Disease flare after EGFR tyrosine kinase inhibitor cessation predicts poor survival in patients with non-small cell lung cancer[J].Pathol Oncol Res,2013,19(4):833-838.
[11]Wood DE.National Comprehensive Cancer Network(NCCN)clinical practice guidelines for lung cancer screening[J].Thorac Surg Clin,2015,25(2):185-197.
[12]Soria JC,Wu YL,Nakagawa K,etal.Gefitinib plus chemotherapy versus placebo plus chemotherapy in EGFR-mutation-positive non-small-cell lung cancer after progression on first-line gefitinib(IMPRESS):a phase 3 randomised trial[J].Lancet Oncol,2015,16(8):990-998.
[13]李佳旻,洪群英,张新,等.化疗序贯EGFR-TKI治疗晚期非小细胞肺癌EGFR-TKI获得性耐药患者的效果和安全性[J].中华医学杂志,2014,94(30):2342-2345.
Clinical observation of chemotherapy sequential EGFR-TKI in treatment of advanced non-small cell lung cancer patients with EGFR-TKI acquired resistance
WANG Zirun, GE Wei*
(DepartmentofOncologyWardⅡ,RenminHospitalofWuhanUniversity,Wuhan430060,China;*Correspondingauthor,E-mail:gewei514@126.com)
ObjectiveTo explore the therapeutic efficacy and safety of chemotherapy sequential epidermal growth factor receptor-tyrosine kinase inhibitor(EGFR-TKI) for advanced non-small cell lung cancer(NSCLC) patients with EGFR-TKI acquired resistance.MethodsThe clinical features of 179 advanced NSCLC patients with EGFR mutation positive and EGFR-TKI acquired resistance in Renmin Hospital of Wuhan University were retrospectively reviewed. Eighty of them received chemotherapy sequential EGFR-TKI in CE group and another ninety-nine accepted chemotherapy alone in control group.The objective response rates, disease control rates and adverse effects were compared between two groups.ResultsThe objective response rates in CE group and control group were respectively 23.8% and 12.1%(P=0.041),and disease control rates were 78.8% and 53.5%(P=0.001).Expect rash(36.3%vs7.0%,P<0.001),no significant difference existed in the rates of leukopenia, neutropenia, anemia, diarrhea, nausea, vomiting, abnormal liver function between two groups.ConclusionCompared with chemotherapy alone, chemotherapy sequential EGFR-TKI could bring better clinical efficacy for NSCLC patients with EGFR-TKI acquired resistance, and the adverse effects could be tolerated.
non-small cell lung cancer(NSCLC);epidermal growth factor receptor-tyrosine kinase inhibitor(EGFR-TKI);acquired resistance;chemotherapy
王紫润,女,1990-12生,在读硕士,E-mail:810605818@qq.com
2016-08-21
R734.2
A
1007-6611(2016)10-0914-04DOI:10.13753/j.issn.1007-6611.2016.10.008

