Rab1A siRNA对SGC7901胃癌细胞增殖和凋亡的影响
郑 琪, 廖子君 , 赵凌宇, 李 旭, 张 茜, 翟 阳
(1西安交通大学医学院附属陕西省肿瘤医院内一科,西安 710061; 2西安交通大学医学院遗传学教研室)
Rab1A siRNA对SGC7901胃癌细胞增殖和凋亡的影响
郑琪1, 廖子君1, 赵凌宇2, 李旭1, 张茜1, 翟阳1
(1西安交通大学医学院附属陕西省肿瘤医院内一科,西安710061;2西安交通大学医学院遗传学教研室)
目的观察Rab1A在胃癌组织的表达及其对胃癌细胞SGC7901增殖和凋亡的影响。方法收集35例胃癌患者的胃癌组织及正常胃组织,用real-time PCR和Western blot法检测胃癌组织和正常胃组织中Rab1A表达水平。SGC7901胃癌细胞分为对照组,阴性对照组,Rab1A siRNA 30 nmol/L组,60 nmol/L组和90 nmol/L组,分别给予无效处理、阴性对照siRNA和三种不同浓度的Rab1A siRNA,MTT法检测各组细胞增殖活力。60 nmol/L的Rab1A siRNA沉默SGC7901细胞中Rab1A的表达,流式细胞仪分析Rab1A siRNA对细胞周期和细胞凋亡的影响,Western blot法检测Rab1A siRNA对Bax和Bcl-2蛋白表达的影响。结果胃癌组织中Rab1A的表达无论在mRNA水平(5.625±0.525vs1.000±0.000,P<0.05)还是蛋白水平(1.013±0.125vs0.219±0.060,P<0.05),均显著高于正常胃组织。RNA干扰48 h后,与对照组相比,30 nmol/LRab1A siRNA组的细胞增殖活力无明显变化(P>0.05),60 nmol/LRab1A siRNA组和90 nmol/LRab1A siRNA组的细胞增殖活力明显下降(P<0.05),但60 nmol/L组和90 nmol/L组间细胞增殖活力无明显差异(P>0.05)。与对照组相比,60 nmol/L siRNA组无论是G1/G0期、S期,还是G2/M期的细胞数量均无明显差异(P>0.05);与对照组相比,60 nmol/L siRNA组无论是早期凋亡细胞比例,还是晚期凋亡细胞的比例均明显上升(P<0.05);而且,与对照组相比,60 nmol/L siRNA组的Bax蛋白的表达水平显著上调(0.483±0.015vs0.767±0.153,P<0.05),Bcl-2蛋白的表达水平显著下调(0.703±0.021vs0.347±0.015,P<0.05)。结论Rab1A在胃癌组织中的表达水平高于正常胃组织,可促进胃癌细胞SGC7901增殖,并且通过上调Bcl-2和下调Bax的表达抑制细胞凋亡。
Rab1A;胃癌;细胞增殖;细胞凋亡
全世界胃癌的年死亡人数在所有恶性肿瘤中排第3位,仅次于肺癌和肝癌[1]。中国胃癌的年发病人数占全球胃癌年发病人数的44.2%[2],且大多数患者确诊时已经处于进展期。尽管化疗改善了进展期胃癌的预后,但其中位生存时间不足1年[3]。胃癌在我国具有较高的发病率和死亡率,有必要深入研究其发病机制,改善其诊疗水平。
Rab蛋白属于小分子三磷酸鸟苷(GTP)结合蛋白,是GTPases的Ras超家族成员之一,与胞内蛋白在各细胞器之间的运输有关,分二磷酸鸟苷(GDP)结合的无活性形式和GTP结合的活性形式[4]。Rab蛋白作为细胞内囊泡运输的分子开关,与其上游调控子和下游特定的效应子相互作用,并与GTP的结合和水解过程相偶联,在囊泡运输的不同阶段发挥作用。
Rab蛋白的异常表达与肿瘤的发生、发展密切相关[5]。研究发现,Rab1A在舌癌、结直肠癌、乳腺癌和肝癌组织中呈高表达[6-8],且能够调控肿瘤细胞的生物学行为。然而,目前有关Rab1A与胃癌的关系少见报道。本研究检测了Rab1A在胃癌组织中的表达,并研究其对胃癌细胞SGC7901增殖和凋亡的调控作用。
1 材料与方法
1.1胃癌组织与细胞株
35例胃癌患者的胃癌组织及相应的正常组织(胃癌手术切除标本中距离癌组织边缘超过5 cm,且经病理科医师鉴定为正常组织的胃组织)、胃癌细胞株SGC-7901由西安交通大学医学院教育部环境与基因相关疾病重点实验室提供。所有患者均确诊为胃腺癌,排除少见病理类型(鳞癌,小细胞癌等)。所有患者平均年龄55岁,60岁以下的患者15例,60岁及以上的患者20例;男性22例,女性13例;病理诊断为中、高分化腺癌的患者18例,低分化腺癌的患者17例;TNM分期Ⅰ-Ⅱ期的患者16例,Ⅲ-Ⅳ期的患者19例;无淋巴结转移的患者10例,伴有淋巴结转移的患者25例。
1.2主要试剂
Rab1A-siRNA由上海吉玛公司设计与合成;Annexin Ⅴ-FITC凋亡试剂盒购于美国BD Bioscience公司;Rab1A一抗、Bcl-2一抗、Bax一抗、β-Actin一抗及二抗均购于美国Santa Cruz公司;ECL化学发光底物试剂盒购于美国Pierce公司;RIPA裂解液购于上海碧云天生物技术有限公司;LipofectamineTM2000转染试剂盒和TRIzol Reagent购于美国Invitrogen公司;逆转录试剂盒TaKaRa Ex Taq HS 和SYBRR Premix Ex TaqTMkit购于中国TaKaRa公司;RPMI-1640细胞培养基、10%新生牛血清购于美国Gibco公司;MTT、胰蛋白酶、RnaseA、碘化丙啶(PI)购于美国Sigma公司。Rab1A鼠单克隆抗体(1∶1 000稀释)、Bcl-2鼠单克隆抗体(1∶1 000稀释)、Bax鼠单克隆抗体(1∶1 000稀释)、β-Actin兔单克隆抗体(1∶5 000稀释)和HRP标记的羊抗兔/羊抗鼠二抗(1∶2 500稀释),实验所用的抗体均为鼠源单克隆抗体,购自Santa公司。
1.3细胞的培养和转染
常规复苏SGC-7901胃癌细胞,培养于10%新生牛血清的RPMI1640培养基中(加入100 U/ml青霉素和100 μg/ml链霉素),置于37 ℃、5%CO2孵箱中培养,达到对数生长期后使用胰酶消化并传代。
按照LipofectamineTM2000转染试剂盒的操作说明书,用不含有抗生素含血清的RPMI1640培养液重悬SGC-7901细胞,调整细胞浓度,接种于96孔细胞培养板中,放置于37 ℃、5%CO2孵箱中过夜。
将Rab1A-siRNA(sense:5′-GUU CAG CCA UUU UGU AUC ATT-3′,antisense:5′-UGA UAC AAA AUG GCU GAA CTT-3′)和negative siRNA (NC-siRNA,sense:5′-UUC UCC GAA CGU GUC ACG UTT-3′, antisense:5′-ACG UGA CAC GUU CGG AGA ATT-3′)瞬时转染SGC-7901细胞,在不含血清和抗生素的细胞培养液中培养4-6 h,然后更换新鲜的含10%新生牛血清的RPMI1640 全培养基,分别收集培养24 h,48 h,72 h的细胞进行MTT实验。
1.4MTT法检测细胞增殖活力
SGC-7901胃癌细胞复苏并培养后,选择对数生长期的细胞,以1×105/ml的浓度接种于96孔细胞培养板,每孔加200 μl,培养48 h,行瞬时转染。阴性对照siRNA是取靶基因特异性siRNA的部分序列合成,用来验证siRNA对靶基因抑制的特异性。实验分组:对照组(control组)、NC-siRNA组(60 nmol/L)、30 nmol/L siRNA组、60 nmol/L siRNA组、90 nmol/L siRNA组。每组设5个复孔,细胞转染完成后,分别继续培养24 h,48 h,72 h,向培养不同时间的细胞中加入5 mg/ml MTT 溶液20 μl,在37 ℃、5%CO2的孵箱中继续培养4 h,弃去培养板孔内培养液,每孔中加入150 μl DMSO,震荡5 min,然后在POLARstar+OPTIMA微板测试仪上检测每孔光吸收值(OD值检测波长为490 nm)。
1.5细胞周期检测
收集转染48 h的各组细胞,首先用预冷的PBS缓冲液洗涤2次,然后加入250 μl PBS液重悬细胞,逐滴加入750 μl无水乙醇,加入同时不断摇动离心管,使乙醇最终浓度为75%,细胞置4 ℃过夜。固定后的细胞用PBS缓冲液洗涤1次,加入0.3 ml无DNase的RnaseA(浓度为100 μg/ml)重悬细胞,再加入0.3 ml PI染液(浓度为100 μg/ml),混合均匀后在室温下避光孵育20 min,用流式细胞仪(FACS)检测。激发波长为488 nm,PI的红色荧光通过630 nm的滤光片进行收集,使用BD FACSort CellQuest软件获取数据,Modfit LT软件分析DNA含量变化。
1.6细胞凋亡检测(Annexin-PI)
收集Rab1A-siRNA转染48 h的各组SGC7901细胞,制备成单细胞悬液,PBS缓冲液洗涤2次。然后用300 μl结合缓冲液重新悬浮细胞,调整其浓度为1×105/ml。5 ml的流式管中加入100 μl的细胞悬液,再加入5 μl的 Annexin Ⅴ/FITC、5 μl的碘化丙锭(20 μg/ml),避光混匀后孵育20 min,最后在流式管中加入400 μl PBS缓冲液。流式细胞仪检测光源为488 nm氩离子激光器,FITC受激发后发绿色荧光,PI发红色荧光,检测结果使用随机软件分析。
1.7real time PCR检测Rab1A mRNA表达水平
在转染48 h的各组细胞和临床标本组织中分别加入适量Trizol裂解细胞。用氯仿、异丙醇、75%的乙醇提取总RNA。逆转录,用总RNA 2.0 μg,oligo(dT)18 1 μl (0.5 μg),5×Buffer 4 μl,10 mmol/L dNTP 2 μl,RNasin 0.5 μl,补去离子水至18 μl,MMuLV 2 μl 。逆转录反应:42 ℃、15 min,灭活逆转录酶:95 ℃、2 min。经过上述反应得到逆转录反应液,加入RT-PCR反应体系。real time PCR反应,依据人SGC7901细胞Rab1A的 cDNA 序列(FLAG Tag Sequence:5′-GATTACAAGGATGACGACGATAAG-3′),设计real time PCR 引物。测序引物: T7 5′-TAATACGACTCACTATAGGG-3′,BGH 5′-TAGAAGGCACAGTCGAGG-3′;干扰序列:Rab1A-RT-F Forward:5′-GGGAAAACAATCAAGCTTCAAA-3′,Rab1A-RT-R Reverse:5′-CTGGAGGTGATTGTTCGAAAT-3′;管家基因:GAPDH Forward:5′-AGCCACATCGCTCAGACAC-3′,GAPDH Reverse:5′-GCCCAATACGACCAAATCC-3′。
real time PCR扩增条件:94 ℃变性2 min,按94 ℃ 30 s,54 ℃ 30 s,72 ℃ 60 s×30 个循环,再于72 ℃延伸10 min。用2-ΔΔCt法对real time PCR的结果进行相对定量统计,2-ΔΔCt表示处理组相对于对照组的扩增倍数。其中ΔΔCt=(实验组Ct值-内参Ct值)-(对照组Ct值-内参Ct值);Ct值即循环阈值,指在real time PCR 循环过程中荧光信号开始由本底进入指数增长阶段拐点所对应的循环次数。1.8Western blot检测凋亡相关蛋白的表达
收集临床标本组织和转染48 h的各组细胞,加入RIPA细胞裂解液,提取细胞总蛋白,使用BCA试剂盒检测蛋白浓度。变性后取50 μg 蛋白,在10%十二烷基硫酸聚丙烯酰胺凝胶(SDS-PAGE)电泳后,半干转至PVDF 膜上,根据分子量的大小切取条带,脱脂奶粉室温震荡封闭2 h,分别加入Rab1A鼠单克隆抗体(1∶1 000稀释)、Bcl-2鼠单克隆抗体(1∶1 000稀释)、Bax鼠单克隆抗体(1∶1 000稀释)、β-actin兔单克隆抗体(1∶5 000稀释),4 ℃冰箱孵育过夜,TBST洗膜3次(10 min/次)。然后与HRP标记的羊抗兔/羊抗鼠二抗(1∶2 500稀释)室温孵育2 h,TBST洗膜3次,10 min/次。加入免疫印迹化学发光剂,置于Syngene G Box凝胶成像仪的暗箱中拍照。使用GeneTools软件(英国SYNGENE公司)分析结果,计算条带的积分光密度(optic density,OD)值,半定量分析。以上所有细胞实验重复3次。
1.9统计学分析

2 结果
2.1Rab1A在人胃癌组织中的表达
应用Real time PCR和Western blot法检测35例胃癌患者的癌组织和相应正常胃组织中Rab1A的mRNA和蛋白表达水平,结果显示,胃癌组织中Rab1A mRNA表达水平显著高于胃正常组织(5.625±0.525vs1.000±0.000,P<0.05,见图1),Rab1A蛋白表达水平也显著高于胃正常组织(1.013±0.125vs0.219±0.060,P<0.05,见图2)。2.2Rab1A对胃癌SGC-7901细胞增殖活力的影响
NC-siRNA 组RNA干扰不同时间其细胞增殖活力均较对照组无明显变化(P>0.05); 30 nmol/L siRNA组在RNA干扰24h,48h后,细胞增殖活力较对照组无明显变化(P>0.05),作用72 h后才较对照组出现轻度下降(P<0.05);60 nmol/L siRNA组除了在RNA干扰24 h后较对照组细胞增殖活力无明显下降外,在48 h,72 h与对照组、NC-siRNA组和30 nmol/L组比较其增殖活力均出现明显下降(P<0.05);干扰24 h,48 h,72 h后,与对照组、NC-siRNA 组、30 nmol/L组相比,90 nmol/L siRNA组细胞增殖活力均明显下降(P<0.05);60 nmol/L siRNA组和90 nmol/L组的细胞增殖活力,在RNA干扰不同时间均无明显差异(P>0.05,见表1)。

与正常胃组织比较,*P<0.05图1 人胃癌组织中Rab1A mRNA表达的变化 (n=35)Figure 1 Real-time PCR results of Rab1A mRNA expression in human gastric cancer tissues (n=35)
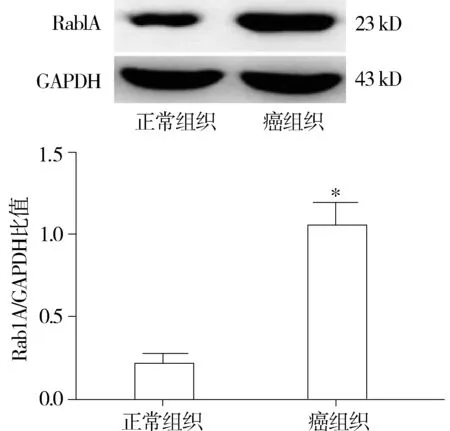
与正常组织比较,*P<0.05图2 人胃癌组织中Rab1A蛋白表达的Western blot结果(n=35)Figure 2 Western blot results of Rab1A protein expression in human gastric cancer tissues(n=35)
表1Rab1A siRNA对胃癌细胞SGC7901增殖活力的影响(OD值)
Table 1Effects of Rab1A siRNA on the cell proliferation ability of SGC7901 gastric cancer cells (OD value)

组别24h48h72h对照组0.386±0.0780.757±0.0431.112±0.045NC-siRNA组0.414±0.0140.743±0.0431.077±0.05130nmol/LsiRNA组0.410±0.0270.729±0.0291.025±0.043*60nmol/LsiRNA组0.318±0.011#Δ0.543±0.031*#Δ0.734±0.037*#Δ90nmol/LsiRNA组0.286±0.019*#Δ0.486±0.025*#Δ0.687±0.035*#Δ
与对照组比较,*P<0.05;与NC-siRNA比较,#P<0.05;与30 nmol/L siRNA组相比,ΔP<0.05
阴性对照siRNA作用后,Rab1A的表达水平较对照组无明显变化(0.965±0.025vs1.000±0.000,P>0.05,见图3);60 nmol/L Rab1A siRNA作用于SGC7901细胞后,Rab1A的mRNA表达水平较对照组显著下降(0.351±0.035vs1.000±0.000,P<0.05,见图3)。
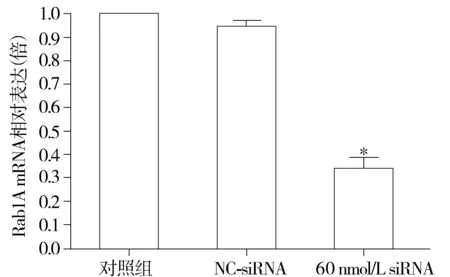
与对照组比较,*P<0.05图3 Rab1A siRNA(60 nmol/L)可有效沉默SGC7901胃癌细胞中Rab1A mRNA的表达Figure 3 Effect of Rab1A siRNA(60 nmol/L) on the expression of Rab1A mRNA in SGC7901 gastric cancer cells
2.3Rab1A对胃癌SGC-7901细胞周期的影响
SGC-7901细胞转染Rab1A siRNA后培养48 h,消化分散为单个细胞,应用流式细胞仪检测细胞周期。与对照组相比,60 nmol/L Rab1A siRNA组G1/G0期细胞数量无显著增加,S期细胞数量无显著减少(P>0.05),G2/M期细胞数量也无明显减少(P>0.05),说明60 nmol/L Rab1A siRNA对SGC701细胞周期影响不明显;NC-siRNA组与各组相比,其细胞数量也无明显变化(P>0.05,见表2,图 4)。
2.4Rab1A对SGC-7901胃癌细胞凋亡的影响
SGC-7901细胞转染Rab1A siRNA 48 h后,消化分散为单个细胞,应用Annexin Ⅴ+PI试剂盒染色,流式细胞仪检测分析。与对照组相比,60 nmol/L siRNA组无论早期凋亡细胞比例,还是晚期凋亡细胞的比例,均较对照组明显增加(P<0.05);NC-siRNA组和对照组相比,凋亡细胞比例无明显变化(P>0.05,见表3,图5)。
表2Rab1A siRNA对胃癌细胞SGC7901细胞周期的影响(%)
Table 2Effects of Rab1A siRNA on the cell cycle of SGC7901 gastric cancer cells (%)
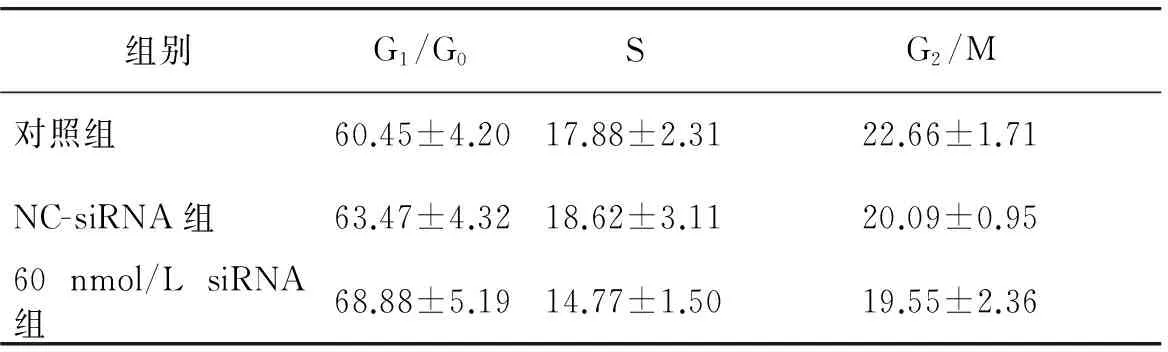
组别G1/G0SG2/M对照组60.45±4.2017.88±2.3122.66±1.71NC-siRNA组63.47±4.3218.62±3.1120.09±0.9560nmol/LsiRNA组68.88±5.1914.77±1.5019.55±2.36

图4 Rab1A siRNA对SGC7901胃癌细胞周期的影响Figure 4 Effects of Rab1A siRNA on the cell cycle of SGC7901 gastric cancer cells
2.5Rab1A通过调控Bax和Bcl-2抑制SGC-7901胃癌细胞凋亡
与对照组相比,60 nmol/L Rab1A siRNA组蛋白水平明显下降(0.703±0.015vs0.213±0.015,P<0.05)。Western blot结果显示,NC-siRNA对蛋白表达水平无明显影响(P>0.05);与对照组相比,60 nmol/L siRNA组的Bcl-2在蛋白水平的表达显著下调(0.703±0.021vs0.347±0.015,P<0.05),Bax在蛋白水平的表达显著上调(0.483±0.015vs0.767±0.153,P<0.05,见图6)。
表3Rab1A siRNA对胃癌细胞SGC7901凋亡的影响(%)
Table 3Effects of Rab1A siRNA on the apoptosis of SGC7901 gastric cancer cells (%)

组别早期凋亡细胞晚期凋亡细胞对照组6.75±1.255.00±0.25NC-siRNA组7.50±1.254.25±0.5060nmol/LsiRNA组17.75±1.75*9.75±1.50*
与对照组比较,*P<0.05
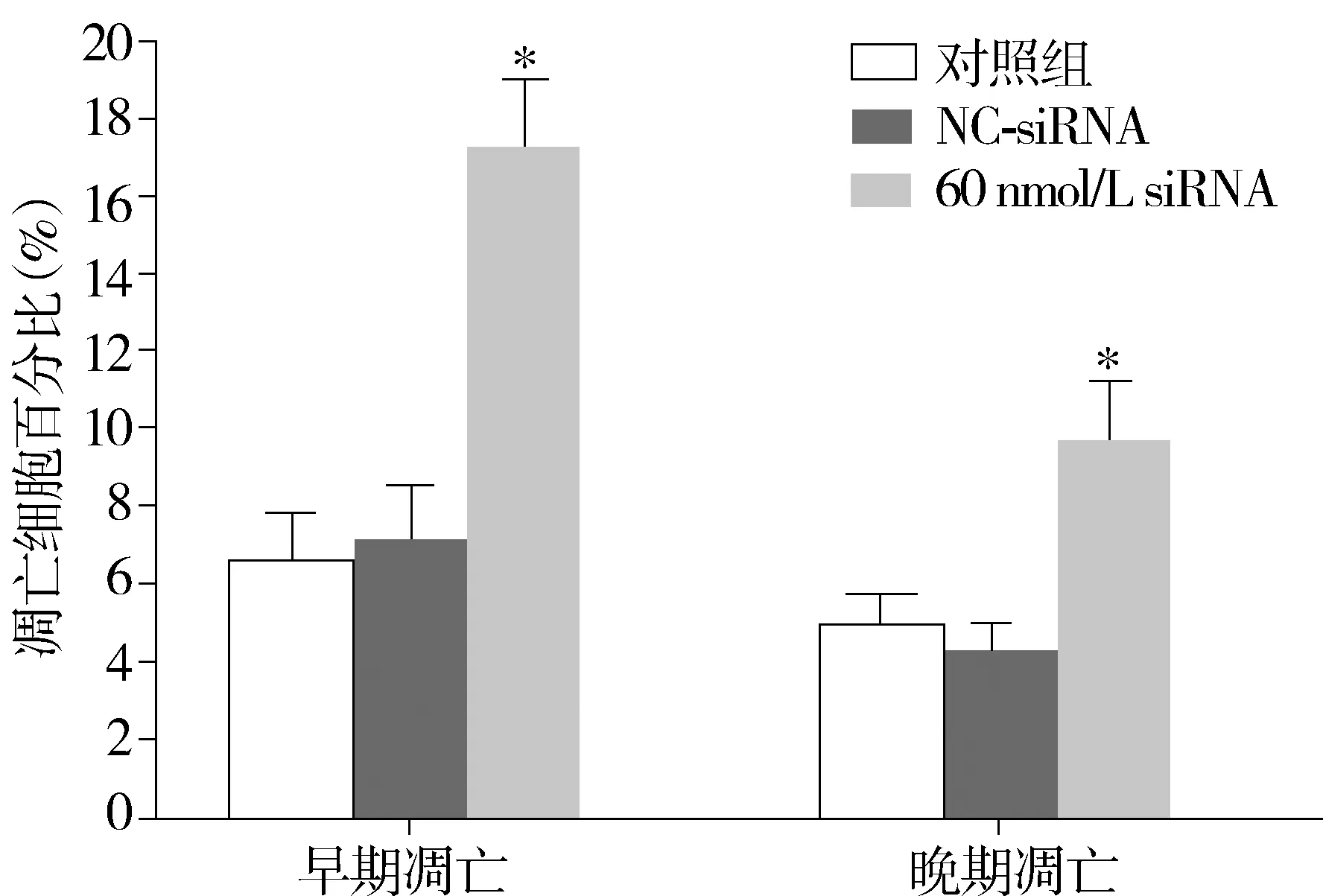
与对照组相比,*P<0.05图5 Rab1A siRNA对SGC7901胃癌细胞凋亡的影响Figure 5 Effects of Rab1A siRNA on the apoptosis of SGC7901 gastric cancer cells
3 讨论
Rab蛋白是Ras小GTPase超家族的成员之一,相对分子质量约20 000-30 000,几乎存在于真核细胞所有的与膜相关的细胞器(如细胞核、线粒体、高尔基体等),它作为最重要的蛋白囊泡运输分子之一,参与囊泡运输的过程,通过胞吐、胞吞的方式完成蛋白在各细胞器间的运输[4,9]。
研究发现,Rab蛋白的异常表达与肿瘤的发生、发展密切相关[5]。Rab1A在98%的舌鳞状细胞癌中过表达[6],在结直肠癌、乳腺癌和肝癌中也发现其高表达[7,8]。由于胃和大肠有相同的组织学来源,所以本研究检测了胃癌组织中Rab1A的表达情况。本研究结果提示,无论在RNA水平还是蛋白水平,Rab1A在胃癌组织中的表达均明显高于胃正常组织,这提示Rab1A可能在胃癌的发生、发展中起一定作用。
进一步研究发现[7,8],Rab1A能够促进SGC7901胃癌细胞的增殖。本研究中,通过RNA干扰法沉默SGC-7901细胞中的Rab1A表达,MTT法检测发现,Rab1A siRNA对SGC7901细胞的增殖活力有一定的抑制作用。RNA干扰作用48 h后,30 nmol/L的Rab1A siRNA对细胞生长抑制不明显,60 nmol/L的Rab1A siRNA不但可以有效地沉默Rab1A表达,而且可使细胞生长出现明显抑制,90 nmol/L的Rab1A siRNA却不能较60 nmol/L的Rab1A siRNA进一步提高生长抑制效果。而且随着浓度的提高,siRNA对细胞的非特异性损伤逐渐增加,可能会干扰实验的结果。所以,在后面的细胞增殖和凋亡的研究中,选用的Rab1A siRNA的实验浓度为60 nmol/L。 由此可见,Rab1A可提高SGC7901细胞的增殖活力,促进胃癌细胞增殖。
细胞的增殖依赖于高效有序的细胞周期,细胞周期的改变往往会引起细胞增殖的显著变化。但本研究中,RNA干扰沉默Rab1A后,SGC7901细胞无论是G1/S期,还是G2期或是M期,细胞数量均无明显变化。这与在宫颈癌HeLa细胞中的研究结果有所不同,当HeLa细胞中Rab1A沉默后其S期细胞明显减少,G1/G0期细胞数量明显增加[10]。这提示Rab1A对于SGC7901胃癌细胞增殖的调控并非通过影响细胞周期而实现,可能存在其他间接调控机制。
另一方面,Rab1A对SGC7901细胞凋亡具有调控作用,可抑制细胞发生凋亡。当Rab1A沉默后,SGC7901细胞无论早期凋亡细胞比例,还是晚期凋亡细胞的比例均明显增加,细胞凋亡受到一个由促凋亡分子和抗凋亡分子组成的网络的调控,该调控网络的代表之一就是Bcl-2家族。Bcl-2翻译的抗凋亡蛋白可阻止细胞色素C(cytochrome C)从线粒体释放,从而阻止凋亡启动基因caspases的激活,最终抑制细胞凋亡[11]。Bax基因是Bcl-2家族中促凋亡分子之一,Bax蛋白可与Bcl-2蛋白结合形成Bax/Bcl-2复合体,或与Bcl-2的靶分子竞争性结合,加速细胞凋亡[12]。Bcl-2/Bax比值是决定细胞是否进入凋亡期的最终决定因素,因其决定了细胞对凋亡刺激物质的敏感性[13]。本研究中,Rab1A沉默后,Bax蛋白表达水平上升,Bcl-2蛋白表达水平下降,Bcl-2/Bax比值显著下降,可解释SGC7901细胞凋亡增加的现象。因此,Rab1A可能通过下调Bax和上调Bcl-2的表达来抑制胃癌细胞凋亡。
有关Rab1A调控细胞增殖的机制,目前尚不完全清楚。2014年的一项研究中发现,大肠癌中高表达的Rab1A可特异性地激活mTORC1,通过活化mTOR通路促进肿瘤的增殖、侵袭和进展,且与患者的不良预后相关[7],在肝癌中也得到了类似的研究结果[8]。mTOR通路是调控细胞生长、增殖、运动的重要信号通路,它的激活可促进细胞的快速生长和增殖[14]。根据上述研究结果推测,Rab1A在胃癌中的作用机制可能与大肠癌、肝癌中相似,通过激活mTOR通路促进SGC7901细胞的增殖,其具体分子机制还有待于进一步研究。
综上所述,Rab1A在人胃癌组织中的表达水平高于胃正常组织,可促进胃癌细胞SGC7901的增殖,抑制细胞凋亡,同时上调凋亡抑制基因Bcl-2的表达,下调凋亡促进基因Bax的表达。
[1]Torre LA,Bray F,Siegel RL,etal.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2]Chen W,Zheng R,Zeng H,etal.Annual report on status of cancer in China,2011[J].Chin J Cancer Res,2015,27(1):2-12.
[3]GASTRIC(Global Advanced/Adjuvant Stomach Tumor Research International Collaboration)Group,Oba K,Paoletti X,etal.Role of chemotherapy for advanced/recurrent gastric cancer:an individual-patient-data meta-analysis[J].Eur J Cancer,2013,49(7):1565-1577.
[4]尹洪金,钱桂生,王关嵩.Rab蛋白研究进展[J].免疫学杂志,2012,28(7):633-641.
[5]Chia W,Tang B.Emerging roles for Rab family GTPases in human cancer[J].Biochem Biophys Acta,2009,1795(2):110-116.
[6]Shimadal K,Uzawa K,Kato M,etal.Aberrant expression of RAB1A in human tongue cancer[J].Br J Cancer,2005,92(10):1915-1921.
[7]Thomas JD,Zhang YJ,Wei YH,etal.Rab1A is an mTORC1 activator and a colorectal oncogene[J].Cancer Cell,2014,26(5):754-769.
[8]Xu BH,Li XX,Yang Y,etal.Aberrant amino acid signaling promotes growth and metastasis of hepatocellular carcinomas through Rab1A-dependent activation of mTORC1 by Rab1A[J].Oncotarget,2015,6(25):20813-20828.
[9]Hutagalung AH,Novick PJ.Role of Rab GTPases in membrane traffic and cell physiology[J].Physiol Rev,2011,91(1):119-149.
[10]段钊,公丕军,杜娟,等.Rab1A对宫颈癌HeLa细胞增殖和凋亡的影响及其分子机制[J].山西医科大学学报,2016,47(4):319-324.
[11]ZivnyJ,Klener P Jr,Pytlik R,etal.The role of apoptosis in cancer development and treatment:focusing on the development and treatment of hematologic malignancies[J].Curr Pharm Des,2010,16(1):11-33.
[12]Oltvai ZN,Milliman CL,Korsmeyer SJ.Bcl-2 heterodimerizesinvivowith a conserved homolog,Bax,that accelerates programmed cell death[J].Cell,1993,74(4):609-619.
[13]Fisher DE.Apoptosis in cancer therapy:crossing the threshold[J].Cell,1994,78(4):539-542.
[14]Guertin DA,Sabatini DM.Defining the role of mTOR in cancer[J].Cancer Cell,2007,12(1):9-22.
Effects of Rab1A siRNA on the proliferation and apoptosis of SGC7901 gastric cancer cells
ZHENG Qi1, LIAO Zijun1, ZHAO Lingyu2, LI Xu1, ZHANG Qian1, ZHAI Yang1
(1FirstDepartmentofMedicalOncology,AffiliatedShaanxiProvincialCancerHospital,Xi’anJiaotongUniversityCollegeofMedicine,Xi’an710061,China;2DepartmentofGenetics,Xi’anJiaotongUniversityCollegeofMedicine)
ObjectiveTo explore the expression of Rab1A in gastric cancer tissues and its effects on the proliferation and apoptosis of SGC7901 gastric cancer cells.MethodsGastric cancer tissues and normal gastric tissues from 35 gastric cancer patients were collected, and Rab1A expression was analyzed by real-time PCR and Western blot. SGC7901 gastric cancer cells were divided into control group, negative control siRNA group, 30 nmol/L siRNA group, 60 nmol/L group and 90 nmol/L group. MTT assay was used to detect the cell proliferation abilities. After Rab1A expression was silenced by 60 nmol/L Rab1A siRNA, the cell cycle and apoptosis of SGC7901 gastric cancer cells were examined with flow cytometer, and the expression levels of Bax and Bcl-2 protein were analyzed with Western blot.ResultsRab1A expression was higher in human gastric cancer tissues than in normal gastric tissues both at the mRNA level (5.625±0.525vs1.000±0.000,P<0.05) and at the protein level(1.013±0.125vs0.219±0.060,P<0.05). At 48 h after RNA interference, the cell proliferation ability showed no significant difference between 30 nmol/L Rab1A siRNA group and control group(P>0.05), and the cell proliferation abilities in 60 nmol/L and 90 nmol/L Rab1A siRNA groups decreased markedly compared with control group(P<0.05), but they showed no significant difference between 60 nmol/L group and 90 nmol/L group(P>0.05). The numbers of cells in G1/G0, S and G2/M phases showed no difference between 60 nmol/L Rab1A siRNA group and control group. Both early apoptotic rate and late apoptotic rate in 60 nmol/L Rab1A siRNA group decreased markedly compared with control group(P<0.05). Compared with control group, Bax protein expression increased(0.483±0.015vs0.767±0.153,P<0.05) and Bcl-2 protein expression decreased significantly(0.703±0.021vs0.347±0.015,P<0.05) in 60 nmol/L Rab1A siRNA group.ConclusionRab1A is highly expressed in human gastric cancer tissues compared with normal gastric tissues. In addition, it can promote proliferation of SGC7901 gastric cancer cells, and inhibit the apoptosis of SGC7901 cells through downregulating Bax expression and upregulating Bcl-2 expression.
Rab1A;gastric cancer;cell proliferation;cell apoptosis
中国博士后科学基金面上资助项目(2013M542358);陕西省自然科学基金资助项目(2014JM4122)
郑琪,男,1979-03生,博士,主治医师,E-mail:snowpinezq@163.com
2016-06-04
R735.2
A
1007-6611(2016)10-0895-07DOI:10.13753/j.issn.1007-6611.2016.10.004

