干旱胁迫条件下转LbDREB基因大青杨瞬时基因表达及生长、生理指标变异分析
李墨野 王 娜 周 宇 普潇莹 冯万举 李开隆
(东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040)
干旱胁迫条件下转LbDREB基因大青杨瞬时基因表达及生长、生理指标变异分析
李墨野 王 娜 周 宇 普潇莹 冯万举 李开隆*
(东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040)
利用转基因技术培育杨树抗逆品种是林木分子育种的重要手段之一。本研究以3个转LbDREB基因株系大青杨及野生型WT为材料,利用PEG6000模拟干旱胁迫处理,调查胁迫条件下不同株系生长、瞬时LbDREB基因表达量和生化指标的变化。结果表明:随着PEG胁迫时间的增加,转基因大青杨较WT的生物量向根部分配更多;LbDREB基因表达量与SOD,POD变化趋势相近,呈现先上升后下降再上升的趋势;转基因株系较WT保护酶活性更强,脯氨酸含量积累增多,MDA积累降低,WT相对电导率比各转基因株系高;结果表明各转LbDREB基因株系的抗旱能力均优于WT,且LbDREB基因上调表达可能是调控植物抗旱能力的重要因素。转基因株系Dr2在干旱胁迫下各抗旱指标均表现优秀,可以初步筛选为大青杨抗旱优良无性系。
大青杨;LbDREB基因;旱胁迫;瞬时表达
DREB(dehydration responsive element binding protein)转录因子是一个干旱应答元件的结合蛋白,它在植物对干旱、高盐及低温胁迫的反应中起重要的调控作用[1]。已证明DREB转录因子具有能够特异性结合DREE/CRT顺式作用元件的特点,在受到干旱、高盐和低温等非生物胁迫时能够有效调控基因表达,从而提高植物抗逆性[2]。逆境条件下,过表达转DREB基因植株,脯氨酸含量、可溶性糖明显高于对照,说明过表达的DREB类转录因子能够调控下游基因,并且与游离脯氨酸、可溶性糖等功能蛋白基因的合成有关,进而提高转基因株系的抗逆能力[2]。2009年杨春霞[3]发现转DREB基因南林杨895在干旱、高盐方面有明显的抗性。2012年Zhou[4]通过对转PeDREB2a基因杨树的研究发现,PeDREB2a基因改变各种生理和生化过程,在干旱和盐耐受性中起重要作用。
大青杨(PopulusussuriensisKom.)是杨柳科(Salicaceae)杨属(PopulusL.)植物,在我国东北三省和内蒙古东部地区广泛分布,其生长快、干形通直、抗瘠薄、抗寒,是东北林区山地主要的更新树种之一[5]。本实验室利用农杆菌介导法将LbDREB基因转入大青杨中,获得了17株转基因株系。本研究以3个转DREB基因大青杨株系为材料,对其干旱胁迫下的生长量、保护酶系统、丙二醛含量、脯氨酸含量及相对电导率进行测定分析,探讨干旱胁迫下不同株系间生长、生理及基因表达差异,为大青杨分子遗传改良提供依据,为选择耐旱速生优质大青杨无性系奠定基础。
1 材料和方法
1.1 试验材料
试验材料包括3个上调表达的转LbDREB基因大青杨株系(Dr2、Dr8、Dr22)和一个野生型WT(非转基因株系),于2015年4月20日,在东北林业大学塑料大棚(平均温度32℃,相对湿度60%)进行营养杯扦插育苗,每个株系扦插250株,50天后每个株系选择生长正常的60株(每个处理12株)进行干旱胁迫试验。
1.2 试验设计
干旱胁迫采用5%(V/V)浓度的聚乙二醇(PEG-6000)溶液进行处理[6];分别在0、12、24、48和96 h取样,取样时间为每天早晨7:00(12 h为19:00),每个单株选取第3~5轮叶片;将采下的叶片放入液氮中待用。
1.3 测定方法
1.3.1 LbDREB基因荧光定量PCR
利用BioTeke试剂中离心过柱法提取总RNA。经超微量分光光度计测定RNA浓度,以TUB基因为内参[7],Forward primer:(5′-CGCCTAAACCCACCAAGCTA-3′);Reverse primer:(5′-CGAAGGTTCCAAGCCAAAGC-3′),引物由中美泰和生物公司合成,采用ABI PRISM 7500荧光定量PCR仪进行定量测定。利用2-ΔΔCT法[8]测定相对基因表达量[9]。
1.3.2 保护酶活性、丙二醛及脯氨酸含量
超氧化物歧化酶(SOD,Superoxide Dismutase)活性、过氧化物酶(POD,Peroxidase)活性、丙二醛(MDA,Malondialdehyde)含量、脯氨酸(Pro,Proline)含量利用苏州科铭生物技术公司的试剂盒中粗酶液、含量提取后吸光度的不同来测定。
1.3.3 相对电导率
参照章文华[10]的方法测定不同株系的电导率。
1.3.4 生物量
在胁迫处理96 h后,对参试各株系,每个株系各选5株,将根用蒸馏水清洗并用吸水纸吸干,装入牛皮纸袋中,放置于105℃的电热鼓风干燥箱中杀青15 min,75℃烘干至恒重,对地上部分和地下部分干重进行测定。
根冠比=地下部分干重/地上部分干重[11]
(1)
1.4 数据分析
所有数据利用EXCEL软件和SPSS软件进行分析。
2 结果与分析
2.1 干旱胁迫对大青杨各株系叶子形态的影响
胁迫前后对转基因株系及WT叶片形态进行观察(图1),未胁迫时(0 h)转基因株系和WT叶片形态正常,没有明显差异,随着胁迫时间增加,各株系症状变化明显,由叶脉间开始颜色逐渐变黄,且面积逐渐扩大,叶子形态也随胁迫时间的延长而逐渐变黄和卷曲。转基因株系较WT变化慢,在96 h时WT组已经完全变枯黄,而转基因株系如株系Dr2只是在叶缘稍干枯。
2.2 干旱胁迫对大青杨各株系生物量的影响
T检验结果表明各株系间胁迫前后根冠比差异未达显著水平,各转基因株系干旱胁迫处理的根冠比小于(株系Dr2和Dr8)或等于(株系Dr22)未胁迫处理的根冠比,而WT胁迫后根冠比小于胁迫前,这表明转基因株系向根部转移更多生物量,从而使根系变得更发达。

图1 干旱胁迫大青杨0、12、24、48和96 h叶片形态和颜色 1~4行分别为株系WT、Dr8、Dr22和Dr2。Fig.1 Drought stress P.ussuriensis Kom. 0,12,24,48 and 96 h leaf shape and color (1-4 lines) were WT,Dr8,Dr22 and Dr2.
Table1TheinfluenceofdroughtonbiomassandrootshootratioofP.ussuriensisKom.
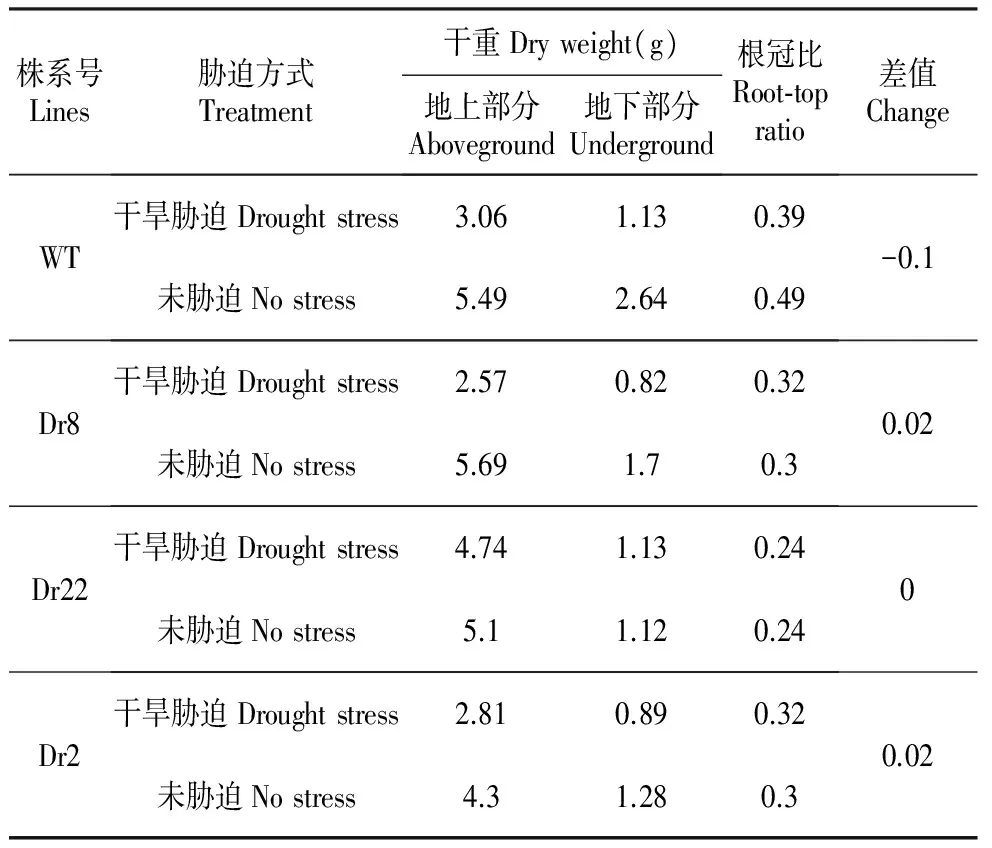
株系号Lines胁迫方式Treatment干重Dryweight(g)地上部分Aboveground地下部分Underground根冠比Root⁃topratio差值ChangeWT干旱胁迫Droughtstress3.061.130.39未胁迫Nostress5.492.640.49-0.1Dr8干旱胁迫Droughtstress2.570.820.32未胁迫Nostress5.691.70.30.02Dr22干旱胁迫Droughtstress4.741.130.24未胁迫Nostress5.11.120.240Dr2干旱胁迫Droughtstress2.810.890.32未胁迫Nostress4.31.280.30.02
2.3干旱胁迫下外源LbDREB在不同株系中基因相对表达量
在干旱胁迫期间内,所有株系相对基因表达都呈先上升,后下降再上升的趋势(图2),其中在12~24 h达到了大青杨基因相对表达量的峰值,在48 h时达到谷值,而在96 h时再次上升;转基因株系随着干旱时间的延长,LbDREB基因表达并比WT表达更为强烈。其中株系Dr2升高波动最明显,WT在胁迫期间相对变化波动比较稳定。
2.4 干旱胁迫下大青杨叶片保护酶活性的影响
干旱胁迫下SOD的变化趋势(图3)与基因表达量的变化趋势大致相同,在24 h时基因表达量和SOD活性都达到峰值,其中在0~96 h时,转基因株系SOD活性都显著高于WT。POD活性与SOD活性趋势相同(图4),但并非所有转基因株系在不同时间POD活性均高于WT,保护酶活性(SOD、POD)转基因株系较WT高很多。
2.5干旱胁迫对转不同大青杨株系MDA含量的影响
干旱胁迫下,MDA含量均呈增长趋势(图5),在96 h时达到相对的峰值,其中株系Dr2、Dr8、Dr22分别增加了1.24,1.17,1.39倍;而WT增加了1.54倍。
2.6 干旱胁迫对转基因大青杨脯氨酸含量的影响
在0~24 h时,脯氨酸含量不稳定,但基本呈现上升趋势;在24 h后,转基因株系脯氨酸含量明显升高,而WT脯氨酸含量却变化较慢(图6)。96 h时株系Dr2、Dr8、Dr22的脯氨酸含量达最大值,并且均比WT高(株系Dr8、Dr22和Dr2脯氨酸含量分别是WT的6.9、11.4和6.6倍)。
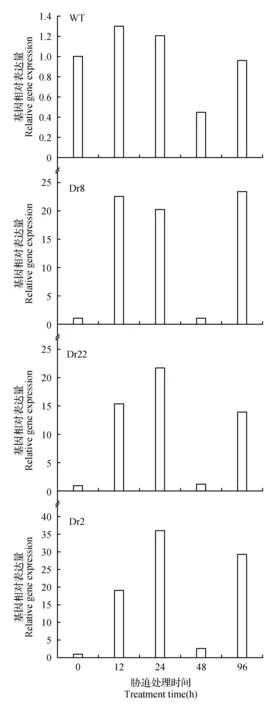
图2 干旱胁迫条件下大青杨4个株系基因相对表达量随处理时间的变化Fig.2 Under drought stress P.ussuriensis Kom. four lines with relative gene expression change amount of processing time

图3 干旱胁迫下SOD活性随时间的变化趋势 同一胁迫处理时间不同字母代表差异显著(P<0.05),下同。Fig.3 SOD activity under drought stress trends over time Different letters represent the same stress treatment time significantly different(P<0.05),the same as below.
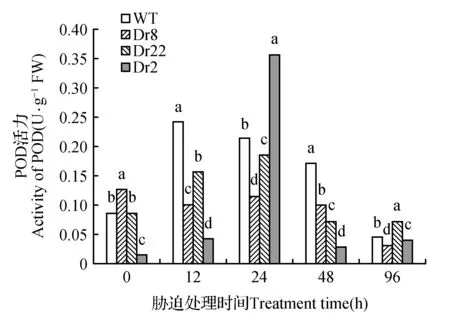
图4 干旱胁迫下POD活性随时间的变化趋势Fig.4 POD activity under drought stress trends over time
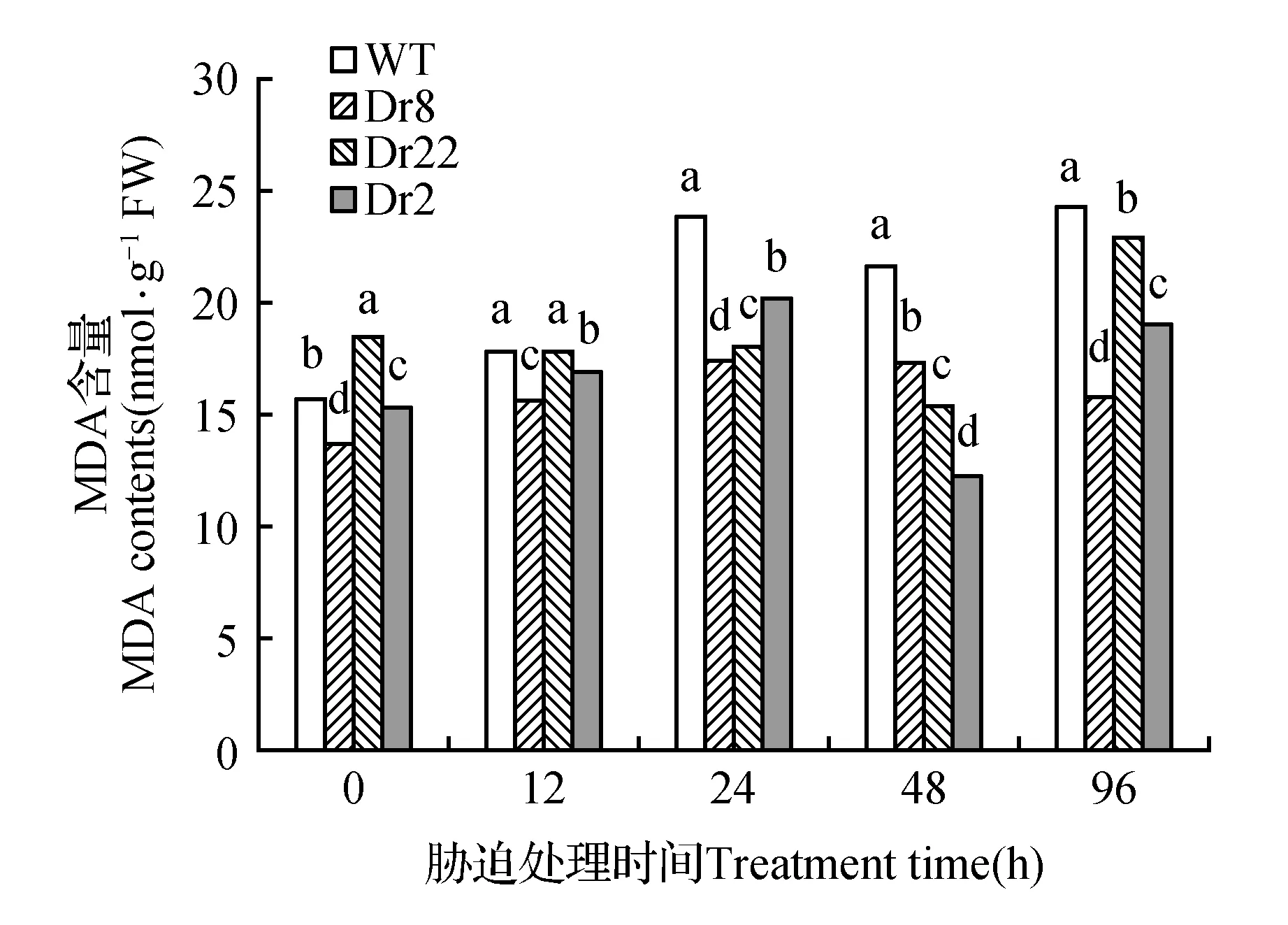
图5 干旱胁迫处理对MDA的含量随时间的变化趋势Fig.5 Drought stress on the content of MDA trends over time
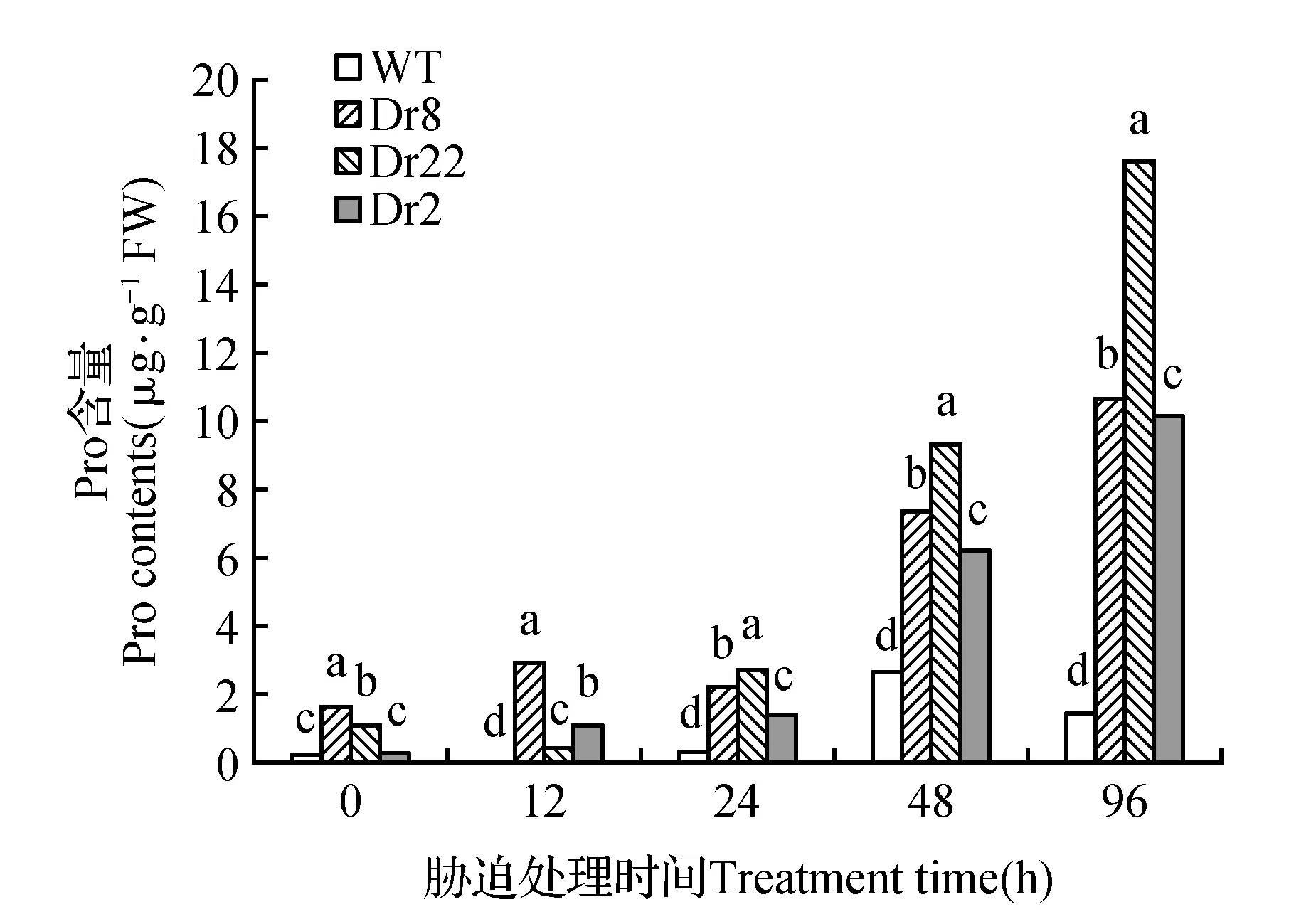
图6 干旱胁迫处理对脯氨酸的含量随时间的变化趋势Fig.6 Drought stress on Pro content trends over time
2.7 干旱胁迫对转基因大青杨相对电导率的影响
胁迫前,各株系的相对电导率无显著差异(表2),随着胁迫时间的延长,各株系的相对电导率均持续上升,说明植物细胞膜受到了损害,在12 h时株系Dr2与其它株系差异显著,在24 h时株系Dr8和Dr2与其它株系差异显著,在48 h后转基因株系与野生型WT差异明显,分析96 h时各株系的增幅发现,WT增幅最大(39.33%),而转基因株系Dr2最小为(22.36%)。
表2干旱胁迫对大青杨转基因株系及野生型相对电导率的平均值
Table2MeanoftherelativeelectricalconductivityintransgenicP.ussuriensisKom.andnon-transgenicP.ussuriensisKom.underdroughtstress
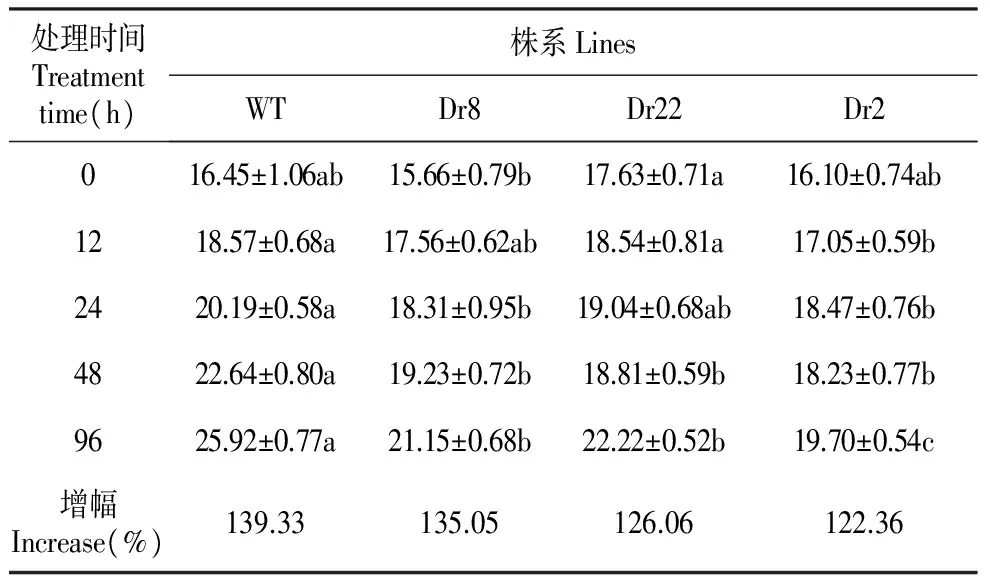
处理时间Treatmenttime(h)株系LinesWTDr8Dr22Dr2016.45±1.06ab15.66±0.79b17.63±0.71a16.10±0.74ab1218.57±0.68a17.56±0.62ab18.54±0.81a17.05±0.59b2420.19±0.58a18.31±0.95b19.04±0.68ab18.47±0.76b4822.64±0.80a19.23±0.72b18.81±0.59b18.23±0.77b9625.92±0.77a21.15±0.68b22.22±0.52b19.70±0.54c增幅Increase(%)139.33135.05126.06122.36
3 讨论
干旱胁迫下植物主要表现为生长弱化、叶面积、比叶面积(单位重量的叶面积)、叶片数量和生物产量都显著降低[12]。干旱胁迫后叶片的形态症状反应发现,转基因株系叶片比野生型变化小,其中株系Dr2从叶子形态上比较,抗旱性强。在干旱胁迫期间,植物生物量向根部的分配增加。但不同耐性品系的植物在干旱胁迫下的反应也不同,抗旱的杨树无性系有更多的干物质优先向根和茎分配[12]。另外,干旱胁迫也会提高根冠比。根冠比越高,根系越发达,吸水能力更强,植株越抗旱[7]。本研究中株系Dr2、Dr8、Dr22胁迫后的根系不低于未胁迫的株系,表明转基因株系比野生型抗旱性更好。
当植物受到非生物胁迫,如低温、干旱、盐碱等,细胞膜被损坏,膜透性变大,电解质外渗,电导率增大。研究者们通过判断电导率的大小,来判断植物细胞膜的损坏程度,从而判断植物的抗逆能力[11]。干旱胁迫处理期间转基因株系和WT的相对电导率都不断增大[20],在96 h时各株系的增幅(表2)发现相对电导率增幅野生型均大于转基因株系;说明转基因株系抗旱能力强。
研究发现,各指标中转基因各株系表现出的抗旱水平与基因相对表达量较一致。总的来说,干旱胁迫下转基因各株系在生长和生理指标上较WT具有明显优势,且LbDREB基因瞬时表达显著升高,推测LbDREB基因在植物抗旱上起到了关键作用;株系Dr2各指标均体现较强的优势,可以作为优良树种进行重点考虑。
1.李科友,朱海兰.植物非生物逆境胁迫DREB/CBF转录因子的研究进展[J].林业科学,2011,47(1):124-134.
Li Keyou,Zhu Hailan.Research progress ofDREB/CBFtranscription factor in response to abiotic-stresses in plants[J].Scientia Silvae Sinicae,2011,47(1):124-134.
2.刘翠芳,邹杰,陈信波.DREB转录因子与植物非生物胁迫抗性研究进展[J].生物技术通报,2010,(10):26-30,48.
Liu Cuifang,Zou Jie,Chen Xinbo.Advances inDREBtranscription factors and plant abiotic stress tolerance[J].Biotechnology Bulletin,2010(10):26-30,48.
3.杨春霞,李火根,程强,等.南林895杨抗旱耐盐基因DREB1C的转化[J].林业科学,2009,45(2):17-21.
Yang Chunxia,Li Huogen,Cheng Qiang,et al.Transformation of drought and salt resistant gene(DREB1C) inPopulus×euramericanacv.Nanlin 895[J].Scientia Silvae Sinicae,2009,45(2):17-21.
4.Zhou M L,Ma J T,Zhao Y M,et al.Improvement of drought and salt tolerance inArabidopsisandLotuscorniculatusby overexpression of a novelDREBtranscription factor fromPopuluseuphratica[J].Gene,2012,506(1):10-17.
5.苏晓华,黄秦军,张香华,等.中国大青杨基因资源研究[J].林业科学研究,2001,14(5):472-478.
Su Xiaohua,Huang Qinjun,Zhang Xianghua,et al.Study on gene resources inPopulusussuriensis[J].Forest Research,2001,14(5):472-478.
6.刘英,李德文,孟庆焕,等.PEG6000胁迫下长春花叶片生物碱含量及相关基因表达的分析[J].植物研究,2015,35(5):746-750.
Liu Ying,Li Dewen,Meng Qinghua,et al.Studies on dynamic change of alkaloids contents and expression of the associated biosynthetic genes inCatharathusroseusleaves[J].Bulletin of Botanical Research,2015,35(5):746-750.
7.袁伟,万红建,杨悦俭.植物实时荧光定量PCR内参基因的特点及选择[J].植物学报,2012,47(4):427-436.
Yuan Wei,Wan Hongjian,Yang Yuejian.Characterization and selection of reference genes for real-time quantitative RT-PCR of plants[J].Chinese Bulletin of Botany,2012,47(4):427-436.
8.Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTMethod[J].Methods,2001,25(4):402-408.
9.陈旭,齐凤坤,康立功,等.实时荧光定量PCR技术研究进展及其应用[J].东北农业大学学报,2010,41(8):148-155.
Chen Xu,Qi Fengkun,Kang Ligong,et al.Advance and application of real-time fluorescent quantitative PCR[J].Journal of Northeast Agricultural University,2010,41(8):148-155.
10.王学奎.植物生理生化实验原理和技术:2版[M].北京:高等教育出版社,2006:278-283.
Wang Xuekui.Principles and techniques of plant physiological biochemical experiment:2nd ed[M].Beijing:Higher Education Press,2006:278-283.
11.柴丽娜,路苹,王金淑.干旱胁迫冬小麦幼苗根冠比的动态变化与品种抗旱性关系的研究[J].北京农学院学报,1996,11(2):19-23.
Chai Lina,Lu Ping,Wang Jinshu.Studies on the variation of root/shoot ratio of winter wheat seedings under drought-stress and its relationship to the resistivity of different varieties[J].Journal of Beijing Agricultural College,1996,11(2):19-23.
12.Ibrahim L,Proe M F,Cameron A D.Interactive effects of nitrogen and water availabilities on gas exchange and whole-plant carbon allocation in poplar[J].Tree Physiology,1998,18(7):481-487.
13.翟俊峰,王法微,王南,等.银中杨DREB基因的克隆及表达[J].西北农林科技大学学报:自然科学版,2012,40(6):79-85.
Zhai Junfeng,Wang Fawei,Wangnan,et al.Cloning and expression of DREB gene fromPopulusalbaxp[J].Journal of Northwest A&F University:Natural Science Edition,2012,40(6):79-85.
14.鲁松.干旱胁迫对植物生长及其生理的影响[J].江苏林业科技,2012,39(4):51-54.
Lu Song.Effects of drought stress on plant growth and physiological traits[J].Journal of Jiangsu Forestry Science&Technology,2012,39(4):51-54.
15.孙骏威,翁晓燕,李峤,等.缺钾对水稻不同品种光合和能量耗散的影响[J].植物营养与肥料学报,2007,13(4):577-584.
Sun Junwei,Weng Xiaoyan,Li Qiao,et al.Effects of potassium-deficiency on photosynthesis and energy dissipation in different rice cultivars[J].Plant Nutrition and Fertilizer Science,2007,13(4):577-584.
16.王霞,侯平,尹林克,等.土壤水分胁迫对柽柳体内膜保护酶及膜脂过氧化的影响[J].干旱区研究,2002,19(3):17-20.
Wang Xia,Hou Ping,Yin Linke,et al.Effect of soil moisture stress on the membrane protective enzyme and the membrane liquid peroxidation ofTamarix[J].Arid Zone Research,2002,19(3):17-20.
17.井大炜,邢尚军,杜振宇,等.干旱胁迫对杨树幼苗生长、光合特性及活性氧代谢的影响[J].应用生态学报,2013,24(7):1809-1816.
Jing Dawei,Xing Shangjun,Du Zhenyu,et al.Effects of drought stress on the growth,photosynthetic characteristics,and active oxygen metabolism of poplar seedlings[J].Chinese Journal of Applied Ecology,2013,24(7):1809-1816.
18.Lei Y B,Yin C Y,Li C Y.Differences in some morphological,physiological,and biochemicalresponses to drought stress in two contrasting populations ofPopulusprzewalskii[J].Physiologia Plantarum,2006,127(2):182-191.
19.于世河,陆爱君,王骞春,等.PEG模拟干旱胁迫对红松幼苗生理生化指标的影响[J].辽宁林业科技,2011,(4):12-14,33.
Yu Shihe,Lu Aijun,Wang QianChun,et al.Effect of dry stress of PEG-6000 on physiology and biochemistry indices ofPinuskoraiensis[J].Journal of Liaoning Forestry Science&Technology,2011,(4):12-14,33.
20.井大炜.杨树苗叶片光合特性和抗氧化酶对干旱胁迫的响应[J].核农学报,2014,28(3):532-539.
Jing Dawei.Response of photosynthetic characteristics and antioxidant enzyme activities in poplar seedlings to drought stress[J].Journal of Nuclear Agricultural Sciences,2014,28(3):532-539.
The National Science & Technology Pillar Program of China(2012BAD21B02)
introduction:LI Mo-Ye(1990—),male,graduate,major in forestry genetic and improvement.
date:2015-11-25
VariationAnalysisofTransientGeneExpressionandGrowth,PhysiologicalIndicatorsunderDroughtStressinExpressedLbDREBPopulusussuriensisKom.
LI Mo-Ye WANG Na ZHOU Yu PU Xiao-Ying FENG Wan-Ju LI Kai-Long*
(State Key Laboratory of Tree Genetics and Breeding,Northeast Forestry University,Harbin 150040)
We used transgenic technology to cultivate stress-resistant varieties ofPopulusussuriensisKom, which was one of the most significant means of molecular breeding.With three expressedLbDREBlines and one wild type(WT), under the condition of PEG6000, which simulated the treatment of the drought stress, we investigated the growth of different lines, and the relative expression levels ofLbDREBand biochemical indicators.With the increase of PEG stress time, the root phytomass of expressedLbDREBline was more than wild type.Meanwhile, the variational trends of SOD and POD were similar to theLbDREBexpression level, which presented the upward trend, the downward trend and eventually beingrising.Additionally, transgenic lines contained stronger protective enzymes activity and proline content than wild type.However, the MDA accumulation and relative conductivity of transgenic lines were less than wild type.The drought tolerance ability of transgenic lines was superior to wild type, furthermore, the up-regulated expression ofLbDREBprobably played an important role in drought resistant in plant.The transgenic line named Dr2 was perfect in the different index of drought resistant, which could be preliminary screened as the excellent drought resistant clones ofP.ussuriensisKom.
PopulusussuriensisKom.;LbDREBgene;drought stress;transient expression
“十二五”国家科技计划课题(2012BAD21B02)
李墨野(1990—),男,硕士研究生,主要从事林木遗传改良方面的研究。
* 通信作者:E-mail:likailongnefu@sohu.com
2015-11-25
* Corresponding author:E-mail:likailongnefu@sohu.com
S792.113
A
10.7525/j.issn.1673-5102.2016.03.014

