外源铜胁迫对长春花幼苗生物碱的影响
林 枫 高媚娇 于博帆 陈华峰*
(1.辽宁省林业调查规划院,沈阳 110122; 2.东北林业大学森林植物生态学教育部重点实验室,哈尔滨 150040)
外源铜胁迫对长春花幼苗生物碱的影响
林 枫1高媚娇2于博帆2陈华峰2*
(1.辽宁省林业调查规划院,沈阳 110122;2.东北林业大学森林植物生态学教育部重点实验室,哈尔滨 150040)
以药用植物长春花为实验材料,采用珍珠岩为培养基质的营养方式培养,初步研究了长春花幼苗对铜胁迫的生长响应、吸收积累、基因表达及生物碱合成的特性。研究结果表明,在外源铜胁迫下,药用植物长春花幼苗根和叶干重表现为低浓度的上升和高浓度的降低,并在300 μmol·L-1Cu时达到峰值,与对照差异显著(P<0.05)。而幼苗的根系耐性指数先上升后下降,在200 μmol·L-1Cu时达到峰值。Cu金属进入长春花幼苗体内绝大部分积累在根部。长春花叶片中含有的长春碱在外源铜胁迫条件下其含量有一定程度上的增加,并且随着处理浓度的增加使之呈现出规律性变化,在300 μmol·L-1Cu时达到峰值,甚至到达CK的2.7倍。结果可为进一步验证长春花是否可以作为一种新的Cu超富集植物提供参考依据。
长春花;铜胁迫;长春碱;Cu超富集植物
近年来,随着工业活动加剧,导致全球生态破坏及环境污染日趋严峻,环境问题已严重威胁到人类的健康与生存。其中,重金属元素对土壤的破坏作用尤为突出。在过去的半个多世纪,由于自然或人为的原因,全球排放到环境中的铜达9.39×105t[1]。在重金属胁迫的条件下,一般植物都会不同程度地从根系吸收各种重金属,贮存在植株根部或运输到地上部,吸收数量的多少受植物种类及根际微生物群落组成、pH值、氧化—还原电位、重金属种类和浓度以及土壤的理化性质等多方面因素的影响[2]。Cu作为重要的重金属污染物,以其毒性强,危害大,在植物体内易积累,难降解的特性受到人们的广泛关注[3]。Cu虽然是植物生长发育的必需元素,也是人体正常代谢所必需的微量元素,其在常量时对生物有益,但过量时则导致毒害,严重时导致植物细胞死亡。据报道,过量的铜在形态建成和发育上,主要表现在根长降低,叶片数量减少并产生较低的生物量,同时叶片发黄,叶片脉间失绿[4~5]。在生理上,重金属影响植物最直接的表现是叶绿素含量减少导致光合作用减弱[6]。因此,对Cu的毒害机制的研究对于植物的生长发育、生理变化及品质的改良均具有重要的意义。
长春花(Catharanthusroseus(L.) G. Don)为夹竹桃科(Apocynaceae)长春花属(Catharanthus)的药用植物[7]。原产于非洲东海岸,现广泛分布于世界各地,我国的广东、广西、云南、海南、贵州、四川以及江浙等地均有栽培。长春花生殖能力强,可全年开花结果,且种子数量巨大,生活周期短,使其在不同生境下表现出较强的可塑性和耐受性。鉴于长春花代谢过程中具有多种生物碱的生物活性,本文以长春花为研究材料,探讨其在Cu胁迫下的生长特性、金属吸收积累、生物碱合成特性,以期为更好的开发利用长春花药用资源奠定基础。
1 材料与方法
1.1 试验材料
供试材料为长春花种子,由海正药业有限公司浙江富阳长春花种植基地所提供,试验所用外源铜为CuSO4·5H2O均为分析纯。
1.2 试验处理
试验设置3个处理浓度组:200,300,400 μmol·L-1(以纯Cu2+计),对照组不添加任何Cu金属。为保证长春花生长环境的统一性从播种到处理均在温室培养,试验中选取长势相同的长春花幼苗进行培养,培养条件为光照6级(day)/光照0级(night),光照时间为6:00~18:00,湿度80%,温度28℃(day)/25℃(night)。幼苗在长春花发芽后移栽于装有珍珠岩、下部有孔的黑色营养杯中,定期对幼苗浇灌1/2浓度的Hogland营养液,待长出第三对叶片开始进行外源铜的处理。
1.3 测定指标与方法
1.3.1 生长指标及生物量测定
长春花幼苗整株取出,洗净,用直尺测量幼苗的根长(cm)及株高(cm);将幼苗在70℃烘干至恒重,用分析天平测定生物量;根系耐性指数=各处理根长(cm)/对照的根长(cm)[8]。
1.3.2 重金属含量的测定
采用原子吸收分光光度计,分别称取烘干的根,茎,叶样品为0.05,0.1,0.2 g,经混合酸(硝酸∶高氯酸=4∶1)消化,测定Cu2+含量(μg·g-1)。
1.3.3 长春花生物碱的含量
(5)CT检查前,医护人员应向受检者做好宣教工作,嘱其在检查过程中不要动来动去,避免造成检查图像模糊或伪影,造成受检者需重新检查,增加医疗费用,也会导致医疗资源浪费。
采用吲哚类生物碱含量的测定方法;分别称取70℃下烘干48 h的长春花叶片和根0.1~0.2 g,经过超声,离心后提取上清液,在40℃条件下减压浓缩至干,复容过滤后供HPLC检测。
1.3.4 长春花RNA的提取与分析
分别称取0.3 g长春花的根和叶,采用TRIZOL试剂法进行总RNA的提取,通过1%的琼脂糖凝胶电泳检测RNA的完整性及纯度进行检测,分光光度计检测其浓度,经PCR和qRT-PCR技术测定得出相关关键酶基因的表达量。
1.4 数据处理
试验数据采用Excel软件处理,差异显著性分析采用SPSS16.0软件进行Duncan检验。
2 结果与分析
2.1外源铜胁迫对长春花幼苗生长及生物量的影响
由表1可以看出200、300、400 μmol·L-1Cu3种处理均在不同程度上改变了长春花生物量,其中根干重和叶干重表现为低浓度的上升和高浓度的降低,并在300 μmol·L-1Cu时达到峰值,与对照差异显著(P<0.05)。地上部干物质量/根系干物质量(SDW/RDW)均小于CK(3.677),而且随着Cu浓度的增加呈现明显的减少的动态变化趋势,在400 μmol·L-1Cu处理条件下达到最小值(2.900),降低了21.13%,说明长春花在外源铜胁迫条件下地上部干物质积累能力随着Cu浓度的增加呈现先增加后降低的趋势。
表1长春花响应铜胁迫条件下生物量的变化
Table1ThebiomasschangesinresponsetocopperstrssinC.roseus

浓度Concentration(μmol·L-1)根干重Dryweightofroot(g)茎干重Dryweightofstem(g)叶干重Dryweightofleaf(g)地上部干物质量/根系干物质量SDW/RDWCK0.1±0.020.06±0.010.31±0.043.6772000.11±0.010.05±0.010.33±0.013.3703000.13±0.030.07±00.39±0.063.4064000.09±0.020.04±0.010.22±0.052.900
表2长春花响应铜胁迫条件下耐受性的变化
Table2ThesurvivabilitychangesinresponsetocopperstressinC.roseus

浓度Concentration(μmol·L-1)根长Rootlength(cm)株高Plantheight(cm)根冠比Rootshootratio根系耐性指数RTICK7.86±0.16.74±0.141.17±0.021.02008.19±0.155.28±0.171.55±0.071.0415606453007.36±0.325.39±0.211.37±0.010.9368108574006.46±0.245.37±0.121.21±0.060.822307040
2.2外源铜胁迫对长春花幼苗铜金属吸收积累的影响
由图1可见,随着Cu处理浓度的增大,长春花幼苗体内的重金属含量先逐渐增加而后降低,在300 μmol·L-1Cu时达到峰值,幼苗叶片和根部里Cu含量分别是CK的12.70、44.12倍,与对照组相比差异显著(P<0.05)。在200~400 μmol·L-1Cu浓度范围内,幼苗根部的Cu含量均明显高于地上部,分别是地上部的12.98、20.29和16.21倍,表明重金属进入幼苗体内后主要积累于根部,因此Cu对根部的伤害较大。
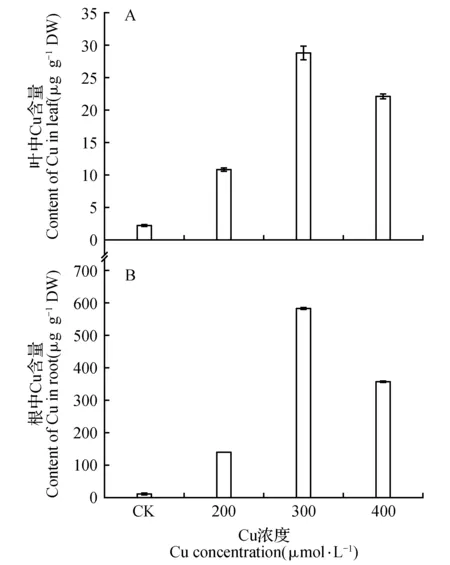
图1 铜胁迫条件下长春花对叶和根中Cu的富集Fig.1 Cu accumulation of C.roseus in copper stress content of Cu in leaf and root
2.3 外源铜胁迫对长春花幼苗生物碱的影响
植物次生代谢产物是植物在长期进化中对生态环境适应的结果,许多植物在收到胁迫或其他侵染后,产生并积累小分子抗生物质,如萜类、生物碱和异黄酮等,用以增强自身的抵抗力。由图2可知,随着不同浓度外源铜处理长春花幼苗,叶片中文多灵含量明显增加,在400 μmol·L-1Cu处理达到最高值,是CK的1.6倍。文多灵属于次生代谢的萜类化合物,长春花幼苗为抵抗外界环境的胁迫,自身合成较多的文多灵以增强自身的抵抗能力。由图2可知,长春碱的含量随着外源铜处理浓度的增加呈现先逐步增加再降低的动态变化,在300 μmol·L-1Cu时达到峰值,甚至到达CK的2.7倍。长春花幼苗的长春质碱含量变化与长春碱变化趋势呈现出相似的规律,说明长春质碱在长春花植株体内处于比较稳定的动态平衡。从图2可以看出,长春花响应不同浓度外源铜胁迫条件下根中长春质碱含量明显低于CK,并随着浓度的增加而呈现动态的变化,在300 μmol·L-1Cu处理条件下根中长春质碱的含量最低,200、 400 μmol·L-1Cu含量相当。
2.4外源铜胁迫对长春花幼苗次生代谢关键酶基因的调控
长春花生物碱合成途径调控网路复杂,其中涉及到30多个关键酶基因和调控因子,长春花的药用价值生物碱有文多灵、长春碱、长春质碱合成部位主要在叶片中。由图3可知,DAT基因和T16H基因在叶片中有表达,在根中几乎没有表达,可见DAT基因和T16H基因的表达对提高长春花叶片中文多灵和长春质碱有重要的作用。在不同浓度外源铜胁迫下,300 μmol·L-1Cu处理浓度下T16H的基因表达量最多,是200 μmol·L-1Cu的15倍,CK的44倍。说明在外源铜的作用下可以促进T16H基因的表达,从而提高长春花叶片中文多灵的生物合成。
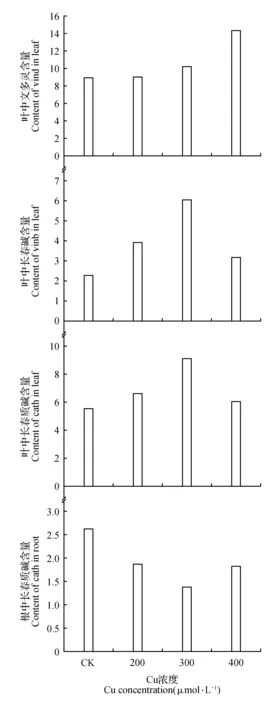
图2 铜胁迫条件下长春花叶、根中各生物碱含量的比较Fig.2 Comparison of the contents of alkaloids in leaves and roots of Catharanthusroseusunder copper stress

图3 铜胁迫条件下长春花生物碱合成基因相对表达量 A.合成途径基因相对表达量;B.生物碱合成调控基因相对表达量Fig.3 The relative expression of the alkaloid biosynthesis genes in C.roseus under copper stress A. of genes in the biosynthetic pathway; B. Relative expression of genes in the regulation of alkaloid synthesis

图4 不同时间内铜胁迫对长春花叶、根里生物碱合成基因相对表达量 A.叶中基因相对表达量;B.根中基因相对表达量Fig.4 The relative expression of the alkaloid biosynthesis genes in the leaves and roots of C.roseus in different time A. Relative expression of gene in leaf; B. Relative expression of gene in root
在不同时间内300 μmol·L-1Cu处理浓度对长春花幼苗的基因表达量存在差异(图4),300 μmol·L-1Cu的长春花幼苗在2~4 h内基因表达量增加明显,其中T16H基因在4 h到达顶峰,是2 h前的4倍。TDC基因和STR基因在叶和根中都有表达,TDC基因在叶中表达量高于根,而STR基因正好与之相反。在不同的植物内MAP3激酶是级联蛋白可以调节不同压力响应生物的过程,植物需要适应外部环境的各种变化,以维持自身正常的生长发育,当植物遭受低温、干旱、病原物侵染等非生物和生物胁迫时,MAPK就会被激活[9]。由图4中可见,在300 μmol·L-1Cu 浓度处理下4 h内MAP3激酶都到达最高值,随着时间增长表达量明显减低。
3 讨论
已有研究表明,外源重金属进入土壤后,植物自身可通过根系吸收进入根细胞内积累,并通过细胞间的运输向地上部移动,但重金属由于自身的化学性质和螯合能力的不同,在植物体内的积累和迁移能力都存在差异性[10]。Cu作为植物生长发育的必需营养元素比较容易被根系吸收,与细胞膜蛋白的活性位点结合,并随着蛋白质大分子转运到植物地上部[10]。本试验证明,Cu金属进入长春花幼苗体内绝大部分积累在根部,在外源Cu胁迫条件下长春花的耐受性较好,并且具有良好的地上干物质的积累能力,与李向科等在大麦中的研究结果基本相同[11]。
Cu是植物生长所必需的微量营养元素,适量的Cu能刺激酶活性,促进幼苗生长。而过量的Cu加速幼苗根系产生大量活性氧,抑制各种酶活性,使根系受损,并影响到生物量的生成[12~14]。在本试验条件下,不同浓度Cu对长春花幼苗的各部位干重,根长表现为随着处理浓度增加先上升后下降,在大麦和玉米中研究结果相同[15]。当Cu的浓度为300 μmol·L-1时,实验组与对照组出现显著差异,根和叶的干重达到最大值。对于长春花幼苗,其根系的耐性指数同样表现为先上升后下降的趋势,在Cu浓度达到200 μmol·L-1时达到峰值,这一研究与水稻中结果相同[16]。
药用植物长春花因其体内含有显著抗癌的活性成分如长春碱、长春新碱而成为国际上研究和应用最多的抗癌药源之一[17~20]。已有报道指出,植物体内生物碱的积累受到多种外界环境胁迫因子的诱导[21]。本次试验发现,Cu胁迫能够显著提高生物碱的积累,并且这一代谢水平与基因水平结果基本相似。在Cu处理下,文多灵的含量随处理浓度的增加而增加,在400 μmol·L-1Cu处理时达到最大值。文多灵合成途径中3个关键酶,包括水苷草碱16-羟化酶(T16H)、脱乙酰氧基文朵灵-4-羟化酶(D4H)、脱乙酰基文多灵4-o-乙酰转移酶(DAT)都需要在光照条件下才能表达[22]。水甘草碱16-羟化酶(T16H)是催化水甘草碱到文多灵途径的第一个酶,存在于细胞中的内质网膜上。脱乙酰基文多灵4-o-乙酰转移酶(DAT)、脱乙酰氧基文朵灵-4-羟化酶(D4H)却专一性地出现在见光的叶和茎中的乳汁细胞以及异细胞中,催化从它波宁到文多灵生物合成的反应,将水甘草碱转化成文多灵[22]。文多灵合成的最后一步反应是由DAT催化的,该基因的转录同样受到光的诱导[23],并且DAT基因的表达量的大小直接关系到叶片中文多灵的含量。本试验选取长春花生物碱合成过程中的几个关键基因酶:TDC、STR、DTA、D4H、T16H。研究表明,在不同浓度Cu处理条件下关键酶基因表达量明显增加,文多灵和长春质碱在基因酶的作用下催化和促进长春碱的合成,从而更好的提高长春花吲哚类生物碱的含量。
有关报道指出,在植物所吸收的重金属中只有极少的一部分对植物造成毒害,而大部分的重金属则被结合在细胞壁上或储存在液泡中,被扣留的重金属是没有任何的生理作用的,不会对植物产生危害,这一特点是由植物对重金属污染的耐性机制所决定的[24]。MAPK是一种丝氨酸/苏氨酸蛋白激酶,是细胞信号转导途径中关键的蛋白激酶,通过MAPKKK-MAPKK-MAPK三酶级联反应对化学和生理应激作出反应,因此控制细胞的生存和适应力。MAPK级联途径是普遍存在于动物、植物和微生物系统中保守的信号传导通路[25]。促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)在植物的生长发育调节和抗逆等生理过程中起重要作用,能够介导生物和非生物胁迫条件下的反应信号通路[26]。本文通过在不用处理浓度和时间内的基因的表达得知,Cu浓度为300 μmol·L-1处理4 h内MAP3激酶达到峰值,随后降低,这可能是由于当处理时间过长而超出植物自身的调节能力,从而出现Cu大量的积累,但是对于MAPK信号转导途径在长春花渗透调节方面的作用研究尚不透彻,需进一步研究。
1.Singh O V,Labana S,Pandey G.Phytoremediation:anoverview of metallic ion decontamination from soil[J].Applied Microbiology and Biotechnology,2003,61(5/6):405-412.
2.金玲,高媚娇.锌胁迫长春花不同部位Zn积累受外源乙烯利调控的特点[J].植物研究,2015,35(1):150-153.
3.周以富,董亚英.几种重金属土壤污染及其防治的研究进展[J].环境科学动态,2003,1(1):15-16.
4.Vaillant N,Monnet F,Hitmi A.Comparative studyof responses in fourDaturaspecies to a zinc stress[J].Chemosphere,2005,59:1005-1013.
5.Muschitz A,Faugeron C,Morvan H.Response of cultured tomato cells subjected to excess zinc:Role ofcell wall in zinc compartmentation[J].Acta Physiol Plant,2009,31:1197-1204.
6.林春野.重金属Cu、Cd、Zn的陆生植物毒性比较研究[J].农业环境保护,1996,6:266-267.
7.祖元刚,王非,马书荣,等.长春花生活史型研究[M].北京:科学出版社,2006.
8.李锋民,熊治廷,郑振华.7种高等植物对铅的耐性及其生物蓄积研究[J].农业环境保护,1999,18(6):246-250.
9.Nakagami H,Pitzschke A,Hirt H.Emerging MAP kinase pathways in plant stress signalling[J].Trends in Plant Science,2005,10:339-346.
10.Yang G,Wu J,Tang Y.Research advances in plant resistance mechanisms under lead stress[J].Chinese Journal of Ecology,2005,24(12):1507-1512.
11.Li X K,Zhang Y X.Study of Cd2+,Pb2+,Cu2+on accumulation and distribution inHordeumvulgareseedling[J].Journal of Agro-Environment Science,2007,26(S2):484-488.
12.Qi X M,Li P J,Liu W,et al.The toxicological response of wheatHordeumvulgareL. and Zea mays to copper stress[J].Journal of Agro-Environment Science,2006,25(2):286-290.
13.Skórzyńska-Polit E,Drzkiewicz M,Krupa Z.Lipid peroxidation and antioxidative response inArabidopsisthalianaexposed to cadmium andcopper[J].Acta Physiologiae Plantarum,2010,32(1):169-175.
14.Li W Q,Khan M A,Yamaguchi S,et al.Effects of heavy metals on seed germination and early seedling growth ofArabidopsisthaliana[J].Plant Growth Regulation,2005,46(1):45-50.
15.齐雪梅,李培军,刘宛,等.Cu对大麦和玉米的毒性效应[J].农业环境科学学报,2006,25(2):286-290.
16.司江英,汪晓丽,赵海涛,等.不同铜水平对水稻幼苗生长、铜积累和养分吸收的影响[J].农业环境科学学报,2007,26(4):1312-1315.
17.Huang Y Z,Zhu Y G,Hu Y,et al.Uptake and accumulation of arsenic by different soybean varieties[J].Journal of Agro-Environment Science,2006,25:1397-1401.
18.Chapelle E W,Kim M S.Ratio analysis of reflectance spectra(RARS):An algorithm for the remote estimation of the concentration of chlorophyll A,chlorophyll B and carotenoids in soybean leaves[J].Remote Sensing of Environment,1992,39:239-247.
19.Wellburn A R.The spectral determination of chlorophylls A and B,as well as total carotenoids,using various solvents with spectrophotometers of different resolution[J].Journal of Plant Physiology,1994,144:307-313.
20.Pan Y J,Liu J,Guo X,et al.Gene transcript profiles of the TIA biosynthetic pathway in response to ethylene and copper reveal their interactive role in modulating TIA biosynthesis inCatharanthusroseus[J].Protoplasma,2015,252:813-824.
21.Deering D W,Rouse J W,Haas R H,et al.Measuring forage production of grazing units from Landsat MSS data[J].Environment,1975,23:1169-1173.
22.伍春莲,杨军,陈卫英,等.长春花生物碱合成途径调控机制研究进展[J].药物生物技术,2010,17(1):91-94.
23.周晨,赵淑娟,胡之璧.长春花次生代谢转录调控的分子机制[J].植物生理学通报,2010,46(3):284-290.
24.VanAssche F,Clijsters H.Enzyme analusis in plants as a tool for assessing phytotoxicity of heavy metal polluted soils[J].Med FacLandbouww,Rijksuniv Gent,1987,52: 1819- 1824.
25.Chen Z,Gibson T B,Robinson F,et al.MAP kinases[J].Chemical Reviews,2001,101:2449-2476.
26.Zhang L,Xi D,Li S,et al,A cotton group C MAP kinase gene,GhMPK2,positively regulates salt and drought tolerance in tobacco[J].Plant Molecular Biology,2011,77(1-2):17-31.
EffectsofCopperStressontheAlkaoidsofCatharanthusroseus
LIN Feng1GAO Mei-Jiao2YU Bo-Fan2CHEN Hua-Feng2*
(1.Liaoning Forestry Survey and Planning Institute,Shenyang 110122;2.Key Laboratory of Forest Plant Ecology,Ministry of Education,Northeast Forestry University,Harbin 150040)
WithCatharanthusroseus, we used perlite as the medium quality nutritional way to study the effects of copper stresson theresponses ofC.roseusseedling growth, accumulation, gene expression and characteristics of alkaloid synthesis. The dry weight of root and leaf ofC.roseusunder exogenous Cu stress levels was increased under low concentration,decreased under high concentration,and reached peak at 300 μmol·L-1, with significant difference compared with the control(P<0.05). The root tolerance index of seedlings was increased firstly, then decreased, and reached the peak at 200 μmol·L-1of Cu. Cu intoC.roseusseedlings was mostly accumulated in roots. But under the stress of exogenous Cu,C.roseusblade parameters, such as the accumulation of dry matter, was improved significantly, by presenting a regular change the concentration was increased, and reached the peak at 300 μmol·L-1Cu, even reaching as much as 2.7 times thanthe CK. TheC.roseushyperaccumulation plants can be usedas further reference basisfor Cu accumulation.
Catharanthusroseus;copper stress;vinblastine;hyperaccumulation plants of Cu
国家自然科学基金青年科学基金项目(31400337)
林枫(1977—),男,高级工程师,主要从事植物和林业调查研究工作。
* 通信作者:E-mail:biginsect2002@163.com
2015-11-21
S567
A
10.7525/j.issn.1673-5102.2016.03.009

