农杆菌介导rd29A启动子驱动otsB基因转化紫茉莉的研究
陆玉建 张韩杰 韩文瑜 沈志强
(1.山东省滨州畜牧兽医研究院/博士后科研工作站,滨州 256600; 2.吉林大学博士后科研流动站,长春 130062; 3.滨州学院生命科学系/山东省黄河三角洲野生植物资源开发利用工程技术研究中心,滨州 256603; 4.山东省滨州畜牧兽医研究院,滨州 256600)
农杆菌介导rd29A启动子驱动otsB基因转化紫茉莉的研究
陆玉建1,2,3张韩杰3韩文瑜2沈志强1,4*
(1.山东省滨州畜牧兽医研究院/博士后科研工作站,滨州 256600;2.吉林大学博士后科研流动站,长春 130062;3.滨州学院生命科学系/山东省黄河三角洲野生植物资源开发利用工程技术研究中心,滨州 256603;4.山东省滨州畜牧兽医研究院,滨州 256600)
紫茉莉为紫茉莉科紫茉莉属多年生草本植物,具有较高观赏和药用价值,对重金属和石油污染有较强修复能力。然而目前为止,紫茉莉再生和遗传转化体系尚未建立。本研究以紫茉莉为材料,初步建立起较为稳定的再生体系。通过克隆拟南芥rd29A启动子和大肠杆菌otsB基因,构建了p2300-rd29Apro-otsB植物表达载体。利用根癌农杆菌介导法对紫茉莉进行遗传转化。结果表明,当农杆菌的OD600=0.5,侵染成熟胚或带芽茎段60 min,共培养2 d,紫茉莉的转化效率较高。通过对筛选出的转基因植株进行PCR检测,显示大肠杆菌otsB基因已成功整合到紫茉莉的基因组中,并可有效的进行转录。
紫茉莉;rd29A启动子;otsB基因;农杆菌;遗传转化
紫茉莉(MirabilisjalapaL.)又名草茉莉、胭脂花、地雷花、粉豆花等,为紫茉莉科(Nyctaginaceae)紫茉莉属(Mirabilis)多年生草本植物,原产南美热带地区,在我国广为分布和种植[1~2]。紫茉莉品种繁多,花色丰富,具有杀菌、抗病毒、解痉和镇痛等功效,观赏和药用价值都较高[2~5]。近年来发现,紫茉莉是一种高生物量重金属富集植物,对镉、铅等有较强的吸收能力[6~7]。紫茉莉还可对石油污染的土壤进行生物修复[3,8]。此外,紫茉莉生长比较迅速,适应长期干旱等不良环境的能力较强[9]。目前,有关紫茉莉的研究还较少,其修复污染和抗胁迫的分子机制仍不清楚。
转基因技术是开展相关研究有效手段,而高效再生体系的建立则是紫茉莉遗传转化的基础。目前,国内外有关紫茉莉再生和转化方面的研究仍未见相关报道,仅有的结果主要分析了不同激素对紫茉莉愈伤组织诱导和细胞悬浮培养的影响[10~11]。本研究首先建立起较为稳定的紫茉莉再生体系,在此基础上,探索其遗传转化的最适条件。启动子是调控基因表达的关键元件,拟南芥rd29A启动子是逆境诱导型启动子[12]。当植物遭受逆境胁迫时,rd29A启动子可驱动下游基因表达以减轻不良环境对植物的损害[13~14]。海藻糖由两分子葡萄糖以α,α1-1糖苷键结合而成的非还原性双糖,为一种重要的渗透保护剂[15~16]。海藻糖的合成主要由6-磷酸海藻糖合成酶(TPS)和6-磷酸海藻糖磷酸化酶(TPP)催化完成[17~18]。大肠杆菌的TPS由otsA基因所编码,TPP则由otsB基因所编码[18]。现阶段,有关otsA基因的研究较多,而otsB几乎没有受到关注。本试验通过利用拟南芥rd29A启动子驱动大肠杆菌otsB基因在紫茉莉中进行表达,可以为今后进一步提高紫茉莉生物修复和抗逆能力,以及相关分子机制的研究提供数据和参考。
1 材料与方法
1.1 试验材料
1.1.1 材料及试剂
野生型拟南芥(columbia生态型)和紫茉莉的种植条件为:16 h光照、8 h黑暗,湿度保持在60%~70%,温度控制在22℃左右,光照强度为2 200 Lux。限制性核酸内切酶、Primer STARTMHS DNA ploymerase购自TakaRa公司,Taq酶、T4DNA连接酶、凝胶回收试剂盒均购自Fermentas公司,pTZ57R/T载体购自兰州鹏程生物技术有限公司,引物合成和核酸测序由上海生工完成,大肠杆菌DH5α、土壤农杆菌GV3101和p2300-GFP载体由滨州学院生命科学系基因工程实验室保存。
1.1.2 培养基成分
根据前期试验的结果,以紫茉莉带芽茎段为外植体,初步建立起较为稳定的再生体系,适宜紫茉莉离体快繁的培养基类型如下所述。基本培养基:MS;无菌苗生长培养基M0:MS+0.1 mg·L-1NAA;不定芽诱导培养基M1:MS+1 mg·L-16-BA+1.5 mg·L-1KT+1 mg·L-1NAA+0.05 mg·L-1TDZ;生根培养基M2:1/2MS+0.5 mg·L-1NAA。
1.2 试验方法
1.2.1拟南芥rd29A启动子和大肠杆菌otsB基因的克隆
根据GenBank数据库中拟南芥rd29A启动子(rd29Apro)和大肠杆菌otsB基因序列的相关信息,应用Primer Premier 5.0软件进行引物设计。rd29Apro和otsB基因引物信息(下划线显示引入酶切位点的位置)如下,rd29Apro-F:5′CGCAAGCTTAGATTTGGGGTTTTGCTTTTGAATG3′(HindⅢ),rd29Apro-R:5′GCGGAGCTCTTTCCAAAGATTTTTTTCTTTCCAA3′(SacⅠ);otsB-F:5′ATAGAGCTCATGACAGAACCGTTAACCGAAACC3′(SacⅠ),otsB-R:5′GCGTCTAGAGATACTACGACTAAACGACTCATAGT3′(XbaⅠ)。分别以野生型拟南芥和大肠杆菌基因组DNA为模板,高保真PCR扩增rd29Apro和otsB,回收PCR扩增产物,连入pTZ57R/T载体。转化大肠杆菌,并对重组克隆进行PCR和酶切鉴定。将含有目的片段的阳性克隆进行测序。
1.2.2 重组质粒的构建
用HindⅢ-SacⅠ分别酶切pTZ57R/T-rd29Apro和p2300-GFP,将回收的目的片段进行连接,从而构建p2300-rd29Apro-GFP载体(图1:A~B)。用SacⅠ-XbaⅠ分别酶切pTZ57R/T-otsB和p2300-rd29Apro-GFP,将目的片段回收并连接,从而构建p2300-rd29Apro-otsB载体(图1:C)。将含目的基因的p2300-rd29Apro-otsB表达载体转入农杆菌GV3101中。
1.2.3 卡那霉素敏感性试验
挑取黑色成熟、饱满的紫茉莉瘦果,50℃水浴1 h,75%酒精消毒10 min,无菌水清洗5次,再用0.1%升汞处理30 min,剥胚,接种于含0、10、30、50、70、90 mg·L-1卡那霉素(Kan)的M0培养基中。观察并记录幼苗的生长状况,统计幼苗的成活率,确定最适抗生素筛选浓度。
1.2.4 紫茉莉的遗传转化
将含目的基因的农杆菌振荡培养,测定OD600值,离心后加入含100 μmol·L-1乙酰丁香酮(AS)的MS培养基重悬菌体;以紫茉莉成熟胚或带芽茎段为受体,置于菌液中侵染后共培养。然后将成熟胚或带芽茎段用含500 mg·L-1羧苄青霉素钠(Carb)的抑菌液浸泡10 min,无菌水冲洗3~4次。对于成熟胚,先将其转入M0+Kan+Carb(500 mg·L-1)培养基中进行筛选培养,获得抗性无菌苗,然后切取带芽茎段,在M1+Kan+Carb(500 mg·L-1)培养基中进行分化培养;对于带芽茎段,可直接转入分化培养基M1+Kan+Carb(500 mg·L-1)中进行抗性芽的诱导。切取生长健壮的不定芽,在M1+Kan+Carb(500 mg·L-1)中进行增殖培养,或在生根培养基M2+Kan+Carb(250 mg·L-1)中诱导生根,获得转基因试管苗。
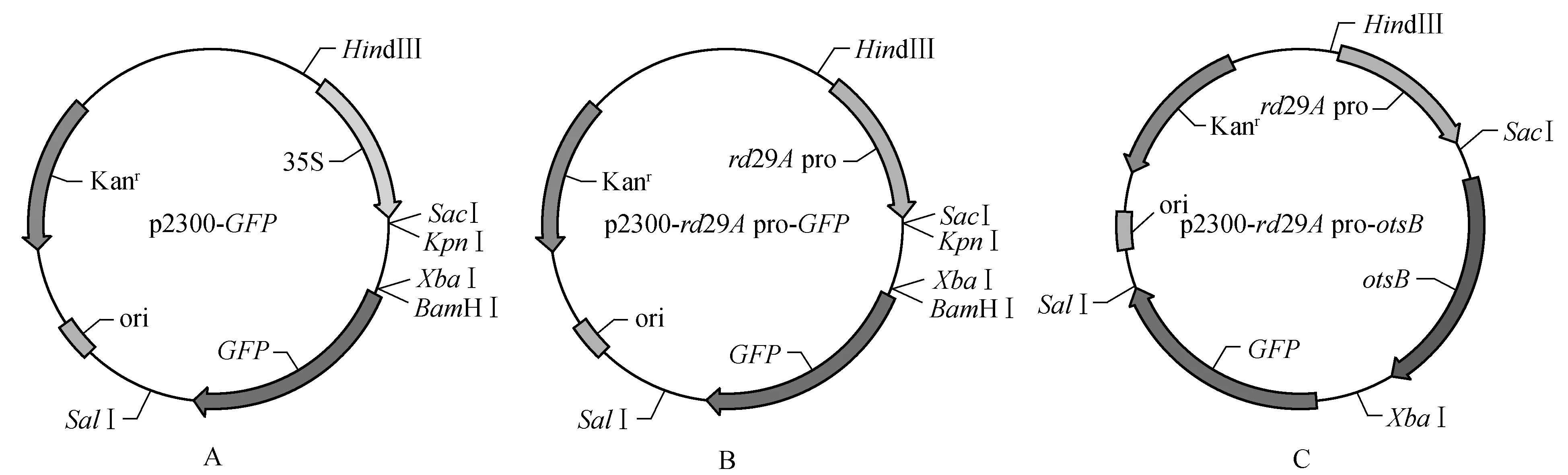
图1 目的基因表达载体的构建 A. p2300-GFP表达载体;B. p2300-rd29A pro-GFP表达载体;C. p2300-rd29A pro-otsB表达载体Fig.1 Construction of p2300-rd29A pro-otsB expression vectors A. Schematic illustration of p2300-GFP expression vector; B. Schematic illustration of p2300-rd29A pro-GFP expression vector; C. Schematic illustration of p2300-rd29A pro-otsB expression vector
1.2.5 转化条件的选择
分别以紫茉莉成熟胚和带芽茎段作为转化的材料,将农杆菌液OD600值调整为0.2、0.5和1.0;侵染时间依次为15、30和60 min;共培养时间设置为1、2和3 d。根据成熟胚的成苗率或茎段的分化率确定最合适的转化条件。
抗性无菌苗成活率(%)=产生抗性无菌苗数/接种成熟胚数×100%
(1)
抗性不定芽分化率(%)=再生抗性芽的茎段数/接种茎段数×100%
(2)
1.2.6 转基因植株的分子检测
用CTAB法提取野生型和转化植株叶片DNA,PCR检测大肠杆菌otsB整合到紫茉莉染色体上的情况;Trizol法提取野生型和转化植株的总RNA,RT-PCR检测大肠杆菌otsB在转基因植株中的转录水平。
1.2.7 统计分析
采用EXCEL 2003和SPSS 19.0软件对所得数据进行统计分析,通过Duncan多重比较进行显著性测验,字母相同者差异不显著,字母不同者表示在0.05(小写字母)或0.01(大写字母)水平上差异显著。
2 结果与分析
2.1 p2300-rd29A pro-otsB表达载体的构建
分别以野生型拟南芥和大肠杆菌基因组DNA为模板,高保真PCR扩增rd29Apro和otsB(图2:A)。回收PCR扩增产物,连入pTZ57R/T载体,转化大肠杆菌,并对重组克隆进行PCR和酶切鉴定。实验结果表明,目的片段已插入pTZ57R/T(图2:B~E)。用HindⅢ-SacⅠ分别酶切pTZ57R/T-rd29Apro和p2300-GFP,连接回收片段,鉴定重组质粒,显示rd29Apro已连入p2300-GFP,从而实现p2300-rd29Apro-GFP表达载体的构建(图2:F~G)。用SacⅠ-XbaⅠ分别酶切pTZ57R/T-otsB和p2300-rd29Apro-GFP,将回收的目的片段进行连接,鉴定重组体,表明otsB基因已插入p2300-rd29Apro-GFP,从而实现p2300-rd29Apro-otsB表达载体的构建(图2:H~I)。
2.2 紫茉莉转化体系的建立
2.2.1 卡那霉素敏感性试验
取成熟饱满的紫茉莉瘦果(图3:A),消毒后剥去果皮,获得成熟胚(图3:B),接种到含不同浓度梯度Kan的M0培养基中,观察紫茉莉幼苗的生长状况,确定最佳的抗生素筛选浓度。培养2周后,在不添加Kan的情况下,紫茉莉幼苗生长旺盛,叶片嫩绿,根系发达(图3:C);Kan浓度为10 mg·L-1时,幼苗的生长开始受到抑制,叶片小,根少而短,排除败育的胚外,幼苗的成活率接近90%(图3:D)。随着Kan浓度的增加,对幼苗的抑制作用越来越强(图3:E~H)。当Kan浓度为70 mg·L-1时,幼苗的长势停滞,叶片枯黄,开始死亡,幼苗的成活率已不足10%(图3:G);Kan浓度为90 mg·L-1时,Kan对幼苗抑制作用过强,紫茉莉幼苗过早出现死亡,成活率几乎为0(图3:H)。因此,比较适合筛选转基因紫茉莉的Kan浓度设定为70 mg·L-1。
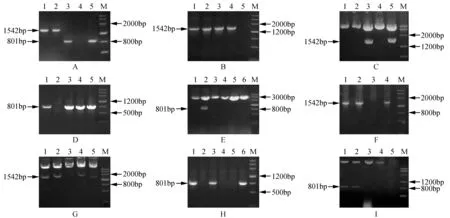
图2 载体的构建与鉴定 A.高保真PCR克隆拟南芥rd29A pro和大肠杆菌otsB基因;B. pTZ57R/T- rd29A pro质粒PCR的结果;C. pTZ57R/T-rd29A pro质粒酶切的结果;D. pTZ57R/T-otsB质粒PCR的结果;E. pTZ57R/T-otsB质粒酶切的结果;F. p2300-rd29A pro-GFP质粒PCR的结果;G. p2300-rd29A pro-GFP质粒酶切的结果;H. p2300-rd29A pro-otsB质粒PCR的结果;I. p2300-rd29A pro-otsB质粒酶切的结果 M. Marker 3(条带大小依次为:4500、3000、2000、1200、800、500和200 bp)Fig.2 Construction and identification of vector A. Amplification results of Arabidopsis thaliana rd29A promoter and otsB gene in E.coli; B. Detection of pTZ57R/T- rd29A pro plasmid by PCR; C. The result of pTZ57R/T-rd29A pro plasmid digested by HindⅢ-SacⅠ; D. Detection of pTZ57R/T-otsB plasmid by PCR; E. The result of pTZ57R/T-otsB plasmid digested by SacⅠ-XbaⅠ; F. Detection of p2300-rd29A pro-GFP plasmid by PCR; G. The result of p2300-rd29A pro-GFP plasmid digested by HindⅢ-SacⅠ; H. Detection of p2300-rd29A pro-otsB plasmid by PCR; I. The result of p2300-rd29A pro-otsB plasmid digested by SacⅠ-XbaⅠ M. DNA marker 3(DNA bands size as follows: 4 500, 3 000, 2 000, 1 200, 800, 500 and 200 bp)
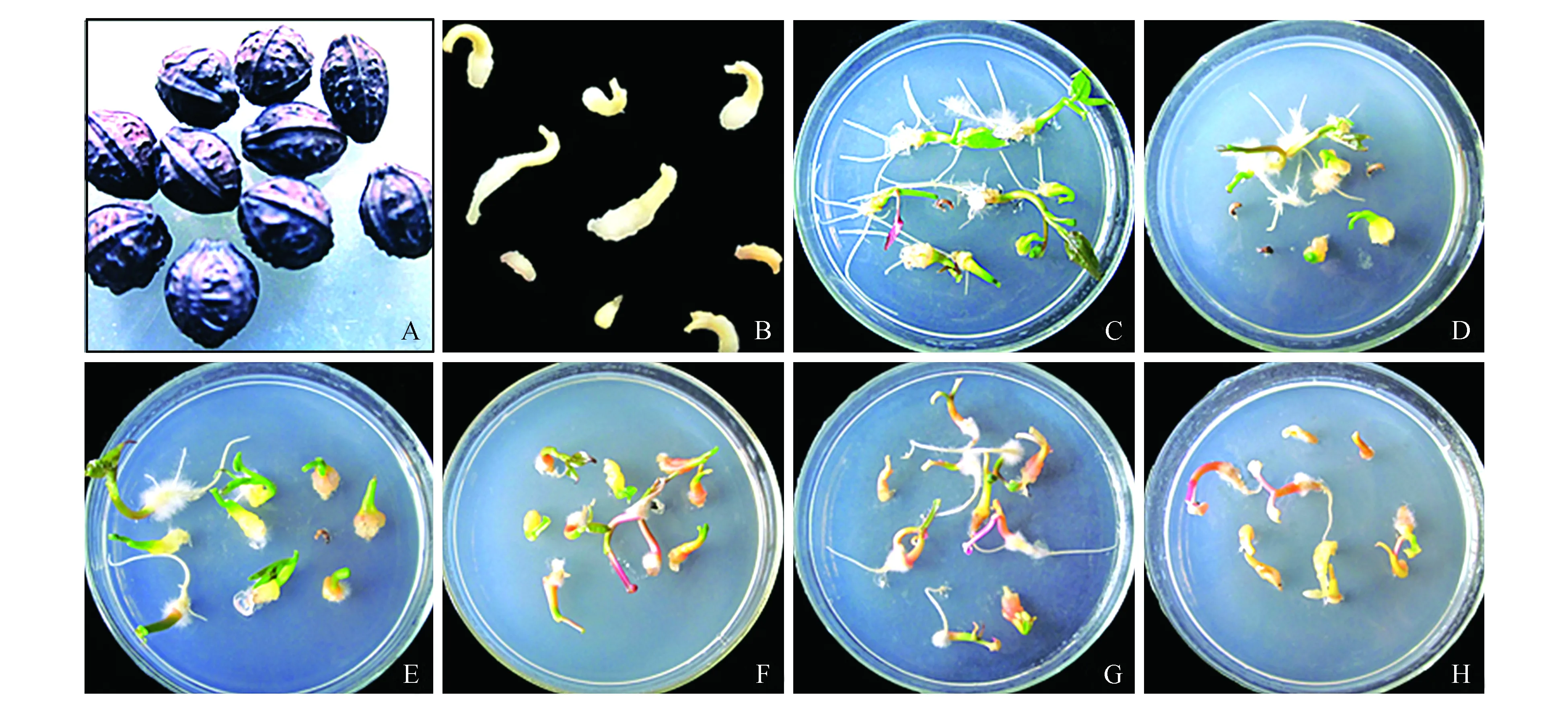
图3 卡那霉素敏感性试验 A.紫茉莉的瘦果;B.紫茉莉的成熟胚;C~H.在筛选培养基中生长2周的紫茉莉 Kan浓度依次为0、10、30、50、70、90 mg·L-1Fig.3 Kanamycin sensitivity test A. The achenes of Mirabilis jalapa L.; B. The mature embryos of M.jalapa L.; C-H. M.jalapa L. grown in the selection media containing 0, 10, 30, 50, 70 and 90 mg·L-1 kanamycin for two weeks
2.2.2 农杆菌转化条件的优化
以紫茉莉成熟胚为遗传转化的受体,通过对抗性无菌苗的生长情况进行观察统计可以发现(图4),当农杆菌OD600=0.2时,紫茉莉成熟胚成苗率约为30%,明显低于OD600=0.5,后者成熟胚成苗率达到50%,而当农杆菌OD600=1.0时,紫茉莉成熟胚成苗率下降为33%。因此,当农杆菌的OD600值为0.5,侵染能力较强,紫茉莉成熟胚转化率最高,三者之间差异显著(P<0.05)。农杆菌侵染时间为60 min,成熟胚成苗率大约为55%,比侵染15 min(26%)与30 min(39%)要高。其中侵染时间15和60 min之间存在显著差异。由此可见,在利用紫茉莉成熟胚进行农杆菌转化过程中,侵染时间为60 min时其转化效果较好。对于共培养时间,2和3 d的效果区别不大,共培养2 d时,成熟胚成苗率可达到61%,比3 d(48%)的略高。而共培养时间为1 d时,成熟胚成苗率只有25%,和2~3 d的结果之间存在比较明显的差异。
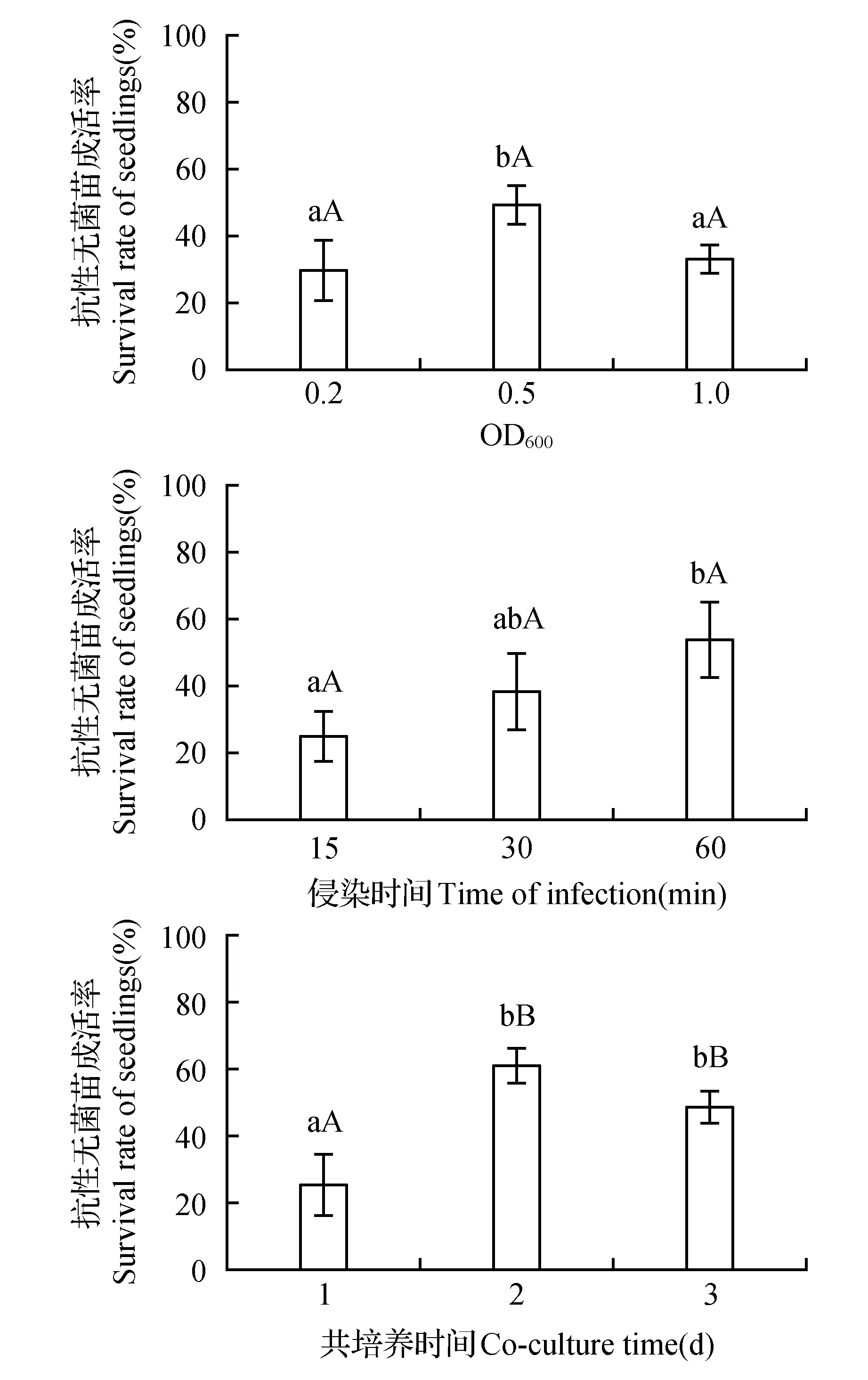
图4 紫茉莉成熟胚转化条件的优化Fig.4 Optimization of transformation conditions for mature embryos of M.jalapa L.
以带芽茎段为遗传转化的受体,进行农杆菌侵染和转化条件的优化。实验结果表明(图5),当农杆菌OD600=0.2时,紫茉莉茎段的转化率约38%,远低于OD600=0.5,后者抗性不定芽诱导率达到70%,二者之间存在及其显著的差异(P<0.01)。而当农杆菌OD600=1.0时,茎段的转化率则下降为52%。因此,当农杆菌的OD600值为0.5,侵染能力较强,抗性不定芽的分化率较高。农杆菌侵染时间为60 min时,抗性不定芽的分化率可达到80%左右,转化效果明显优于15 min,但和30 min转化率(71%)差异并不十分明显。因此,侵染时间60 min为宜,此时抗性不定芽的分化率高。对于共培养时间,2 d的效果较好,不定芽的分化率约为72%,比共培养1 d(25%)和3 d(58%)时的效果好,三者之间差异显著。此外,在紫茉莉转化过程中,无论外植体为成熟胚或茎段,向农杆菌菌液中添加100 μmol·L-1乙酰丁香酮都对提高紫茉莉的转化效率有一定的促进作用。
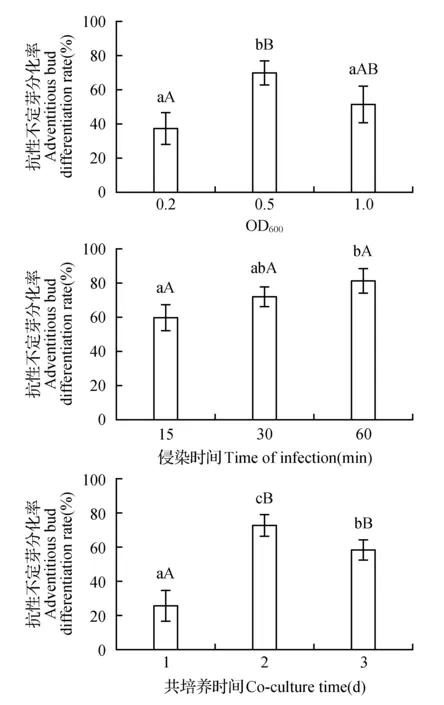
图5 紫茉莉不定芽转化条件的优化Fig.5 Optimization of transformation conditions for nodal stem segments of M.jalapa L.

图6 紫茉莉遗传转化体系的建立 A.和农杆菌共培养2 d的紫茉莉胚;B.转入筛选培养基中的胚;C.筛选培养7 d的胚;D.筛选培养15 d后紫茉莉的幼苗;E.茎段的分化培养;F.分化培养30 d的茎段;G.茎段的遗传转化;H.在筛选培养基中培养15 d的茎段;I.在筛选培养基中培养30 d的茎段;J.增殖培养15 d的茎段;K.生根诱导;L.试管苗的形成;M.处于花期的转基因紫茉莉;N.转基因植株的普通PCR检测;O.转基因植株的RT-PCR检测Fig.6 The genetic transformation and identification of M.jalapa L. A. Mature embryos infected by Agrobacterium tumefaciens for 2 d; B. Embryos in the selection medium; C. Embryos cultured for 7 d in the selection medium; D. Seedlings cultured for 15 d in the selection medium; E. Differentiation culture of stem segments; F. Stem segments cultured for 30 d in the differentiation medium; G. Genetic transformation of nodal stem segments; H. Stem segments cultured for 15 d in the selection medium; I. Stem segments cultured for 30 d in the selection medium; J. Proliferation culture of stem segment for 15 d; K. Rooting induction; L. Formation of plantlets; M. Flowering transgenic Mirabilis jalapa L.; N. PCR analysis of otsB gene in putative transgenic plants; O. RT-PCR detection of transgenic plants
2.2.3 转基因紫茉莉的获得
通过对成熟胚或带芽茎段进行转化和筛选,初步获得了紫茉莉转基因植株。具体过程如图6所示。图6A为和农杆菌共培养2 d后的紫茉莉成熟胚,共培养后转移到添加抗生素的培养基中进行筛选培养(图6:B)。筛选培养7 d后,转化成功的成熟胚进一步发育,开始抽出叶片(图6:C);筛选培养15d后部分紫茉莉幼苗开始快速生长,而目的基因没有导入的成熟胚则发育迟缓,逐渐死亡(图6:D)。切取转化苗的茎段,进行不定芽诱导(图6:E)。培养30 d后,茎段在筛选培养基中快速增殖(图6:F)。图6G为带芽茎段的遗传转化。茎段在抗性培养基中培养15 d后,可以看到转化成功的茎段开始产生新芽(图6:H)。茎段在筛选培养基中培养30 d后,没有转化成功的茎段枯萎死亡,而具有抗性的不定芽则继续快速生长(图6:I)。切取抗性不定芽,转入增殖培养基中增殖培养15 d后,大部分不定芽增殖旺盛(图6:J)。待抗性芽生长到一定阶段,进行生根诱导(图6:K)。大约1个月后,初步获得具有抗性的转基因试管苗(图6:L)。当根布满培养基底部,株高8~10 cm时,对幼苗进行驯化和移栽,生长1~2月后便可开花(图6:M)。提取转基因植株的DNA进行PCR检测,结果表明,大肠杆菌otsB基因已成功的整合到部分紫茉莉的基因组中(图6:N)。提取转基因植株的RNA,RT-PCR检测大肠杆菌otsB基因表达情况,显示该基因在部分紫茉莉中可以有效的进行转录(图6:O)。
3 讨论
转基因技术是选育优良品种极为便捷和有效的途径,成功的基因转化首先依赖于良好的植物受体系统的建立,外植体高效稳定的再生能力是遗传转化能否成功的关键因素。通过试验发现,以紫茉莉叶片为材料,极易诱导形成大量的不定根,产生愈伤组织的量却极少,且质量较差,难以分化成芽,这与已有的研究结果并不一致[10~11]。因此,以叶片为外植体,建立稳定的再生体系目前尚存在一定的困难。而紫茉莉带芽茎段再生能力强,可不经愈伤组织阶段直接产生大量的丛生芽,通过生根诱导即可建立较为稳定的再生体系,故可作为良好的植物受体系统。作为植物基因转化受体系统,不仅能够高效稳定的再生,还要对转化选择抗生素敏感。在筛选过程中,非转化细胞应对抗生素敏感,细胞的分裂和分化受到抑制;而转化细胞由于携带该抗生素的抗性基因则能够正常分裂和分化,最终获得完整的转化植株[19~20]。现阶段,较为普遍使用的选择标记基因是新霉素磷酸转移酶基因(nptⅡ),其编码的蛋白可以抑制卡那霉素的活性[20~21]。卡那霉素敏感性试验表明,野生型紫茉莉对Kan较为敏感,比较合适的筛选浓度为70 mg·L-1,在此浓度下,绝大部分紫茉莉幼苗的生长受到抑制,黄化死亡。所以,通过适宜浓度的Kan对转化植株进行初步筛选是完全可行的。农杆菌介导法是植物遗传转化的最重要方法之一,利用农杆菌浸染的特性和植物细胞自身的物质转运系统,外源基因可以被导入受体细胞基因组,并能稳定的表达与遗传。由于农杆菌介导的植物转化频率较低,因此需要对影响转化效率的重要因素进行优化,进而建立高效的遗传转化体系。农杆菌介导遗传转化的过程是其侵入植物组织,吸附细胞表面,完成T-DNA插入的过程。农杆菌的浓度、浸染时间和共培养时间是影响转化效率的重要因素。有研究表明,农杆菌浓度过大、侵染时间过长,对植物生长具有毒害作用;浓度过低、侵染时间过短,菌体不能充分吸附在受体表面或吸附量过少,使T-DNA不能有效转移或转化的数目较少,从而降低转化率[22~24]。共培养时间过短,农杆菌的T-DNA难以有效的进入受体细胞内部并将目的基因整合到该细胞的基因组中,导致转化效率降低;共培养时间过长,除菌困难,污染比较严重[24~25]。据外植体的生长状态和转化率的高低,最终确定当农杆菌OD600=0.5,侵染60 min,共培养2 d时,对紫茉莉的遗传转化比较有利。对成熟胚和带芽茎段而言,以后者为受体,转化效率高,培养周期短。推测其可能的原因是带芽茎段细胞分裂更为活跃,对基因转化较敏感,有利于T-DNA转移和整合。因此,在紫茉莉遗传转化过程中,选择茎段作为受体更为合适。经抗生素筛选获得的转基因植株仍需用分子生物学的方法进行检测,以确保大肠杆菌otsB基因成功插入到紫茉莉的基因组中并能进行有效的表达。在选取的35株Kan抗性植株中,通过PCR方法检测到otsB基因的阳性植株为9株,而otsB基因能够进行表达的只有5株。可见,紫茉莉的实际转化效率还比较低,转化成功率可能在10%左右。
采用传统的育种技术改良和筛选作物品种,花费时间过长,限制因素过多,存在较高的不确定性,通过基因工程技术可以方便省时的将特定外源基因导入到受体植物的基因组,筛选出性状优良的新品种[26~27]。因此,转基因技术已成为加速农业发展的强有力手段,具有广阔的应用前景。当前,我国存在大量盐渍化和石油、重金属等污染的土壤,严重威胁着农业生产和人民群众的身体健康。紫茉莉具有生长迅速,生物量大,适应性强等特点,是一种较为理想的污染土壤修复植物;而且,紫茉莉花色鲜艳,种类繁多,观赏价值极高,所以,在进行土壤修复的同时还可美化环境[6~8]。虽然紫茉莉生物修复能力较强,但仍难以满足高效修复严重污染土壤的需要。而将具有修复功能的外源基因引入植物,进而增强转基因植物的生物修复功能,则为解决土壤污染问题提供了有效手段。本研究紫茉莉为材料,首次建立起较为稳定的再生和遗传转化体系,并成功的将p2300-rd29Apro-otsB植物表达载体导入到受体细胞,试图利用拟南芥rd29A启动子驱动大肠杆菌otsB基因在紫茉莉中高效表达,进而提高紫茉莉的生物修复功能和抗逆能力。但在紫茉莉转化过程中,还存在筛选效果不佳,假阳性高,转化率较低的不足之处,因此,转化条件仍需要进一步优化。当前,农杆菌介导紫茉莉的遗传转化仍处于建立和优化完善阶段,初步获得的研究结果对于今后建立高效的紫茉莉遗传转化体系和通过基因工程技术改善紫茉莉生物修复以及抗逆能力具有一定的参考和应用价值。
1.陈军.紫茉莉栽培管理[J].中国花卉园艺,2012,24(18):1-2.
2.王永飞.紫茉莉的种植和利用[J].农业与技术,2005,25(5):83,101.
3.Peng S W,Zhou Q X,Cai Z,et al. Phytoremediation of petroleum contaminated soils byMirabilisjalapaL. in a field plot experiment [J]. J Hazard Mat,2009,168(2-3):1490-1496.
4.李光喜,杨培全.紫茉莉属药用植物研究进展[J].广东医药学院学报,1994,10(4):251-253.
5.Zachariah S M,Aleykutty N A,Viswanad V,et al. In-vitro antioxidant potential of methanolic extracts ofMirabilisjalapaLinn [J]. Free Rad Antiox,2011,1(4):82-86.
6.陈杰.2种强化措施辅助紫茉莉修复镉污染土壤研究[J].安徽农业科学,2010,38(24):13205-13206.
7.叶晟.紫茉莉对铅胁迫的响应及耐性研究[D].长沙:中南大学,2009:21-38.
8.刘家女,周启星,孙挺,等.花卉植物应用于污染土壤修复的可行性研究[J].应用生态学报,2007,18(7):1617-1623.
9.罗南书.干旱胁迫对紫茉莉种子萌发及幼苗生长的影响[J].湖南农业科学,2011(23):114-116,123.
10.白玉,高月,赵倩,等.紫茉莉愈伤组织诱导的激素优化研究[J].园艺与种苗,2012(7):52-54.
11.赵倩,林景卫,冯雅萍,等.紫茉莉悬浮细胞培养体系的建立[J].热带亚热带植物学报,2013,21(5):453-458.
12.张俊莲,王丽,秦舒浩,等.利用拟南芥rd29A启动子驱动AtNHX1基因提高烟草耐盐性[J].农业生物技术学报,2011,19(4):669-676.
13.张宁,司怀军,王蒂.拟南芥rd29A基因启动子克隆及其在马铃薯抗胁迫转基因中的应用[J].作物学报,2005,31(2):159-164.
14.押辉远,秦广雍,霍裕平.Prd29A及DREB1A的克隆和干旱诱导型植物表达载体的构建与鉴定[J].植物生理学通讯,2005,41(3):371-375.
15.齐宏飞,阳小成.植物抗逆性研究概述[J].安徽农业科学:2008,36(32):13943-13946.
16.Crowe J H,Hoekstra F A,Crowel M. Anhydrobiosis [J]. Anllu Rev Physiol,1992,54:579-599.
17.戴秀玉,王忆琴,杨波,等.大肠杆菌海藻糖合成酶基因对提高烟草抗逆性能的研究[J].微生物学报,2001,41(4):427-431.
18.戴秀玉,王忆琴,周坚,等.大肠杆菌海藻糖的代谢调控[J].生物工程进展,2000,20(6):26-29.
19.张岗,康振生,孙燕飞,等.84K杨基因转化受体系统的建立[J].西北农林科技大学学报,2005,33(4):87-90,96.
20.罗素兰,陈若,长孙东亭,等.番茄组培苗的不同阶段对抗生素和PPT的抗性筛选试验[J].海南大学学报,2003,21(1):58-64.
21.杨广东,朱祯,李燕娥,等.几种抗生素对大白菜种子发芽及离体子叶再生的影响[J].华北农学报,2002,17(1):55-59.
22.王丹,吴燕民,刘水,等.利用农杆菌浸种法建立白三叶草遗传转化体系的研究[J].中国农业科技导报,2009,11(1):96-101.
23.吴关庭,胡张华,郎春秀,等.农杆菌介导高羊茅遗传转化体系的建立[J].核农学报,2005,19(5):340-346.
24.雷江丽,王丹,吴燕民,等.农杆菌浸种法介导中华结缕草遗传转化体系的建立[J].农业生物技术学报,2009,17(5):865-871.
25.陆玉建,张韩杰,刘南南,等.大肠杆菌otsB基因的克隆与转化本生烟草的初步研究[J].广东农业科学,2015,8:108-112.
26.张振霞.几种牧草和草坪植物遗传转化体系的建立及其转基因研究[D].兰州:甘肃农业大学,2002:1-7.
27.李玉婷.根癌农杆菌介导的橡胶树胚状体遗传转化体系的建立及AtFT转基因的初步研究[D].海口:海南大学,2012:1-15.
TransformationofMirabilisjalapaL.withotsBGeneinE.coliDrivenbyrd29APromoterfromArabidopsisthaliana
LU Yu-Jian1,2,3ZHANG Han-Jie3HAN Wen-Yu2SHEN Zhi-Qiang1,4*
(1.Postdoctoral Programme,Binzhou Animal Science & Veterinary Medicine Academy,Binzhou 256600;2.Postdoctoral Programme,Jilin University,Changchun 130062;3.Shandong Provincial Engineering and Technology Research Center for Wild Plant Resources Development and Application of Yellow River Delta,Department of Life Sciences,Binzhou University,Binzhou 256603;4.Binzhou Animal Science & Veterinary Medicine Academy,Binzhou 256600)
MirabilisjalapaL. is a perennial herb ofNyctaginaceae. Not only is it a high-value ornamental flowering and greening plants, but also can be used as medicine.M.jalapaL. has good bioremediation function.M.jalapaL. was used as experimental material, and the perfect regeneration system was initially established. Therd29Apromoter ofArabidopsisthalianaandotsBgene inE.coliwere cloned by PCR respectively. Afterwards, therd29Apromoter andotsBgene were ligated into plasmid p2300-GFP, which would lead to the construction of p2300-rd29Apro-otsBexpression vector. Then, the expression vector was introduced into the cells ofM.jalapaL. byAgrobacterium-mediated method. The genetic transformation results showed that when the concentration ofAgrobacteriumwas OD600=0.5, the time of infection of mature embryo or nodal stem segments was 60 min, and the co-culture time was 2 d, the transformation efficiency ofM.jalapaL. was the highest. By PCR detection,otsBgene was successfully integrated into the genome ofM.jalapaL., and the efficient transcription could be performed.
MirabilisjalapaL.;rd29Apromoter;otsBgene;Agrobacterium;genetic transformation
山东省自然科学基金(ZR2012CL14);滨州学院博士基金(2010Y08)
陆玉建(1979—),男,博士,讲师,主要从事细胞工程及分子生物学研究。
* 通信作者:E-mail:bzshenzq@163.com
2015-11-19
S685.16
A
10.7525/j.issn.1673-5102.2016.03.013

