胞外ATP通过H2O2对菜豆叶片光系统Ⅱ光化学特性的系统性影响
田武英 焦青松 石岱龙 孙 坤 贾凌云 冯汉青
(西北师范大学生命科学学院,兰州 730070)
胞外ATP通过H2O2对菜豆叶片光系统Ⅱ光化学特性的系统性影响
田武英 焦青松 石岱龙 孙 坤 贾凌云*冯汉青
(西北师范大学生命科学学院,兰州 730070)
研究了细胞外ATP对菜豆叶片光系统Ⅱ(PSⅡ)光化学特性的系统性影响及可能的内在机制。研究发现,用外源ATP处理菜豆叶片的一侧,处理侧和同叶未处理侧潜在最大光化学效率(Fv/Fm)、非调节性能量耗散量子产量(Y(NO))与对照相比无显著变化;而实际光化学效率 (Y(Ⅱ))、电子传递速率(ETR)和光化学猝灭系数 (qP)与对照相比显著上升,但非光化学猝灭系数(qN)和调节性能量耗散量子产量(Y(NPQ))则显著下降。表明了细胞外ATP能够系统性地提高菜豆叶片PSⅡ光化学效率。用外源ATP处理菜豆叶片的一侧,检测叶片处理侧与同叶未处理侧过氧化氢的含量,发现与对照相比,叶片处理侧与未处理侧过氧化氢含量均显著上升。用外源过氧化氢(H2O2)处理菜豆叶片一侧也导致了处理侧与同叶未处理侧Y(Ⅱ)、ETR和qP的显著上升,以及qN和Y(NPQ)的显著下降。因此,过氧化氢和ATP能够对处理侧与同叶未处理侧叶片的光化学特性产生相似的影响。进一步研究表明,用过氧化氢的淬灭剂N,N′-二甲基硫脲(DMTU,dimethylthiourea)可以减弱ATP对菜豆叶片处理侧与未处理侧Y(Ⅱ)、ETR、qP、qN和Y(NPQ)产生的影响。这些结果表明:菜豆叶片局部细胞外ATP的增加可加强邻近组织PSⅡ的光化学效率,并且胞外ATP对叶片PSⅡ光化学特性的这种系统性影响依赖于H2O2调节的下游信号途径。
叶绿素荧光;细胞外ATP;过氧化氢(H2O2);菜豆;系统性
三磷酸腺苷(ATP)通常被认为广泛存在于线粒体、叶绿体等细胞器以及细胞质中,并作为能量货币分子参与多种生理生化反应。尽管ATP是极性分子无法自由穿过细胞膜[1],但近年来的研究表明,动物、植物和微生物细胞可以通过通道蛋白等方式将胞内的部分ATP释放到细胞外基质中,从而使得细胞外也存在着ATP,即胞外ATP(extracellular ATP,eATP)[2]。
人们首先在动物和绿藻的细胞膜上发现了能够特异性结合eATP的跨膜受体蛋白(如P2X和P2Y蛋白);且发现这些受体蛋白在胞质侧的结构域与一些调节细胞信号传递的蛋白相偶联[2~3]。在动物细胞中的研究发现,eATP能够作为一种存在于胞外的信号分子通过上述受体蛋白的介导可诱发多种下游信号分子(如:Ca2+,一氧化氮(NO),活性氧(ROS)等)的积累[4~8]从而调节细胞的生长、免疫和神经传导等重要的生理反应[2]。
相对于动物eATP的研究,植物eATP的研究尚处于起步阶段。但已揭示了植物细胞能够通过ATP结合转运载体蛋白或膜泡运输的方式将细胞内ATP释放到胞外,使得植物细胞也同样存在eATP[9~10],一些环境刺激(如:损伤和高渗胁迫等)也会使植物细胞释放ATP[11]。Choi等已经在拟南芥中鉴定出特异性结合eATP的受体蛋白,这将使得植物eATP的研究进入到全新的阶段[12]。有研究表明,植物的eATP也是一种重要的胞外分子,并通过受体介导的作用来调节植物细胞的生长、发育、抗病反应和向地性等生理学活动[13]。
光合作用是植物最为重要的生理学活动,决定着植物的生长与发育。然而,目前关于eATP对植物光合作用影响的研究报道较少。最近,Chivasa[1]等发现,放氧增强蛋白及Psbp蛋白等植物光反应阶段相关蛋白的表达水平受到了eATP水平的影响,提示了植物光合作用的光反应阶段可能受到了eATP的调节。本实验室在以前的工作中已发现,对菜豆叶片施加外源ATP可提高被ATP施加组织处光系统Ⅱ的光化学效率[14]。但有趣的是,Chivasa[15~16]等发现,在叶片的一侧施加ATP能够改变同叶另一侧叶片组织对于病原菌和病毒的抗性,这提示了eATP对于植物叶片的生理学反应有着系统性的影响。但是否eATP也可能对叶片光系统Ⅱ光化学效率也有着系统性的影响却未被研究。为此,我们利用叶绿素荧光技术研究了eATP对叶片光能吸收和传递效率的系统性影响。同时也进一步探讨了eATP下游信号分子H2O2是否参与了这一系统性影响的信号传递过程。相信该研究可进一步深入了解植物光合作用的调控机制及丰富对eATP的生理学角色的认知。
1 材料与方法
1.1 材料的培养
供试菜豆(PhaseolusvulgarisL.)为‘农普12号’,来源于广州市农业科学研究院。试验菜豆用2%的次氯酸钠溶液消毒10 min后,用蒸馏水冲洗2~3次,置于含多层纱布的培养皿中,用蒸馏水浸湿纱布,放于培养箱中待种子萌发。萌发后的菜豆种子被移栽到塑料盆钵中,每盆1株。培养基质为营养土、蛭石、珍珠岩(比例3∶1∶1)。培养室的昼夜温度变化为25℃/20℃,光照强度为200 μmol·m-2·s-1,光周期12 h光照/12 h黑暗。每天浇水一次保持表层培养介质湿润。选取第一对真叶叶龄8 d的菜豆植株备用。
1.2 材料处理
用去离子水配制:(1)1.0 mmol·L-1的ATP溶液;(2)1.0 mmol·L-1的H2O2溶液;(3)1.0 mmol·L-1N,N′-二甲基硫脲(DMTU)溶液;(4)以及1.0 mmol·L-1ATP与1.0 mmol·L-1DMTU等体积的混合溶液。选取上述备用的菜豆植株,将塑料板放置于菜豆植株第一对真叶叶片的主叶脉上,分别吸取上述四种溶液并喷洒菜豆叶片的一侧。以同样的方法喷洒去离子水作为对照(图1),每组重复处理四片叶子。处理后将植株放置在光照强度为200 μmol·m-2·s-1培养架上照射20 min后测定第一对真叶叶片处理侧与同叶未处理侧的叶绿素荧光参数。
图1 菜豆叶片处理方法Fig.1 Processing methods of bean leaves
1.3 参数测定
叶绿素荧光参数测定使用叶绿素荧光成像仪IMAGING-PAM(Waltz,Germany)。参照Demmig-Adams[17]等的方法。在空气湿度45%,温度为20℃培养室进行测定。具体测定步骤如下:测定前对所处理材料暗适应20 min,打开测量光(0.1 μmol·m-2·s-1),测得初始荧光(Fo),再打开饱和脉冲光(6 000 μmol·m-2·s-1,光照时间0.8 s)测得暗适应下叶片的最大荧光(Fm),再开启作用光(300 μmol·m-2·s-1),当所测材料在作用光的实时荧光(Fs)达到稳态后20 s打开饱和脉冲光,测得最大荧光(Fm′);再打开远红光(far-red light)测定光适应叶片的最小荧光(Fo′)。测定结束后根据以上参数计算出:暗适应下PSⅡ潜在最大光化学量子效率Fv/Fm=(Fm-Fo)/Fm。并由仪器直接导出光适应下PSⅡ的实际光化学效率(Y(Ⅱ)),光合电子传递速率(ETR),光化学猝灭(qP),非光化学猝灭(qN),调节性能量耗散量子产量(Y(NPQ)),非调节性能量耗散量子产量(Y(NO))等参数的值。
1.4 过氧化氢含量的检测
H2O2含量的检测参照Sergiev[19]的方法。根据1.2的实验处理方法,用ATP和去离子水分别处理菜豆叶片的一侧,处理后将植株放置在光照强度为200 μmol·m-2·s-1培养架上照射20 min后分别称取处理侧与同叶未处理侧叶片各0.15 g,加入预冷的1.5 mL三氯乙酸(TCA,0.1%)研磨,12 000 g离心20 min,然后取0.5 mL的上清液,加入0.5 mL的磷酸缓冲液(10 mmol·L-1,pH7.0)和1 mL的碘化钾(1 mol·L-1),390 nm测定吸光值,每组处理重复4次。根据ΔA390值计算H2O2的含量,结果以μmol·g-1FW所示。H2O2标准曲线的制作步骤同上。
1.5 数据分析
将所得数据用Excel预处理,计算出平均值和标准差,然后使用Origin 9.0统计软件进行显著性检验(P<0.05),以及绘图。
2 结果
2.1外源ATP对菜豆叶片叶绿素荧光的系统性影响
用1.0 mmol·L-1ATP处理菜豆叶片的一侧后,处理侧与同叶未处理侧叶片Fv/Fm与对照相比无显著差异。而外源ATP处理侧与未处理侧叶片Y(Ⅱ)的值分别比对照叶片处理侧和未处理侧提高了79.8%和59.73%,qP则均提高了60.6%(表1)。光系统Ⅱ(PSⅡ)的实际光化学效率与电子传递速率之间呈正相关,所以外源ATP的处理同样使得菜豆叶片处理侧与未处理侧电子传递速率(ETR)与对照相比显著升高,分别提高了71.88%和58.14%(表1)。
qN代表非光化学猝灭系数。外源ATP的处理使菜豆叶片处理侧与未处理侧qN与对照相比显著下降,分别降低了14.8%和14.77%(表1)。同时,菜豆叶片处理侧与未处理侧Y(NPQ)与对照相比也显著下降,分别降低了35.58%和33.33%(表1),而对Y(NO)则无影响(表1)。
2.2外源ATP处理后菜豆叶片过氧化氢含量的变化
用外源ATP处理菜豆叶片的一侧,检测ATP处理侧与同叶未处理侧过氧化氢含量的变化。发现,与对照相比,处理侧与同叶未处理侧过氧化氢含量均显著上升(图2)。
2.3H2O2对菜豆叶片叶绿素荧光特性系统性影响
用1.0 mmol·L-1外源H2O2处理菜豆叶片一侧,叶片处理侧与未处理侧叶绿素荧光参数的变化与外源ATP处理后的变化趋势一致。即:处理侧与未处理侧Fv/Fm和Y(NO)与对照相比无显著变化。Y(Ⅱ)、ETR和qP显著上升,并与对照相比,1.0 mmol·L-1H2O2使叶片处理侧与未处理侧Y(Ⅱ)分别增加了51.72%和35.84%。ETR分别提高了44.78%和37.46%,而qP均提高了51.63%。而qN和Y(NPQ)则显著下降,与对照相比,1.0 mmol·L-1H2O2使叶片处理侧与未处理侧qN分别降低了6.59%和7.32%;Y(NPQ)分别降低了16.16%和13.21%(表1)。
表1外源ATP和H2O2(1.0mmol·L-1)对菜豆叶片处理侧与同叶未处理侧叶绿素荧光参数的影响
Table1Theeffectsofthetreatmentsofahalfofabean(P.vulgarisL.)leafwithexogenousATPandH2O2(1.0mmol·L-1)onthechlorophyllfluorescenceparametersofthetreatedhalfandtheuntreated,oppositehalf
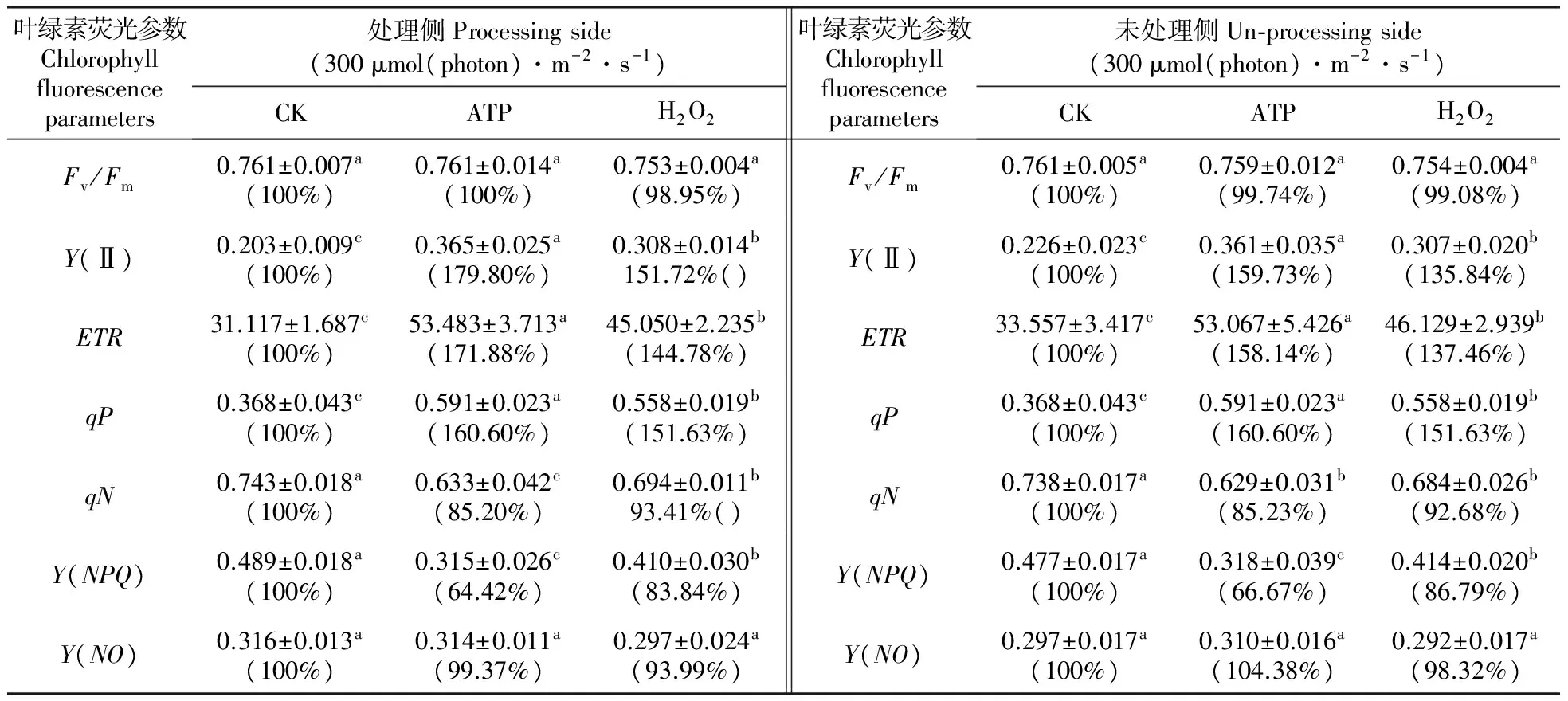
叶绿素荧光参数Chlorophyllfluorescenceparameters处理侧Processingside(300μmol(photon)·m-2·s-1)CKATPH2O2叶绿素荧光参数Chlorophyllfluorescenceparameters未处理侧Un⁃processingside(300μmol(photon)·m-2·s-1)CKATPH2O2Fv/Fm0.761±0.007a(100%)0.761±0.014a(100%)0.753±0.004a(98.95%)Fv/Fm0.761±0.005a(100%)0.759±0.012a(99.74%)0.754±0.004a(99.08%)Y(Ⅱ)0.203±0.009c(100%)0.365±0.025a(179.80%)0.308±0.014b151.72%()Y(Ⅱ)0.226±0.023c(100%)0.361±0.035a(159.73%)0.307±0.020b(135.84%)ETR31.117±1.687c(100%)53.483±3.713a(171.88%)45.050±2.235b(144.78%)ETR33.557±3.417c(100%)53.067±5.426a(158.14%)46.129±2.939b(137.46%)qP0.368±0.043c(100%)0.591±0.023a(160.60%)0.558±0.019b(151.63%)qP0.368±0.043c(100%)0.591±0.023a(160.60%)0.558±0.019b(151.63%)qN0.743±0.018a(100%)0.633±0.042c(85.20%)0.694±0.011b93.41%()qN0.738±0.017a(100%)0.629±0.031b(85.23%)0.684±0.026b(92.68%)Y(NPQ)0.489±0.018a(100%)0.315±0.026c(64.42%)0.410±0.030b(83.84%)Y(NPQ)0.477±0.017a(100%)0.318±0.039c(66.67%)0.414±0.020b(86.79%)Y(NO)0.316±0.013a(100%)0.314±0.011a(99.37%)0.297±0.024a(93.99%)Y(NO)0.297±0.017a(100%)0.310±0.016a(104.38%)0.292±0.017a(98.32%)
注:不同小写字母表示不同的处理之间存在显著性差异(P<0.05),下同。
Note:Different letters denote significant differences from the treatment with different chemical solutions at the same light intensity(P<0.05),the same as below.
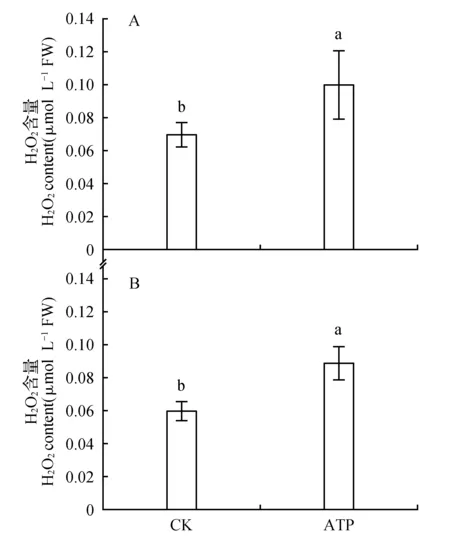
图2 ATP对菜豆叶片处理侧(A)与未处理侧(B)H2O2含量的影响Fig.2 The effects of ATP on H2O2 content of the treated half(A) and the untreated half(B) of bean leaves
2.4H2O2抑制剂减弱了外源ATP对菜豆叶片叶绿素荧光的系统性影响
为了进一步研究外源ATP对菜豆叶片叶绿素荧光参数的系统性影响是否与H2O2相关。本研究利用过氧化氢淬灭剂N,N′-二甲基硫脲(DMTU)进行了研究。用1.0 mmol·L-1的DMTU单独处理叶片一侧,发现上述荧光参数与对照相比均无显著变化(数据未列出)。与外源ATP单独处理叶片一侧相比,ATP与DMTU的混合液处理的菜豆叶片处理侧与未处理侧Fv/Fm和Y(NO)无变化,而Y(Ⅱ)、ETR和qP水平均显著降低,且qN和Y(NPQ)水平显著上升(表2)。
3 讨论
本实验结果表明:1.0 mmol·L-1外源ATP对叶片处理侧Fv/Fm无影响,但显著增加了Y(Ⅱ)和ETR水平(表1)。这表明eATP水平的升高可增加用于光化学反应和光合作用电子传递速率的量子比例。而外源ATP处理可引起qN的显著下降(表1),表明eATP水平的增加使得更多的光能被用于光化学反应而不是以热能的形式散失。qP反应了PSⅡ反应中心氧化态质体醌的比例,并且氧化态质体醌比例越高则PSⅡ接受并传递电子的能力越强[20]。而本研究发现,外源ATP处理可显著增加处理侧qP的水平(表1)。这些观察表明eATP提高了PSⅡ反应中心氧化态质体醌所占的比例。外源ATP的处理可导致处理侧Y(NPQ)显著下降,但对Y(NO)无影响(表1)。说明外源ATP的处理使得吸收的光能的热耗散降低可能是通过调节非光化学能量耗散实现的。我们之前研究发现,对菜豆叶片施加外源ATP可提高被ATP施加组织处光系统Ⅱ的光化学效率[14]。而本研究揭示了,外源ATP对叶片处理侧的上述叶绿素荧光指标的影响也同样发生在未直接接触ATP的同叶另一侧上。综合上述观察可知,eATP不仅能够影响那些直接感受到eATP的叶片组织的光系统Ⅱ光化学反应,而且同时还能够影响同叶片其他组织光系统Ⅱ的光化学反应。因此,eATP能够系统性地调节叶片的光系统Ⅱ光化学反应。
表2外源ATP和ATP与DMTU等量混合液对菜豆叶片处理侧与同叶未处理侧叶绿素荧光参数的影响
Table2Theeffectsofthetreatmentsofahalfofabean(PhaseolusvulgarisL.)leafwithexogenousATPandATP+DMTUonthechlorophyllfluorescenceparametersofthetreatedhalfandtheuntreated,oppositehalf

叶绿素荧光参数Chlorophyllfluorescenceparameters处理侧Processingside(300μmol(photon)·m-2·s-1)CKATPATP+DMTU叶绿素荧光参数Chlorophyllfluorescenceparameters未处理侧Un⁃processingside(300μmol(photon)·m-2·s-1)CKATPATP+DMTUFv/Fm0.761±0.007a0.761±0.014a0.753±0.004aFv/Fm0.761±0.005a0.759±0.012a0.756±0.002aY(Ⅱ)0.203±0.009c0.365±0.025a0.266±0.016bY(Ⅱ)0.226±0.023c0.361±0.035a0.274±0.024bETR31.117±1.687c53.483±3.713a40.200±1.913bETR33.557±3.417b53.067±5.426a37.450±5.026bqP0.368±0.043c0.591±0.023a0.492±0.014bqP0.368±0.043c0.591±0.023a0.496±0.017bqN0.743±0.018a0.633±0.042b0.752±0.034aqN0.738±0.017a0.629±0.031b0.743±0.010aY(NPQ)0.489±0.018a0.315±0.026c0.438±0.012bY(NPQ)0.477±0.017a0.318±0.039b0.454±0.036aY(NO)0.316±0.013a0.314±0.011a0.297±0.017aY(NO)0.297±0.017a0.310±0.016a0.287±0.018a
eATP作为一种重要的胞外信号分子,因自身具有极强的极性而不能自由穿过细胞膜。Chivasa[1,15]等研究发现eATP对烟草叶片对病菌或病毒的抗性的系统性影响并不是由于胞内ATP的释放或ATP的移动到未处理侧所引起的。故其可通过与膜上的受体蛋白结合然后诱发多种下游信号分子(如:Ca2+,一氧化氮(NO),活性氧(ROS)等)的积累[4~8]从而调节植物细胞的生长、发育、抗病反应和向地性等生理学活动[13]。
本研究用外源ATP处理菜豆叶片一侧,检测了叶片处理侧与同叶未处理侧过氧化氢含量的变化。发现叶片处理侧与同叶未处理侧H2O2含量均显著上升(图2)。这表明:植物叶片eATP的增加可导致H2O2产量的增加。Demidchik[5]等研究发现:eATP可通过激活质膜上NADPH氧化酶使胞外产生超氧阴离子,而部分超氧阴离子可转变成H2O2,而这些H2O2可进入细胞并引起胞内H2O2含量的增加。Jiang[21]等最近也报道了外源的过氧化氢可以促进光系统Ⅱ的光化学效率和氧化态质体醌的比例。而Gilroy[22]等研究发现,当植物的部分组织受到环境胁迫而出现H2O2产量增加时,这种增加可以系统性地在整个植株中传递,从而导致了整个植株H2O2水平的上升。因此,eATP很可能是通过引起H2O2信号途径而对直接接触ATP和未直接接触ATP的同叶另一侧叶片组织的PSⅡ光化学反应产生了影响。综上所述,我们猜测ATP对菜豆叶片光系统Ⅱ光化学特性的这种系统性影响可能是与H2O2有关。为了查明这一猜测,本研究用1.0 mmol·L-1外源H2O2处理叶片一侧,发现处理侧与同叶未处理侧的叶绿素荧光参数产生与外源ATP处理具有相似的结果,即:处理侧与同叶未处理侧的Fv/Fm和Y(NO)无影响,而Y(Ⅱ)、ETR和qP显著上升,qN和Y(NPQ)显著下降(表1)。这提示了eATP对菜豆叶片光系统Ⅱ光化学特性的影响(包括系统性影响)可能和H2O2有关。,本研究用过氧化氢淬灭剂DMTU和ATP的混合溶液对叶片的一侧进行了处理,并和单独用ATP处理的叶片进行了比较。结果发现,DMTU可明显减弱外源ATP所引起的ATP处理侧和同叶未处理侧叶绿素荧光参数的变化。这一观察表明,eATP对菜豆叶片光系统Ⅱ光化学特性的影响(包括系统性影响)依赖于H2O2。
1.Chivasa S,William J S,Alex M.The effects of extracellular adenosine 5′-triphosphate on the tobacco proteome[J].Proteomics,2010,10:235-244.
2.Khakh B S,Burnstock G.The double life of ATP[J].Scientific American,2009,301(6):84-92.
3.Fountain S J,Parkinson K,Young M T,et al.An intracellular P2X receptor required for osmoregulation inDictyosteliumdiscoideum[J].Nature,2007,448:200-203.
4.Demidchik V,Nichols C,Oliynyk M,et al.Is ATP a signaling agent in plants?[J].Plant Physiol,2003,133:456-461.
5.Demidchik V,Shang Z,Shin R,et al.Plant extracellular ATP signalling by plasma membrane NADPH oxidase and Ca2+channels[J].Plant J,2009,58:903-913.
6.Jeter C R,Tang W,Henaff E,et al.Evidence of a novel cell signaling role for extracellular adenosine triphosphates and diphosphates inArabidopsis[J].Plant Cell,2004,16:2652-2664.
7.Song C J,Steinebrunner I,Wang X,et al.Extracellular ATP induces the accumulation of superoxide via NADPH oxidases inArabidopsis[J].Plant Physiol,2006,140:1222-1232.
8.Foresi N P,Laxalt A M,Tonon C V,et al.Extracellular ATP induces nitric oxide production in tomato cell suspensions[J].Plant Physiol,2007,145:589-592.
9.Thomas C L,Rajagopal A,Windsor B,et al.A role for ectophosphatase in xenobiotic resistance[J].Plant Cell,2000,12(4):519-533.
10.Kim S Y,Sivaguru M,Stacey G.Extracellular ATP in plant.Visualization,localization,and analysis of physiological significance in growth and signaling[J].Plant plysiol,2006,142:984-992.
11.Tanaka K,Gilroy S,Jones A M,et al.Extracellular ATP signaling in plants[J].Trends Cell Biol,2010a,20:601-608.
12.Choi J,Tanaka K,Cao Y R,et al.Identification of a Plant Receptor for Extracellular ATP[J].Science,2014,343:290.
13.Tanaka K,Swanson S J,Gilroy S,et al.Extracellular nucleotides elicit cytosolic free calcium oscillations inArabidopsis[J].Plant Physiology,2010,154:705-719.
14.冯汉青,焦青松,田武英,等.不同光强下细胞外三磷酸腺苷对菜豆叶片光化学反应特性的影响[J].植物生态学报,2014,38(10):1117-1123.
15.Chivasa S,Murphy A M,Hamilton J M,et al.Extracellular ATP is a regulator of pathogen defence in plants[J].The Plant Journal,2009a,60:436-448.
16.Chivasa S,Tome D F A,Murphy A M,et al.Extracellular ATP:a modulator of cell death and pathogen defense in plants[J].Plant Signaling & Behavior,2009b,4:1078-1080.
17.Adams D B,AdamsIII W W.Xanthophyll cycle and light stress in nature:uniform response to excess direct sunlight among higher plant species[J].Planta,1996,198(3):460-470.
18.Li X,Feng W,Zeng X C.Advances in Chlorophyll Fluorescence Analysis and Its Uses[J].Acta Bot Boreal,2006,26(10):2186-2196.
19.Sergiev I,Alexieva V,Karaanov E.Effect of spermine,atrazine and combination between them on some endogenous protective systems and stress marker in plant[J].Compt Rend Acad Bulg Sci,1997,51:121-124.
20.Maxwell K,Johnson G N.Chlorophyll fluorescence-a practical guide[J].Journal of experimental botany,2000,51(345):659-668.
21.Jiang Y P,Cheng F,Zhou Y H,et al.Hydrogen peroxide functions as a secondary messenger for brassinosteroids-induced CO2assimilation and carbohydrate metabolism inCucumissativus[J].Journal of Zhejiang University-SCIENCE B(Biomedicine & Biotechnology),2012,13(10):811-823.
22.Gilroy S,Suzuki N,Miller G,et al.A tidal wave of signals:calcium and ROS at the forefront of rapid systemic signaling[J].Plant Science,2014,19(10):623-630.
ExtracellularATPExertSystemicEffectsonPhotosystemⅡPhotochemistryofKidneyBean(Phaseolusvulgaris)LeafthroughaH2O2SignallingPathway
TIAN Wu-Ying JIAO Qing-Song SHI Dai-Long SUN Kun JIA Ling-Yun*FENG Han-Qing
(College of Life Science,Northwest Normal University,Lanzhou 730070)
We studied the systemic effects of extracellular ATP(eATP) on the Photosystem Ⅱ photochemistry of kidney bean(Phaseolusvulgaris) leaf and possible mechanism for this effect. Treatment of a half of a bean leaf with exogenous ATP had no significant effect on the maximal photochemical efficiency of photosystem Ⅱ(Fv/Fm), and the quantum yield of non-regulated energy dissipation(Y(NO)) of the treated half and the untreated, opposite half of the same leaf. However, this treatment significantly increased the values of photochemical efficiency(Y(Ⅱ)), the rate of photosynthetic electron transport(ETR), and photochemical quenching(qP), while the values of the non-photochemical quenching(qN) and the quantum yield of regulated energy dissipation(Y(NPQ)) were significantly decreased by exogenous 1 mmol·L-1ATP. These observations indicate that eATP can function in systematically enhancing the PSⅡ photochemistry of kidney bean leaves. Treatment of a half of a bean leaf with exogenous ATP, we tested the change of the oxidation hydrogen content of the treated half and the untreated, opposite half of the same leaf. Compared to the control, hydrogen peroxide content of the treated half and the untreated, opposite half of the same leaf were significantly increased. Similar to the effects of exogenous ATP, treatment with exogenous H2O2at 1 mmol·L-1also led to a significant increase inY(Ⅱ),qPandETRand a significant decrease inqNandY(NPQ) of the treated half and the untreated, opposite half of the same leaf. DMTU(dimethylthiourea, a scavenger of H2O2) weakened the effects of exogenous ATP on theY(Ⅱ)),qP,ETR,qNandY(NPQ). These observations indicate that an increase in eATP concentration of partial region of bean leaf can enhance the PSⅡ photochemistry of the adjacent tissues, and such function of eATP could be dependent of H2O2.
chlorophyll fluorescence;extracellular ATP;exogenous H2O2;kidney bean(Phaseolusvulgaris);systemic
国家自然科学基金资助项目(31260059和30900105);教育部科学技术研究重点资助项目(211190);甘肃省财政厅高校基本科研业务资助项目
田武英(1989—),女,硕士研究生,主要从事植物生理生态研究。
* 通信作者:E-mail:lingyunjia1982@126.com
2015-10-19
S643.1
A
10.7525/j.issn.1673-5102.2016.03.008

