三倍体芍药品种花粉母细胞减数分裂行为观察与比较
王玉蛟 刘建鑫 于晓南,2,3*
(1.北京林业大学园林学院,北京 100083; 2.国家花卉工程技术研究中心,北京 100083; 3.花卉种质资源创新与育种北京市重点实验室,北京100083)
三倍体芍药品种花粉母细胞减数分裂行为观察与比较
王玉蛟1刘建鑫1于晓南1,2,3*
(1.北京林业大学园林学院,北京 100083;2.国家花卉工程技术研究中心,北京 100083;3.花卉种质资源创新与育种北京市重点实验室,北京100083)
芍药是中国传统名花,我国品种均为二倍体,培育多倍体新品种是一项长期的育种目标。本研究选取3个芍药三倍体新品种,采用植物染色常规压片法观察其花粉母细胞的减数分裂情况。结果显示:(1)同一品种不同花蕾直径大小的花粉母细胞所处的分裂状态不同,同一品种同一花蕾直径大小花粉母细胞有不同步分裂现象,但大多数表现为相同的分裂相;(2)不同品种的相近花蕾直径大小所处的分裂时期也不同,有比较显著的差异,因此直径不能作为判断减数分裂时期的唯一的标准;(3)三倍体品种花粉母细胞减数分裂存在单价体、三价体、染色体桥、染色体不均等分离等染色体异常行为,这些异常行为使一些遗传物质缺失或最终形成二分体或三分体,导致三倍体花粉的育性非常低。该研究为掌握芍药三倍体减数分裂规律及多倍体育种奠定了细胞学基础。
芍药;三倍体;减数分裂
芍药(Paeonialactiflora)是中国传统名花,隶属芍药科(Paeoniaceae)芍药属(Paeonia),有着丰富的种质资源和悠久的栽培历史,在十九世纪初传入欧美,被当地的园艺家视为重要的育种亲本[1]。中国芍药栽培虽然历史悠久,但切花市场一直在起步期徘徊,其中,优质品种匮缺是制约其发展的原因之一[2]。我国传统的芍药品种均为二倍体(2n=2x=10),欧美则拥有一些多倍体的野生资源[3],如荷兰芍药(P.officinalis)(2n=4x=20)、大叶芍药(P.macrophylla)(2n=4x=20)、摩洛哥芍药(P.coriacea)(2n=4x=20)等。经过人工远缘杂交,近些年国外培育出一批性状优良的三倍体新品种,它们具有生长旺盛、抗逆性强、茎秆粗壮、花色明艳、切花水养时间长等优点,很快成为芍药切花市场的新宠[4]。因此,培育三倍体新品种或利用三倍体进行育种已成为当前芍药领域的重要育种方向。前人研究表明,植物三倍体并非完全不育,利用其有限的可育配子杂交是培育多倍体的重要途径[5]。然而,三倍体植物在减数分裂过程中,易发生染色体行为异常现象,从而导致染色体核型改变,产生无活性配子,降低花粉育性,对植物的个体发育和后代繁殖产生不良影响。本研究选取3个三倍体芍药新品种,观察其花粉母细胞减数分裂过程和染色体行为,并对其进行分析和比较,以期为芍药远缘杂交、三倍体新品种培育等提供细胞学依据。
1 材料与方法
1.1 实验材料
芍药‘Brightness’(2n=3x=15),‘Roseletter’(2n=3x=15),‘Coral Sunset’(2n=3x=15),均为三倍体品种,露地种植于北京林业大学小汤山实验基地。
1.2 实验方法
花粉母细胞的减数分裂观察采用植物染色常规压片法。在晴天上午(9:00~11:00)分别取直径大小不同(6.00~18.00 mm)的花蕾,用镊子取出花药置于卡诺固定液(无水乙醇∶冰醋酸=3∶1)里固定24 h以上,观察时取出3~5个花药,放在滤纸上吸干固定液,然后转移到载玻片上,滴3~4滴卡宝品红染液,用镊子挤压花药将花粉挤出,除去残渣,染色4 min后,加上盖玻片,吸去多余染液,用Leica DM-2500荧光显微镜进行观察。对不同品种花粉母细胞减数分裂发育时期与花蕾直径和花药形态的相关性进行分析,对出现的染色体桥、不同步分裂、三分体等染色体异常现象进行了计数统计,并采用Leica Application Suite V3.3.0系统对不同时期分裂相典型的花粉母细胞照相。
2 结果与分析
2.1 减数分裂时期与花蕾直径大小的关系
通过观察,3个三倍体品种的减数分裂行为并不是同步的,即同一个花蕾中的花药所处的减数分裂时期并不相同,可以观察到不同时期的分裂相。但可以根据花蕾的形态、直径及花药的颜色进行大致判断,即随着减数分裂的进行,花蕾直径逐渐增大,花药颜色由白色到乳白色,再到浅黄色和黄色。
品种‘Brightness’在花蕾直径为13.20 mm时,可以同时观察到细线期、双线期以及终变期的分裂相,即此直径下减数分裂处于前期Ⅰ,此时花药颜色为白色;在花蕾直径为16.14 mm时,可以同时观察到中期Ⅱ、后期Ⅱ等时期的分裂相,此时花药颜色为浅黄色(表1)。据此可认为,该品种减数分裂时期在花蕾直径为13.00~18.00 mm。
表1芍药‘Brightness’花蕾同一直径下出现不同分裂期的比率
Table1Rateofdifferentmeiosisstateinthesamediameterofpeony‘Brightness’

观察项目Observedterms花药数(个)Numberofanther分裂期Phase比率Percentage(%)直径13.20mmDiameterof13.20mm25细线期Leptotene30.0双线期Dipbtene12.5终变期Diakinesis7.1直径16.14mmDiameterof16.14mm24中期ⅡMetaphaseⅡ15.4后期ⅡAnaphaseⅡ23.1末期ⅡTelophaseⅡ31.3
表2芍药‘Roseletter’花蕾同一直径不同分裂期的比率
Table2Rateofdifferentmeiosisstateinthesamediameterofpeony‘Roseletter’
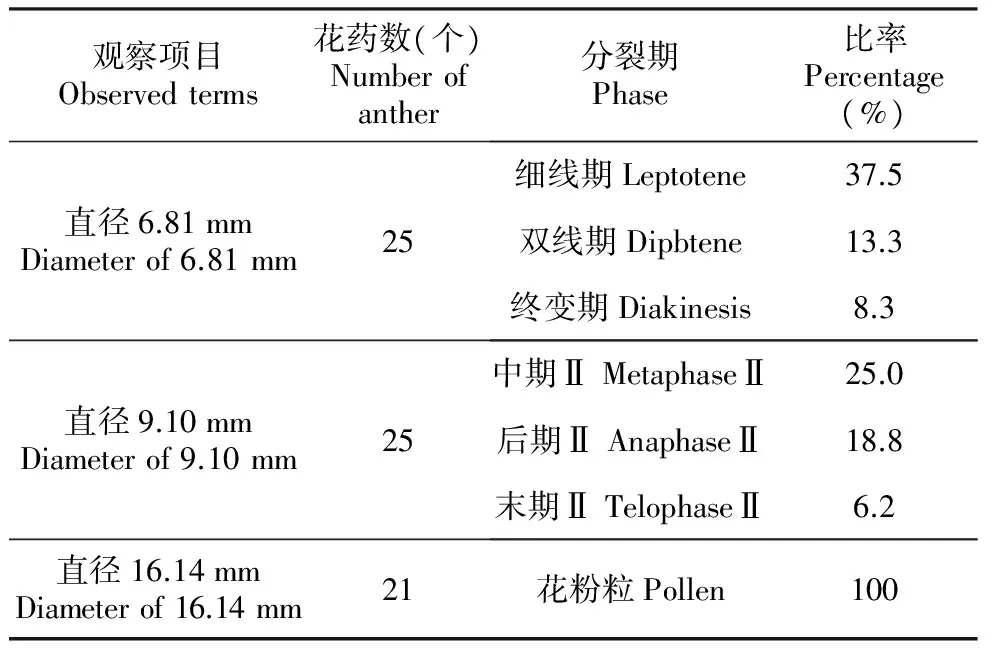
观察项目Observedterms花药数(个)Numberofanther分裂期Phase比率Percentage(%)直径6.81mmDiameterof6.81mm25细线期Leptotene37.5双线期Dipbtene13.3终变期Diakinesis8.3直径9.10mmDiameterof9.10mm25中期ⅡMetaphaseⅡ25.0后期ⅡAnaphaseⅡ18.8末期ⅡTelophaseⅡ6.2直径16.14mmDiameterof16.14mm21花粉粒Pollen100
品种‘Roseletter’在花蕾直径为6.81 mm时,可以观察到前期Ⅰ的不同分裂相,此时花药颜色为白色;在花蕾直径为9.10 mm时,可以观察到中期Ⅱ、后期Ⅱ、末期Ⅱ的分裂相,此时花药颜色为浅黄色;而在花蕾直径为16.14 m时,已全部发育成花粉粒,此时花药颜色为深黄色(表2)。可以认为该品种减数分裂时期为花蕾直径在6.50~11.00 mm。
品种‘Coral Sunset’在花蕾直径为6.75 mm时,可观察到前期Ⅰ的分裂相,此时花药颜色为白色;在花蕾直径为8.38 mm时,可观察到后期Ⅰ和末期Ⅰ的分裂相,此时花药颜色为乳白色;在花蕾直径为11.61 mm时,可以观察到后期Ⅱ及末期Ⅱ的分裂相,还可以观察到部分二分体或三分体,此时花药颜色为浅黄色(表3)。可以认为该品种的减数分裂期在花蕾直径为6.00~12.00 mm。
先生的《译名》写于1919年,正值20世纪初中国国内译名研究的高潮期,不久前就有章士钊、胡以鲁、容挺公等学者对于译名的激烈论战,这在《译名》中也多次被提起,先生由此对译名讨论予以了全面的总结。全文一共分为八节,对译名讨论的历史进行了简单的回顾,又分别考究了由来已久的对于译名的五种译法,通读的过程中自然而然地加深了对译名的理解。
表3芍药‘CoralSunset’花蕾同一直径不同分裂期的比率
Table3Rateofdifferentmeiosisstateinthesamediameterofpeony‘CoralSunset’

观察项目Observedterms花药数(个)Numberofanther分裂期Phase比率Percentage(%)直径6.75mmDiameterof6.75mm22前期ⅠProphaseⅠ90.1直径8.38mmDiameterof8.38mm25后期ⅠAnaphaseⅠ31.3末期ⅠTelophaseⅠ43.8直径11.61mmDiameterof11.61mm24后期ⅡAnaphaseⅡ6.7末期ⅡTelophaseⅡ18.8二分体或三分体Dyadortriad12.5
表4不同芍药品种减数分裂时期与花蕾直径的关系
Table4RelationbetweenmeiosisdurationofPMCanddiameterofbudsofpeonycultivars
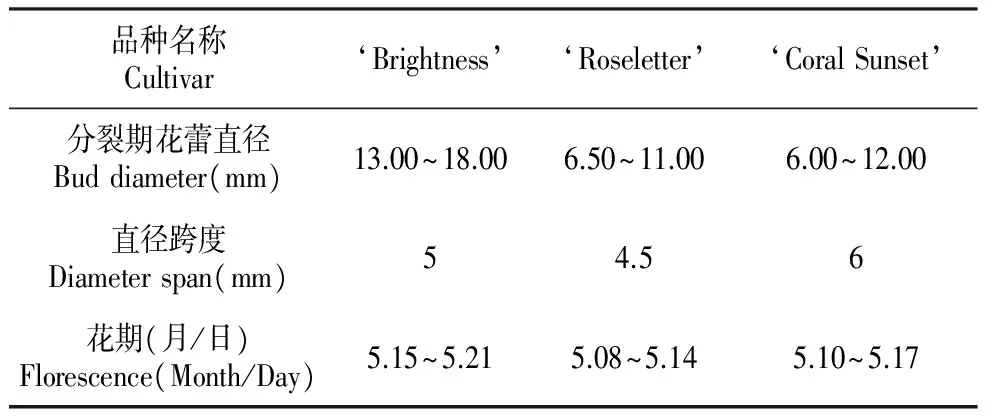
品种名称Cultivar‘Brightness’‘Roseletter’‘CoralSunset’分裂期花蕾直径Buddiameter(mm)13.00~18.006.50~11.006.00~12.00直径跨度Diameterspan(mm)54.56花期(月/日)Florescence(Month/Day)5.15~5.215.08~5.145.10~5.17
同时发现(表4),不同的三倍体品种在减数分裂过程中,其减数分裂所处的时期与花蕾直径的关系是有差异的,减数分裂开始的时间不同,但‘Coral Sunset’和‘Roseletter’之间差异不明显,二者和‘Brightness’差异较明显,这从各品种的花期中也可以得到一些证明,因为据近两年在基地对芍药的物候期记录显示,品种‘Brightness’的花期较‘Roseletter’和‘Coral Sunset’晚一周左右,因此减数分裂开始的也比较晚;减数分裂期间花蕾直径大小的跨度可以代表减数分裂持续的时间,不同品种之间,减数分裂持续的时间略有差异。这些差异是因为不同品种遗传特性不同,其次还可能与具体的营养状况与生长环境有关。
2.2 减数分裂过程及分裂期异常现象
通过观察比较,3个三倍体品种减数分裂过程具有相似性,为两次连续的细胞分裂,最终形成四分孢子,进而发育形成花粉粒,且在细胞分裂的过程中都存在一些异常的分裂现象。
细线期:染色质凝集成细长的染色质丝,相互缠结在一起(图版Ⅰ:1)。
偶线期:染色体形态变化不大,分别来自两个亲本的染色体互相靠拢,开始发生或多或少的配对,即联会。
粗线期:染色体明显缩短变粗,同源染色体配对完成(图版Ⅰ:2)。
双线期:染色体继续缩短变粗,同源染色体开始分开,但是有交叉,即发生了姐妹染色单体的交叉互换,且交叉的数目逐渐减少,交叉的位置逐渐向染色体的两端移动,称为交叉端化[6](图版Ⅰ:3)。
终变期:染色体螺旋化达到最高程度,以至于难以观察到染色单体,核仁核膜消失,开始形成纺锤体。这个时期是染色体计数和观察染色体构型的最佳时期[7]。可以看到染色体构型复杂,有二价体、单价体、三价体形成(图版Ⅰ:4~6)。
中期Ⅰ:所有染色体聚集在赤道板附近,只能观察到染色体呈一字型排列,无法辨认具体的每一条染色体(图版Ⅰ:7~8)。
后期Ⅰ:配对的染色体发生分离,染色体在纺锤丝的牵引下向细胞两极移动。因为材料为三倍体,所以染色体不是均等的分向两极,移向两端的染色体数目大致相等,但是具体的数目难以计数,同时可以观察到染色体桥和落后染色体等染色体的异常行为,并伴有染色体片段(图版Ⅰ:9~12)。
末期Ⅰ:染色体分别到达细胞两极并发生细胞质的分离。可以清楚地看到染色体单桥和染色体双桥等异常染色体行为。有的小孢子母细胞由于染色体分离的不平衡,只在二分体中的其中一个子核内有染色体(图版Ⅰ:13~16)。
中期Ⅱ:染色体分别排列在两个子细胞的赤道板上,此时因为染色单体分离,染色体数目较多,难以观察到每一条染色体。
后期Ⅱ:染色体向两极移动,仍然可以观察到染色体桥,同时可以观察到部分细胞的其中一个子细胞染色体正常向两极移动,而另一个子细胞的染色体相互靠近,这种子细胞在减数分裂完成之后可能会形成三分体(图版Ⅰ:17~21)。
末期Ⅱ:染色体解螺旋,重新形成细长的染色质丝缠绕成一团,进行第二次胞质分裂,形成四分体或三分体(图版Ⅰ:22~25)。
最后观察到花粉粒的形成(图版Ⅰ:26)。
虽然3个三倍体品种在减数分裂过程中,染色体的行为都有一定程度的异常现象,但是对染色体异常行为频率的观察显示(表5),不同品种存在差异。总体看来,‘Coral Sunset’染色体异常行为的频率最高,而‘Brigheness’频率最低,这可能与不同品种的遗传特性不同有关。
表5芍药不同品种染色体异常行为的频率(观察细胞总个数)
Table5Rateofchromosomeabnormalbehaviorindifferentpeonycultivars(Numberofcells)(%)

品种名称Cultivar‘Brightness’‘Roseletter’‘CoralSunset’单价体Univalent(196)23.127.326.7三价体Trivalent(196)66.763.769.2染色体单桥(后期Ⅰ)Singlechromosomebridge(AnaphaseⅠ)(183)58.353.371.4染色体双桥(后期Ⅰ)Doublechromosomebridge(AnaphaseⅠ)(183)46.753.057.1染色体不同步分离Nonsynchronousdivision(207)21.436.737.5三分体Triad(162)28.636.442.9
3 讨论
3.1 减数分裂异常现象产生的原因及影响
减数分裂从根本上保证了亲代和子代之间染色体数目的恒定性,为后代个体的正常生长发育和性状的稳定遗传提供了物质基础,保障了物种之间的连续性和稳定性[6]。然而减数分裂发生异常将对花粉的育性产生直接影响,进而影响性状的稳定遗传。尤其是奇数倍数目的染色体,由于联会紊乱,染色体配对会发生各种异常现象,影响花粉的育性。在本研究中,观察到芍药的三倍体减数分裂过程中存在多种染色体异常行为。
在品种‘Brightness’终变期可以观察到倒位圈,在减数分裂后期Ⅰ和后期Ⅱ观察到染色体桥,有染色体双桥和染色单体桥,染色体桥的出现可以作为染色体是否出现倒位的依据之一[8],倒位圈内发生交叉互换,形成双着丝粒染色体和无着丝粒片段,产生染色体桥和断片,染色体断片在末期Ⅱ形成微核[9]。最终由于染色体片段的缺失导致遗传物质的缺失,使花粉部分不育。
三倍体在减数分裂过程中存在着复杂的染色体配对现象。在每个品种的终变期,均可以观察到单价体、二价体和三价体。在对猕猴桃三倍体的观察研究中表明,同源三倍体其终变期应含有频率较高的三价体,异源三倍体终变期应全部或者大部分为单价体和二价体[10~11]。在芍药三倍体中,有的品种亲本并未确定,也可以根据染色体的价体构型及频率来大体判断是同源染色体还是异源染色体。通过染色体的价体构型及频率进而确定品种亲本的来源,这对芍药的品种分类工作有一定指导意义。单价体和三价体在以后的分裂过程中随机分到不同的子细胞,产生非整倍体的配子。产生的非整倍体配子在理论上应是完全不育的。
未减数配子的形成主要是由于异常的纺锤体方向和缺失的胞质分裂。异常的纺锤体方向可能会引起减数分裂核重组,导致未减数配子的产生。融合纺锤体和三极纺锤体被分别认为是二分体和三分体形成的原因[12]。细胞不均等分裂也可能形成三分体或多分体,即在后期Ⅱ只有一半的染色单体正常分裂,而另一半不分离,最后形成大小不等的配子[13]。在‘Brightness’中观察到一些子细胞染色体在后期Ⅱ相互靠近,在‘Coral Sunset’中观察到三分体。本实验中没有观察到胞质分离异常,需要进一步的观察研究。
芍药三倍体染色体的异常行为对配子的育性有直接的影响,一般均导致配子不育。但是据一些研究表明,许多三倍体植物是有一定的育性的,梁国鲁[14]对七个枇杷品种的多个三倍体单株进行了花粉离体和活体萌发试验,都观察到了小部分花粉萌发。异源三倍体百合减数分裂产生了单倍体、二倍体和非整倍体,甚至高倍性的配子,且大部分花粉具有活力[15]。类似的结果在杨树中有更多的研究结果[16],但是在芍药属的植物中还没有更多的证明,本研究中并没有观察到正常的四分体,可以推断三倍体品种配子可育性极低,也需要进一步的研究,以挖掘芍药三倍体的育种潜力。
3.2 三倍体的应用及发展前景
三倍体植株减数分裂过程中会产生一些异常现象,导致配子不育性降低甚至丧失,但三倍体仍然是有很大的利用价值。在蔬菜育种中,可以利用三倍体旺盛的营养生长培育新品种蔬菜;在林木育种中,可以利用三倍体获得无籽果实;在花卉育种中,三倍体也得到了广泛的应用,如三倍体水仙,花量多而香气浓郁,抗病性强;三倍体杜鹃花期延长;而三倍体的芍药花径大,有芳香,花茎挺直且较粗,更适合切花水养。
在利用三倍体培育其他新品种中,也有应用的可能。三倍体在减数分裂终变期会出现单价体、三价体等异常染色体行为,是获得三体和单体的重要来源,在以后的分裂过程中可能会形成n+1的配子,然后与二倍体杂交可获得2n+1的非整倍体,在作物遗传育种中有很高的利用价值。蔬菜作物中的番茄是最早获得整套三体的植物之一。非整倍体用于品种改良在小麦等作物中已经受到普遍重视,取得了巨大成就。而通过四倍体小孢子培养建立大白菜三体系的工作已经取得了进展[17],这是多倍体育种中的一个新动向,在芍药三倍体中也可以探究花粉育性比较高的品种,利用其建立三体系进行遗传上的研究。
在杂交育种中,通过将三倍体作为母本来实现种质资源的渗入,进行杂交获得新品种,可以获得成功,在许多植物中已经得到了一些证明。很多有关百合的报道表明,百合三倍体尽管通常雄性不育,但可以作为母本与二倍体或四倍体杂交,实现了种质资源的渗入[18~19]。在芍药中对三倍体做母本还没有系统的实验研究,但是通过一些杂交实验,以三倍体为母本授予一些品种的花粉,获得过少量的种子,可以说明在芍药中以三倍体做母本,配合胚抢救等离体培养或其他技术,可以得到子一代,获得新品种,是有很大的育种潜力的。
另外,对于芍药来说,除了播种繁殖外,主要通过分株法进行繁殖,因此若芍药三倍体发生体细胞突变,可以通过无性繁殖保存下来得到新品种。
4 结论
通过对3个芍药三倍体品种‘Brightness’、‘Roseletter’以及‘Coral Sunset’花粉母细胞减数分裂过程中染色体的行为进行观察,得出了以下结论:
(1)芍药花粉母细胞减数分裂是不同步的,同一品种同一直径大小的花蕾中的花粉母细胞减数分裂中染色体有不止一种的分裂相,花粉母细胞减数分裂时期与花蕾直径的关系因品种不同而有差异。减数分裂各时期可以根据花蕾的形态和大小以及花药的颜色等作简单的判断。
(2)芍药三倍体在减数分裂过程中,染色体存在单价体、三价体、形成染色体桥和染色体断片以及染色体分裂不均等等多种异常行为,因为染色体的这些异常行为,导致配子中遗传物质的缺失、形成二分体三分体等,最终导致三倍体品种花粉育性极低。
1.于晓南,宋焕芝,郑黎文.国外观赏芍药育种与应用及其启示[J].湖南农业大学学报:自然科学版,2010,36(2):159-162.
Yu X N,Song H Z,Zheng L W.Brief introduction of breeding and horticulture utilization of ornamental herbaceous peony at abroad[J].Journal of Human Agriculture University:Natural Sciences,2010,36(2):159-162.
2.Yu X N,Guo P P,Lu G P,et al.Optimum harvesting time of herbaceous peony buds for cutting flowers[J].Journal of Forestry Research,2011,22(1):137-140.
3.Hong D Y,Pan K Y,Zhou S L,et al.Peonies of the world[M].Kew:Royal Botanic Gardens,2010.
4.王历慧,于晓南,郑黎文.中西方芍药切花应用与市场趋势分析[J].黑龙江农业科学,2011(2):147-149.
Wang L H,Zheng L W,Yu X N.Analysis of applications and market trends of herbaceous peony cut flower in China and the West[J].Heilongjiang Agriculture and Sciences,2011(2):147-149.
5.许重阳,王君,叶粟,等.白杨杂种三倍体小孢子母细胞减数分裂及花粉形态观察[J].西北植物学报,2011,31(12):2454-2458.
Xu C Y,Wang J,Ye S,et al.Meiosis of microsporocyte and variation of pollen in an allotriploid white poplar[J].Acta Bot Boreal Occident Sin,2011,31(12):2454-2458.
6.戴思兰.园林植物遗传学[M].北京:中国林业出版社,2010.
Dai S L.Genetics of landscape plants[M].Beijing:China Forestry Publishing House,2010.
7.陈瑶.天然三倍体枇杷小孢子母细胞减数分裂研究[D].重庆:西南大学,2008.
Chen Y.Studied on meiosis proeess of pollen mother Cells(PMC) of Natural Triploid Loquat[D].Chongqing:Southwest University,2008.
8.Qian C T,Jahn M M,Staub J E,et al.Meiotic chromosome behavior in an allotriploid derived from an amphidiploid × diploid mating inCucumis[J].Plant Breeding,2005,124:272-276.
9.许晓光,陈龙,彭建营.酸枣和赞皇大枣花粉母细胞减数分裂的观察[J].园艺学报,2009.36(8):1127-1133.
Xu X G,Chen L,Peng J Y.Meiotic observations on the pollen mother cells ofZiziphusspinosusHu.andZiziphusjujubaMill.‘Zanhuang Dazao’[J].Acta Horticulturae Sinica,2009,36(8):1127-1133.
10.熊治廷.猕猴桃种间杂种三倍体形态学和减数分裂观察[J].植物研究,1990,10(1):99-103.
Xiong Z T.Observations on the morphology and meiosis of interspecies hybrid triploid inActinidia[J].Bulletin of Botanical Research,1990,10(1):99-103.
11.崔娜新,陈发棣,赵宏波,等.几种菊属植物及其种间杂种减数分裂行为观察[J].园艺学报,2006,33(5):1033-1038.
Cui X N,Chen F D,Zhao H B et al.Research on meiosis of someDendranthemaspecies and their hybrids[J].Acta Horticulturae Sinica,2006,33(5),1033-1038.
12.Wang J,Kang X Y,Zhu Q.Variation in pollen formation and its cytological mechanism in an allotriploid white poplar[J].Tree Genetics & Genomes,2010,6:281-290.
13.何丽霞.黄牡丹花粉母细胞减数分裂过程的细胞遗传学观察[J].兰州大学学报:自然科学版,2004,40(6):78-82.
He L X.Observation on meiosis of pollen mother cells of Paeonia delavayi in cytogenetics[J].Journal of Lanzhou University:Natural Sciences,2004,40(6):78-82.
14.梁国鲁,李育农,李晓林.中国苹果属植物小孢子减数分裂染色体系统研究[J].西南农业大学学报,1996,18(4):299-307.
Liang G L,Li Y N,Li X L.Evolutionary study of the chromosomes at pollen mother cell meiosis in Malus[J].Journal of Southwest Agriculture University,1996,18(4):299-307.
15.封紫,魏迟,贾桂霞.异源三倍体百合减数分裂染色体行为的研究[J].北京林业大学学报,2012,34(2):118-124.
Feng Z,Wei C,Jia G X.Meiotic chromosome behavior in allotriploid cultivar ofLilium[J].Journal of Beijing Forestry University,2012,34(2):118-124.
16.康向阳,朱之悌,张志毅.毛白杨异源三倍体形态和减数分裂观察[J].北京林业大学学报,1999,21(1):1-5.
Kang X Y,Zhu Z T,Zhang Z Y.Morphology and meiosis of Chinese white poplar[J].Journal of Beijing Forestry University,1999,21(1):1-5.
17.申书兴,李振秋,张成合,等.大白菜3号6号染色体双三体及其初级三体的鉴定[J].园艺学报,2002,29(5):438-442.
Shen S X,Li Z Q,Zhang C H,et al.Identification of double triplo-3,6 and acquisition of primary triplo-3 and triplo-6 in Chinese Cabbage[J].Acta Horticulturae Sinica,2002,29(5):438-442.
18.袁国良.用三倍体做母本实现百合种质渗入育种[D].杭州:浙江大学,2014.
Yuan G L. Lily introgression breeding using triploids cultivars as maternal parents[D].Hangzhou:Zhejiang University,2014.
19.李克虎.异源三倍体百合(Lilium)育种潜力研究[D].杭州:浙江大学,2011.
Li K H.Study on the potential of allotriploid lilies(Lilium) in breeding[D].Hangzhou:Zhejiang University,2011.
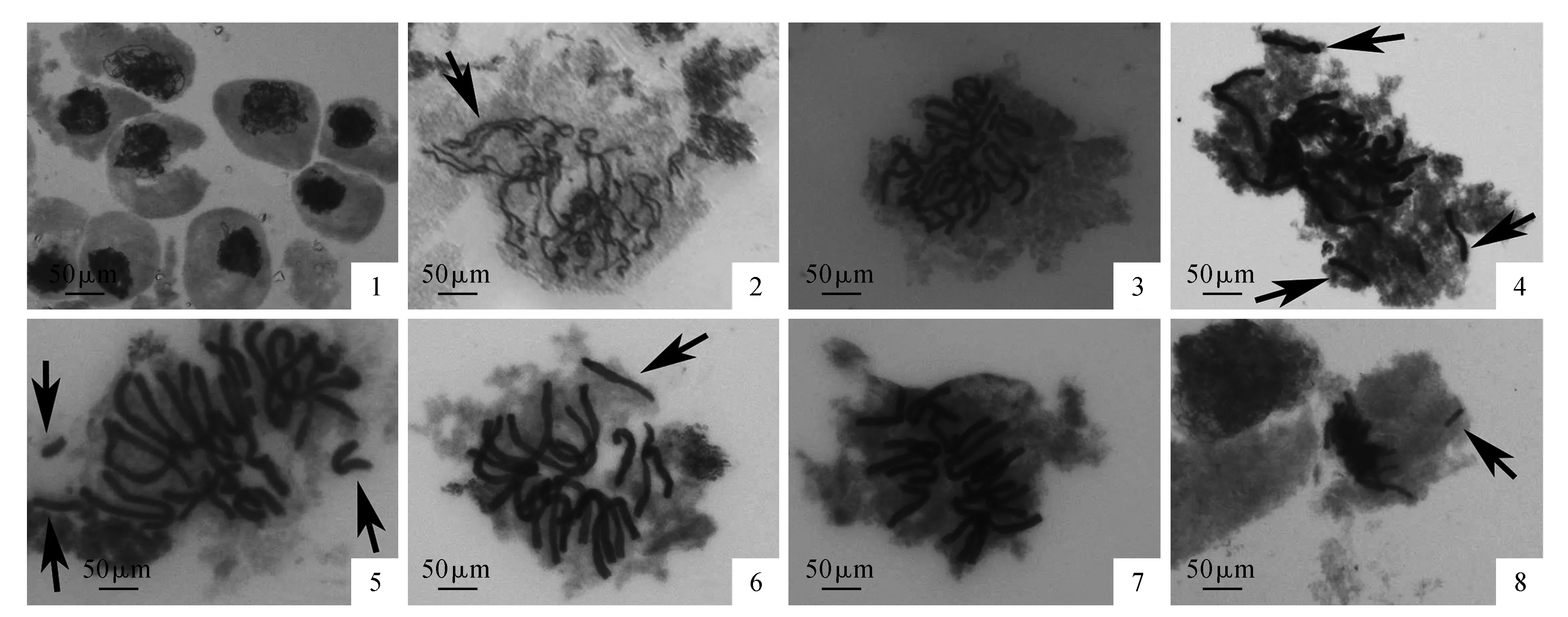

图版Ⅰ 芍药不同三倍体品种的的染色体行为 1.‘Brightness’细线期;2.‘Brightness’粗线期三价体;3.‘Brightness’双线期;4.‘Roseletter’终变期单价体;5.‘Brightness’终变期单价体;6.‘Coral Sunset’终变期单价体;7.‘Coral Sunset’中期Ⅰ;8.‘Brightness’中期Ⅰ落后染色体;9.‘Coral Sunset’后期Ⅰ细胞核不解体;10.‘Coral Sunset’后期Ⅰ;11.‘Roseletter’后期Ⅰ;12.‘Roseletter’后期Ⅰ染色体单桥;13.‘Brightness’末期Ⅰ;14.‘Coral Sunset’末期Ⅰ染色体单桥(a)和断片(b);15.‘Coral Sunset’末期Ⅰ染色体单桥(c)和双桥(d);16.‘Coral Sunset’末期Ⅰ微核;17.‘Roseletter’后期Ⅱ;18.‘Brightness’后期Ⅱ染色体不均等分离;19.‘Coral Sunset’后期Ⅱ染色体不同步分裂;20.‘Coral Sunset’后期Ⅱ染色体相互靠近;21.‘Brightness’后期Ⅱ染色体不同步分离;22.‘Roseletter’末期Ⅱ染色体双桥;23.‘Roseletter’二分体;24.‘Coral Sunset’二分体;25.‘Coral Sunset’三分体;26.‘Roseletter’花粉粒PlateⅠ Meiotic chromosome behavior in different triploid peony cultivars 1.Leptotene of ‘Brightness’; 2.Trivalence in pachytene of ‘Brightness’; 3.Dipbtene of ‘Brightness’; 4.Univalence in diakinesis of ‘Roseletter’; 5.Univalence in diakinesis of ‘Brightness’; 6.Univalence in diakinesis of ‘Coral Sunset’; 7.MetaphaseⅠof ‘Coral Sunset’; 8.Lagging chromosome in metaphaseⅠof ‘Brightness’; 9.Nucleus non division in anaphase Ⅰof ‘Coral Sunset’; 10.Anaphase Ⅰof ‘Coral Sunset’; 11.AnaphaseⅠof ‘Roseletter’; 12.Single chromosome bridge in anaphaseⅠof ‘Roseletter’; 13.TelophaseⅠof ‘Brightness’; 14.Single chromosome bridge(a) and fragment(b) in telophase Ⅰof ‘Coral Sunset’; 15.Single(c) and double (d)chromosome bridge in telophaseⅠof ‘Coral Sunset’; 16.Micronucleus in telophaseⅠof ‘Coral Sunset’; 17.AnaphaseⅡof ‘Roseletter’; 18.Unequal separation in anaphaseⅡof ‘Brightness’; 19.Nonsynchronous division in anaphaseⅡof ‘Coral Sunset’; 20.Chromosome close to each other in anaphaseⅡof ‘Coral Sunset’; 21.Nonsynchronous division in anaphaseⅡof ‘Brightness’; 22.Double chromosome bridge in telophaseⅡof ‘Roseletter’; 23.Dyad of ‘Roseletter’; 24.Dyad of ‘Coral Sunset’; 25.Triad of ‘Coral Sunset’; 26.Pollen of ‘Roseletter’
Chinese Nature Science Foundation(31400591)
introduction:WANG Yu-Jiao(1993—),female,graduate student,Main research direction:germplasm&molecule breeding of herbaceous peony.
date:2015-11-23
MeiosisObservationandComparisonofPollenMotherCellsofTriploidPaeonialactifloraCultivars
WANG Yu-Jiao1LIU Jian-Xin2YU Xiao-Nan1,2,3*
(1.Beijing Forestry University,Beijing 100803;2.National Engineering Research Center for Floriculture,Beijing 100083;3.Beijing Key Laboratory of Ornamental Plants Germplasm Innovation & Molecule Breeding,Beijing 100083)
Paeonialactiflorais a traditional Chinese flower. The traditional cultivars are diploid, and cultivating new cultivars has become an important goal in breeding. We selected three new cultivars of peony triploid, ‘Brightness’, ‘Roseletter’ and ‘Coral Sunset’, and observed its meiosis behavior of pollen mother cells by fluorescence microscope. The pollen mother cells of the same variety with same bud diameter were not divided synchronously. But the majority performed same meiosis state. The different cultivars of the similar bud diameter were also different in the period of meiosis, and had significant differences. There were many chromosome abnormal behaviors in the meiosis of pollen mother cell of triploid cultivars, such as the univalent chromosome, the trivalent chromosome, the chromosome bridge and unequal separation and so on. These abnormal behavior leading to triploid pollen fertility is very low.
Paeonialactiflora;triploid;meiosis
国家自然科学基金(31400591)
王玉蛟(1993—),女,硕士研究生,主要从事芍药种质资源与育种的研究。
* 通信作者:E-mail:yuxiaonan626@126.com
2015-11-23
* Corresponding author:E-mail:yuxiaonan626@126.com
S682.1+2
A
10.7525/j.issn.1673-5102.2016.03.004

