黑果枸杞色素在水溶液中的降解动力学及护色剂的筛选
张建琪,杨文宇*,石冬俊唐 盛骆春旭
(1.西华大学食品与生物工程学院,四川 成都 610039;2.重庆大学生物工程学院,重庆 400044)
黑果枸杞色素在水溶液中的降解动力学及护色剂的筛选
张建琪1,2,杨文宇1,*,石冬俊1,唐盛1,骆春旭1
(1.西华大学食品与生物工程学院,四川 成都 610039;2.重庆大学生物工程学院,重庆 400044)
以一定时间内黑果枸杞水溶液紫外-可见吸收光谱Aλmax的变化为参数,用多个动力学模型进行拟合,以建立降解动力学方程;通过比较不同添加剂对黑果枸杞水溶液的紫外-可见吸收光谱及Aλmax随时间的变化情况筛选护色剂。结果表明:黑果枸杞色素水溶液的降解动力学基本符合Weibull模型;添加量为0.4~80.0 mg/mL的柠檬酸对黑果枸杞色素有稳定作用,可使溶液颜色变为桃红色;添加量为4.0~80.0 mg/mL的抗坏血酸无护色作用,且使降解规律有所改变(基本符合Baker-Lonsdale模型);添加量为250.0 mg/mL以上的NaCl对色素有稳定作用,且能使溶液保持紫色;钙离子和多元醇类物质无护色作用;硼酸使其褪色速率变慢,体积分数为50%的乙醇则加快其褪色,提示黑果枸杞色素的降解机理可能为非酶途径,而与邻二酚羟基有关。
黑果枸杞;花色素;降解;动力学;护色
黑果枸杞(Lycium ruthenicum Murr.)为产于青藏高原的一种茄科植物[1-2],其果实呈紫黑色,为药食两用藏药(藏语称“旁那摘吾”)[3],藏医常用于“心热病”的防治[4]。现代药理学研究表明其色素有抗氧化[5-6]、降血脂[7-8]、抗动脉粥样硬化[9]、耐缺氧和抗疲劳[10]、增强免疫力[11]等活性,毒理学研究表明其色素属实际无毒物质[12-13],因此在开发功能性食品方面有巨大潜力。黑果枸杞含有多种水溶性花色苷,苷元主要为矮牵牛素、飞燕草素和锦葵素,所含糖主要为葡萄糖和芸香糖,且糖上往往被香豆酰、咖啡酰、阿魏酰等基团烷基化[14-17]。黑果枸杞鲜果中花色素的含量为5.4 mg/100 g,其中矮牵牛素-3-O-芸香糖(反-对-香豆酰基)-5-O-葡萄糖苷的含量最高(约占总花色素的80%)[14-15],其次为矮牵牛素-3-O-芸香糖(葡萄糖基-反-对-香豆酰基)-5-O-葡萄糖苷和矮牵牛素-3-O-芸香糖(顺-对-香豆酰基)-5-O-葡萄糖苷[17]。黑果枸杞色素在水溶液中的稳定性较差,其溶于水后数小时即出现变淡、变色等现象,有研究表明酸性条件有助于增强其稳定性[6,18],且烷基化的花色素较非烷基化的更稳定[6]。目前,黑果枸杞色素在水溶液中的降解机理尚不清楚,哪些食品添加剂可用作其水溶液的护色剂亦未见报道,针对这些问题进行探索,可为深入开发黑果枸杞的保健类食品提供有益参考。
1 材料与方法
1.1材料与试剂
黑果枸杞原料采自青海省察尔汗盐湖,经鉴定为茄科植物黑果枸杞(Lycium ruthenicum Mur.)的果实,晒干后使用。
柠檬酸、抗坏血酸、硼酸、NaCl、抗坏血酸钙、氯化钙、丙三醇、木糖醇、葡萄糖、无水乙醇均为国产分析纯,水为蒸馏水。
1.2仪器与设备
2600A型紫外-可见分光光度仪 尤尼柯(上海)仪器有限公司;TB-214电子分析天平(d=0.1 mg) 北京赛多利斯仪器系统有限公司;KT-350W超声波清洗机济宁科特超声电子有限责任公司。
1.3方法
1.3.1黑果枸杞色素的提取
取黑果枸杞,除去果梗、残留的苞片和泥沙等杂质,研碎,取约2.5 g,精密称定,置具塞锥形瓶中,准确加入蒸馏水100.0 mL,超声处理10 min,滤过,取续滤液备用。
1.3.2黑果枸杞色素水溶液的稳定性考察
精密量取黑果枸杞水提取液20.0 mL,加蒸馏水至50.0 mL,立即进行400~800 nm紫外-可见光谱扫描并测定最大吸收波长处的吸光度,并每隔10 min测定一次,直至吸光度无明显变化;测定过程中同时观察溶液的颜色变化。
1.3.3黑果枸杞色素护色剂的初步筛选
取50 mL量瓶8 个,分别加入适量不同的护色剂溶液,各精密加入黑果枸杞水提取液2.0 mL,以水稀释至刻度,使各护色剂的质量浓度分别如下:柠檬酸80.0 mg/mL、抗坏血酸80.0 mg/mL、NaCl300.0 mg/mL、抗坏血酸钙80.0 mg/mL、氯化钙80.0 mg/mL、丙三醇250.0 mg/mL、木糖醇400.0 m g/m L、葡萄糖400.0 m g/m L。室温(15 ℃)条件下将上述配好的溶液放置一段时间,观察颜色的变化。
1.3.4不同质量浓度护色剂的护色效果考察
将1.3.3节所筛出的护色剂以不同质量浓度添加到新配黑果枸杞色素水溶液中,控制最大吸收波长处的初始吸光度在0.2~0.8,室温(15 ℃)放置,每隔一段时间进行400~800 nm紫外-可见光谱扫描并测定最大吸收波长处的吸光度,并观察颜色变化。
1.3.5黑果枸杞色素降解动力学的分析
以时间t为自变量、降解率Q为因变量,按零级、一级、Hixson-Crowell、Higuchi、Baker-Lonsdale、Ritger-Peppas、Weibull方程[19]进行拟合,其中,Q=1-At/A0(A0为最大吸收波长处的初始吸光度,At为时间t时刻的吸光度)。
2 结果与分析
2.1黑果枸杞色素水溶液的稳定性
刚配好的黑果枸杞水溶液为鲜艳的紫色,光谱扫描结果显示在539 nm波长处有最大吸光度,与文献[17]报道一致。随着室温(15 ℃)条件下放置时间的延长,其颜色逐渐变淡,紫外-可见光谱扫描谱线不断下移,显示色素在逐渐降解(图1),539 nm波长处的吸光度逐渐下降(图2)。放置70 min后,溶液颜色变为微弱的红色,539 nm波长处的吸光度变化很小。

图1 黑果枸杞水溶液放置70 min的紫外-可见扫描光谱图Fig.1 UV-Vis absorption spectrum of aqueous solution of PLR during standing for 70 min
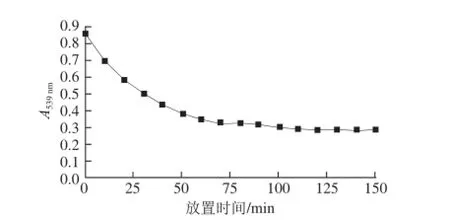
图2 黑果枸杞水溶液A539nm随时间的变化Fig.2 Changes in A539nmof PLR during different time intervals
将图2的数据进行动力学方程拟合,结果见表1。以We i b u l l模型拟合度最高,但相关系数仍偏小(r<0.99),在此模型基础上,再用最小二乘法进行多项式拟合,结果为:lnln(1/(1-Q))=0.656 1(lnt)4-0.019 5(lnt)3-1.224 9(lnt)2+0.995 8lnt-0.121 9,r=0.999 6,此方程能够很好地描述黑果枸杞色素在水溶液中降解变化的动力学过程。

表1 黑果枸杞色素水溶液降解率的数学模型拟合结果Table1 Kinetic models for PLR degradation in aqueous solution
2.2几种物质的护色效果
黑果枸杞水提液与柠檬酸溶液或抗坏血酸溶液混合后,其颜色由紫色立即变为桃红色,且柠檬酸溶液的颜色较抗坏血酸溶液更深,放置3 h后,二者的颜色均无明显变化。黑果枸杞水提液与NaCl溶液混合后,其紫色未见变化,放置3 h后,溶液仍呈鲜艳的紫色。黑果枸杞水提液与抗坏血酸钙溶液混合后,溶液立即变为蓝色并逐渐变浅,放置3 h后,溶液呈微弱蓝色。黑果枸杞水提液与氯化钙溶液混合后,溶液立即变为绿色并逐渐变黄,放置50 min后,溶液呈较稳定的黄色。黑果枸杞水提液分别与丙三醇溶液、木糖醇溶液和葡萄糖溶液混合后,仍呈紫色,但放置30 min后,加有木糖醇的溶液紫色褪去,放置70 min后,加有丙三醇和葡萄糖的溶液紫色褪去。
可以看出,高质量浓度的柠檬酸(80.0 mg/mL)、抗坏血酸(80.0 mg/mL)或NaCl(300.0 mg/mL)对黑果枸杞色素有一定的稳定作用,但柠檬酸和抗坏血酸能使溶液pH值下降而致颜色改变;钙离子和多元醇类物质对此色素无护色作用。
2.3不同柠檬酸添加量对黑果枸杞色素稳定性的影响
黑果枸杞色素水溶液中添加有柠檬酸时,溶液由紫色立即变为桃红色,且柠檬酸质量浓度越高颜色越深;室温放置46 h颜色不变。不同柠檬酸添加量条件下黑果枸杞色素水溶液的紫外-可见光谱扫描结果如图3A所示,均在530 nm波长附近有最大吸光度,混合溶液总体积均为50.0 mL,所加黑果枸杞水提液均为7.0 mL,柠檬酸添加量分别为:80.0、60.0、40.0、20.0、4.0、0、3.0、2.0、1.2、0.8、0.4 mg/mL。对室温放置46 h的上述溶液再进行紫外-可见光谱扫描,结果如图3B所示,图中最下面的谱线为未添加柠檬酸的溶液,其余添加柠檬酸的谱线的顺序与图3A相同。加有不同质量浓度柠檬酸的黑果枸杞色素水溶液在530 nm波长处的吸光度随时间的变化如图4所示。
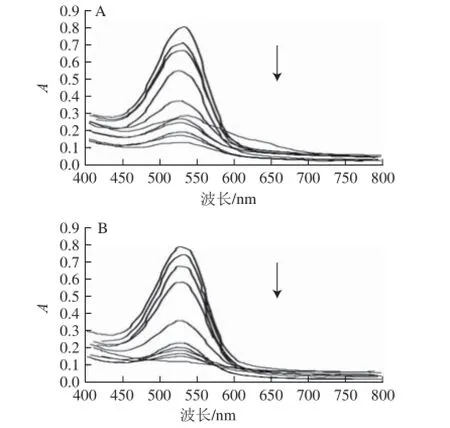
图3 不同柠檬酸添加量条件下黑果枸杞色素水溶液的紫外-可见扫描光谱图Fig.3 UV-Vis absorption spectra for PLR with different concentrations of citric acid added upon standing at room temperature
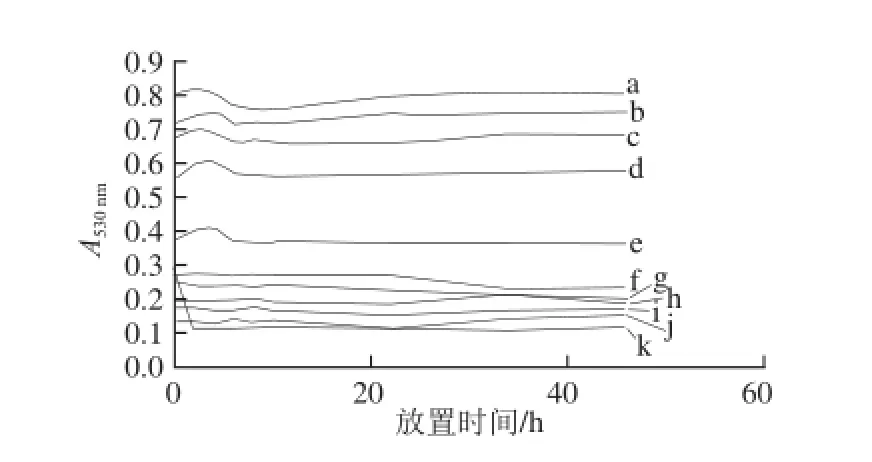
图4 不同柠檬酸添加量条件下A530nm随时间的变化Fig.4 Changes in A530nmduring different time intervals for PLR added with different concentrations of citric acid
由图4可知,添加量为0.4~80.0 mg/mL的柠檬酸,在较长时间内,紫外-可见光谱扫描图无明显变化、最大吸收波长处的吸光度变化很小,对黑果枸杞色素均有良好的稳定作用;但柠檬酸可使其变色,这可能是因为柠檬酸使溶液pH值下降,引起花色苷结构发生了一定变化,而柠檬酸添加前后Aλmax从539 nm变为530 nm(图3A)则体现了这一变化。
2.4不同抗坏血酸添加量对黑果枸杞色素稳定性的影响
黑果枸杞色素水溶液中添加抗坏血酸时,溶液由紫色立即变为桃红色,且抗坏血酸添加量越大颜色越深;但室温放置46 h过程中颜色逐渐变浅。不同抗坏血酸添加量条件下黑果枸杞色素水溶液的紫外-可见光谱扫描结果如图5A所示,最大吸收波长位于529~532 nm间,溶液总体积均为50.0 mL,所加黑果枸杞水提液均为7.0 mL。不同抗坏血酸添加量条件下的黑果枸杞色素水溶液在最大吸收波长处的吸光度随时间的变化如图6所示。
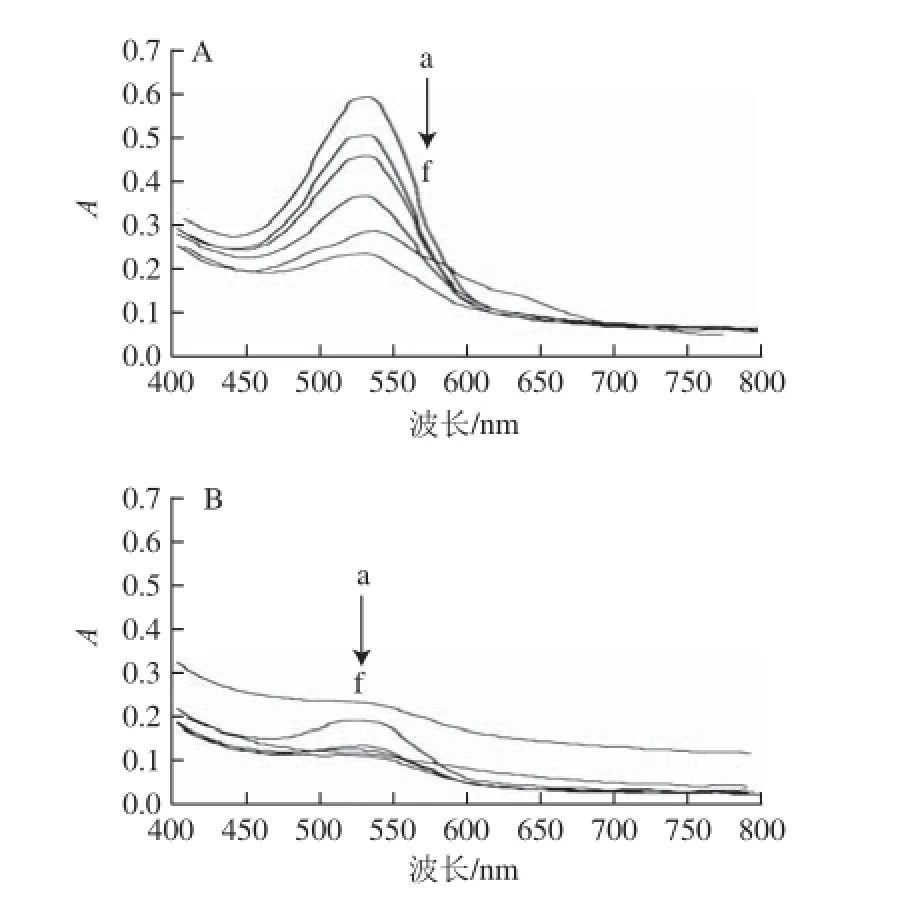
图5 不同抗坏血酸添加量条件下黑果枸杞色素水溶液的紫外-可见扫描光谱图Fig.5 UV-Vis absorption spectra for PLR added with different concentrations of ascorbic acid upon standing at room temperature

图6 不同抗坏血酸添加量条件下Aλmax随时间的变化Fig.6 Changes in Aλmaxduring different time intervals for PLR added with different concentrations of ascorbic acid
由图6可知,抗坏血酸添加量为4.0~80.0 mg/mL,放置46 h,其最大吸收波长处的吸光度有显著变化,表明黑果枸杞色素已部分降解,因此,抗坏血酸不仅使该色素变色,对其稳定性也无明显保护作用。
对图6的曲线a→e进行多个动力学方程模型拟合,所得各模型的相关系数如表2所示。可以看出,添加抗坏血酸后,黑果枸杞色素的降解过程不再符合Weibull模型,用Baker-Lonsdale模型能更好地描述。对于曲线a,Baker-Lonsdale拟合方程为3/2[1-(1-Q)2/3]-Q=0.001 8 t+ 0.001 5,在此模型基础上,再用最小二乘法进行多项式拟合,结果为:3/2[1-(1-Q)2/3]-Q=-10-8t5+ 10-6t4-4×10-5t3+0.000 5t2+0.000 6t-0.000 5,r= 0.999 3,此方程能够很好地描述添加抗坏血酸时黑果枸杞色素在水溶液中降解变化的动力学过程。
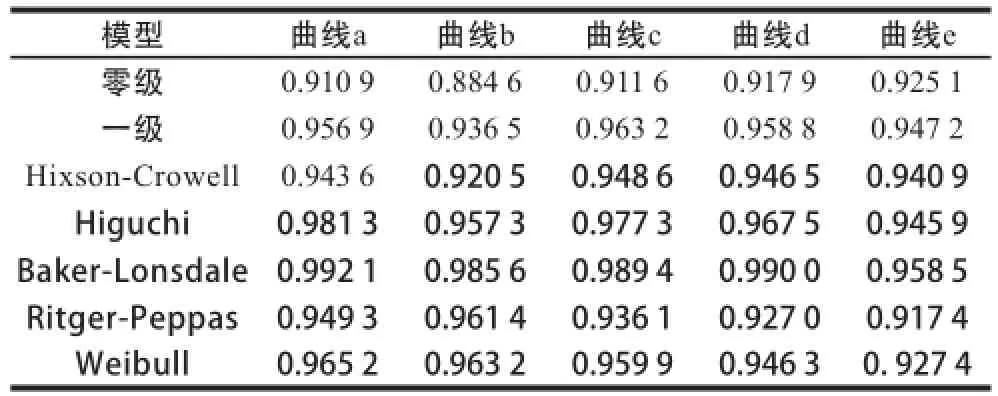
表2 黑果枸杞色素中加入抗坏血酸后降解率的数学模型拟合的相关系数Table2 Correlation coefficients of model equations for PLR- ascorbic acid system fitted with various kinetic models
2.5不同NaCl添加量对黑果枸杞色素稳定性的影响
黑果枸杞色素水溶液中添加有NaCl时,溶液未见变色,仍呈紫色,且NaCl添加量越大,紫色越深;室温放置46 h,溶液颜色变化与NaCl添加量有关,高添加量时(250.0 mg/mL)不褪色,添加量较低时(50.0 mg/mL)紫色完全褪去。不同NaCl添加量条件下,黑果枸杞色素水溶液的紫外-可见光谱扫描结果如图7A所示,均在537 nm波长处有最大吸收,图中延箭头曲线方向所代表的溶液总体积均为50.0 mL,所加黑果枸杞水提液均为9.5 mL,对室温放置46 h的上述溶液再进行紫外-可见光谱扫描,结果如图7B所示,不同NaCl添加量条件下的黑果枸杞色素水溶液在537 nm波长处的吸光度随时间的变化如图8所示。

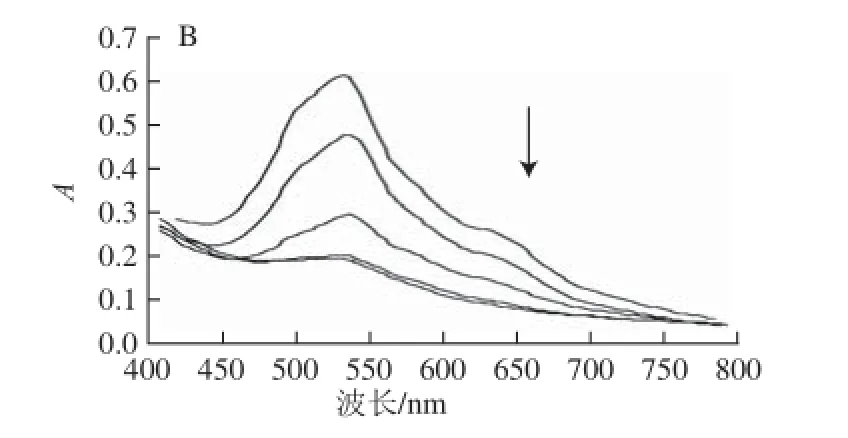
图7 黑果枸杞色素水溶液不同NaCl添加量条件下的紫外-可见扫描光谱图Fig.7 UV-Vis absorption spectra at different storage time for PLR added with different concentrations of sodium chloride
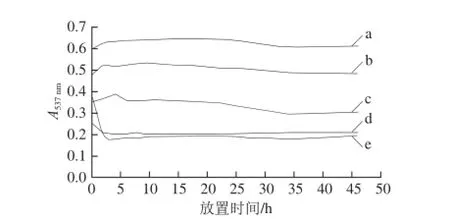
图8 不同NaCl添加量条件下A537nm37nm随时间的变化Fig.8 Changes in A537nmduring different time intervals for PLR added with different concentrations of sodium chloride
由图8可知,NaCl添加量在250.0 mg/mL以上时,较长时间内紫外-可见光谱扫描图无明显变化、最大吸收波长处的吸光度变化很小,黑果枸杞色素基本未降解;NaCl添加量为150.0 mg/mL时,46 h内黑果枸杞色素略有降解;NaCl添加量为50.0 mg/mL时,放置46 h,黑果枸杞色素几乎完全降解。因此,高添加量NaCl(250.0 mg/mL以上)对黑果枸杞色素均有良好的稳定作用,且仍能维持其天然紫色。
3 讨 论
黑果枸杞色素的降解机理尚不清楚。Cabrita等[20]认为,花色苷的稳定性与苷元上的酚羟基数目有关,酚羟基越多越不稳定;Cheynier等[21]认为,一方面花色苷的降解可能与植物中的酶(如多酚氧化酶)有关,另一方面,结构中存在邻二酚羟基的花色苷的降解速率较无邻二酚羟基者更快。黑果枸杞色素的主要成分矮牵牛素-3-O-芸香糖(反-对-香豆酰基)-5-O-葡萄糖苷的苷元除3、5位与糖相连外,还有7、4’和5’ 3个酚羟基(存在邻二酚羟基结构)。为了探索黑果枸杞色素的降解原理,另外考察了黑果枸杞色素的水溶液、体积分数50%乙醇溶液(可抑制植物中酶的活性)和质量分数3%硼酸溶液放置12 h的变化情况,结果50%乙醇溶液褪色最快,硼酸溶液褪色最慢。硼酸有保护邻二酚羟基的作用,因此,黑果枸杞色素的降解与邻二酚羟基有密切关系。
酸性条件对黑果枸杞色素有一定的稳定作用[6],但柠檬酸与抗坏血酸的作用不同,这可能与抗坏血酸有还原性、柠檬酸无还原性有关。Markakis等[22]认为,抗坏血酸被氧化后能产生过氧化氢,后者可进攻花色素的C环而导致其降解。抗坏血酸对花色素稳定性的影响可能与浓度有关,例如低浓度抗坏血酸对蓝莓色素有保护作用,高浓度时则促进其降解[23]。de Rosso等[24]的实验也表明,西印度樱桃花色素溶液中所添加的抗坏血酸浓度越高,花色素越容易降解。
高浓度NaCl对黑果枸杞色素有较好的护色作用,其机理尚不清楚,可能与离子强度增加有关。但Hubbermann等[25]针对黑加仑子花色素的研究却表明NaCl浓度越高则降解越快。因此,NaCl与花色素的相互作用有待进一步研究。
[1] 中国科学院中国植物志编辑委员会. 中国植物志(第67卷第1分册)[M].北京: 科学出版社, 1978: 10.
[2] 韩丽娟, 叶英, 索有瑞. 黑果枸杞资源分布及其经济价值[J].中国野生植物资源, 2014, 33(6): 55-57. DOI:10.3969/ j.issn.1006-9690.2014.06.014.
[3] 青海省药品检验所, 青海省藏医药研究所. 中国藏药(第三卷)[M].上海: 上海科学技术出版社, 1996: 193-196.
[4] 帝玛尔・丹增彭措. 晶珠本草[M]. 上海: 上海科学技术出版社, 1986: 66.
[5] 李进, 瞿伟菁, 张素军, 等. 黑果枸杞色素的抗氧化活性研究[J].中国中药杂志, 2006, 31(14): 1179-1183. DOI:10.3321/ j.issn:1001-5302.2006.14.014.
[6] HU N, ZHENG J, LI W, et al. Isolation, stability, and antioxidant activity of anthocyanins from Lycium ruthenicum Murray and Nitraria Tangutorum Bobr of Qinghai-Tibetan Plateau[J]. Separation Science and Technology, 2014, 49(18): 2897-2906. DOI:10.1080/01496395.20 14.943770.
[7] 李进, 瞿伟菁, 刘丛, 等. 黑果枸杞色素对高脂血症小鼠血脂及脂质过氧化的影响[J]. 食品科学, 2007, 28(9): 514-518. DOI:10.3321/ j.issn:1002-6630.2007.09.125.
[8] 林丽, 李进, 李永洁, 等. 黑果枸杞花色苷对氧化低密度脂蛋白损伤血管内皮细胞的保护作用[J]. 中国药学杂志, 2013, 48(8): 606-611. DOI:10.11669/cpj.2013.08.008.
[9] 林丽, 李进, 吕海英, 等. 黑果枸杞花色苷对小鼠动脉粥样硬化的影响[J]. 中国中药杂志, 2012, 37(10): 1460-1466. DOI:10.4268/ cjcmm20121024.
[10] 贾琦珍, 陶大勇, 陈瑛. 黑果枸杞色素对小鼠常压耐缺氧及游泳耐力的影响[J]. 时珍国医国药, 2009, 20(11): 2682-2683. DOI:10.3969/ j.issn.1008-0805.2009.11.012.
[11] 马丽艳, 陶大勇, 陈瑛. 黑果枸杞色素对三黄鸡体液免疫, 细胞免疫的影响[J]. 塔里木大学学报, 2008, 12(4): 6-10. DOI:10.3969/ j.issn.1009-0568.2008.04.002.
[12] 李进, 原惠, 曾献春, 等. 黑果枸杞色素的毒理学研究[J]. 食品科学,2007, 28(7): 470-475. DOI:10.3321/j.issn:1002-6630.20 07.07.115.
[13] 赵晓辉, 陶燕铎, 邵赟, 等. 黑果枸杞红色素毒理学安全性评价[J].时珍国医国药, 2011, 22(2): 373-375. DOI:10.3969/ j.issn.1008-0805.2011.02.049.
[14] ZHENG J, DING C, WANG L, et al. Anthocyanins composition and antioxidant activity of wild Lycium ruthenicum Murr. from Qinghai-Tibet Plateau[J]. Food Chemistry, 2011, 126(3): 859-865. DOI:10.1016/j.foodchem.2010.11.052.
[15] CHEN C, YUN S, TAO Y, et al. Main anthocyanins compositions and corresponding H-ORAC assay for wild Lycium ruthenicum Murr. fruits from the Qaidam Basin[J]. Journal of Pharmaceutical Technology and Drug Research, 2013, 2(1): 1-5. DOI:10.7243/2050-120X-2-1.
[16] JIN H, LIU Y, GUO Z, et al. High-performance liquid chromatography separation of cis-trans anthocyanin isomers from wild Lycium ruthenicum Murr. employing a mixed-mode reversed-phase/strong anion-exchange stationary phase[J]. Journal of Agricultural and Food Chemistry, 2015, 63(2): 500-508. DOI:10.1021/jf504525w.
[17] JIN H, LIU Y, YANG F, et al. Characterization of anthocyanins in wild Lycium ruthenicum Murray by HPLC-DAD/QTOF-MS/MS[J]. Analytical Methods, 2015, 7(12): 4947-4956. DOI:10.1039/ C5AY00612K.
[18] 李进, 赵红艳, 原惠, 等. 黑果枸杞色素性质研究[J]. 食品科学, 2006,27(10): 146-151. DOI:10.3321/j.issn:1002-6630.2006. 10.032.
[19] COSTA P, LOBO J M S. Modeling and comparison of dissolution profi les[J]. European Journal of Pharmaceutical Sciences, 2001, 13(2): 123-133. DOI:10.1016/S0928-0987(01)00095-1.
[20] CABRITA L, FOSSEN T, ANDERSEN ☒ M. Colour and stability of the six common anthocyanidin 3-glucosides in aqueous solutions[J]. Food Chemistry, 2000, 68(1): 101-107. DOI:10.1016/S0308-8146(99)00170-3.
[21] CHEYNIER V, SOUQUET J M, KONTEK A, et al. Anthocyanin degradation in oxidising grape musts[J]. Journal of the Science of Food and Agriculture, 1994, 66(3): 283-288. DOI:10.1002/jsfa.2740660304.
[22] MARKAKIS P, JURD L. Anthocyanins and their stability in foods[J]. Critical Reviews in Food Science & Nutrition, 1974, 4(4): 437-456. DOI:10.1080/10408397409527165.
[23] 陈伟平, 陈华江, 曹雪丹, 等. 抗坏血酸和异抗坏血酸对蓝莓花色苷稳定性的影响[J]. 浙江农业科学, 2013, 50(9): 1145-1148. DOI:10.3969/j.issn.0528-9017.2013.09.032.
[24] de ROSSO V V, MERCADANTE A Z. The high ascorbic acid content is the main cause of the low stability of anthocyanin extracts from acerola[J]. Food Chemistry, 2007, 103(3): 935-943. DOI:10.1016/ j.foodchem.2006.09.047.
[25] HUBBERMANN E M, HEINS A, ST☒CKMANN H, et al. Influence of acids, salt, sugars and hydrocolloids on the colour stability of anthocyanin rich black currant and elderberry concentrates[J]. European Food Research and Technology, 2006, 223(1): 83-90. DOI:10.1007/s00217-005-0139-2.
Degradation Kinetics of Pigments from Lycium ruthenicum in Aqueous Solution and Screening of Their Color Fixatives
ZHANG Jianqi1,2, YANG Wenyu1,*, SHI Dongjun1, TANG Sheng1, LUO Chunxu1
(1. School of Food and Bioengineering, Xihua University, Chengdu 610039, China;2. School of Bioengineering, Chongqing University, Chongqing 400044, China)
Lycium ruthenicum is widely distributed in the Qinghai-Tibet Plateau, and its fruits are rich in anthocyanins, 80% of which is petunidin-3-O-rutinoside (trans-p-coumaroyl)-5-O-glucoside, an ortho-diphenolic compound. Considering the rapid degradation of the purple pigment from Lycium ruthenicu (PLR) in aqueous solution, this work aimed to explore the degradation mechanism of PLR and to improve its stability. Optimal degradation kinetics and appropriate color fixatives for PLR were investigated by determining the changes of its UV-Vis absorption spectrum and absorbance at the maximum wavelength (Aλmax) and fitting the changes in Aλmaxto several models. The results indicated that: (1) the degradation of PLR in aqueous solution followed the Weibull model basically; (2) 0.4-80.0 mg/mL citric acid was beneficial to the stabilization of PLR while it could change its color from purple to peach; (3) 4.0-80.0 mg/mL ascorbic acid could not prevent the degradation of PLR, and it changed the degradation kinetics to Baker-Lonsdale model; (4) sodium chloride at higher concentrations (250.0 mg/mL or above) could have a stabilizing effect on PLR; (5) additives such as calcium or polyols were not helpful for improving the stability of PLR. It could be supposed that ortho-diphenolic group rather than plant enzyme could be the main factor responsible for the degradation of PLR, due to slower fading when adding boric acid when compared with 50% ethanol.
Lycium ruthenicum; anthocyanins; degradation; kinetic models; color protection
10.7506/spkx1002-6630-201619016
TS202.3
A
1002-6630(2016)19-0094-06
张建琪, 杨文宇, 石冬俊, 等. 黑果枸杞色素在水溶液中的降解动力学及护色剂的筛选[J]. 食品科学, 2016, 37(19): 94-99. DOI:10.7506/spkx1002-6630-201619016. http://www.spkx.net.cn
ZHANG Jianqi, YANG Wenyu, SHI Dongjun, et al. Degradation kinetics of pigments from Lycium ruthenicum in aqueous solution and screening of their color fixatives[J]. Food Science, 2016, 37(19): 94-99. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201619016. http://www.spkx.net.cn
2015-12-15
西华大学科研基金项目(12205027)
张建琪(1992—),女,硕士研究生,研究方向为药食两用中药活性成分。E-mail:893962282@qq.com
杨文宇(1973—),男,副教授,博士,研究方向为药食两用中药活性成分。E-mail:youngwenyu@hotmail.com

