黄酒中生物胺的HPLC-MS/MS测定
许禄,欧杰,王婧,贾素中
上海海洋大学食品学院,上海201306
黄酒中生物胺的HPLC-MS/MS测定
许禄,欧杰*,王婧,贾素中
上海海洋大学食品学院,上海201306
本文建立了一种新型的检测市售黄酒中常见的六种生物胺(尸胺、组胺、酪胺、色胺、腐胺和2-苯乙胺)的HPLC-MS/MS分析方法。采用Atlantis HILIC色谱柱(150.0 mm×2.1 mm,3µm);乙腈和水(2 mmol/L的乙酸铵,0.1%甲酸)作为流动相进行梯度进样;以电喷雾离子源(ESI)在正离子模式下进行母离子全扫描;采用多反应监测(MRM)模式和外标法进行质谱定量分析,分析时间为15 min。六种生物胺的检出限为9.7 μg/L~50 μg/L,定量限为28.6 μg/L~148.6 μg/L,且在0~1000 μg/L范围内具有良好的线性关系,样品平均添加回收率为81.34%~104.23%,相对标准偏差(RSD)为1.23%~8.56%。本方法不需要衍生化处理,且操作简便,灵敏度高,可快速准确对黄酒中多种生物胺进行定性和定量分析。
黄酒;生物胺;HPLC-MS/MS
生物胺(BA)是一类含氮的低分子量有机化合物总称,具有生物活性,是由动物、植物和微生物组织在正常新陈代谢过程中降解产生[1]。生物胺广泛存在于食品中,尤其是蛋白质和氨基酸含量多的食品中,如鱼、肉、奶酪及各类发酵产品等中。组胺和酪胺在食品中含量最多,同时也是对人体健康危害最大的两种生物胺,如酪胺可引起人体血压升高及偏头痛,组胺积累到一定浓度可导致食源性中毒,造成腹部痉挛、呕吐等症状命[2,3]。
黄酒是我国传统的发酵酒,随着消费者对黄酒安全问题的关注度不断增加,黄酒中生物胺含量的安全性也被多次提及。由于黄酒的酿造地区和发酵方法不同,黄酒中生物胺的种类和含量存在差异,陆永梅等[4,5]对中国4个黄酒产区的14种黄酒中生物胺进行测定,结果显示黄酒中含有酪胺、组胺、尸胺、精胺、腐胺等五种生物胺。目前生物胺的检测方法主要有反相高效液相色谱法(RP-HPLC)、离子色谱法(IC)、薄层色谱法(TLC)等,其中RP-HPLC法最为常用[6,7]。其中GB/T.5009-208[8]采用HPLC测定食品中生物胺含量,但该方法需要进行柱前或柱后衍生,反应条件非常苛刻。本实验建立了高效液相色谱串联质谱法,将色谱对复杂样品的高分离能力与质谱的高选择性、高灵敏度结合起来,且不需要衍生化处理,同时具有可提供相对分子质量与结构信息的优点,为黄酒中多种生物胺的同时定性和定量分析提供了有效便利的分析方法。
1 材料与方法
1.1实验试剂与仪器
主要试剂:组胺(His,C5H9N3)标准品、腐胺(Put,C4H12N2)标准品、尸胺(Cad,C5H14N2)标准品、苯乙胺(Phe,C8H11N)标准品、色胺(Try,C10H12N2)标准品、酪氨(Tyr,C8H11NO)标准品均购于Sigma公司(纯度均>98%);甲醇(色谱纯);乙腈(色谱纯)甲醇/乙腈溶液80/20(v/v);氨水甲醇溶液(量取5 mL氨水,溶解于100 mL甲醇中);实验室用水为MILI-Q超纯水。
实验仪器:Quattro Micro型液相色谱串联三重四级杆质谱仪(美国Waters公司);MasslynxV4.1软件;有机相0.22 μm过滤膜;超声波清洗仪;DC12系列氮吹仪吹仪(上海安谱);梅特勒电子天平SBZ04-N;BESEP®HR-XC混合型阳离子交换固相萃取柱(60 mg,3 mL)。
1.2实验方法
1.2.1样品前处理取10 mL黄酒样品经0.45 μm有机相滤膜过滤,将滤液加入混合型阳离子交换固相萃取柱后,用2 mL的3%甲酸水溶液过柱,然后弃去流出液,再用3 mL氨水甲醇溶液洗脱,收集洗脱液,氮吹浓缩后,用甲醇溶液定容至1 mL,过0.22 μm有机相滤膜后入样品瓶,上机测定。1.2.2色谱条件Atlantis HILIC色谱柱(150.0 mm×2.1 mm,3µm);进样量为10 μL;分析时间为15 min;柱温为35℃;流速为0.2 mL/min;流动相A为水(2 mmol/L的乙酸铵,0.1%甲酸),B为乙腈;具体梯度洗脱程序如图所示(见表1)。
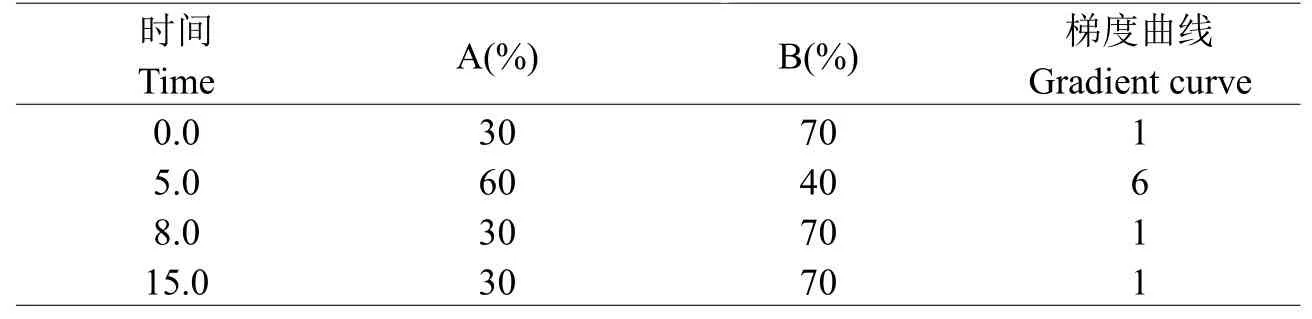
表1 梯度洗脱参数Table 1 Parameters of gradient elution
1.2.3质谱条件电离源采用电喷雾离子源(ESI);离子源温度为120℃;毛细管电压为3.00 kV脱溶剂和锥孔气为N2;脱溶剂温度为300℃;脱溶剂流速为500 L/h;锥孔气流速为50 L/h;碰撞气体为氩气;扫描方式为正离子扫描,驻留时间为50 ms;监测模式为多重离子反应(MRM)。
2 结果与讨论
2.1样品前处理的优化
2.1.1固相萃取柱柱型的选择本试验采用了几种不同的固相萃取小柱:HLB固相萃取柱、C18固相萃取小柱、MCX固相萃取柱和DSC-18固相萃取柱。结果显示HLB固相小柱和DSC-18固相小柱对腐胺和尸胺没有任何保留,而MCX固相小柱对腐胺和尸胺的回收率分别为86.27%和93.14%,因此本实验选择MCX固相萃取小柱。与其他萃取小柱净化样品相比,混合型离子交换固相萃取小柱的使用使生物胺的回收率有所提高,有利于大批量样品的检测。
2.1.2洗脱液的选择洗脱液的选择会影响样品中生物胺的回收率,对实验结果精确度影响很大。实验采用MCX固相萃取小柱,样品过柱流速控制在1 mL/min,探究了四种常见的洗脱液:二氯甲烷和丙酮混合液(1:1),甲醇,乙腈,氨水甲醇溶液(5 mL氨水,100 mL甲醇)。结果表明,用氨水甲醇混合溶液(5 mL氨水,100 mL甲醇)洗脱,腐胺和酪胺的回收率分别为87.6%、92.7%,六种生物胺的平均回收率在82.3%~88.9%,而用二氯甲烷和丙酮混合液(1:1),甲醇和乙腈洗脱时,六种生物胺的平均回收率为72.5%~78.3%、34.5%~46.3%、27.8%~32.3%,当用甲醇洗脱时,酪胺和腐胺的回收率仅为19.6%、23.4%。另外二氯甲烷和丙酮混合液(1:1)洗脱氮吹后,需要转溶剂为甲醇并定容到1.0 mL,氨水甲醇混合液洗脱后无需转溶剂可直接定容进样,操作也简单。所以实验最终选取氨水甲醇溶液(5 mL氨水,100 mL甲醇)作为洗脱液。
2.2色谱条件的优化
实验分析发现,Atlantis HILIC色谱柱(150.0 mm×2.1 mm,3µm)对生物胺的保留效果远比C18色谱柱要好。流动相的组成和比例影响物质的分离和灵敏度,本实验使用了不同比例的甲醇-水和乙腈-水等多种流动相体系,发现当流动相为乙腈-水(2 mmol/L乙酸铵,0.1%甲酸)时,六种生物胺的分离效果最好。同时乙酸铵和甲酸的加入可提高离子化的速率,因此溶出时间最早的物质峰型很尖锐,灵敏度也随之提高。然而当用甲醇-水(80:20)作为流动相时,得到的峰形不仅拖尾严重,而且灵敏度也大大下降。按照表1的梯度洗脱使得样品的峰型比较窄而且尖锐,分离能力很强,从而有效地缩短分离时间。六种生物胺标准品的色谱图(见图1)。
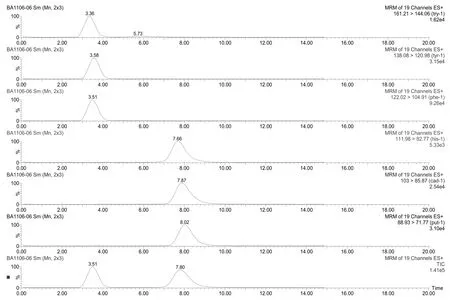
图1 6种生物胺标准品的色谱图Fig.1 Chromatograms of six standards of biogenic amines
2.3质谱条件的优化
用50 μg/L的6种生物胺标准溶液分别用电喷雾离子源(ESI)方式在正离子模式下进行母离子全扫描,确定其准分子离子峰,然后以其分子离子作为母离子,进行二级质谱分析,最终选取干扰较小、丰度较强的子离子为定性离子,然后通过调谐其流动相流速、锥孔电压、碰撞能、母离子以及两对子离子等参数,使其特征离子的强度达到最大。MS检测条件的优化就是为了保证被测离子具有较好的稳定性和灵敏度,最终优化后的质谱条件如下(见表2)。
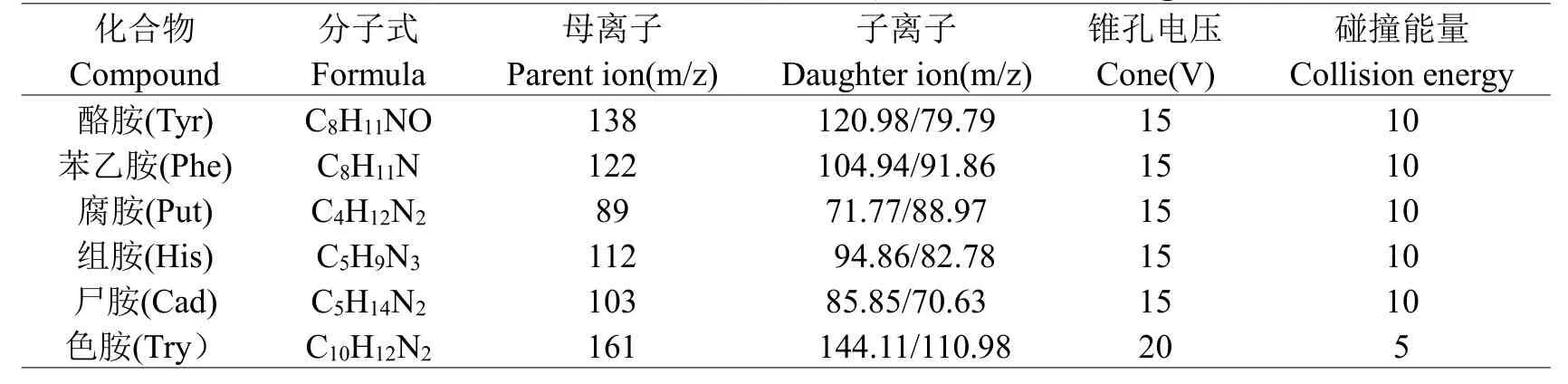
表2 多反应监测(MRM)模式下6种生物胺优化后的质谱条件Table 2 Multiple reaction monitoring(MRM)conditions of 6 biogenic amines
2.4线性范围与检出限
用生物胺标准混合溶液做线性实验,各组生物胺浓度分别为:0、50、100、250、500、1000 μg/L。按照本实验所创建的方法进行测定,然后以定量离子的峰面积为纵坐标(Y),相对应的标准溶液浓度为横坐标(X)作标准曲线,并计算所得标准曲线的线性回归方程以及相关系数,结果显示六种生物胺的相关系数R的平方均大于0.994,说明在0~1000 μg/L的浓度范围内该方法具有良好的线性关系(见表3)。以3倍信噪比(S/N=3)对应黄酒样品中生物胺浓度作为检出限(LOD),以10倍信噪比(S/N=10)对应的黄酒样品中生物胺作为定量限(LOQ),最终算得六种生物胺的检出限和定量限,所得结果(见表3)。
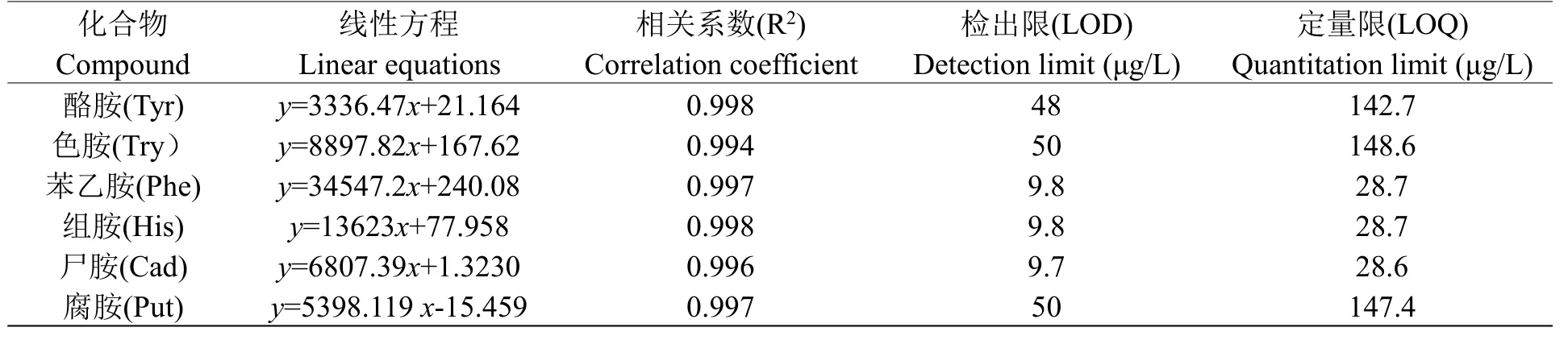
表3 六种生物胺的线性关系和检测限Table 3 Linear equation and LOD of six biogenic amines
2.5方法回收率和精确度
向不含待测化合物的黄酒样品中加入三种浓度水平的混合标准溶液,加标量分别为50 μg/L、100 μg/L、500 μg/L,进样分析并计算其回收率和精密度,每个水平重复测量七次,结果见表4,其平均回收率为81.34%~104.23%,相对标准偏差在之间1.23%~8.56%。
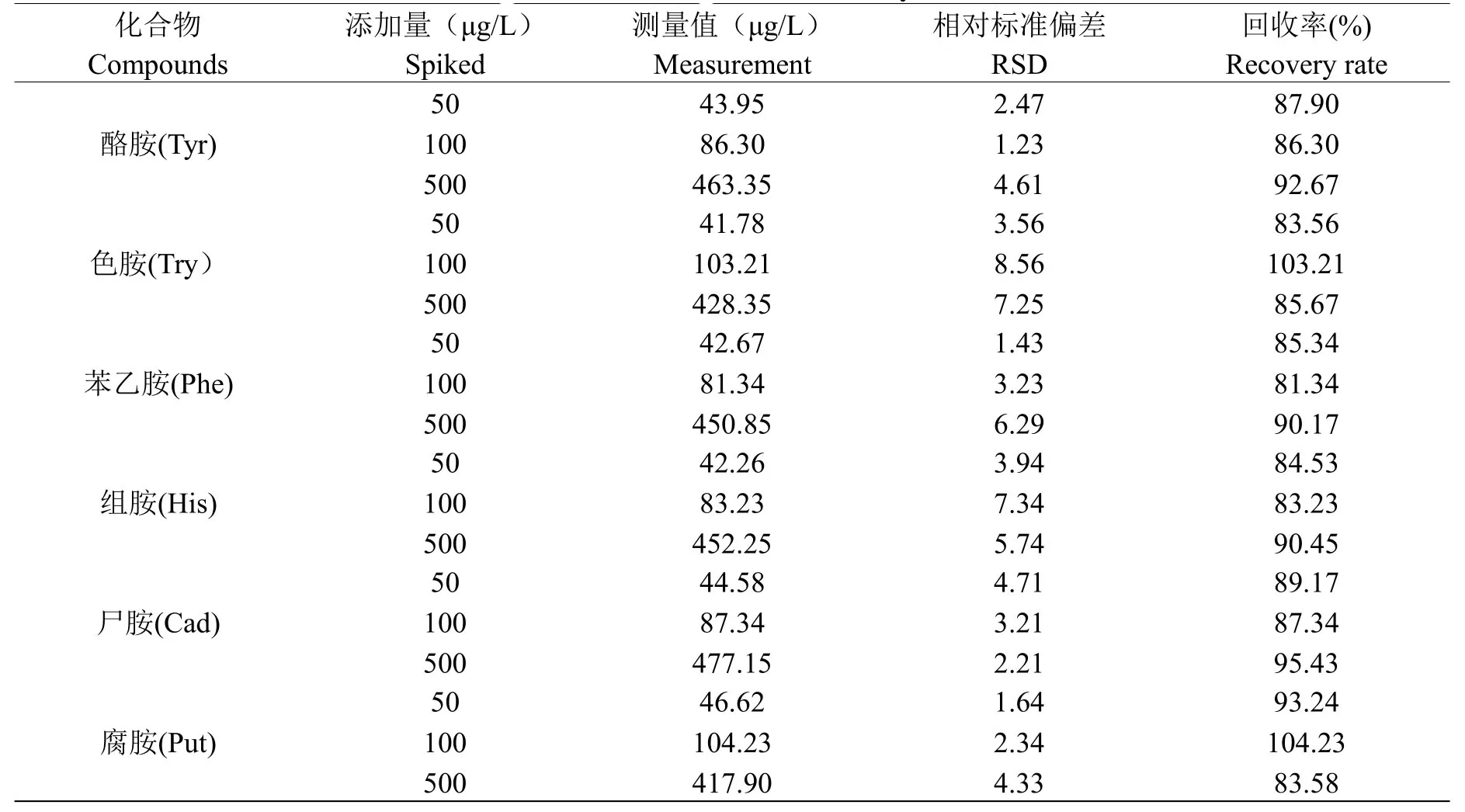
表4 黄样品中六种生物胺的回收率(n=7)Table 4 The recovery rate of six biogenic amines in yellow rice wine(n=7)
2.6实际样品的测定
在本文建立的高效液相色谱串联质谱的实验条件下,对上海市市售品牌黄酒进行随机取样,将样品中添加混合标准溶液进行测定,从得到的质谱图(图2)可以看出,图像平稳清晰,样品各组分出峰点与标样出峰点都有准确的对应,而且没有其他杂峰的干扰。随机取样的50个黄酒样品中均检测到生物胺,其含量均在国家规定的安全范围内,其中43个样品中检测到组胺和酪胺,其含量分别在370.2 μg/L~850.7 μg/L和98.5 μg/L~670.5 μg/L,23个样品检测到了腐胺,其含量为156.6 μg/L~245.6 μg/L,14个样品检测到尸胺,其含量为120.4 μg/L~210.6 μg/L,5个样品检测到了苯乙胺,其含量为135.3 μg/L~256.4 μg/L,50个样品均未检测到色胺。
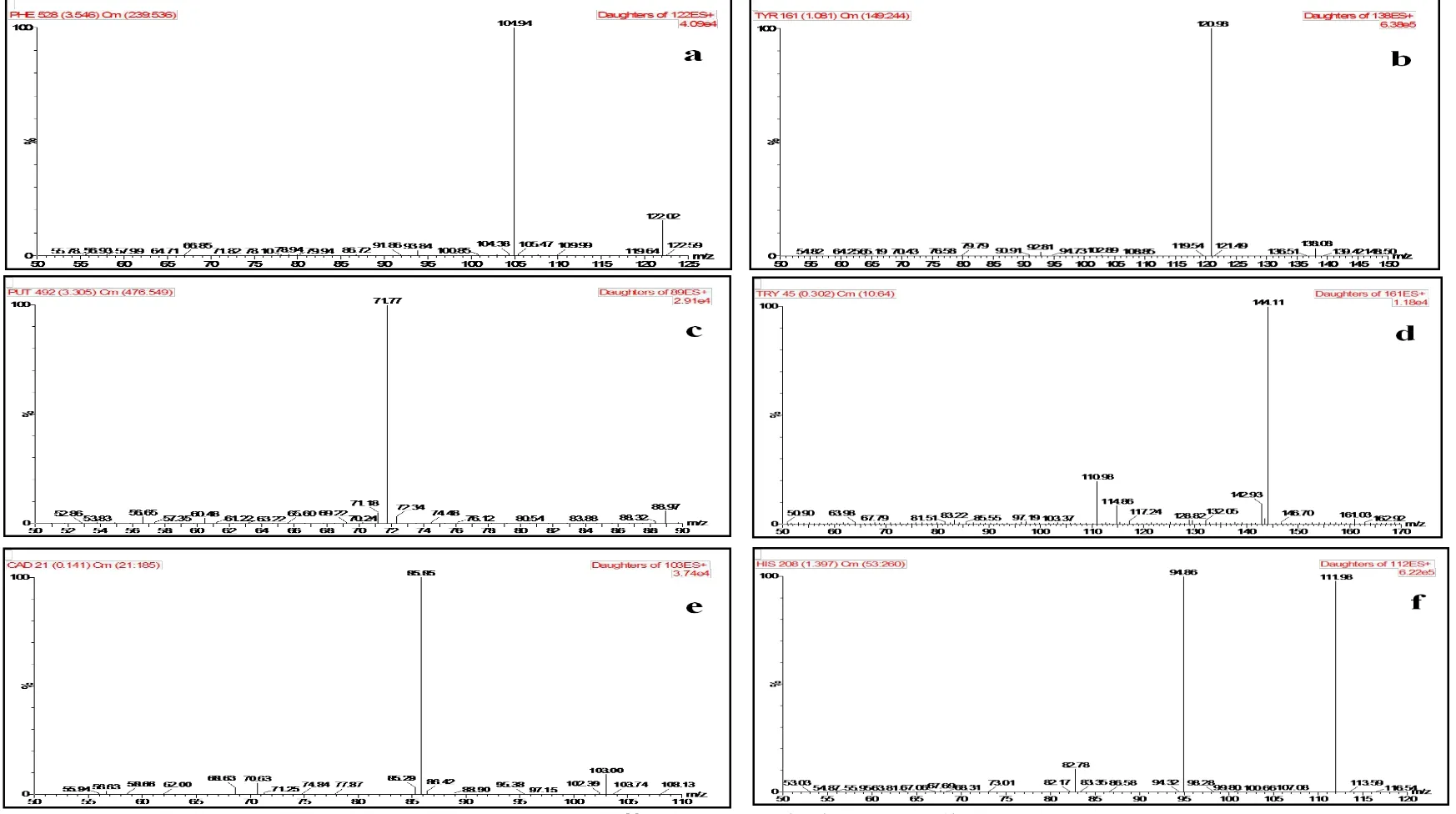
图2 加标后黄酒样品生物按检测质谱图Fig.2 The MRM spectrum of biogenic amines in Yellow Rice Wine with standards
3 结论
本文建立了HPLC-MS/MS法测定黄酒中生物胺的分析方法,采用多反应监测(MRM)模式和外标法进行质谱定量分析,六种生物胺的定量离子对分别为组胺112/94.86、尸胺103/85.85、色胺161/144.11、酪胺138/120.98、腐胺89/71.77、苯乙胺122/104.94。本方法中六种生物胺的检出限为9.7 μg/L~50 μg/L,定量限为28.6 μg/L~148.6 μg/L,且在0~1000 μg/L范围内具有良好的线性关系。六种生物胺在黄酒样品中的平均回收率为81.34%~104.23%,相对标准偏差在之间1.23%~8.56%之间,均符合国际标准中残留检测要求。本方法中样品无需衍生化处理,可对黄酒中生物胺进行快速准确的定性和定量,大大提高了大批量样品检测的效率。
[1]张敬,赵树欣,薛洁,等.发酵型饮料酒中生物胺含量的调查与分析[J].分析与检测,2012,38(6):165-168
[2]李志军,吴永宁,薛长湖.生物胺与食品安全[J].食品与发酵工业,2004,30(10):84-91
[3]冯雅蓉,马俪珍.生物胺对食品安全和人类健康的重要性[J].肉类研究,2005,16(12):25-28
[4]陆永梅,董明盛,吕欣,等.高效液相色谱法测定黄酒中生物胺的含量[J].食品科学,2006,27(1):196-199
[5]张凤杰,薛洁,王异静,等.黄酒中生物胺的形成及其影响因素[J].食品与发酵工业,2013,39(2):62-68
[6]刘辰麟,王锡昌,丁卓平.水产品中生物胺的测定方法[J].上海水产大学学报,2007,16(4):357-361
[7]李志军,薛长湖,吴永宁.反相高效液相色谱法测定食品中生物胺[J].食品工业科技,2005,26(4):175-178
[8]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T.5009-208食品中生物胺含量的测定[S].北京:中国标准出版社,2008
[9]董伟峰,林维宣,田苗,等.固相萃取-高效液相色谱法测定七种痕量生物胺[J].食品研究与开发,2006,27(1):107-111
[10]赵中辉.水产品贮藏过程中生物胺的变化及组胺形成机制的研究[D].青岛:中国海洋大学,2011:23-32
[11]李志军.食品中生物胺及其产生菌株检测方法研究[D].青岛:中国海洋大学,2007:10-11
[12]王颖,邱瑶,韩北忠,等.食品中的生物胺及其检测方法[J].中国酿造,2011,235(10):1-3
[13]玉澜,谢济运,蓝峻峰.黄酒中生物胺的测定[J].安徽农业科学,2012,400(1):6498-6500
[14]邹阳.高盐稀态酱油生产过程中生物胺的形成机制及发酵调控研究[D].广州:华南理工大学,2012
[15]谢铭.黄酒中生物胺的分析研究[J].广州化工,2010,38(4):139-141
[16]VinciG,AntonelliML.Biogenicamines:qualityindexoffreshnessinredandwhitemeat[J].Foodcontrol,2002,13(8):519-524
[17]Moret S,Smela D,Populin T,et al.A survery on free biogenic amine content of fresh and preserved vegetable[J].Food Chemistry,2005,89(3):355-361
DeterminationofBiogenicAminesinYellowRiceWinebyHPLC-MS/MS
XU Lu1,OU Jie1*,WANG Jing2,JIASU-zhong1
1.College of Food Science and Technology/Shanghai Ocean University,Shanghai 201306,China
2.Shanghai Food Research Institute,Shanghai 200235,China
A new HPLC-MS/MS analytical method was developed to detect the biogenic amines(Cadaverine,Histamine,Tyramine,Tryptamine,Putrescine and Phenethylamine)in Yellow Rice Wine.The analysis was performed using a Atlantis HILIC column(150.0 mm×2.1 mm,3 μm)and the mobile phase was consisted of acetonitrile and water(2 mmol/L ammonium acetate,0.1%formic acid)in the mode of gradient elution programand it was employed in multiple reaction monitoring(MRM)with electrospray ionization(ESI)in the positive mode and the analysis time was fifteen minutes.The detection limits of the six biogenic amines were in the range of 9.7 μg/L to 50 μg/L.The limit of quantitation was in the range of 28.6 μg/L to 148.6 μg/L.A good linear relationship was observed in the range of 0 μg/L to 1000 μg/L.The average recoveries were in the range of 81.34%to 104.23%for the six biogenic amines.The relative standard deviations(RSD)were between 1.23%and 8.56%.This method is reliable,sensitive and reproducible for the qualitative and quantitative analysis on the biogenic amines in Yellow Rice Wine.
Yellow Rice Wine;biogenic amines;HPLC-MS/MS
O657.7+2
A
1000-2324(2016)05-0654-05
2015-11-16
2015-12-23
上海市科委应用技术开发专项资金(2013-116);(2014-110)
许禄(1990-),女,硕士研究生,研究方向为食品分析化学.E-mail:525080716@qq.com
Author for correspondence.E-mail:jou@shou.edu.cn

