除草剂筛选小麦转基因植株的有效浓度研究
李艺,王悦,王健,赵翔宇,王芳,别晓敏
山东农业大学生命科学学院,作物生物学国家重点实验室,山东泰安271018
除草剂筛选小麦转基因植株的有效浓度研究
李艺,王悦,王健,赵翔宇,王芳,别晓敏*
山东农业大学生命科学学院,作物生物学国家重点实验室,山东泰安271018
利用筛选标记基因可方便快捷的区分转基因植株和非转基因植株。筛选标记基因通常用PCR、Southern杂交等分子手段检测。随着规模化转基因工作的开展,大量转基因植株需要及时准确的鉴定。叶片涂抹除草剂筛选转基因植株具有快速、高效的优势。本研究结果显示,除草剂草铵膦对小麦品种轮选987和科农199的有效筛选浓度分别为75 mg·L-1和125 mg·L-1;对以轮选987为受体材料的转bar基因小麦植株的有效筛选浓度为100 mg·L-1,该浓度可用于针对此类转基因材料的大规模筛选。
小麦;转基因;除草剂;bar基因;有效浓度
小麦是世界上重要的粮食作物之一,分布范围广,种植面积大,关系到经济和社会稳定发展。因此,培育具有高产、优质、抗病、抗逆等优良性状的小麦品种具有重要意义。在基因水平操控和定向改良方面,转基因技术明显优于传统育种方式,是改良植物抗病、抗虫、抗除草剂、抗旱以及其它重要农艺性状的一个有力工具。自1992年Vasil等利用基因枪转化技术获得世界上第一例转基因小麦植株至今[1],小麦遗传转化技术经过不断改进已日趋成熟,基因工程育种逐渐成为小麦品种改良的主要补充手段[2-5]。目前,全球转基因作物面积达到1.7×108hm2[6]。
筛选标记基因可以为获得真正的转化体提供有利的判断依据,在植物遗传转化过程中发挥着至关重要的作用。筛选标记的选用不仅关系到获得转基因植株的效率,也关系到转基因材料的安全性评价和后续产业化进程[7,8]。目前在植物遗传转化中广泛应用的标记基因有抗抗生素基因和抗除草剂基因,均属于传统的选择标记基因,其成熟的技术体系和广泛的适用性,使得转化工作能够更加顺利地开展。
小麦遗传转化常用的筛选标记基因主要有bar、nptII、hpt等基因。其中,bar基因编码的草丁膦乙酰转移酶PAT蛋白赋予植物细胞对Bialaphos等(活性成分为PPT)除草剂的抗性,nptII或aphA基因编码的新霉素磷酸转移酶基因使植物细胞获得对氨基糖苷类抗生素如卡那霉素(Kanamycin)、G418(Geneticin)、巴龙霉素(Paromomycin)的抗性,hpt基因编码的潮霉素磷酸转移酶赋予植物细胞潮霉素(Hygromycin)抗性。
bar基因是一种抗除草剂基因,是目前使用最多的选择标记基因之一[9]。它编码的蛋白能使筛选培养基中的草丁膦自由氨基乙酰化,消除草丁膦对转基因植物细胞的毒害作用。此外,草丁膦在土壤中易被土壤微生物快速分解,不会对环境和人畜造成毒害。该筛选体系快速、简便、高效,细胞产生的假转化体少,并且使植物获得抗除草剂的农艺性状[10,11],在当下转基因作物的种植面积中占有相当大的比重。
筛选标记基因在植物遗传转化中具有极为重要的作用,使用这类基因可大大减少工作量,能够方便快捷的区分转化细胞和非转化细胞。关于筛选标记基因的检测,目前常用PCR[12-14]、Southern杂交[15]等分子手段鉴定。随着规模化转基因工作的开展,大量候选转基因植株需要及时准确的鉴定,因此,需要探明一种快速、高效、准确的检测方法。本研究拟通过对转bar基因小麦植株叶片涂抹不同浓度的除草剂,以期获得能够有效鉴定转基因植株的除草剂浓度。
1 材料与方法
1.1小麦材料
本实验所用的非转基因小麦材料为小麦国审品种—轮选987和科农199;所用的转基因材料为以轮选987受体的3个转bar基因小麦株系,编号为B1、B2、B3等3个株系。转化方法为农杆菌介导法。所有实验材料均于2014年10月份种植于山东农业大学网室。
1.2实验方法
分别配制浓度为50 mg·L-1、75 mg·L-1、100 mg·L-1、125 mg·L-1和150 mg·L-1的草铵膦溶液(美国Sigma公司)并涂抹非转基因小麦植株;50 mg·L-1、75 mg·L-1、100 mg·L-1、125 mg·L-1、150 mg·L-1、200 mg·L-1和250 mg·L-1的草铵膦溶液涂抹转基因小麦植株。用棉签蘸取相应浓度的草铵膦溶液涂抹拔节期的小麦叶片,涂抹位置选择生长节位和叶面积基本一致的叶片中部,并保证涂抹面积一致。
涂抹时间于下午16:00~18:00进行。涂抹72 h后调查叶片表型。
1.3基因组提取及PCR鉴定
利用CTAB法提取转基因小麦T3代植株和非转基因小麦植株的基因组DNA。根据bar基因序列设计特异引物。上游引物序列为:CGGTCTGCACCATCGTCAACCACT;下游引物序列为:GAAACCCACGTCATGCCAGTTCCC(生工生物工程(上海)股份有限公司合成)。PCR扩增体系为:1 μL DNA模板(200 ng μL-1),2 μL上游引物(5 μmol μL-1),2 μL下游引物(5 μmol μL-1),10 μL 2×Trans Diect PCR SuperMix(天根生化科技(北京)有限公司),加ddH2O将总体积补充至20 μL。扩增条件为:94℃预变性5 min;94℃变性50 s,60℃退火50 s,72℃延伸40 s,循环32次;72℃延伸10 min。PCR扩增时以阳性质粒作为阳性对照、非转基因小麦植株的基因组DNA为阴性对照。
2 结果与分析
2.1不同浓度草铵膦对非转基因小麦叶片的影响
在非转基因小麦叶片上涂抹50 mg·L-1、75 mg·L-1、100 mg·L-1、125 mg·L-1、150 mg·L-15种不同浓度的草铵膦溶液,3 d后观察并统计实验结果(表1)。
由表1和图1可知,75 mg·L-1草铵膦涂抹轮选987叶片,涂抹部位叶色由绿色变为黄色,与未涂抹部位有明显差异(图1A),可作为有效筛选浓度;科农199在草铵膦浓度为125 mg·L-1时,叶色明显由绿色变黄色(图1B)。

表1 不同浓度草铵膦涂抹非转基因小麦植株叶片的结果统计Table 1 Statistics of non-transgenic wheat leaves painted different concentrations of herbicide

图1 小麦叶片涂抹草铵膦72 h后的表型观察Fig.1 Phenotype of wheat leaves painted with glufosinate-ammonium for 72 h
2.2不同浓度草铵膦对转基因小麦植株的影响
由于转基因材料为转bar基因小麦植株,我们首先对5个T3代转基因株系进行了PCR鉴定(图2),发现bar基因均已整合到小麦基因组中。结合轮选987草铵膦涂抹实验得出75 mg·L-1为有效筛选浓度,设置了50 mg·L-1、75 mg·L-1、100 mg·L-1、125 mg·L-1、150 mg·L-1、200 mg·L-1、250 mg·L-17个浓度梯度。选取株系3、4、5(编号B1,B2,B3)的T4代转基因植株和非转基因植株的叶片涂抹不同浓度的草铵膦,观察表型(图1C和图1D),并统计实验结果(表2)。

图2 T3代转基因小麦株系PCR鉴定Fig.2 PCR detection of T3 transgenic wheat
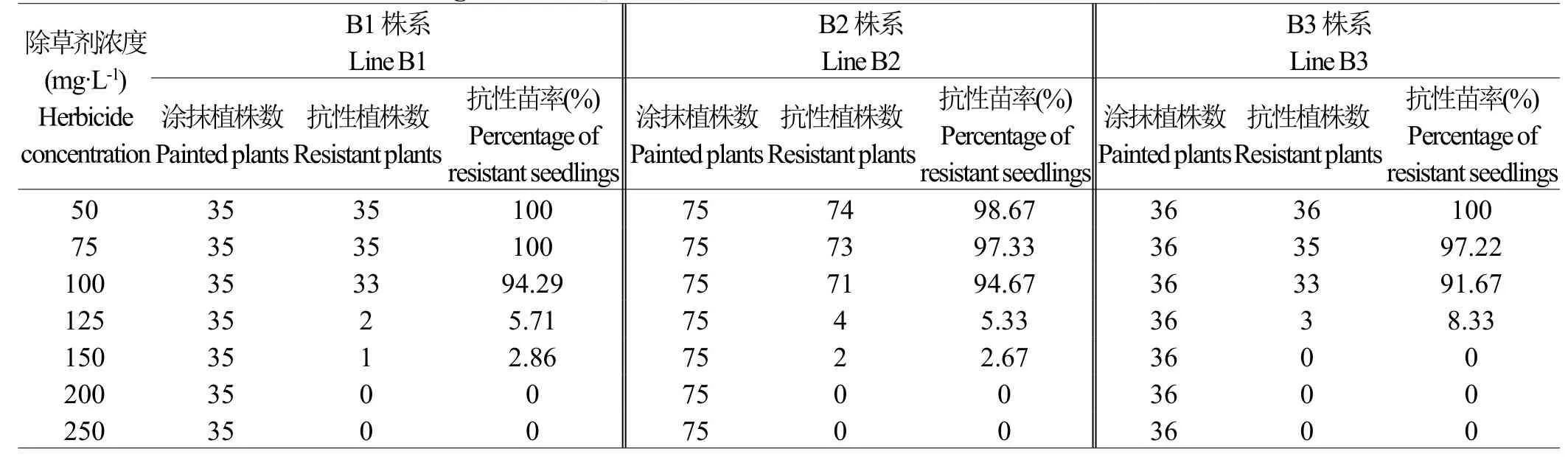
表2 不同浓度草铵膦涂抹转基因小麦植株的统计结果Table 2 Statistics of transgenic wheat plants painted with different concentrations of glufosinate-ammonium
由表2可知,B1、B2、B3转基因株系在涂抹草铵膦浓度为100 mg·L-1时,几乎所有植株均具有除草剂抗性;125 mg·L-1浓度时,抗性苗率不超过10%;高于150 mg·L-1浓度时,几乎无抗性苗存活。结合轮选987有效筛选浓度为75 mg·L-1,表明在100 mg·L-1浓度时,草铵膦涂抹实验可以有效区分小麦植株是否为转基因植株。
3 讨论
随着作物转基因工作的大规模开展,转基因植株的鉴定工作量急剧增大,且时间较为集中。相比于PCR检测、Sourthern杂交等分子生物学手段,除草剂涂抹实验具有操作简单、价格低廉、高效快速等优势。
轮选987和科农199作为两种不同的非转基因材料(转化受体材料),对除草剂的敏感性有差异,我们推测其它的各种小麦受体材料可能对除草剂敏感性亦有差异。在实验鉴定过程中,如需涂抹除草剂,应先对受体材料进行预实验,确定最低有效筛选浓度后,再进行转基因材料的除草剂涂抹试验及浓度确定。
本研究中,以轮选987为受体的多个株系的有效筛选浓度基本一致,均为草铵膦100 mg·L-1,这一浓度低于李欣等[16]在叶片涂抹200 mg·L-1Liberty的浓度,推测可能与实验所用除草剂有效浓度及处理时的天气条件等有关。同时,本研究所用小麦转基因株系为农杆菌侵染法所得,该转化方法获得的转基因植株中bar基因多为单拷贝插入,故对除草剂敏感性基本一致。对于基因枪轰击法获得的小麦转基因植株,可能会由于bar基因在不同转化事件中拷贝数的差异,导致植物体内草丁膦乙酰转移酶PAT蛋白的表达量不一致,对除草剂抗性会在有效浓度基础上有所提高。
4 结论
本研究通过对小麦转化的受体材料——轮选987和科农199,即非转基因小麦植株的叶片涂抹不同浓度的除草剂溶液(草铵膦),确定75 mg·L-1可有效筛选轮选987,125 mg·L-1有效筛选科农199。对于转bar基因小麦植株(轮选987为受体材料),结果表明100 mg·L-1浓度为有效筛选浓度。研究结果对以轮选987为受体的小麦转基因植株的快速筛选具有一定的参考价值。
[1]Vasil V,Castillo A,Fromm ME,et al.Herbicide resistant fertile transgenic wheat plants obtained by microprojectile bombardment of regenerable embryogenic callus[J].Nat Bio/Technol,1992,10(6):667-674
[2]别晓敏,佘茂云,杜丽璞,等.植物多基因转化研究进展[J].中国农业科技导报,2010,4:18-23
[3]万建民.我国转基因植物研发形势及发展战略[J].生命科学,2011,2(23):157-167
[4]叶兴国,陈明,杜丽璞,等.小麦转基因方法及其评述[J].遗传,2011,33(5):422-430
[5]阳力.转基因农作物的研究进展[J].生物技术世界,2012,5:31-32,35
[6]James C.Global status of commercialized biotech/GM crops[M].Ithaca,New York,USA:ISAAA,2013:46
[7]郭倩倩,孙熙森,唐益雄,等.新型筛选标记磷酸甘露糖异构酶基因在转基因植物中的应用[J].中国农业科技导报,2011,13(6):12-19
[8]周岩,游建.植物基因工程——标记基因的安全利用[J].生物技术通报,2012(7):7-13
[9]唐安军,龙春林,刀志灵.种子休眠机理研究概述[J].云南植物研究,2004,26(3):241-251
[10]王相春,程在全,曾千春,等.植物筛选标记基因应用进展[J].安徽农业科学,2011,39(22):13290-13291,13365
[11]刘洪艳,弭晓菊,崔继哲.bar基因、PAT蛋白和草丁膦的特性与安全性[J].生态学杂志,2007,26(6):938-942
[12]段武德.转基因植物检测[M].北京:中国农业出版社,2009
[13]郭斌,祁洋,尉亚辉.转基因植物检测技术的研究进展[J].中国生物工程杂志,2010,30(2):120-126
[14]李亚南,高俨,张艳,等.转基因植物核酸检测策略与体外扩增技术研究进展[J].生物技术通报,2012(10):52-62
[15]刘禄,牛焱焱,雷昊,等.基于地高辛标记对小麦进行Southern杂交分析主要影响因素的优化和验证[J].植物遗传资源学报,2012,13(2):182-188
[16]李欣,杜丽璞,殷桂香,等.转bar基因小麦和非转基因小麦抗除草剂鉴定方法比较[J].植物遗传资源学报,2012(13):596-600
Study on the Effective Concentration of Herbicide Screening for Transgenic Wheat
LI Yi,WANG Yue,WANG Jian,ZHAO Xiang-yu,WANG Fang,BIE Xiao-min*
College of Life Sciences,State Key Laboratory of Crop Biology/Shandong Agricultural University,Tai'an 271018,China
The selection marker gene was widely used to detect and identify transgenic plants in biotechnological breeding of crops.For detection of selection marker genes,the molecular techniques such as Polymerase-Chain-Reaction(PCR)and Southern blot were generally applied.However,with the rapid progress of genetic transformation of crop species,a large number of transgenic plants need to be identified timely and usually,bar was designed as the marker gene.The method painting herbicide(glufosinate-ammonium)on leaf has the advantage of quickness and effectiveness for verifying transformation.The results showed that in wheat varieties Lunxuan 987 and Kenong199,the effective selection concentrations of herbicide were 75 mg·L-1and 125 mg·L-1,respectively.Further,the effective selection concentrations of herbicide were 100 mg·L-1for detecting the activity of bar protein when Lunxuan 987 was transformed as the donor plant,suggesting this concentration of glufosinate-ammonium might be suitable for large scale detection.
wheat;transgenosis;Herbicide;bar gene;effective concentration
Q786
A
1000-2324(2016)05-0664-04
2015-10-14
2015-11-16
泰安市大学生科技创新行动计划项目(2014D027)
李艺(1991-),女,本科生.E-mail:18706380053@163.com
Author for correspondence.E-mail:biexm@sdau.edu.cn

