毛细管电泳电化学发光检测香草扁桃酸和高香草酸
杨洋,孙雪梅,李传龙
(青岛科技大学 化学与分子工程学院 生态化工教育部重点实验室,山东 青岛 266042)
毛细管电泳电化学发光检测香草扁桃酸和高香草酸
杨洋,孙雪梅,李传龙
(青岛科技大学 化学与分子工程学院生态化工教育部重点实验室,山东 青岛266042)
利用毛细管电泳电化学发光(CE-ECL)法检测了尿样中的香草扁桃酸(VMA)和高香草酸(HVA),得到了最佳的分离检测条件:50 mmol/L磷酸盐缓冲溶液(pH 8.2);分离电压16 kV;检测电势1.2 V(相对于饱和甘汞电极).在最佳条件下,VMA和HVA的浓度检测限(S/N=3)分别为5.0×10-7mol/L和6.1×10-7mol/L,线性回归系数分别为0.999 3和0.997 9.并以此方法将尿液中的VMA和HVA在10 min内有效地分离检测,不受其他干扰,得到加标回收率分别为98%和99%,取得了满意的结果.
毛细管电泳;电化学发光检测;香草扁桃酸;高香草酸
香草扁桃酸(vanilla mandelic acid,VMA)和高香草酸(homovanillic acid,HVA)是人体内神经递质儿茶酚胺的主要终末代谢产物,儿茶酚胺由肾上腺髓质、交感神经、中枢神经系统内的激素通过生物合成而得,这2种产物可以作为神经母细胞瘤和嗜铬细胞瘤的肿瘤标记物,大约有90%的患者尿液中VMA和HVA的含量都会升高[1],因此,检测尿中VMA 和HVA对2种细胞瘤早期诊断及病情监测有着重要的临床意义.对于VMA或HVA的检测前人做了大量的工作,传统的检测方法主要有重氮法[2]、微柱法[3]、层析法[4]等,但这些方法过程繁琐,易受外界干扰,所以很难用于临床检测.高效液相色谱法对于尿液中HVA和VMA 的检测具有可靠性强、特异性高、准确性好等优点,但是因为其仪器设备特殊,并且价格昂贵,所以难以广泛应用于临床[5].毛细管电泳作为一种新型的有效的分离分析技术,具有分析速度快、分辨率高、试样消耗量小等优点.电化学发光检测选择性好、灵敏度高、线性范围宽,经常与毛细管电泳技术相结合来达到更低的检测限,目前已广泛应用于医药科学、生命科学、分子生物学[6-8]等多个领域.国内虽然有关于用毛细管电泳来检测尿液中神经递质的代谢产物的报道,但是要预处理样本,操作比较麻烦[9].本文结合了毛细管电泳与电化学发光检测技术,建立了一种能够简单快速分离检测尿样中VMA和HVA的方法.
1 实验部分
1.1仪器与试剂
MPI-A型毛细管电泳电化学发光检测仪(西安瑞迈分析仪器有限责任公司);KQ-500B型超声波清洗器(昆山市超声仪器有限公司);三电极体系由自制的碳纤维簇微盘电极(工作电极)、饱和甘汞电极(参比电极)、铂丝电极(辅助电极)组成.弹性石英毛细管(60 cm×25 μm I.D.,375 μm O.D.)(河北永年光导纤维厂);香草扁桃酸标准品,高香草酸标准品,美国Sigma公司;磷酸二氢钠,磷酸氢二钠,市售分析纯试剂;三联吡啶钌.
1.2实验方法
实验中CE分离系统和ECL检测池的俯视图同参考文献[10],简单地说,由高压电源在毛细管两端提供高压(0~30 kV),毛细管两端插在存有缓冲液的检测池中,在进样端施加高压,检测池采用的三电极体系为:碳纤维素微盘电极(工作电极),其制作过程同文献[11],饱和甘汞电极(参比电极),铂丝电极(辅助电极).把工作电极固定在检测池上,在三维显微镜下将毛细管与工作电极间的距离调节为80~100 μm,将1.2 V作为检测电势,进样方式为12 kV下电迁移进样10 s.当毛细管内电渗流达到恒定值后开始进样并记录电泳图.
2 结果与讨论
2.1香草扁桃酸和高香草酸电化学发光行为
采用循环伏安法,在含有5.0×10-3mol/L Ru(bpy)32+的50 mmol/L pH 为8.2的NaH2PO4-Na2HPO4缓冲溶液中进行循环伏安扫描,得到如图1a所示的电化学发光强度谱图,在上述条件下分别加入VMA和HVA,循环伏安扫描所得的相应的电化学发光谱图,如图1b、c所示.
图1曲线a反应出,Ru(bpy)32+溶液本身在这种实验条件下电化学发光强度不是很明显.但随着VMA和HVA的加入,Ru(bpy)32+的电化学发光信号明显增强(图1b,c),说明了VMA和HVA可以与Ru(bpy)32+相互作用,产生比较强的发光信号,因此,本实验可通过加入Ru(bpy)32+采用电化学发光的方法来检测VMA和HVA.

a.Ru(bpy)32+;b.Ru(bpy)32++VMA;c.Ru(bpy)32++HVA.图1 电化学发光曲线Fig.1 Curves of the ECL emission
2.2VMA与HVA分离条件的选择
2.2.1缓冲溶液种类的选择
缓冲溶液的成分直接影响毛细管内的电渗流和待测组分的迁移及最后的分离效果,实验考察了硼酸盐和磷酸盐缓冲体系,结果得出,在磷酸盐缓冲体系中,样品峰形好,基线平稳,因此选择磷酸盐作为电泳缓冲溶液.
2.2.2缓冲溶液pH值的选择
在50 mmol/L不同pH值的NaH2PO4-Na2HPO4缓冲体系中分别检测VMA和HVA,得到2种物质电化学发光强度与pH值的关系,见图2.由图2可知,当缓冲液pH为8.2时,2物质的电化学发光强度均最大,因此选择缓冲液的pH为8.2.
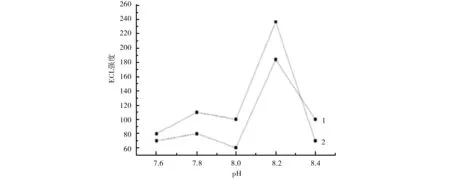
1.VMA;2.HVA.图2 电化学发光强度随缓冲液pH变化的曲线Fig.2 Curves of ECL intensity along with the change of the buffer pH
2.2.3缓冲液浓度的选择
在不同浓度磷酸盐(pH为8.2)的条件下分别检测了VMA和HVA,所得的电化学发光强度以及迁移时间tm随缓冲溶液浓度cB的变化曲线如图3所示.综合考虑2种物质的电化学发光强度以及背景噪音和迁移时间的因素,采用NaH2PO4-Na2HPO4的浓度为50 mmol/L做为实验条件.

a.化学发光强度曲线;b.迁移时间曲线;1.VMA;2.HVA.图3 化学发光强度和迁移时间随缓冲液浓度变化的曲线Fig.3 Curves of ECL intensity and tm along with the change of the buffer concentration
2.2.4分离电压的选择
在不同分离电压US下,对VMA和HVA分别进行检测,图4为电化学发光强度和迁移时间tm随分离电压US的变化曲线.综合考虑被测组分的分离度、基线噪音、分析时间等因素,选择了16 kV作为分离电压.
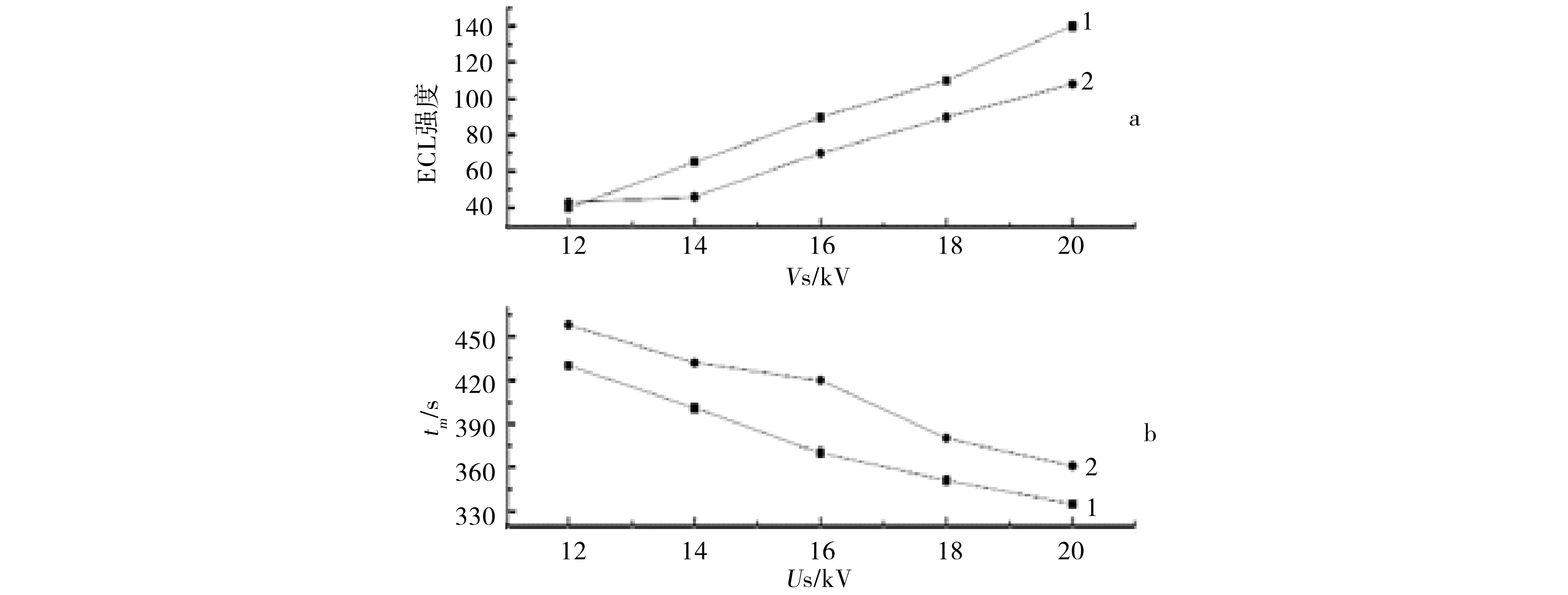
a.化学发光强度曲线;b.迁移时间曲线;1.VMA;2.HVA.图4 化学发光强度与迁移时间随Us变化的曲线Fig.4 Curves of ECL intensity and tm along with the change of Us
2.2.5检测电势的选择
在不同检测电势Ed下,对VMA和HVA分别进行检测,得到检测电势与电化学发光强度关系如图5所示.由图5可看出,VMA和HVA的电化学发光强度随检测电势的增大而增强,但噪音信号也随之呈上升趋势,导致基流不稳,为保证检测的灵敏度与较好的信噪比,故选择1.2 V作为检测电势.
2.2.6Ru(bpy)32+的浓度的选择
在不同浓度的Ru(bpy)32+的磷酸盐缓冲溶液中,分别检测2种物质,得到VMA和HVA的发光强度随缓冲液中Ru(bpy)32+的浓度变化规律如图6所示.综合考虑2组分的分离度和基线噪音等因素,故选择5.0 mmol/L作为Ru(bpy)32+检测分离组分的最佳浓度.
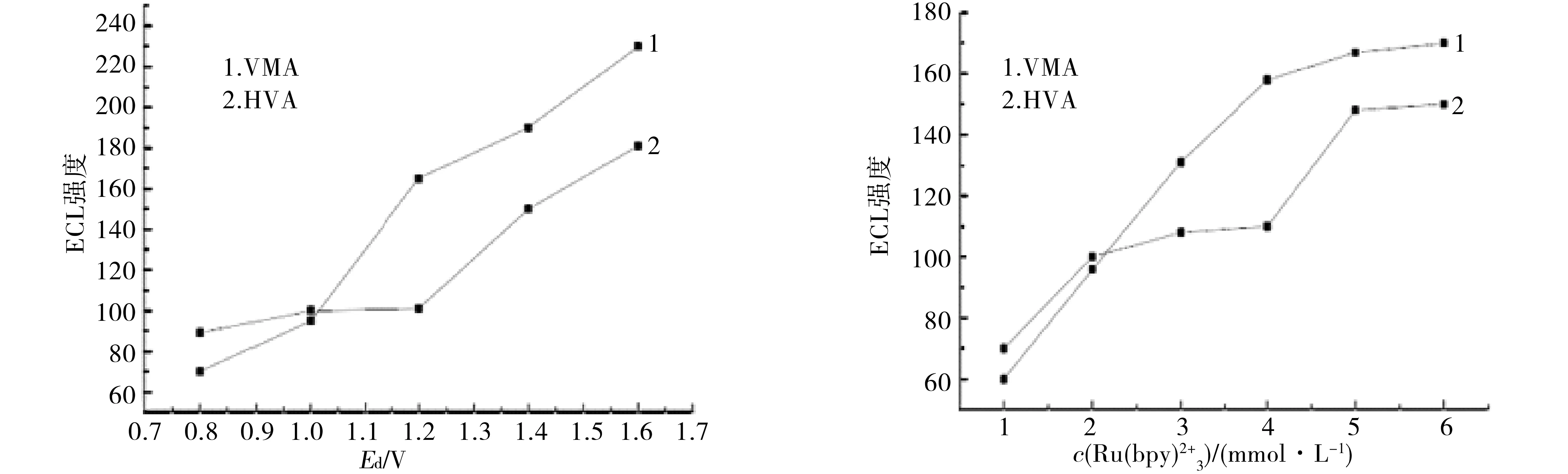
图5 化学发光强度随电势Ed变化的曲线图6 化学发光强度随Ru(bpy)32+浓度变化的曲线Fig.5 Curves of ECL intensity of along withFig.6 Curves of ECL intensity of along with the the change of Ed change of Ru(bpy)32+ concentration
本实验确定了分离检测VMA和HVA的最佳条件为50 mmol/L pH 8.2的磷酸盐缓冲溶液、初始电位为1.2 V、16 kV下电迁移进样10 s、发光剂Ru(bpy)32+的浓度为5.0 mmol/L.在最优条件下,通过电化学发光来检测浓度均是1.0×10-5mol/L 的2待测物的标准混合液,电化学发光强度随迁移时间变化的谱图如7所示,可以看出,VMA和HVA已经有效分离.
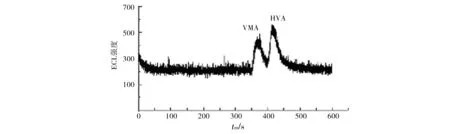
图7 VMA与HVA混合标准溶液的电泳Fig.7 Electropherogram of the standard mixture solution of VMA and HVA
2.3重现性、线性范围及检测限
配一系列2组分的混合标准液(浓度范围1.0×10-6~1.0×10-3mol/L),在上述最优条件下,测定待测物的电化学发光强度I与浓度的关系,考察了各组分的线性范围,得出2组分的线性回归方程,并以信噪比为3时得到检测下限,结果如表1.
在最优条件下,连续检测6次浓度均是1.0×10-5mol/L的2组分的混合标准溶液,得到峰高的相对标准偏差(RSD)为2.7%(VMA)和3.1%(HVA),以及迁移时间的RSD为1.1%(VMA)和0.9%(HVA).

表1 VMA与HVA的线性范围和检测下限Tab.1 Linear ranges and the LOD of VMA and HVA
2.4样品的检测及回收率实验
准确取10 mL成人尿液标准样品,将浓度均为1.0×10-5mol/L的VMA与HVA的标准混合液用尿液标准样品稀释10倍,得到样品混合液.在以上优化条件下对样品混合液进行检测,得到电化学发光强度谱图如下,2待测物在10 min内被有效地分离与检测.
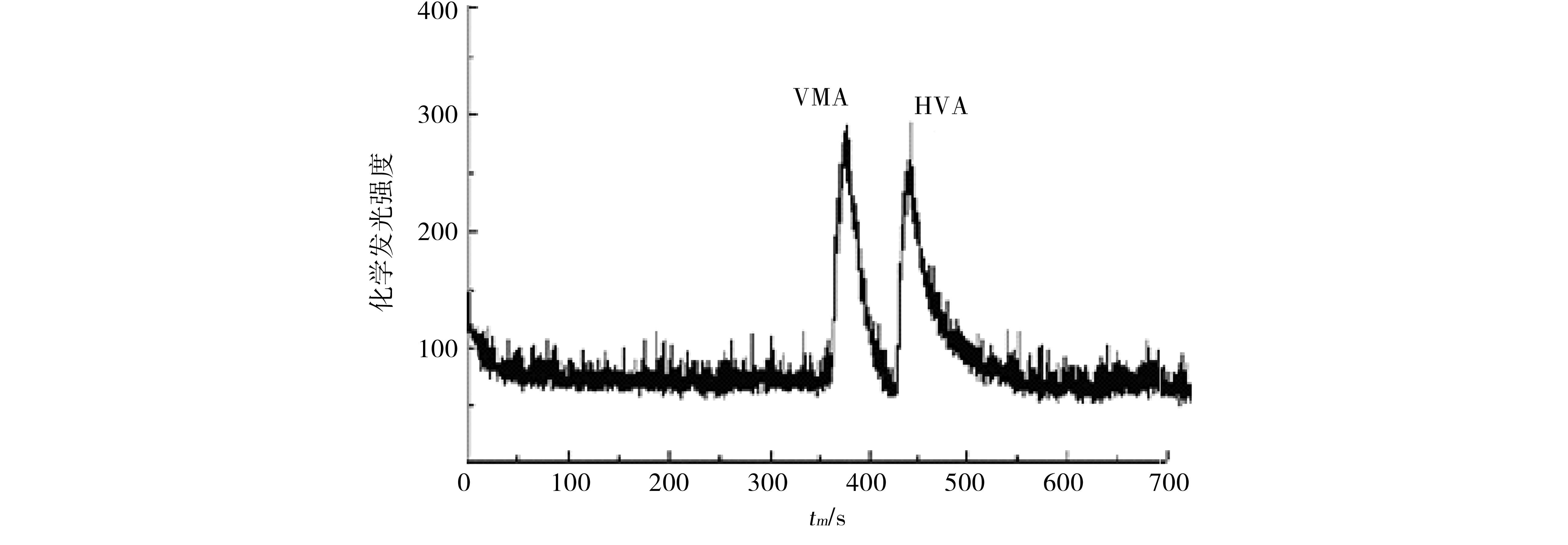
图8 尿样中VMA与HVA的电泳谱Fig.8 Electropherogram of VMA and HVA in urine
在最佳条件下的回收率实验采用标准加入法,结果如表2,VMA和HVA的加标回收率分别为98%和99%,上述结果表明,本方法简单快速,灵敏度很高,给尿液中的2物质的分离与检测提供了一种可靠易行的方法.

表2 加标回收率的结果 (n=5)Tab.2 Results of recovery (n=5)
3 结论
采用毛细管电泳电化学发光检测法分离并检测了尿液中的VMA和HVA,得到最佳检测条件.在此条件下,VMA与HVA的浓度检测限分别为5.0×10-7mol/L和6.1×10-7mol/L,其加标回收率分别为98%和99%,此方法设备简单,快速易行,2被测物在10 min内有效地分离与检测,且无干扰,结果准确可靠,笔者期望在以后的临床医学中能够得到实际应用.
[1]SADILKOVA K,DUGAW K,BENJAMIN D,et al.Analysis of vanillylmandelic acid and homovanillic acid by UPLC-MS/MS in serum for diagnostic testing for neuroblastoma[J].Clinica Chimica Acta,2013,424:253-257.DOI:10.1016/j.cca.2013.06.024.
[2]许育丹.重氮法和微柱比色法检测尿液香草扁桃酸的方法比较[J].实用医技杂志,2005,12(03A):578-579.
[3]陈曼娜,廖瑛.微柱比色法检测尿液VMA含量的评价[J].现代检验医学杂志,2003,18(1):14-15.
CHEN Manna,LIAO Ying.To envalue the way of using micro-column chromatography determine VMA in the urine[J].Journal Of Modern Laboratory Medicine,2003,18(1):14-15.
[4]TOKUDA T,TOKIEDA T,ANAZAWA A,et al.Simultaneous determination of vanillylmandelic acid,homovanillic acid and creatinine in urine by reversed-phase ion-pair chromatography[J].Journal of Chromatography B:Biomedical Sciences And Applications,1990,530:418-423.DOI:10.1016/s0378-4347(00)82344-0.
[5]张华,李永兴.高效液相电化学法检测尿儿茶酚胺和VMA诊断嗜铬细胞瘤[J].现代检验医学杂志,2003,18(3):8-9.
ZHANG Hua,LI Yongxing.Urinary catecholamines and VMA measured by high performance liquid chromatography(HPLC)-electrochemical detector (ECD) for diagnosis of pheochromocytoma[J].Journal of Modern Laboratory Medicine,2003,18(3):8-9.
[6]DENG Biyang,SU Caina,KANG Yanhui.Determination of norfloxacin in human urine by capillary electrophoresis with electrochemiluminescence detection[J].Analytical And Bioanalytical Chemistry,2006,385(7):1336-1341.DOI:10.1007/s00216-006.
[7]AN Dong,CHEN Zhuqiu,ZHENG Jiachun,et al.Determination of biogenic amines in oysters by capillary electrophoresis coupled with electrochemiluminescence[J].Food Chemistry,2015,168:1-6.DOI:10.1016/j.foodchem.2014.07.019.
[8]LI Jianguo,YAN Qinyi,GAO Yunlong,et al.Electrogenerated chemiluminescence detection of amino acids based on precolumn derivatization coupled with capillary electrophoresis separation[J].Analytical Chemistry,2006,78(8):2694-2699.DOI:10.1021/ac052092m.
[9]高萍,徐佳,孙玉倩,等.毛细管电泳检测尿儿茶酚胺代谢产物及在诊断嗜铬细胞瘤中的应用[J].哈尔滨医科大学学报,2008,42(5):511.
GAO Ping,XU Jia,SUN Yuqian,et al.Determination of urine catecholamine metabolic products by capillary electrophoresis for diagnosis of pheochromocytoma[J].Journal Of Harbin Medical University,2008,42(5):511.
[10]JIN Wenrui,WENG Qianfeng,WU Jianren.Determination of bovine serum albumin by capillary zone electrophoresis with end-column amperometric detection at the carbon fiber microdisk array electrode[J].Analytica Chimica Acta,1997,342(1):67-74.DOI:10.1016/s0003-2670(96)00530-2.
[11]JIN Wenrui,YU Daiqing,DONG Qian,et al.A new method of quantification of pipemidic acid by capillary zone electrophoresis with end-column amperometric detection[J].Electrophoresis,2000,21(5):925-929.
(责任编辑:梁俊红)
Determination of vanilla mandelic acid and homovanillic acid based on capillay electrophoresis combinated with electrochemiluminescence detection
YANG Yang,SUN Xuemei,LI Chuanlong
(Key Laboratory of Eco-chemical Engineering,Ministry of Education,College of Chemistry and Molecular Engineering,Qingdao University of Science and Technology,Qingdao 266042,China)
Vanilla mandelic acid(VMA) and homovanillic acid(HVA) in the urine were detected by capillary electrophoresis with electrochemiluminescence detection(CE-ECL).The following conditions were suitable for the determination of VMA and HVA:running buffer,50 mmol/L NaH2PO4-Na2HPO4(pH=8.2);separation voltage,16 kV;detection potential,1.2 V(vs.saturated calomel electrode (SCE)).Under the optimum conditions of detection,satisfactory sensitivities (LOD of 5.0×10-7mol/L for VMA and 6.1×10-7mol/L for HVA at S/N=3) were obtained,the correlation coefficients of the method were 0.999 3 and 0.997 9,respectively.The determination of these metabolites in human urine was completed within 10 min without any interferences,the recoveries were VMA 98% and HVA 99%,the result obtained is satisfactory.
capillary electrophoresis;electrochemiluminescence detection;vanilla mandelic acid;homovanillic acid
10.3969/j.issn.1000-1565.2016.03.007
2015-08-23
山东省自然科学基金资助项目(ZR2009BM029)
杨洋(1990—),女,河北沧州人,青岛科技大学在读硕士研究生.E-mail:1193428612@qq.com
孙雪梅(1967—),女,山东青岛人,青岛科技大学副教授,主要从事毛细管电泳研究.E-mail:2634702755@qq.com
O657.8
A
1000-1565(2016)03-0257-07

