甘草酸18位差向异构体不同配比和浓度对Caco-2细胞P-gp功能的影响
赵燕燕,孙东,刘丽艳,柳亚飞,王静
( 1.河北大学 化学与环境科学学院,河北 保定 071002;2.河北大学 药学院,河北 保定 071002;3.河北大学 医学实验中心,河北 保定 071000)
甘草酸18位差向异构体不同配比和浓度对Caco-2细胞P-gp功能的影响
赵燕燕1,2,孙东1,刘丽艳3,柳亚飞1,王静1
( 1.河北大学 化学与环境科学学院,河北 保定071002;2.河北大学 药学院,河北 保定071002;3.河北大学 医学实验中心,河北 保定071000)
研究甘草酸18位差向异构体18α-甘草酸(18α-Gly)与18β-甘草酸(18β-Gly)不同配比和浓度对结肠癌(Caco-2)细胞P-糖蛋白(P-gp)功能的影响,选择最佳浓度比例.建立细胞模型,选择甘草酸总浓度为1∶10∶30∶60∶120∶240 μmol/L,18α-Gly与18β-Gly物质的量比分别为10∶0、8∶2、6∶4、5∶5、4∶6、2∶8、0∶10,根据细胞存活率,选择合适浓度比例,利用流式细胞仪测定细胞内荧光强度,寻找荧光强度最大的浓度比,即对P-gp抑制作用最强,P-gp功能最弱.研究结果表明甘草酸总浓度为1 μmol/L时,随着18α-Gly比例的减少,荧光强度逐渐减弱,P-gp诱导作用逐渐增加.甘草酸总浓度为10 μmol/L和60 μmol/L时,随着两者物质的量比的变化,荧光强度变化明显;当总浓度为10 μmol/L,n(18α-Gly)∶n(18β-Gly)=4∶6时,荧光强度较强,抑制作用明显;当总浓度为60 μmol/L,两者物质的量比为5∶5时荧光强度最强,抑制作用最强.
18α-甘草酸;18β-甘草酸;P-糖蛋白功能;Caco-2细胞;不同配比/浓度
甘草是一味重要的传统中草药,甘草酸是甘草中最主要的活性成分,具有解毒、消炎、抗病毒、抗癌、免疫调节、降血脂等多方面药理作用[1].18位H的立体构型不同,使甘草酸存在2种差向异构体,即18α-甘草酸(18α-glycyrrhizin,18α-Gly)和18β-甘草酸(18β-glycyrrhizin,18β-Gly).两者空间构型存在微小差异,但在药理学、药效学、药代动力学及不良反应等方面却有着显著不同[2].近年来,其在抗SARS病毒[3]和抗HIV病毒[4]活性方面的重要作用,使得18α-Gly和18β-Gly的比较研究越来越受到国内外研究者的关注[5-9].
P-糖蛋白(P-glycoprotein,P-gp)是一种能量依赖性蛋白,通过转运作用降低细胞内化合物浓度,减轻了药物的不良反应,同时也降低了药物对细胞的作用,使药效降低,产生耐药现象[10];同时,P-gp的表达水平的变化,可影响药物的吸收、分布、代谢、排泄和毒性[11].近年来研究表明,18α-Gly和18β-Gly在细胞膜上的转运表现出一定的立体选择性,对P-gp功能和表达的影响分别表现为抑制作用和诱导作用,2种异构体的影响截然相反.目前国内外在转录水平和细胞膜转运方面对甘草酸的研究,仅限于18α-Gly和18β-Gly单体分别对CYP3A表达或P-gp功能和表达的影响[12-13],尚未见不同比例的18α-Gly和18β-Gly混合物在此方面的研究.上市制剂众多,大部分制剂为18α-Gly和18β-Gly混合物,二者所占比例各不相同[5],现有各国药典及其质量标准中尚没有对2种异构体的组成比例做出规定.本实验就2种甘草酸差向异构体不同配比和浓度对Caco-2细胞P-gp功能的影响进行了研究,为新制剂的研发,临床用药选择,以及相关药物的研究与开发提供依据和新的研究思路.
1 实验部分
1.1仪器与试剂
C6流式细胞仪(美国BD公司);ELX800酶标仪(美国宝特公司);CKX41型倒置相差显微镜(日本奥林巴斯有限公司);BHC-1300ⅡA/B3超净工作台(苏州安泰空气技术有限公司);Allegar X-22R Centriguge低温高速离心机(美国BECKMAN);MCO-18AIC恒温二氧化碳培养箱(日本三洋设备有限公司);MLS-3780型高压灭菌锅(日本三洋设备有限公司);WZD-160型微量振荡器(上海创发电子科技有限公司);移液枪(美国GIBCO);25 cm2培养瓶(美国Costar Corning);75 cm2培养瓶(美国Costar Corning);96孔细胞培养板(美国Corning Costar);吸管.
Caco-2细胞(30代,购自中国武汉大学典型培养物保藏中心);胎牛血清(美国GIBCO,批号:141104);100 U/mL青-链霉素双抗(碧云天生物技术研究所,批号:423A0522);丙酮酸钠(美国MERCK,批号:HG3-1166-78);Eagle’s minimum essential medium (MEM) 培养基(美国GIBCO,批号:1460618);二甲基亚砜(DMSO)(美国Sigma-Aldrich,批号:0231);噻唑蓝(MTT)(中国药品生物制品检定所,批号:0793);罗丹明123(中国Solarbio,批号:1015A053);Hepes盐(中国Solarbio,批号:710130411);18α-Gly对照品(18α,20β-glycyrrhizic acid,ALPS制药,批号:10B001S);18β-Gly对照品(18β,20β-glycyrrhizinic acid,ALPS制药,批号:05C11S).
1.2 实验方法
1.2.1细胞培养
MEM培养基制备:取1袋MEM培养基,称取HEPES 盐2.38 g和丙酮酸钠0.11 g,用800 mL去离子水溶解稀释,磁力搅拌3 h,加入Na2CO32.00 g,加入200 mL去离子水,磁力搅拌1 h,调pH为7.2~7.4,然后用0.22 μm微孔滤器过滤除菌,分装,4 ℃保存.
胰蛋白酶制备:称取胰蛋白酶0.25 g,EDTA-Na 0.30 g,NaCl 0.8 g,KCl 0.04 g,葡萄糖0.1 g,苯酚红0.000 5 g,加入100 mL去离子水溶解,磁力搅拌2~3 h,调pH为7.8~8.0,用0.22 μm微孔滤器过滤除菌,分装,-20 ℃保存.
冻存液制备:全培养基、胎牛血清、DMSO 3者体积比为7∶2∶1.用前配制.
罗丹明123溶液配制:精确称取0.38 mg罗丹明123,用400 μL PBS溶解,备用.使用时用PBS稀释到500 μmol/L和0.550 0 μmol/L.
MTT溶液制备:称取250 mg MTT,溶于50 mL PBS,磁力搅拌30 min,0.22 μm微孔滤器过滤除菌,分装至1.5 mL EP管,4 ℃避光保存,保质期为2周.
细胞培养及形态学观察:Caco-2细胞以2×105/mL接种于25 cm2的细胞培养瓶中,加入体积分数10% FBS的MEM培养基6 mL和0.1 U/L青霉素-链霉素双抗.将细胞置于37 ℃、体积分数5%CO2的培养箱中培养2 d,细胞换液,在第4天,细胞长到80%~90%时,用质量分数0.1%的胰蛋白酶消化并传代,当细胞生长到30~50代时用于实验.
1.2.218α-Gly和18β-Gly不同配比和浓度对Caco-2细胞毒性的考察
将处于对数生长期的Caco-2细胞以2×104/mL的密度接种于96孔培养板,每孔终体积为200 μL,放入37 ℃、体积分数5%CO2的培养箱中培养24 h.18β-Gly用DMSO(终体积分数<1%)溶解,18α-Gly用MEM培养基溶解,并加入等量的DMSO,用MEM培养基稀释,使甘草酸最终总浓度均为1、10、30、60、120、240 μmol/mL,两者物质的量比为10∶0、8∶2、6∶4、5∶5、4∶6、2∶8、0∶10;将每孔培养24 h后细胞培养液吸尽,于阴性对照孔加入培养基和溶剂DMSO,实验孔加入不同配比和浓度的18α-Gly和18β-Gly混合液,每孔中DMSO含量相等;空白调零孔为不含细胞的完全培养基,放入37 ℃、体积分数5%CO2的培养箱中继续培养72 h.每孔加入5 mg/mL的MTT 20 μL,放入37 ℃、体积分数5%CO2的培养箱中继续培养4 h,终止培养,小心吸弃上清液,每孔加入150 μL DMSO,震荡10 min,使结晶物溶解.以空白对照孔调零后,测量490 nm处的吸光度(A)(实验平行重复3次).计算细胞的存活率,观察各浓度细胞的存活状况.
细胞存活率=(实验组平均吸光度值/阴性对照组平均吸光度值)×100%.
选取细胞存活率≥90%的药物配比和浓度,进行下一步非细胞毒性实验.
1.2.318α-Gly和18β-Gly不同配比和浓度对P-糖蛋白功能影响的考察
依据“1.2.2”实验结果和文献[14-15],选取18α-Gly 和18β-Gly总浓度为60、10、1 μmol/mL高中低3个浓度,在实验孔中分别加入以上3个浓度18α-Gly和18β-Gly不同配比(10∶0、8∶2、6∶4、5∶5、4∶6、2∶8、0∶10)的混合液.将处于对数生长期的Caco-2细胞用0.1 mol/L胰酶消化,用含体积分数10%胎牛血清的MEM培养基重悬为单细胞悬液,进行细胞计数,离心(4 ℃,1 500 r/min,5 min),弃上清液,用PBS分散成1×106/mL的细胞悬液,接种于2 mL的EP管中.离心(4 ℃,1 500 r/min,5 min),弃上清液,按实验分组分别在实验孔加入高中低浓度的不同配比的18α-Gly和18β-Gly混合液,将细胞置于37 ℃、体积分数5%CO2的培养箱中培养60 min.置冰上终止作用(约10 min),离心(4 ℃,1 500 r/min,5 min),弃上清液,用冰冷的PBS洗2次,离心(4 ℃,2 500 r/min,5 min),弃上清液.按实验分组加入Rh-123或PBS,将细胞置于37 ℃、体积分数5% CO2的培养箱中培养60 min,置冰上终止作用(约10 min),离心(4 ℃,2 500 r/min,5 min),弃上清液,冰冷的PBS清洗2次,离心(4 ℃,1 500 r/min,5 min),弃上清液,加0.5 mL PBS轻轻吹打,制成单细胞悬液.具体分组见表1.
流式细胞仪选择F1通道,每次采集1万个细胞,检测细胞内Rh-123平均荧光强度,分析时设门以除去细胞碎片和细胞团对实验的干扰.

表1 18α-Gly与18β-Gly不同配比和浓度对P-糖蛋白功能影响分组Tab.1 Groups of the different proportion and concentration of 18α-Gly and 18β-Gly effect on P-gp function
1.2.4统计学处理
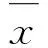
2 结果与讨论
2.1细胞培养及形态学观察
细胞传代于25 cm2培养瓶中,很快开始贴壁,48 h换液,再经48 h细胞贴壁80%~90%.在倒置相差显微镜下观察,Caco-2细胞成铺路石状镶嵌排列,形态正常,与文献报道[16]相似,见图1.
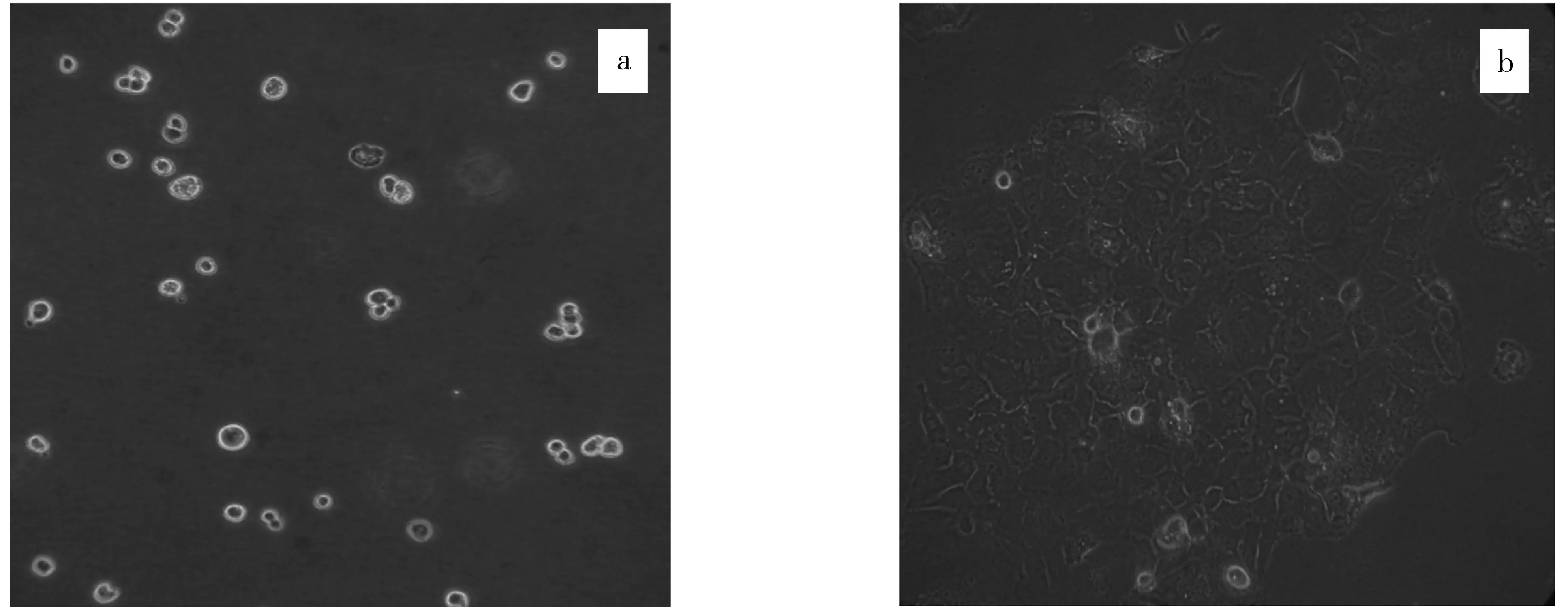
a.消化后的细胞;b.细胞形态.图1 消化后的细胞和细胞形态Fig.1 Digestion cell and the morphology cell
2.218α-Gly和18β-Gly不同配比和浓度对Caco-2细胞毒性的考察
实验分别考察了18α-Gly和18β-Gly不同配比和浓度对Caco-2细胞的毒性.结果表明,甘草酸总浓度一定时,18α-Gly和18β-Gly比例不同对细胞存活率影响不同.在7种不同配比的条件下,甘草酸总浓度在1~60 μmol/L,细胞存活率均大于90%,为非细胞毒性浓度.其中当甘草酸总浓度在1~30 μmol/L,n(18α-Gly):n(18β-Gly)=8∶2时,以及总浓度为60 μmol/L,n(18α-Gly)∶n(18β-Gly)=4∶6时,细胞总体存活率表现较高(>110%),见图2 a、b、c、d;总浓度在120~240 μmol/L内,18α-Gly和18β-Gly在7种不同配比的条件下,细胞存活率均小于90%,为细胞毒性浓度.随着浓度增加,毒性表现增强,见图2 e、f.因此选取甘草酸总浓度分别为1、10、60 μmol/L,18α-Gly和18β-Gly物质的量比分别为10∶0、8∶2、6∶4、5∶5、4∶6、2∶8、0∶10进行下一步研究.
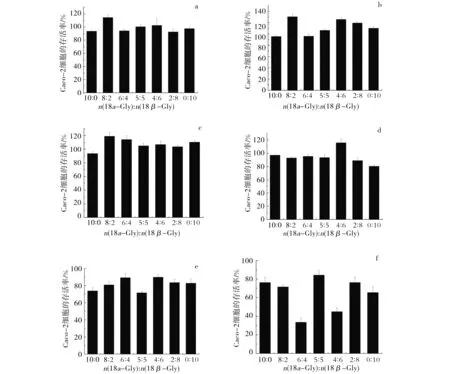
甘草酸总浓度(μmol/L)分别为a.1;b.10;c.30;d.60;e.120;f.240.图2 18α-Gly与18β-Gly不同配比和浓度对Caco-2细胞存活率的影响Fig.2 Different proportion and concentration of 18α-Gly and 18β-Gly effect on the cell survival rate
2.318α-Gly和18β-Gly不同配比和浓度对P-gp功能影响的考察
实验分别考察了18α-Gly与18β-Gly总浓度(1、10、60 μmol/L)及不同配比(10∶0、8∶2、6∶4、5∶5、4∶6、2∶8、0∶10)混合液对Caco-2细胞内P-gp转运Rh-123的影响,见表2.结果表明,18α-Gly单体浓度为10 μmol/L和60 μmol/L时,细胞内Rh-123摄取量增多,与阴性对照相比荧光强度增强,对P-gp功能表现出抑制作用;18β-Gly单体浓度为1、10、60 μmol/L时,细胞内Rh-123摄取量减少,与阴性对照相比荧光强度减弱,对P-gp功能表现出诱导作用,见图3.
甘草酸总浓度为1 μmol/L时,随着18α-Gly与18β-Gly 2种异构体比例的减小,荧光强度逐渐减弱,诱导作用逐渐增强;在浓度为10 μmol/L,二者物质的量比为4∶6时,以及浓度为60 μmol/L,物质的量比为5∶5时,荧光较强,抑制作用明显,见图3.
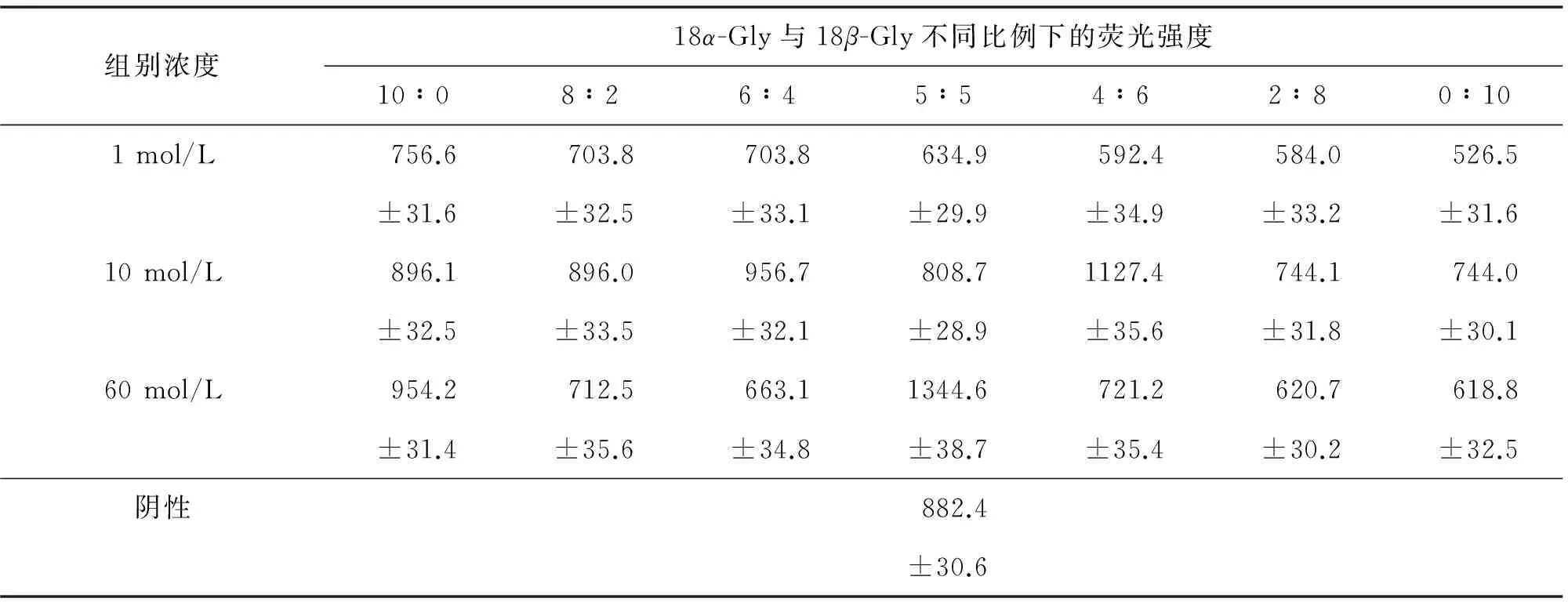
表2 18α-Gly与18β-Gly不同配比和浓度对Caco-2细胞内Rh-123荧光强度的影响(n=3)Tab.2 Different proportion and concentration of 18α-Gly and 18β-Gly effect on the fluorescence intensity of Rh-123 in Caco-2 cells (n=3)

图3 18α-Gly与18β-Gly不同配比和浓度对Caco-2细胞内Rh-123聚积作用比较Fig.3 Different proportion and concentration of 18α-Gly and 18β-Gly effect on Rh-123 accumulation compared with the control group in Caco-2 cells
甘草酸由于C18位H构型不同,存在2种立体异构体,18α-Gly为反式构型,18β-Gly为顺式构型,根据位阻效应,前者大于后者,易于受体蛋白结合,导致两者比例不同时,甘草酸的药效不同.甘草酸2个差向异构体虽然在自然界、制剂中或在体内很难发生差向异构化,但在一定的化学条件下能发生构型的改变.本实验前期工作中已经研究了不同的炮制条件对甘草药材中主成分异构体的含量及比例的影响[17],结果表明,生甘草中18α-Gly与18β-Gly的物质的量比始终为1∶7,未发现炮制条件的变化,对甘草酸2个差向异构体比例的影响.并对国内外上市的4代甘草酸制剂中主成分18α-甘草酸和18β-甘草酸进行了含量测定[5],对同一代制剂不同剂型、不同代制剂同一剂型中两差向异构体的组成比例进行了分析.结果表明,甘草酸制剂不同,18α-Gly与18β-Gly所占比例各不相同,第1代与第2代、第3代与第4代甘草酸不同剂型制剂中,18α-Gly与18β-Gly的物质的量比分别为1∶20~1∶109、3∶1~500∶1.甘草酸上市制剂众多,各制剂选用的原料药不同以及采取的制剂工艺不同,都可能会导致甘草酸制剂中主成分差向异构体组成比例的不同.
从天然产物中提取、精制18β-Gly比较简单,成本比较低,而直接合成18α-Gly成本高,多数厂家选用由前者转化的方式制造18α-Gly.目前市售的甘草酸制剂的主成分均以18α-Gly与18β-Gly混合物的形式存在,以α体占主体的第4代甘草酸制剂-异甘草酸镁,也含有少量的18β-Gly (n(18α-Gly)∶n(18β-Gly)=500∶1[5]).所以研究甘草酸18位差向异构体18α-甘草酸(18α-Gly)与18β-甘草酸(18β-Gly)不同配比和浓度对结肠癌(Caco-2)细胞P-糖蛋白(P-gp)功能的影响,对新制剂的研发和临床用药选择具有重要的意义.
P-gp可以将细胞内的药物泵出细胞外,从而降低细胞内的药物浓度,减轻细胞的毒副作用,保护机体免受外源毒素作用,这也是导致肿瘤细胞出现耐药性的重要原因.Caco-2细胞来源于人类结肠癌及直肠癌,P-gp是其中的一种主要转运蛋白.Rh-123是P-gp的特异性底物,可以用来评价P-gp的功能活性,当P-gp功能受抑制时,Rh-123从Caco-2细胞的外排量将减少.
18β-Gly甘草可以通过诱导P-gp功能以加速药物排出细胞外,起到解毒的作用,而18α-Gly对于P-gp的抑制作用,则可以减弱细胞外排,使药物在细胞内发挥最大药效.诱导和抑制作用,对于其他治疗药物的辅助作用非常大,可以使药物发挥最大药效同时,对机体的毒性降到最低,因此寻找合适的浓度比例非常重要.
本实验首先培养Caco-2细胞模型,配制甘草酸总浓度为1、10、30、60、120、240 μmol/L 6个浓度系列,18α-Gly与18β-Gly比例分别为10∶0、8∶2、6∶4、5∶5、4∶6、2∶8、0∶10,通过毒性实验,选择了1,30,60 μmol/L作为低中高3个浓度系列,用流式细胞仪测定细胞内Rh-123荧光强度,判断P-gp的功能活性,从而推断甘草酸合适的浓度比,最终得出在总浓度为60 μmol/L,n(18α-Gly)∶n(18β-Gly)=5∶5时,荧光最强,细胞的外排作用最弱,细胞内药物最多,抗药性最弱.
实验结果表明,甘草酸的作用强度及安全性与18α-Gly和18β-Gly的浓度和比例有关.通过甘草酸总浓度(1、10、60 μmol/L)及不同配比物质的量比(10∶0、8∶2、6∶4、5∶5、4∶6、2∶8、0∶10)的混合液对Caco-2细胞内P-gp转运Rh-123作用影响的比较研究,在浓度为60 μmol/L,n(18α-Gly)∶n(18β-Gly)=5∶5时,荧光强度最强,对Caco-2细胞内P-gp抑制作用最强,对于药物外排最弱,可减弱抗药性,可能是18α-GL和18β-Gly发挥最大协同作用的的最佳浓度配比.具体作用机制尚需进一步研究.
[1]ABE M,AKBAR F,HASEBE A,et al.Glycyrrhizin enhances interleukin-10 production by liver dendritic cells in mice with hepatitis[J].J Gastroenterol,2003,38(10):962-967.
[2 ]宋红波,刘茜,赵辉,等.甘草酸铵类制剂中甘草酸差向异构体的分析[J].药物分析杂志,2012,32(5):883-886.
SONG Hongbo,LIU Qian,ZHAO Hui,et al.Analysis of 2 epimers in ammonium glycyrrhizinate drugs[J].China J Pharm Anal,2012,32(5):883-886.
[3]CINML J,MORGENSTEM B,BAUER G,et al.Glycyrrhizin,all active component of liquorice roots,and replication of SARS-associated coronavirus[J].Lancet,2003,361(9374):2045-2046 DOI:10.1016/S0140-6736(03)13615-X.
[4]PLIASUNOVA OA,HONA,KISELEVA I,et al.The anti-HIV activity of glycyrrhizic acid penta-O-nicotinate[J].Vestn Ross Akad Med Nauk,2004(11):42-46.
[5]赵燕燕,石敏健,刘丽艳,等.4代甘草酸制剂主成分异构体及杂质含量差异分析与变化趋势[J].药物分析杂志,2014,34(2):247-254.
ZHAO Yanyan,SHI Minjian,LIU Liyan,et al.Analysis of content differences and variation trends of the principal component isomers and related substances in the four generations of glycyrrhizin preparations[J].Chin J Pharm Anal,2014,34(2):247-254.
[6]ZOU Q G,WEI P,LI J,et al.Simultaneous determination of 18a-and18β-glycyrrhetic acid in human plasma by LC-ESI-MS and its application to pharmacokinetics[J].Biomed Chromatogr,2009,23:54-62.
[7]杨柏灿,潘颖宜.甘草“调和”的影响因素探析[J].中成药,2013,35(1):155-156.
YANG Bocan,PAN Yingyi.Influence factors analysis of licorice “reconciliation”[J].Chinese Traditional Patent Medicine,2013,35(1):154-156.
[8]周倩,孙立立.蜜炙对甘草化学成分影响研究[J].中国药学杂志,2013,48(10):768-772.
ZHOU Qian,SUN Lili.Changes of chemical constituents in radix glycyrrhizae before and after honey processing[J].Chin Pham J,2013,48(10):768-772.
[9]席先蓉,陈庆.正交设计研究甘草蜜制工艺[J].中国中药杂志,2001,26(7):460-462.
XI Xianrong,CHEN Qing.Research of licorice honey processing with Orthogonal design[J].China Journal of Chinese Materia Medica,2001,26(7):460-462.
[10]LAURETTA M S CHAN,SIMON LOWES,BARRY H HIRST.The ABCs of drug transport in intestine and liver:efflux proteins limiting drug absorption and bioavailability[J].Eur J Pharm Sci,2004,21(1):25-51.DOI:10.1016/j.ejps.2003.07.003.
[11]LIN J H.Drug-drug interaction mediated by inhibition and induction of P-glycoprotein[j].Adv Drug Dev,2003,55:1:53.
[12]王宇光,杨明会,马增春,等.18β-甘草酸和18α-甘草酸对大鼠原代肝细胞CYP3A酶表达的影响[J].中国中药杂志,2009,34(3):307-311.
WANG Yuguang,YANG Minghui,MA Zengchun,et al.Effects of 18β-glycyrrhizic acid and 18α-glycyrrhizic acid on mRNA and protein expression of cytochrome P450 3A in cultured rat primary hepatocyte[J].China Journal of Chinese Materia Medica,2009,34(3):307-311.
[13]颜苗,李兰芳,李焕德,等.18α-甘草酸和18β-甘草酸对Caco-2细胞P-gp功能和表达的影响[J].中国中药杂志,2012,37(1):99-103.
YAN Miao,LI Lanfang,LI Huande,et al.Effect of 18α-glycyrrhizic acid and 18β-glycyrrhizic acid on P-gp function and expression in Caco-2 cells[J].China Journal of Chinese Materia Medica,2012,37(1):99-103.
[14]SUN Li,SHEN Jingfang,PANG Xiaoyun,et al.Phase I safety and pharmacokinetic study of magnesium isoglycyrrhizinate after single and multiple intravenous doses in Chinese healthy volunteers[J].J Clin Pharmacol,2007,47(6):767-773 DOI:10.1177/0091270007299757.
[15]张喜全,夏万光,万顺之.天晴甘美[J].中国新药杂志,2006,15(16):1409-1410.
[16]孙敏捷,盛星,胡一桥.Caco-2细胞单层模型的建立与验证[J].中国药学杂志,2006,41(18):1431-1434.
[17]赵燕燕,李杨,刘丽艳,等.甘草炮制条件对18α-Gly和18β-Gly含量及比例的影响[J]:河北大学学报(自然科学版),2015,35(2):138-146.DOI:10.3969/j.issn.1000-1565.2015.02.006.
ZHAO Yanyan,LI Yang,LIU Liyan,et al.Effects of licorice processing conditions on content and proportion of 18α-glycyrrhizic acid and 18β-glycyrrhizic acid[J].Journal of Hebei University(Naturnal Science Edition),2015,35(2):138-146.DOI:10.3969/j.issn.1000-1565.2015.02.006.
(责任编辑:梁俊红)
Different proportion and concentration of Glycyrrhizic acid -18-epimers effect on P-gp function in Caco-2 cells
ZHAO Yanyan1,2,SUN Dong1,LIU Liyan3,LIU Yafei1,WANG Jing1
(1.College of Chemistry and Environmental Science,Hebei University,Baoding 071002,China;2.College of Pharmaceutical Sciences,Hebei University,Baoding 071002,China;3.Experimental Center of Medicine,Hebei University,Baoding 071000,China)
To evaluate the effect of glycyrrhizic acid 18 epimers,18α-glycyrrhizic acid (18α-Gly) and 18β-glycyrrhizic acid (18β-Gly) at different proportion and concentration on the P-glycoprotein (P-gp) activity in colon cancer Caco-2 cell to select their appropriate concentration and proportion in use.Making a cell model,selecting the total glycyrrhizic acid concentration of 1,10,30,60,120,240 μmol/L and proportion of 10∶0,8∶2,6∶4,5∶5,4∶6,2∶8,0∶10,determining their optimum concentration and proportion by cell survival rate,and detecting the maximum fluorescence value by flow cytometer,that is,thestrongest inhibitory effect of P-gp and its weakest function.When the concentration of glycyrrhizic acid was 1 μmol/L,the fluorescence intensity became gradually weak and its induction fuction was strengthed gradually with the reduction in proportion of 18α-Gly.When the concentration of glycyrrhizic acid was 10 μmol/L and 60 μmol/L,the fluorescence intensity changed significantly.When the concentration of glycyrrhizic acid was 10 μmol/L and their proportion wasn(18α-Gly)∶n(18β-Gly)=4∶6,the fluorescence intensity became stronger and its inhibitory effect was remarkable.When the concentration of glycyrrhizic acid was 60 μmol/L and their proportion wasn(18α-Gly)∶n(18β-Gly)=5∶5,the fluorescence intensity was the highest,and the strongest inhibitory effect of P-gp appeared.
18α-glycyrrhizic acid;18β-glycyrrhizic acid;P-glycoprotein;Caco-2 cell;different proportion/ concentration
10.3969/j.issn.1000-1565.2016.03.006
2015-10-08
河北省自然科学基金资助项目(H2013201203);河北大学医学学科专项资金建设项目(2014A1003)
赵燕燕(1960—),女,天津人,河北大学教授,主要从事药学以及将现代分离技术用于临床、药学、食品、环境等方面的研究.E-mail:zhaoyany606@tom.com
R285.5
A
1000-1565(2016)03-0249-08

