Mycobacterium sp. BFZ304转化植物甾醇产9α-羟基雄烯二酮培养基的响应面优化
柳相鹤,张瑞婕,赵树欣,张保国,史吉平
(1.天津科技大学生物工程学院,天津 300457;2.中国科学院上海高等研究院,上海 201210 3.上海科技大学生命学院,上海 201210)
Mycobacteriumsp. BFZ304转化植物甾醇产9α-羟基雄烯二酮培养基的响应面优化
柳相鹤1,2,张瑞婕2,3,赵树欣1,张保国2,*,史吉平2,3
(1.天津科技大学生物工程学院,天津 300457;2.中国科学院上海高等研究院,上海 201210 3.上海科技大学生命学院,上海 201210)
本研究以Mycobacteriumsp. BFZ304作为实验菌株,研究了不同碳源、氮源、磷酸盐等培养基成分对Mycobacteriumsp. BFZ304发酵转化植物甾醇生产9α-羟基雄烯二酮的影响。在单因素实验的基础上,以9α-羟基雄烯二酮的产量为衡量指标,采用响应面法优化了转化培养基的组成,并建立了玉米浆、葡萄糖、硝酸钠、磷酸氢二铵变化的二次回归方程,探讨了各因子对9α-羟基雄烯二酮产量的影响。最终确定最适宜的转化培养基为葡萄糖10 g/L、玉米浆40 g/L、硝酸钠6 g/L、磷酸氢二铵0.7 g/L。在此条件下,底物植物甾醇添加量为10 g/L时,9α-羟基雄烯二酮的产量可达到4.86 g/L,底物植物甾醇的转化率比优化前提高了近40%,具有极好的产业化前景。
Mycobacteriumsp. BFZ304,植物甾醇,9α-羟基雄烯二酮,响应面
甾体药物作为仅次于抗生素的第二大药物,人们对其的需求量不断增加[1-2]。目前,以生物转化方法催化合成甾体药物越来越受到重视,相较于传统化学合成方法,生物转化具有产率高、专一性强、条件较温和且环境友好等多种优势,使其逐渐成为医药工业合成甾体药物的先进技术手段[3-4]。9α-羟基雄烯二酮(9α-OH-AD)是一类重要的甾体医药中间体,利用9α-OH-AD作为前体物可以合成氢化可的松、17α-羟基黄体酮、依普利酮、β米松、地塞米松、可的松等多种重要的甾体原料药,具有重要的商业价值[5-6]。利用分枝杆菌等微生物转化植物甾醇生产甾体医药中间体9α-OH-AD,是当下甾体医药工业体系的一条重要工艺路线。因此利用不同微生物转化甾醇制备9α-OH-AD的研究逐渐成为甾体激素类行业中又一个研究热点[7-10]。在甾体微生物转化过程中,微生物菌株的生长与培养基组成密切相关,培养基中的各种成分,对菌株的生长以及细胞内酶的表达都具有很大的影响[11-12]。同时培养基成分是影响微生物甾体转化活性的主要因素,因此对培养基进行优化是提高微生物转化甾醇生成9α-OH-AD的有效途径。
考察培养基组分对产酶的影响通常采用的优化手段多为单因素实验。因其未考虑各因素之间的交互作用,故无法提供未考察区域的信息,以及进行预测和控制。响应面法可同时对多因子水平及其交互作用进行优化与评价,并能快速有效地确定多因子系统的最优条件。近年来采用响应面法对生物反应过程进行优化已有一些报道,并取得了较好的优化结果[13-14]。
利用微生物转化植物甾醇生产9α-OH-AD的内容在国内却鲜有报道,本文通过单因素和响应面分析实验优化培养基成分来提高分支杆菌转化植物甾醇的发酵转化效率,本研究通过微生物转化方法,以Mycobacteriumsp. BFZ304作为实验菌种,植物甾醇为底物,通过单因素和响应面分析实验优化生物转化培养基成分来提高底物转化效率和产物的得率,以期为进一步工业化生产奠定基础。
1 材料与方法
1.1材料与仪器
Mycobacteriumsp. BFZ304本研究室自主筛选后鉴定保存;植物甾醇HPLC纯度95%,江苏越红饲料有限公司;玉米浆N上海西王淀粉糖有限公司;山梨醇、牛肉膏、葡萄糖、淀粉、蛋白胨、酵母粉、甘油等有机碳氮源上海生工生物工程有限公司;(NH4)2HPO4、NaNO3、甲醇、乙酸乙酯等化学试剂均为分析纯,国药集团(上海)化学试剂有限公司;平板培养基酵母粉15 g,葡萄糖6 g,NaNO35.4 g,(NH4)2HPO40.6 g,琼脂20 g,定容到1 L,pH7.8;种子培养基酵母粉15 g,葡萄糖6 g,NaNO35.4 g,(NH4)2HPO40.6 g,定容到1 L,pH7.8;初始转化培养基葡萄糖5 g,蛋白胨5 g,NaNO36 g,NaH2PO40.5 g,定容到1 L,pH7.8。
RID-10A/SPD-20A型高效液相色谱仪日本岛津公司;GC-2010Plus气相色谱仪日本岛津公司;PB-10型pH计德国Sartorius;BSA 224SCW型电子天平德国Sartorius;DU730型紫外分光光度计德国Beckman;BX51型显微镜日本OLYMPUS;ZHWY-2102C型恒温培养振荡器上海智城分析仪器制造有限公司。
1.2微生物培养及初始甾体转化条件
将实验室保藏的Mycobacteriumsp. BFZ304用平板培养基活化,于恒温培养箱中30 ℃培养2~3 d后挑取单克隆接种到液体种子培养基中,30 ℃、130 r/min摇床培养48 h,获得液体种子。实验培养基中接入5%的液体种子,于30 ℃、130 r/min条件下摇床培养48 h后,补加10 g/L的植物甾醇进行发酵转化,每隔12 h取样测定相关物质的含量。植物甾醇转化率计算公式如下:植物甾醇转化率(%)=(产物9α-OH-AD浓度/投加底物植物甾醇浓度)×100
1.3培养基的优化方法
1.3.1氮源单因素实验本研究以40 g/L的含氮水平添加玉米浆、酵母粉、牛肉膏、硝酸钠、硫酸铵、氯化铵作为氮源,其他条件不变,与以蛋白胨为主要氮源的转化培养基作比较,实验平行三次。
1.3.2碳源单因素实验本研究以20 g/L的含碳水平添加山梨醇、蔗糖、甘油、乳糖、淀粉作为碳源,其他条件不变,与以葡萄糖为主要碳源的转化培养基作比较,实验平行三次。
1.3.3磷酸盐单因素实验保持其他条件不变,以10 g/L的含磷水平分别添加磷酸氢二钠、磷酸二氢钠、磷酸氢二铵、磷酸二氢铵,进行发酵转化,根据9α-OH-AD浓度的大小确定最佳的磷酸盐,实验平行三次。
1.3.4响应面分析实验方法根据单因素的实验结果,选用葡萄糖、玉米浆、磷酸氢二铵、硝酸钠为考察因素,采用Design-Expert 8.0软件设计实验并进行响应面分析,设计四因素三水平的响应面分析实验,实验因子和编码水平如表1。

表1 响应面实验因素水平表
1.4植物甾醇及9α-OH-AD的测定方法
对于一些自身结构中存在共轭结构的甾体化合物,如本研究中的目的产物9α-OH-AD可以利用高效液相色谱检测该化合物在UV 254 nm下的吸收值,通过比对标准对照或者建立的标准曲线,可以测定产物的相对水平。对于在紫外光下无吸收的底物植物甾醇则可以通过气相色谱检测甾体化合物的含量。高效液相色谱(HPLC)检测法:采用C18反相层析柱(Agilent Extend-C18,4.6 mm×250 mm,5 μm);流动相为70%甲醇:30%水(v/v),流速为1.0 mL/min;柱温为32 ℃;紫外检测波长为254 nm;进样体积为20 μL。
气相色谱(GC)检测法:将发酵样品用乙酸乙酯萃取后,与同体积的浓度为1 g/L的胆固醇内标参照物混合用于GC分析。采用岛津2010 Plus气相色谱仪进行GC分析;检测器为FID检测器,色谱柱为二甲基聚硅氧烷柱(30 m×0.25 mm× 0.25 μm);入口温度为300 ℃,柱温箱为320 ℃,FID检测器温度为300 ℃;载气为氮气,压力为81.7 kPa,柱流量为1 mL/min,氢气流量为40 mL/min,空气流量为400 mL/min,氮气流量为9.3 mL/min;进样体积为1 μL;洗针溶液为乙酸乙酯。
1.5数据处理
本实验通过Design-Expert 8.0软件进行响应面实验设计及数据分析并对最优结果进行预测验证,采用Origin Pro8.5软件进行数据处理。
2 结果与分析
2.1单因素实验
2.1.1氮源的优化氮源主要用来构成菌体细胞物质和代谢产物,是微生物细胞需要量非常大的元素。不同氮源对Mycobacteriumsp. BFZ304转化植物甾醇生成9α-OH-AD的影响如图1所示。从图1中可以看出,在多种氮源存在下,Mycobacteriumsp. BFZ304都可以转化植物甾醇生成9α-OH-AD,几种有机氮源中以玉米浆作为氮源时9α-OH-AD浓度最高达到2.98 g/L。可能是因为玉米浆中含有丰富的可溶性蛋白和生长素,能为菌体生长提供更多的营养物质,有利于甾醇侧链降解酶的合成。在无机氮源中以硝酸钠为氮源时,9α-OH-AD的产量最大达到2.632 g/L,而以硫酸铵时,9α-OH-AD浓度最低。可能是因为当氨根离子被代谢后,培养基中生成H2SO4,导致pH降低,不利于反应的进行。由此实验结果可知,微生物Mycobacteriumsp. BFZ304在转化过程中既需要有机氮源的参与也需要无机氮源,其能够较快利用无机氮源,在利用无机氮源的基础上分解利用有机氮源,因此本实验选择玉米浆和硝酸钠同时作为氮源用于后续的研究。
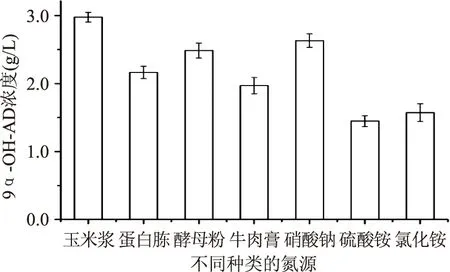
图1 氮源对9α-OH-AD浓度的影响Fig.1 Effect of nitrogen source type on the concentration of 9α-OH-AD
2.1.2碳源的优化碳源作为分支杆菌培养基的基本成分之一,能够为分支杆菌的生长代谢提供能量。同时它也是菌体细胞组成的原料,是菌体生长发育必需的能源物质,某些碳源是分支杆菌侧链降解相关酶的诱导物,选择适宜的碳源有利于定向促进某些酶的合成,增强分支杆菌的活性[15]。本研究中添加的不同碳源对Mycobacteriumsp. BFZ304转化植物甾醇生成9α-OH-AD的影响如图2所示。Mycobacteriumsp. BFZ304可以利用不同的碳源,但不同碳源类型对9α-OH-AD产量影响较大。当以葡萄糖为碳源时,9α-OH-AD的产量为2.21 g/L,高于其他的几种碳源。因为葡萄糖是单糖,所以Mycobacteriumsp. BFZ304相对更容易利用葡萄糖,故选用葡萄糖作为Mycobacteriumsp. BFZ304转化培养基的最佳碳源。
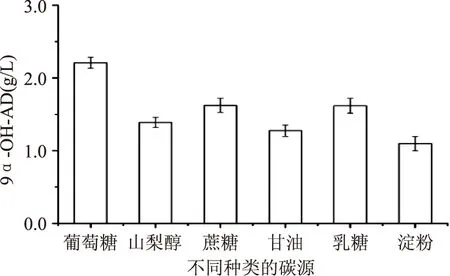
图2 不同碳源对9α-OH-AD浓度的影响Fig.2 Effect of carbon source type on the concentration of 9α-OH-AD
2.1.3磷酸盐的优化磷是核酸、蛋白质和辅酶的主要成分,可改变菌体的能荷状态,磷酸盐也是培养基中重要的缓冲盐,使得培养基中pH不会随菌体产酸而引起剧烈的变化[16]。Mycobacteriumsp. BFZ304对不同的磷酸盐利用效果不尽相同,由图3可知添加磷酸氢二铵的发酵液中9α-OH-AD含量最高,达到2.308 g/L,因此,选择磷酸氢二铵作为最适磷酸盐用于后续的研究。
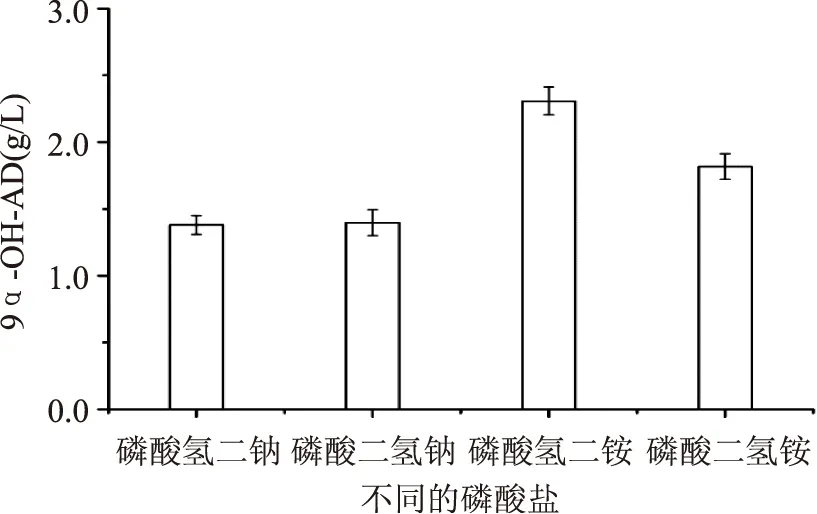
图3 磷酸盐对9α-OH-AD浓度的影响Fig.3 Effect of phosphate on the concentration of 9α-OH-AD
2.2响应面实验设计优化结果
2.2.1模型的建立及显著性检验利用Design-Expert 8.0软件进行统计分析。根据表2的实验结果,对表中数据进行多元回归拟合,得到Mycobacteriumsp. BFZ304发酵转化植物甾醇产9α-OH-AD浓度(Y)对葡萄糖(X1)、玉米浆(X2)、硝酸钠(X3)、磷酸氢二铵(X4)的多项回归方程为:
Y=-6.8742+8.1052+2.0416+5.7826+69.8081+0.1090-1.2287+8.2500+0.4995-4.600+23.9889-4.3684-0.2744-6.8099-572.1833。
对实验结果进行方差分析,结果如表3所示。
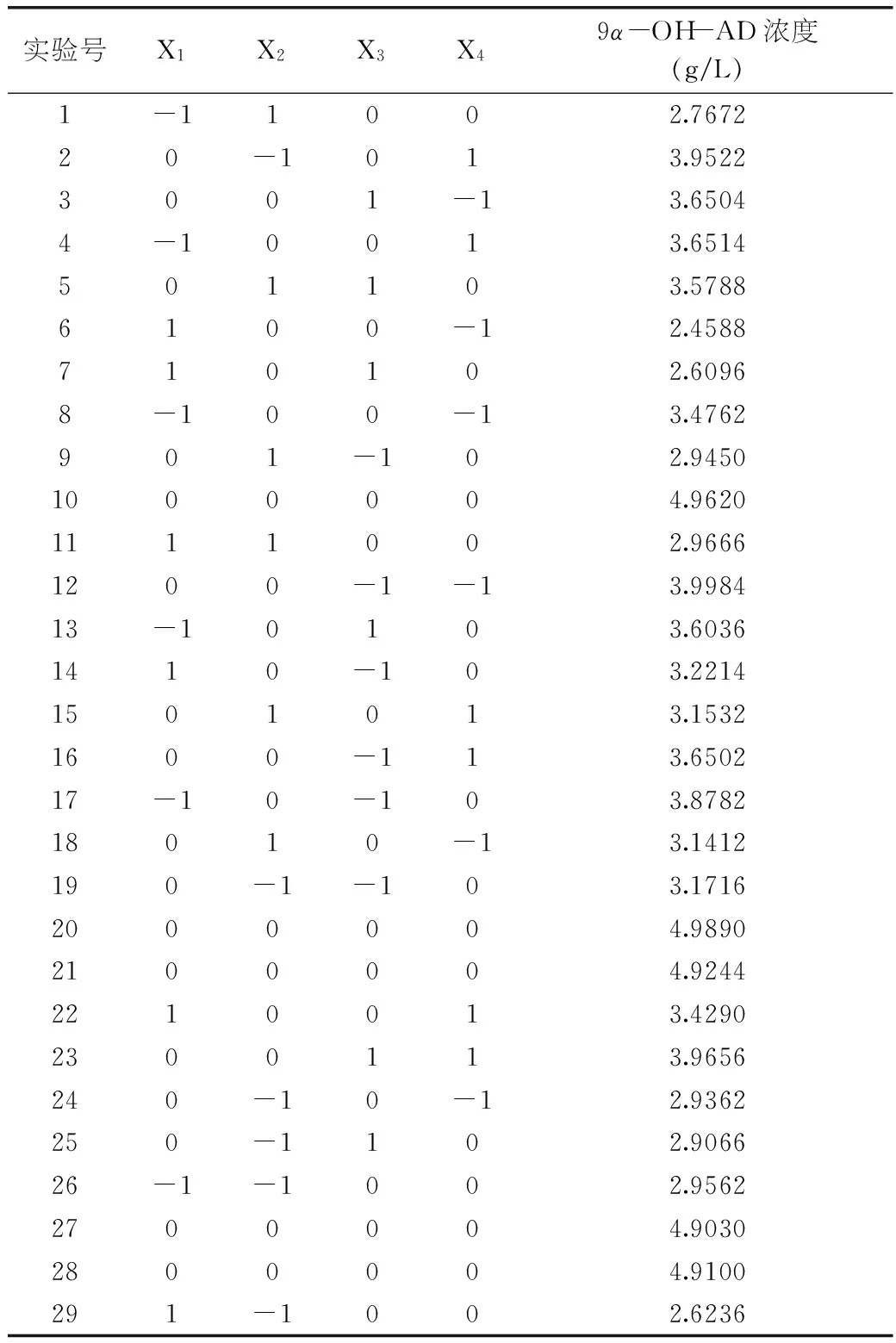
表2 响应面分析实验结果
从表3可以看出建立的回归模型极显著(p<0.0001)说明方程拟合度较好;失拟项p=0.1007>0.05,说明失拟项不显著,残差由随机误差引起,模型选择正确;复相关系数=0.9531,表明预测值和实测值之间具有很高的相关性;调整性决定系数=0.9062,表明方程模型可信度较高,能够较好地描述实验结果。
由表3可知,四因素中对9α-OH-AD产量影响从大到小的顺序为X1、X4、X3、X2。X2对9α-OH-AD产量影响不显著,X3对9α-OH-AD产量影响显著,X1、X4的影响为极显著,4因子的交互及二次项的影响均为极显著。
2.2.2相应面优化及分析4因子的交互图见图4~图9。
葡萄糖和玉米浆对9α-OH-AD产量的影响如图4所示,当葡萄糖的添加量一定时,9α-OH-AD的产量随着玉米浆添加量的增加而增大,但当玉米浆的添加量大于40 g/L时,9α-OH-AD的产量呈下降趋势。当玉米浆的添加量一定时,随着葡萄糖添加量的增加,9α-OH-AD的产量随之增大,但当葡萄糖的添加量继续增大时,9α-OH-AD产量逐渐降低。其他图所反映出来的升降趋势与图4一致,故分析略。
三维图反映出的结果与方差分析表所反映出的结果一致。在此基础上,通过Design-Expert8.0软件,进行分析计算,可得到Mycobacteriumsp. BFZ304发酵转化植物甾醇产9α-OH-AD的最佳培养基配方为:葡萄糖10.00 g/L、玉米浆40.00 g/L、硝酸钠6.00 g/L、磷酸氢二铵0.70 g/L,在此条件下9α-OH-AD的产量预测值可达4.96 g/L。
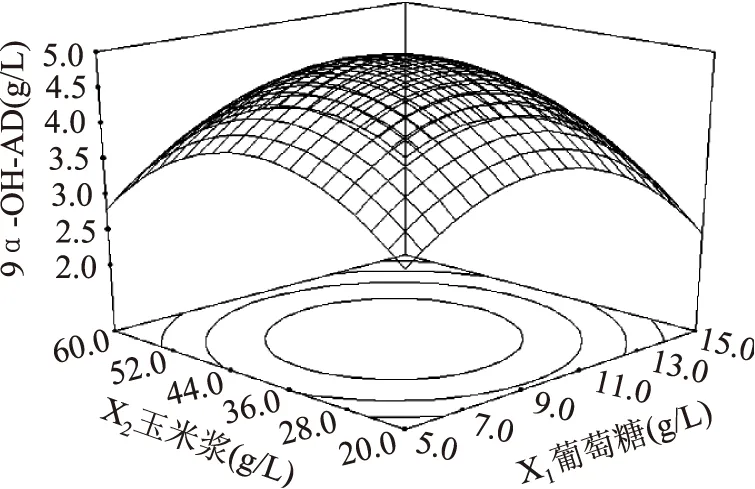
图4 葡萄糖和玉米浆对9α-OH-AD产量影响的响应面立体分析图Fig.4 Response surface for the effect of cross-interaction between corn steep liquor and glucose on the yield of 9α-OH-AD

图5 葡萄糖和硝酸钠对9α-OH-AD产量影响的响应面立体分析图Fig.5 Response surface for the effect of cross-interaction between NaNO3 and glucose on the yield of 9α-OH-AD
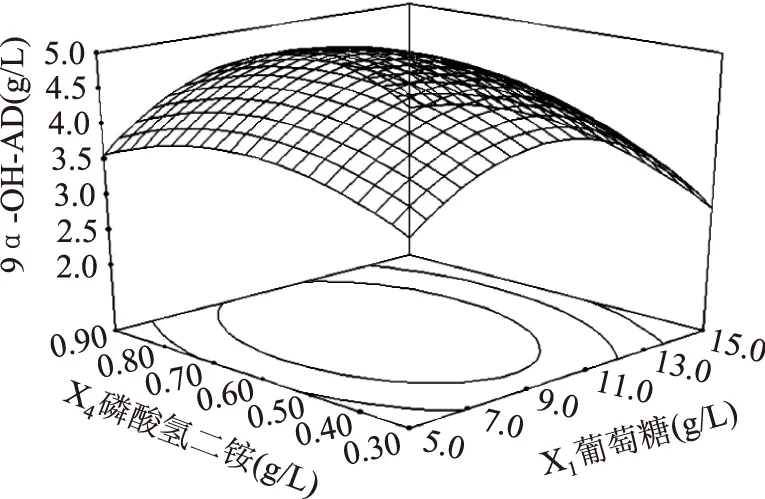
图6 葡萄糖和磷酸氢二铵对9α-OH-AD产量影响的响应面立体分析图Fig.6 Response surface for the effect of cross-interaction between (NH4)2HPO4 and glucose on the yield of 9α-OH-AD

表3 9α-OH-AD产量多项式回归模型方差分析
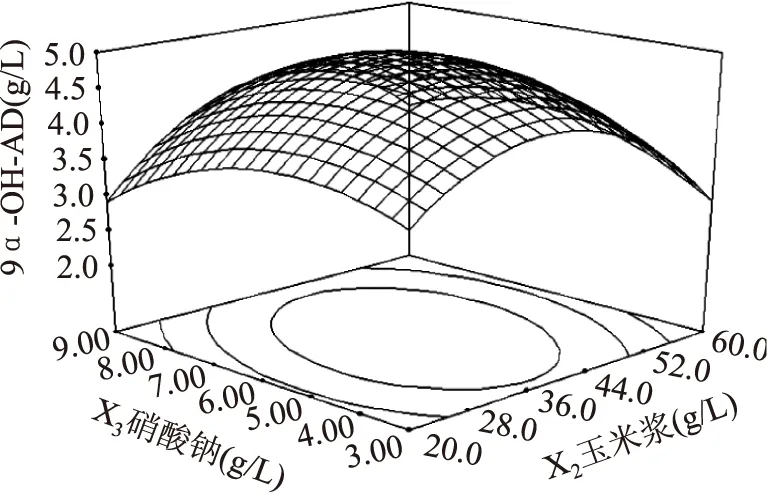
图7 玉米浆和硝酸钠对9α-OH-AD产量影响的响应面立体分析图Fig.7 Response surface for the effect of cross-interaction between NaNO3 and corn steep liquor the yield of 9α-OH-AD
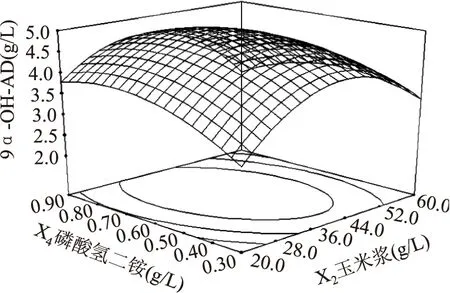
图8 玉米浆和磷酸氢二铵对9α-OH-AD产量影响的响应面立体分析图Fig.8 Response surface for the effect of cross-interaction between (NH4)2HPO4and corn steep liquor on the yield of 9α-OH-AD
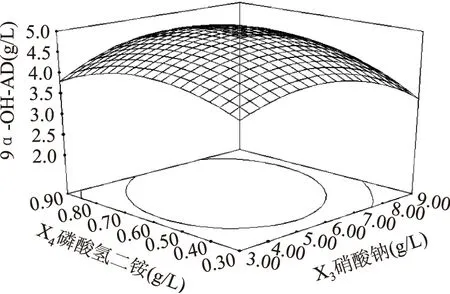
图9 硝酸钠和磷酸氢二铵对9α-OH-AD产量影响的响应面立体分析图Fig.9 Response surface for the effect of cross-interaction between(NH4)2HPO4 and NaNO3 on the yield of 9α-OH-AD
2.2.3响应面优化实验结果的验证考虑到实际操作的方便性,将以上组合校正为葡萄糖10 g/L、玉米浆40 g/L、硝酸钠6 g/L、磷酸氢二铵0.7 g/L,在此条件下进行验证实验,结果如图10所示。发酵转化96 h时,产物9α-OH-AD的产量达到最大,为4.86 g/L,此时底物植物甾醇的残留量为2.99 g/L,植物甾醇的转化率为70.12%。
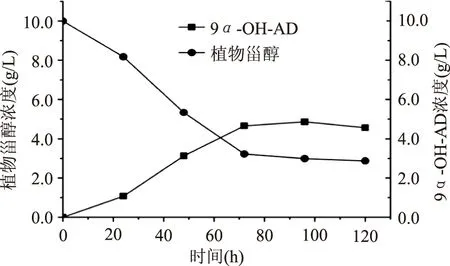
图10 分支杆菌转化植物甾醇生成9α-OH-AD的转化过程Fig. 10 Time-course of the accumulation of products during phytosterol conversion by Mycobacterium sp.
3 结论
通过单因素优化实验进行了培养基成分的筛选,确定了Mycobacteriumsp. BFZ304发酵转化植物甾醇生产9α-OH-AD的培养基配方成分。在单因素实验的基础上,采用响应面实验设计,对Mycobacteriumsp. BFZ304发酵转化植物甾醇生产9α-OH-AD培养基进行了优化,通过实验数据进行分析与评价,得到影响9α-OH-AD产量的二次多项式回归模型,并对该模型进行显著性检验。最终得到优化培养基组成为:葡萄糖10 g/L、玉米浆40 g/L、硝酸钠6 g/L、磷酸氢二铵0.7 g/L,在此条件下9α-OH-AD的产量最高,预测值为4.96 g/L。对优化后的培养基进行验证实验,得到的结果为9α-OH-AD的产量为4.86 g/L,底物植物甾醇的残留量为2.99 g/L,基本接近理论预测值,证明该模型合理。Mycobacteriumsp. BFZ304发酵转化植物甾醇生产9α-OH-AD的培养基通过单因素及响应面的优化后,底物植物甾醇的转化率达到70.12%,与初始转化培养基植物甾醇转化率(31.54%)相比提高了近40%。
目前国内外对微生物转化植物甾醇生成9α-OH-AD的研究很少。其中袁家代等在分枝杆菌中异源表达3-甾酮-9α-羟基化酶基因,构建了9α-OH-AD菌株,植物甾醇经过该菌转化后,发酵液中9α-OH-AD的含量仅为0.453 mg/L[17]。杨亚力等利用筛选到的偶发分枝杆菌转化甾醇,9α-OH-AD的含量也小于1 g/L[18]。虽然本研究已经将底物的转化率大大提高,但是还有很多底物未能被微生物所利用而损失掉,因此下一步工作可通过添加一些促进剂增大底物植物甾醇与菌体细胞的接触面积进一步优化转化工艺,提高植物甾醇的转化率。
[1]齐香君.现代生物制药工艺学[M].北京:北京化学工业出版社,2003:259-261.
[2]童望宇,章亭州,傅向阳.制药微生物技术-基础与应用[M].北京:化学工业出版社,2006,243-265.
[3]杨亚力,杨顺凯,吴中柳.偶发分枝杆菌发酵甾醇侧链积累9α-羟基雄烯二酮[J].应用与环境生物学报,2015,21(2):256-262.
[4]魏长龙,赵树欣,王珊,等. Nocardia canicruria BF313催化甾体9α-羟基化发酵工艺优化[J].食品工业科技,2014,35(18):320-323.
[5]VanRheenen V,Shephard K. New synthesis of corticosteroids
from 17-keto steroids:Application and stereochemical study of the unsaturated sulfoxide-sulfenate rearrangement[J].Journal of Organic Chemistry,1979,44(9):1582-1584.
[6]林彦良.甾体化合物微生物转化的研究[D].济南:山东大学,2009:19-22.
[7]杨顺楷,杨亚力,吴中柳,等.微生物发酵降解植物甾醇侧链生产17-酮甾体研究进展[J]. 生物加工过程,2010,8(5):69-77.
[8]Rodina NV,Molchanova MA,Voishvillo NE,et al.Conversion of phytosterols into androstenedione byMycobacteriumneoaurum[J].Prikl Biokhim Mikrobiol,2008,44(1):56-62.
[9]Andriushina VA,Rodina NV,Stytsenko TS,et al. Conversion of soybean sterols into 3,17-diketosteroids using actinobacteriaMycobacteriumneoaurum,PimelobactersimplexandRhodococcuserythropolis[J]. Prikl Biokhim Mikrobiol,2011,47(3):297-301.
[10]Rodina NV,Andryushina VA,Stytsenko TS,et al. The introduction of the 9α-hydroxy group into androst-4-en-3,17-dione using a newActinobacteriumstrain[J]. Prikl Biokhim Mikrobiol,2009,45(4):439-445.
[11]Donova MV,Gulevskaya SA,Dovbnya DV.Mycobacteriumsp. Mutant strain producing 9α-hydroxy-androstenedione from sitosterol[J]. Appl Microbiol Biotechnol,2005,67:671-678.
[12]徐阳光.分枝杆菌降解植物甾醇侧链过程基础研究[D]. 杭州:浙江大学,2014:28-29.
[13]康远军,杨华,李欣,等.基于响应面法的鲁氏酵母发酵培养基优化[J].中国酿造,2015,34(4):25-29.
[14]乔君,赵祥颖,马钦元,等.响应曲面优化柠檬酸淀粉清料发酵培养基[J].生物工程,2015,36(2):231-234.
[15]刘波,邬应龙,张霞,等.红曲霉固态发酵产木聚糖酶培养基的响应面优化[J].食品工业科技,2014,35(1):254-258.
[16]杨英. 徽生物转化植物甾醇制备甾体药物关健中间体研究[D].合肥:合肥工业大学,2009:64-67.
[17]袁家代,陈贵英,程世君,等. 3-甾酮-9α-羟基化酶基因在分枝杆菌中的异源表达与9α-羟基雄烯二酮的制备[J]. 生物工程学报,2015,31(4):523-533.
[18]杨亚力,杨顺楷,吴中柳. 偶发分枝杆菌发酵断甾醇侧链积累9α-羟基雄烯二酮[J]. 应用与环境生物学报,2015,21(2):256-262.
Optimization of medium composition ofMycobacteriumsp. BFZ304 for the transformation of phytosterol to 9α-hydroxy-4-androstene-3,17-dione by response surface analysis
LIU Xiang-he1,2,ZHANG Rui-jie2,3,ZHAO Shu-xin1,ZHANG Bao-guo2,*,SHI Ji-ping2,3
(1.College of Biotechnology,Tianjin University of Science and Technology,Tianjin 300457,China;2.Shanghai Advanced Research Institute,Chinese Academy of Sciences,Shanghai 201210,China;3.College of Biotechnology,Shanghai Tech University,Shanghai 201210,China)
The influence of different carbon sources,nitrogen source,phosphate on 9α-OH-AD producted byMycobacteriumsp. BFZ304 was studied. On the base of single factors experiments,using 9α-OH-AD production as index response surface analysis was applied to optimize the fermentation medium composition. The quadratic regression analysis was applied to get the optimal level of main factors(corn steep liquor,glucose,NaNO3、(NH4)2HPO4). Finally determined the optimal medium were as follows:corn steep liquor 40 g/L,glucose 10 g/L,NaNO36 g/L,(NH4)2HPO40.7 g/L. Under these optimal conditions,the production of the 9α-OH-AD was high up to 4.86 g/L when the concentration of the feeding was 10 g/L,increased by 40% compared with the original medium. It would have a disirable prosfect.
Mycobacteriumsp. BFZ304;phytosterol;9α-hydroxy-4-androstene-3,17-dione;response surface analysis
2016-03-04
柳相鹤(1989-),女,硕士研究生,研究方向:甾体药物微生物转化,E-mail:liuxianghe2013@163.com。
张保国(1979-),男,博士,研究方向:甾体药物微生物转化,E-mail:zhangbg@sari.ac.cn。
国家自然科学基金(41106125)。
TS201.3
A
1002-0306(2016)16-0172-06
10.13386/j.issn1002-0306.2016.16.026

