钙离子通道抑制剂处理下发芽大豆主要生理生化和γ-氨基丁酸的代谢变化
尹永祺,李 童,王淑雯,史颖悟,高 璐,饶胜其,杨振泉,方维明
(扬州大学食品科学与工程学院,江苏扬州 225127)
钙离子通道抑制剂处理下发芽大豆主要生理生化和γ-氨基丁酸的代谢变化
尹永祺,李童,王淑雯,史颖悟,高璐,饶胜其,杨振泉,方维明*
(扬州大学食品科学与工程学院,江苏扬州 225127)
为研究钙离子通道抑制剂对NaCl胁迫下发芽大豆生理代谢和γ-氨基丁酸(GABA)富集的影响,通过NaCl联合质膜钙离子通道抑制剂(LaCl3)和内膜钙离子通道抑制剂(Heparin)处理大豆籽粒,分析发芽期间主要生理生化和GABA代谢酶活力的变化。结果显示,发芽大豆经NaCl联合LaCl3处理后,其生长发育较单独NaCl处理进一步受到抑制,芽长显著降低,经Heparin处理芽长无显著性变化,而二者呼吸速率均显著增加。相较单独NaCl处理,NaCl联合LaCl3或Heparin处理后其子叶中GABA代谢酶活力均显著下降,LaCl3处理后子叶和胚中GABA含量分别为NaCl处理的50%和79%,而Heparin处理则分别为70%和66%,表明抑制内源钙库的释放对NaCl胁迫下GABA富集的影响小于抑制质膜钙离子通道。
发芽大豆,γ-氨基丁酸,NaCl胁迫,钙离子通道抑制剂
γ-氨基丁酸(GABA)于2009年被中国卫生部批准为新资源食品,其属于非蛋白质氨基酸,作为抑制性神经递质在哺乳动物中枢神经系统中发挥作用,具有改善大脑血液循环、促进脑组织新陈代谢、改善神经机能、降血氨、抗惊厥、降血压以及恢复脑细胞等多种生理功能[1-3]。
研究发现,植物籽粒发芽期间,尤其在盐胁迫[4]和低氧[5]等非生物胁迫下发芽,其GABA含量数以倍计的提高。因此,植物籽粒在逆境条件下发芽累积GABA受到国内外功能食品研究者的高度关注。然而,植物籽粒在胁迫条件下发芽其生长同样受到严重抑制,导致其生物产量下降[6]。据报道,盐胁迫下的发芽大豆施用CaCl2后可恢复正常生长,且仍能大量累积GABA[7]。据此,推测外源Ca2+可缓解逆境胁迫对植物生长的抑制作用并促进GABA累积,但其作用机制尚不明确。植物细胞受到外界信号刺激时,其既可通过质膜钙离子通道释放胞外钙库,亦可利用细胞内膜上的钙通道使钙离子从胞内钙库进入细胞质,促使细胞质内钙离子含量升高,其后细胞质中的CaM与钙离子结合并激活相应靶酶或靶蛋白,从而导致细胞生理生化反应[8-9]。因此,为探讨钙离子通道在发芽大豆生长及累积GABA中发挥的作用,本研究分析质膜钙离子通道抑制剂(LaCl3)和内膜离子通道抑制剂(Heparin)处理对NaCl胁迫下发芽大豆生长状况、生化代谢的影响,并研究其对发芽大豆子叶和胚中GABA含量以及GABA合成酶活性的调控作用,以期初步揭示钙离子通道介导NaCl胁迫下发芽大豆生理生化及GABA代谢的作用机理。
1 材料与方法
1.1材料与仪器
大豆(GlycinemaxL. Merr)籽粒购于2015年,产自中国东北吉林省,封装于密闭容器中,4 ℃保存备用;GABA标准品美国Sigma公司;乙腈色谱纯;其余试剂均为国产分析纯。
Agilent 1200 Series高效液相色谱仪Agilent公司;UV-7504C型紫外可见分光光度计上海欣茂仪器有限公司;BCD-257SL型冰箱青岛海尔股份有限公司;PHS-3C pH计上海精密科学仪器有限公司;ZXDP-A2080电热恒温培养箱 上海智诚有限公司;高速冷冻离心机上海安亭科学仪器厂。
1.2实验方法
1.2.1样品制备称取20 g籽粒饱满的大豆,经去离子水冲洗后置于1%(v/v)次氯酸钠水溶液中浸泡消毒15 min,消毒大豆用去离子水冲洗至pH中性后于30 ℃浸泡4 h;将浸泡后大豆置于发芽机于30 ℃避光发芽,分别设以下处理并进行发芽:对照(去离子水);NaCl胁迫处理(50 mmol/L NaCl);NaCl胁迫加LaCl3处理(50 mmol/L NaCl+5 mmol/L LaCl3);NaCl胁迫加Heparin处理(50 mmol/L NaCl+5 mmol/L Heparin);发芽4 d期间,每隔1 d更换培养液至培养结束,期间定时取样测定相关指标。
1.2.2指标测定与方法
1.2.2.1芽长随机选取30粒发芽大豆,用游标卡尺测定其芽长。
1.2.2.2呼吸速率参照小篮子法[10]测定。
1.2.2.3脯氨酸含量取样品0.5 g于试管中,加入5 mL 3%磺基水杨酸,经沸水浴提取10 min,期间不断晃动;吸取2 mL提取液于另一具塞试管,加入2 mL冰醋酸及2 mL酸性茚三酮,混匀后沸水浴30 min,冷却后加入4 mL甲苯摇荡30 s,静置取上清液至10 mL离心管于3000 g离心5 min,取离心后上层脯氨酸红色甲苯溶液于比色皿中,以甲苯为空白于520 nm处测定其光密度值[10]。
1.2.2.4谷氨酸脱羧酶(GAD)活性参照Zhang等[11]方法进行测定。
1.2.2.5氨基醛脱氢酶(AMADH)活性称取1 g发芽大豆,加入预冷酶提取液1∶2(w/v):0.1 mol/L pH8.0 磷酸钾缓冲液,5 mmol/L DTT,1 mmol/L EDTA,10%(w/v)蔗糖,12000×g离心30 min,上清液即为粗酶液;取适量酶液加入0.1 mol/L pH8.0 Tris-HCl缓冲液,内含1 mmol/L NAD+,加入终体积为1 mmol/L的4-氨基丁醛启动反应,37 ℃于340 nm处连续测定吸光值,以每分钟OD340 nm变化0.01个单位为1个酶活力单位(U)[12]。
1.2.2.6GABA含量参照Bai等[13]方法进行测定。
1.3数据统计与处理
实验结果以平均值±标准差表示。数据采用统计分析软件18.0(SPSS,18.0)进行统计分析,均值间比较采用Tukey多重比较,在0.05水平上进行显著检验(p<0.05)。
2 结果与分析
2.1钙离子通道抑制剂对发芽大豆主要生理生化指标的影响
2.1.1形态特征图1直观显示发芽大豆经NaCl及其联合钙离子通道抑制剂处理后,其生长状态明显受到影响,其中经NaCl联合LaCl3处理的发芽大豆受抑制情况更严重,表观上可看出发芽4 d时,Heparin处理组的生长较单独NaCl处理组无明显差异。
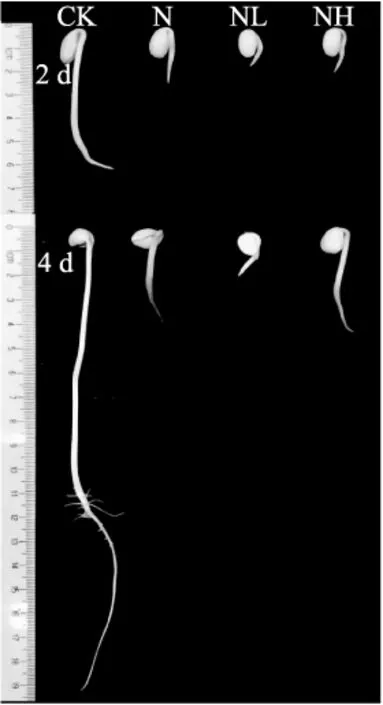
图1 钙离子通道抑制剂对发芽大豆形态的影响Fig.1 Effect of calcium channel inhibitor treatment on morphology of germinating soybean注:CK:对照;N:NaCl;NL:NaCl+LaCl3;NH:NaCl+Heparin,图2~图7同。
2.1.2芽长由图2可看出,发芽期间各处理下的发芽大豆芽长均随发芽时间延长呈增加趋势,发芽4 d后各处理间芽长具有显著差异(p<0.05)。NaCl联合LaCl3处理的芽长显著低于对照处理与NaCl处理,发芽4 d时其芽长分别为对照组和NaCl处理组的30%和51%;相对而言,发芽4 d经NaCl联合Heparin处理的豆芽与NaCl无显著差异;NaCl联合LaCl3处理组对芽长起到的抑制作用显著高于NaCl联合Heparin处理组。
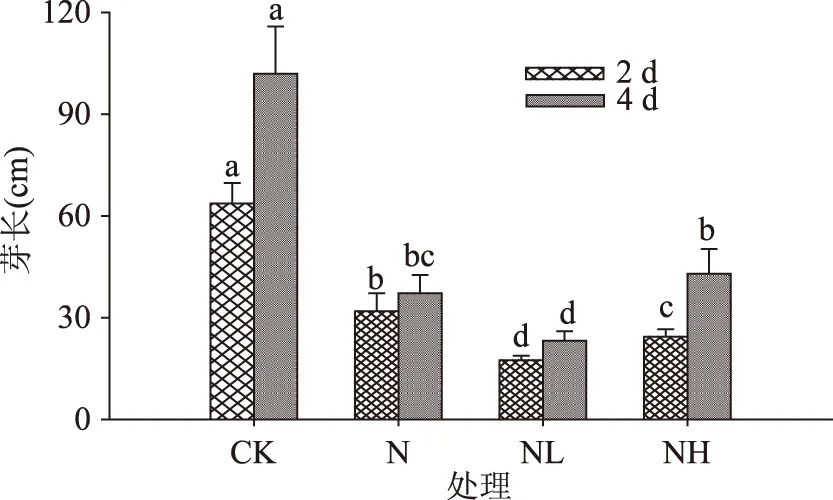
图2 钙离子通道抑制剂对发芽大豆芽长的影响Fig.2 Changes in sprout length of germinating soybeanunder calcium channel inhibitor treatments注:图中字母表示显著性检验结果,不同小写字母表示不同处理间差异达显著水平(p<0.05);图3~图7同。
2.1.3呼吸速率发芽期间各处理的豆芽呼吸速率均呈增长状态,NaCl胁迫下,各处理的豆芽呼吸速率都受到了抑制(图3),发芽4 d后,NaCl联合钙离子通道抑制剂处理组的呼吸速率均显著高于单独NaCl处理。前期(发芽2 d)NaCl联合Heparin处理的豆芽呼吸速率受抑制作用较小,其与对照并无显著性差异。两种钙通道抑制剂在发芽期间对发芽大豆的影响不同,这可能是因为两种钙离子通道的作用机制不同造成的差异,LaCl3可结合质膜Ca2+泵上的Mg2+催化位点,抑制Ca2+泵作用进而阻碍Ca2+跨膜运输,而Heparin抑制细胞内膜上的钙释放通道,致使产生的钙信号强度不同,发芽大豆的生理状态产生差异[9,14]。
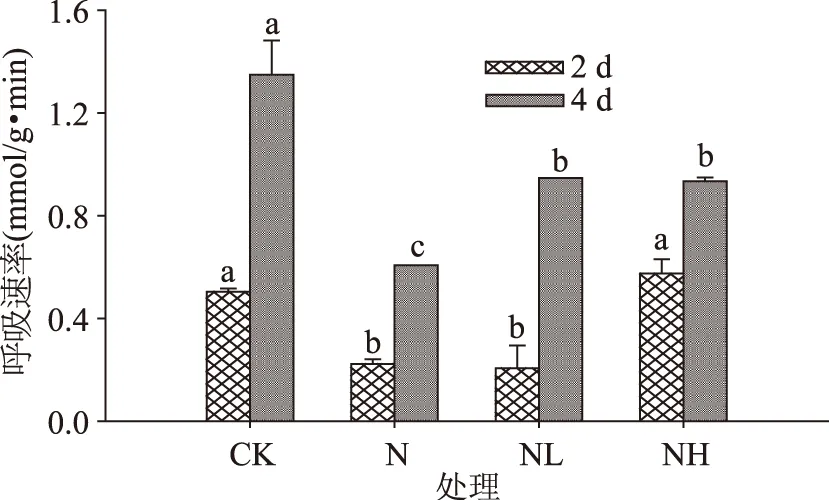
图3 钙离子通道抑制剂处理下发芽大豆呼吸速率的变化Fig.3 Changes in respiratory rate of germinating soybean under calcium channel inhibitor treatments
2.1.4脯氨酸含量发芽期间各处理下发芽大豆中脯氨酸含量均呈增加趋势(图4)。NaCl胁迫导致发芽大豆子叶中脯氨酸含量显著增加,发芽4 d时其子叶中含量为对照的2倍,而胚中却显著下降;经NaCl联合LaCl3处理后其子叶中含量较NaCl胁迫无显著变化,胚中则显著增加。NaCl联合Heparin处理4 d后其子叶和胚中脯氨酸含量均显著低于NaCl及其联合LaCl3处理。目前学界对于脯氨酸在植物中所发挥的作用有着不同的观点,低温、低氧和干旱等非生物胁迫均能引起植物中脯氨酸含量显著增加,盐胁迫下烟草、拟南芥、大豆和番茄等多种植物亦显著积累脯氨酸并提高了其抗胁迫能力,表明脯氨酸的积累可增加植物对渗透胁迫的耐受性[15];然而,亦有研究认为脯氨酸是植物伤害性指标,与植物抗胁迫并无相关性[16],研究发现一些高粱属植物[17]和大豆[18]经胁迫处理,其脯氨酸含量显著增加并未提高植物的耐盐能力。本研究中,NaCl胁迫下,大豆在发芽期间子叶中脯氨酸含量显著高于对照,而胚中其含量显著降低,表明脯氨酸累积量与植物的器官类型有关。而Ca2+通道对于脯氨酸的调控影响可能从侧面证实脯氨酸只是植物伤害性指标,与植物抗胁迫并无直接相关性。

图4 钙离子通道抑制剂对发芽大豆游离脯氨酸含量的影响Fig.4 Effect of calcium channel inhibitor on proline content of germinating soybean
2.2钙离子通道抑制剂对发芽大豆GABA富集的影响
2.2.1GAD活性在植物中,GABA代谢包括GABA支路和多胺降解两条途径,GABA支路中GAD将谷氨酸直接脱羧生成GABA,因此GAD是GABA支路的限速酶[19]。由图5可看出,单纯经NaCl胁迫处理的发芽大豆子叶和胚中GAD活力显著高于对照。4 d发芽大豆经NaCl联合LaCl3或Heparin处理,其子叶中GAD活力均显著低于单纯经NaCl处理(p<0.05),胚中联合LaCl3处理组显著下降,而联合Heparin处理组则与NaCl处理无显著差异。这可能是由于植物GAD中存有钙调素结合域,其活性受到细胞质内Ca2+浓度的影响,Matsumoto等利用Ca2+通道激活剂提高了芦笋细胞内Ca2+浓度,进而提高GAD活力,因此,施用Ca2+通道抑制剂后导致了GAD活力下降,然而不同抑制剂对于GAD活力影响具有差异。

图5 钙离子通道抑制剂处理下发芽大豆GAD活性的变化Fig.5 Changes in GAD activity of germinating soybeanunder calcium channel inhibitor treatment
2.2.2AMADH活性AMADH是多胺降解途径中的限速酶,其可将多胺经胺氧化酶氧化产生的4-氨基丁醛脱氢生成GABA[20]。由图6可知,发芽期间各处理下发芽大豆AMADH活力变化趋势具有显著差异。NaCl胁迫处理4 d显著提高了大豆子叶中AMADH活力(p<0.05),其活力为对照的1.38倍,而胚中则无显著变化(p>0.05)。发芽4 d后,经NaCl联合LaCl3或Heparin处理发芽大豆子叶中AMADH活力较NaCl处理组显著下降,胚中LaCl3组则显著低于NaCl及其联合Heparin处理组。
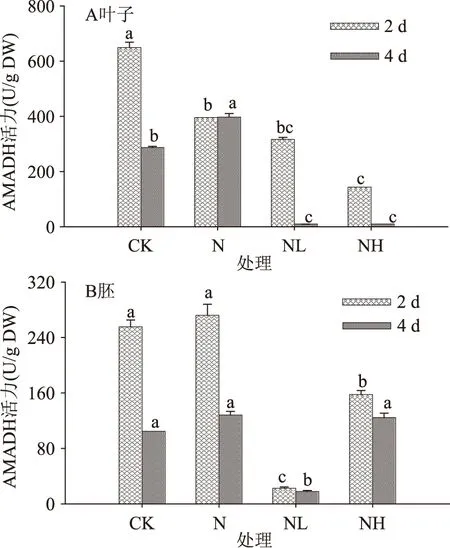
图6 钙离子通道抑制剂处理下发芽大豆AMADH活性变化Fig.6 Changes in AMADH activity of germinating soybeanunder calcium channel inhibitor treatment
2.2.3GABA含量图7显示各处理下发芽大豆子叶和胚中GABA含量都随发芽时间显著增加(p<0.05)。发芽4 d,单纯经NaCl处理的大豆子叶和胚中GABA含量显著高于对照,子叶中为对照的1.61倍,胚中则为1.87倍。NaCl联合LaCl3或Heparin处理后GABA含量与对照相比差异不显著,但均显著低于单纯经NaCl处理,这是由于GABA合成两途径中的限速酶GAD和AMADH的活力受到Ca2+通道抑制剂的影响(图5和图6)。发芽4 d时,NaCl联合LaCl3处理后,子叶和胚中GABA含量分别为NaCl处理的50%和79%,NaCl联合Heparin处理则分别为70%和66%,表明Ca2+通道参与调控植物中GABA代谢,且抑制内源钙库的释放对NaCl胁迫下GABA富集的影响小于抑制质膜钙离子通道。
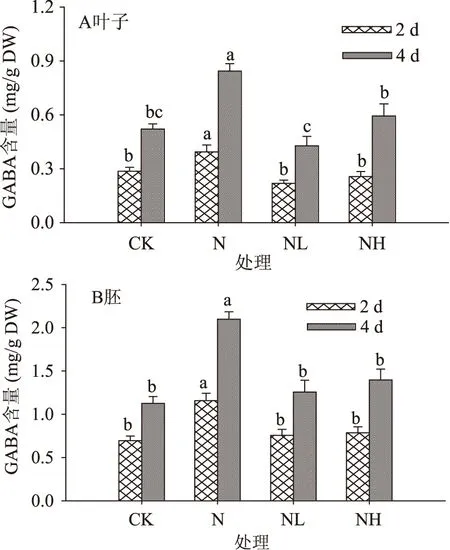
图7 钙离子通道抑制剂处理下发芽大豆GABA含量的变化Fig.7 Changes in GABA expression in germinating soybeanunder calcium channel inhibitor treatment
3 结论
相较单独NaCl处理,大豆籽粒发芽4 d期间经NaCl联合LaCl3(质膜钙离子通道抑制剂)处理,发芽大豆的芽长显著下降,发芽大豆生长受到进一步抑制,同时,钙离子通道抑制剂显著抑制了发芽大豆各部位脯氨酸含量;施用两种钙离子通道抑制剂均显著降低了发芽大豆子叶中GAD和AMADH活力,而胚中GABA代谢限速酶活力变化趋势不一致,且相较联合Heparin处理,联合LaCl3处理对GABA代谢限速酶活力影响较大,进而阻碍发芽大豆中GABA累积,但抑制效果存在差异,内源钙库的释放对NaCl胁迫下GABA富集的影响小于质膜钙离子通道。
[1]梁恒宇,邓立康,林海龙,等. 新资源食品-γ-氨基丁酸(GABA)的研究进展[J]. 食品研究与开发,2013,34(15):119-123.
[2]Wadei H A,Ullah M F,Wadei M. GABA(γ-aminobutyric acid),a non-protein amino acid counters theβ-adrenergic cascade-activated oncogenic signaling in pancreatic cancer:A review of experimental evidence[J]. Molecular Nutrition & Food Research,2011,55(12):1745-1758.
[3]Mody I,DE Koninck Y,Otis T,et al. Bridging the cleft at GABA synapses in the brain[J]. Trends in Neurosciences,1994,17(12):517-525.
[4]Bai Q,Yang R,Zhang L,et al. Salt Stress Induces Accumulation of γ-Aminobutyric Acid in Germinated Foxtail Millet(SetariaitalicaL.)[J]. Cereal Chemistry,2013,90(2):145-149.
[5]Yang R,Guo Q,Gu Z. GABA shunt and polyamine degradation pathway on γ-aminobutyric acid accumulation in germinating fava bean(ViciafabaL.)under hypoxia[J]. Food Chemistry,2013,136(1):152-159.
[6]Kleinw C M,Meyer A K,Selmar D. Malting revisited:Germination of barley(HordeumvulgareL.)is inhibited by both oxygen deficiency and high carbon dioxide concentrations[J]. Food Chemistry,2012,132(1):476-481.
[7]Yin Y,Yang r,Guo Q,et al. NaCl stress and supplemental CaCl2regulating GABA metabolism pathways in germinating soybean[J]. European Food Research and Technology,2014,238(5):781-788.
[8]BATISTIC O,KUDLA J. Integration and channeling of calcium signaling through the CBL calcium sensor/CIPK protein kinase network[J]. Planta,2004,219(6):915-924.
[9]贾如,雷梦琦,徐佳妮,等. 植物细胞中钙通道的分布及其在植物抗逆机制中作用的研究进展[J]. 植物生理学报,2014,50(12):1791-1800.
[10]王学奎. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2006.
[11]Bai Q,Chai M,Gu Z,et al. Effects of components in culture medium on glutamate decarboxylase activity and gamma-aminobutyric acid accumulation in foxtail millet(SetariaitalicaL.)during germination[J]. Food Chemistry,2009,116(1):152-157.
[12]Zhang H,Yao H,Chen F,et al. Purification and characterization of glutamate decarboxylase from rice germ[J]. Food Chemistry,2007,101(4):1670-1676.
[13]Petrivalsky M,Brauner F,Luhova L,et al. Aminoaldehyde dehydrogenase activity during wound healing of mechanically injured pea seedlings[J]. Journal of Plant Physiology,2007,164(11):1410-1418.
[15]Verbruggen N,Hermans C. Proline accumulation in plants:a review[J]. Amino Acids,2008,35(4):753-759.
[16]Maggio A,Miyazaki S,Veronese P,et al. Does proline accumulation play an active role in stress-induced growth reduction?[J]. The Plant Journal,2002,31(6):699-712.
[17]DE Lacerda C F,Cambraia J,Oliva M A,et al. Solute accumulation and distribution during shoot and leaf development in two sorghum genotypes under salt stress[J]. Environmental and Experimental Botany,2003,49(2):107-120.
[18]Moftah A E,Michel B E. The effect of sodium chloride on solute potential and proline accumulation in soybean leaves[J]. Plant Physiology,1987,83(2):238-240.
[19]Zhang H,Yao H-Y,Chen F,et al. Some molecular properties of glutamate decarboxylase from rice germ[J]. Food Chemistry,2007,105(1):65-71.
[20]Flores H E,Filner P. Polyamine catabolism in higher plants:characterization of pyrroline dehydrogenase[J]. Plant Growth Regulation,1985,3(3):277-291.
Physiological change and the regulation of γ-aminobutyric acid accumulation in germinated soybean under inhibitors of calcium channel treatment
YIN Yong-qi,LI Tong,WANG Shu-wen,SHI Ying-wu,GAO Lu,RAO Sheng-qi,YANG Zhen-quan,FANG Wei-ming*
(College of Food Science and Engineering,Yangzhou University,Yangzhou 225127,China)
The effect of membrane calcium channel inhibitor(LaCl3)and endometrium calcium channel inhibitor(Heparin)on the main physiological metabolism and γ-aminobutyric acid(GABA)accumulation in soybeans during germination under NaCl stress were investigated. Under NaCl combining LaCl3treatment,the growth of germinating soybeans was further suppressed,the sprout length decreased significantly,while no significant change was observed under heparin treatment. However,the respiratory rate both increased significantly under LaCl3and heparin treatment. Compared with NaCl treatment,rate-limiting enzyme activities of GABA metabolism in cotyledon decreased significantly under NaCl plus LaCl3or heparin treatment. Under LaCl3treatment,GABA content was 50% and 79% of the NaCl treatment in cotyledon and embryo,respectively. However,under heparin treatment,GABA content in cotyledon and embryo was 70% and 66% of the NaCl treatment,respectively. This result indicates that the inhibit effect of endogenous calcium stores on GABA content was smaller than membrane calcium channel.
germinated soybean;γ-aminobutyric acid;NaCl stress;inhibitor of calcium channel
2016-01-15
尹永祺(1988-),男,博士,讲师,研究方向:植物功能物质富集机理及技术,E-mail:yqyin@yzu.edu.cn。
方维明(1965-),男,博士,教授,研究方向:农产品加工及贮藏,E-mail:wmfang@yzu.edu.cn。
国家自然科学基金青年科学基金项目(31501401);江苏省自然科学基金青年基金(BK20150448);江苏省高校自然科学研究面上项目资助(15KJB550010);江苏省普通高校研究生科研创新计划项目(SJLX16_0901)。
TS210.1
A
1002-0306(2016)16-0122-05
10.13386/j.issn1002-0306.2016.16.016

