肢端型黑素瘤NRAS基因突变检测及预后分析
曾颖 康晓静 张祥月 靳颖 柴莉 曾明凤 王莹 王唯嘉
830001乌鲁木齐,新疆维吾尔自治区人民医院皮肤性病科(第一作者现在石河子大学医学院研究生院,832000)
肢端型黑素瘤NRAS基因突变检测及预后分析
曾颖 康晓静 张祥月 靳颖 柴莉 曾明凤 王莹 王唯嘉
830001乌鲁木齐,新疆维吾尔自治区人民医院皮肤性病科(第一作者现在石河子大学医学院研究生院,832000)
目的分析肢端黑素瘤临床及病理特点,检测肢端型黑素瘤NRAS基因突变情况,探讨NRAS基因突变与疾病预后的关系。方法收集经病理确诊的55例肢端型黑素瘤患者的临床及病理资料,提取其石蜡包埋组织及15例色素痣石蜡包埋组织DNA,采用PCR及DNA直接测序法检测NRAS基因突变。采用Cox比例风险回归模型进行单因素和多因素分析。结果55例肢端型黑素瘤患者中,6例(10.9%)发生NRAS突变,突变位于61密码子,以Q61R为主。NRAS基因1、2外显子及15例色素痣组织未见上述突变。6例NRAS突变患者中,4例发生淋巴结转移。多因素Cox回归模型分析中,临床分期晚(RR=2.54,95%CI:1.062~6.066)、未手术切除(RR=2.98,95%CI:1.316~ 3.525)、存在NRAS突变(RR=2.73,95%CI:0.932~ 3.257)为预后不良的独立影响因素(均P<0.05)。结论肢端型黑素瘤患者NRAS突变可能与淋巴结转移相关,临床分期、治疗方法、NRAS突变与预后有关。NRAS突变可能为肢端型黑素瘤提供一个新的预后评估指标。
黑色素瘤;NRAS基因;突变;预后
研究显示,黑素瘤的发生与基因突变密切相关,其中包括 BRAF[1⁃2]、KIT[3⁃4]、NRAS[5]等,前两者在肢端型及黏膜型黑素瘤中研究较多,而位于RAS/RAF/MEK/ERK途径的NRAS基因在肢端型黑素瘤中的突变研究较少。我们对肢端型黑素瘤NRAS基因突变进行检测,并结合临床及病理特点进行肢端型黑素瘤预后分析。
对象与方法
一、对象
选取新疆维吾尔自治区人民医院病理科及皮肤科2004年1月至2010年12月确诊为肢端型黑素瘤的石蜡包埋组织55份及色素痣石蜡包埋组织15份。
二、临床资料
55例肢端型黑素瘤患者均无家族史。发病年龄20~95(62±11.8)岁,其中20~40岁4例,41~50岁10例,51~60岁15例,61~70岁20例,71~95岁6例。男30例(54.55%),女25例(45.45%)。汉族患者22例(40%),维吾尔族患者33例(60%)。肢端型黑素瘤原发于手部10例(拇指甲下5例,其他指甲下3例,其他部位2例),原发于足45例(足跖28例,足跟10例,拇趾甲下2例,其他部位5例)。原发部位伴有溃疡者26例(47.27%),且溃疡多见于足掌趾。病程5 d至22年,中位病程32(11~38)个月,其中病程<1年者35例(63.63%),1~5年者15例(27.27%),>5年者5例(9.1%)。15例(27.27%)发生淋巴结转移,40例(72.73%)无淋巴结转移。参照美国癌症联合会(AJCC)临床分期,基于病理对原发病灶的评估,将初诊患者分为以下3期:Ⅱ期40例(72.73%),无区域及远处淋巴结转移;Ⅲ期10例(18.18%),有区域淋巴结转移;Ⅳ期5例(9.09%),有远处转移。55例患者中38例接受手术治疗(包括局部肿瘤切除、截指/趾及扩大切除),17例因年龄等特殊情况未接受手术治疗。
三、实验方法
1.DNA提取:石蜡包埋组织DNA提取按QIAamp DNA FFPE试剂盒(德国Qiagen公司)说明书进行,提取的DNA置-20℃保存备用。
2.PCR扩增:特异引物扩增NRAS基因1、2、3外显子。引物使用DNAMAN软件设计,由生工生物工程(上海)股份有限公司合成。外显子1上游引物:5′-TTTGCTTTCTCCAGTTTTCTGTT-3′;下游引物:5′-TGCTCCATTTCTGGCATCA-3′;外显子2 上游引物:5′-GGGTTTTCATTTCCATTGATT-3′;下游引物:5′-TGGGTAAAGATGATCCGACA-3′;外显子3 上游引物:5′-GACAAACCAGATAGGCAGAAAT-3′;下游引物:5′-TCCCCATAAAGATTCAGAACAC-3′。PCR反应体系(25 μl):上下游引物各0.5 μl,模板DNA 4 μl,Taq PCR Master Mix 12.5 μl,dNTP 7.5 μl。PCR反应条件:95℃预变性5 min;95℃变性50 s,外显子1、2、3的退火条件分别是56℃50 s、56.8℃50 s、60℃ 50 s,72℃延伸30 s,共35个循环;72℃总延伸5 min;温度降至4℃终止反应。以dNTP代替模板DNA作为阴性对照。
3.电泳鉴定:为证实PCR产物中含有目的片段DNA,取PCR扩增产物5 μl,经2%琼脂糖凝胶电泳(120 V)20 min,鉴定PCR扩增产量和特异性。
4.PCR扩增产物测序:将经电泳鉴定的PCR扩增产物25 μl送生工生物工程(上海)股份有限公司测序,所得结果与NCBI基因数据库中的序列进行对比,确定突变位点。同时对15例色素痣石蜡包埋组织进行PCR扩增,并对扩增产物测序。
四、随访
对入选本研究的55例肢端型黑素瘤患者进行电话随访,生存期的计算从患者接受手术之日起至死亡或2010年12月31日末次随访日止,至末次随访日仍存活者生存时间定为删失值。
五、统计学方法
应用SPSS22.0软件,单因素分析采用Kaplan⁃Meier法,多因素分析采用Cox比例风险回归模型,P<0.05为差异有统计学意义。
结 果
一、NRAS突变分析
1.目的片段鉴定:NRAS基因1、2、3外显子PCR扩增产物长度分别为410、278、376 bp。肢端黑素瘤、色素痣组织和阴性对照PCR扩增片段鉴定电泳见图1。
2.NRAS基因突变类型:55例肢端型黑素瘤患者中,6例NRAS基因的第3外显子发生Q61R点突变(图2),其编码的谷氨酰胺均被精氨酸所取代。NRAS基因1、2外显子及15例色素痣组织未见上述突变。
二、NRAS突变与临床特征之间的关系
6例发生NRAS突变的患者中,4例皮损位于足跖,1例位于足跟,1例位于拇指甲下;2例放射状生长,4例垂直性生长;4例有淋巴结转移,2例无淋巴结转移。15例淋巴结转移患者中4例检测到NRAS基因突变,40例无淋巴结转移患者中2例检测到NRAS突变,NRAS突变与淋巴结转移有关(χ2=5.269,P=0.041)。不同民族、性别、年龄之间,NRAS突变差异无统计学意义(P>0.05)。
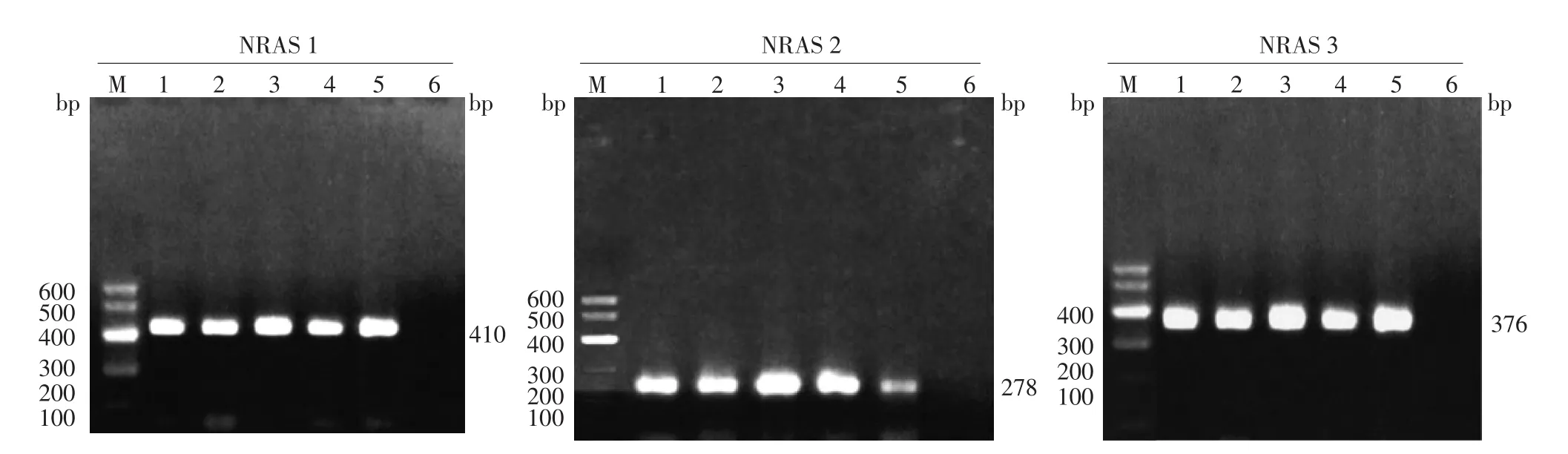
图1 NRAS基因1、2、3外显子PCR扩增片段凝胶电泳图 M:标准参照物;1:色素痣组织;2~5:肢端型黑素瘤组织;6:阴性对照。NRAS基因1、2、3外显子PCR扩增产物长度分别为410、278、376 bp
三、生存情况
55例患者均获得完整随访记录,中位(P25-P75)随访时间36(12~47)个月,随访期间死亡14例,中位(P25-P75)存活时间为32(11~ 38)个月。采用寿命表法计算1年、3年、5年生存率分别为79%、47%、32%,标准误分别为0.008 4、0.010 4、0.010 8。
四、影响肢端型黑素瘤生存时间的因素分析
Kaplan⁃Meier法进行单因素分析,Clark分级、临床分期、是否淋巴结转移、治疗方法、NRAS突变与预后有关(P<0.05),年龄、性别、民族、原发灶是否有溃疡与预后无关(表1)。将单因素分析中与预后不良有关的指标纳入模型进行逐步Cox回归模型分析,临床分期晚[β值=0.931 3,RR值(95%可信区间)为2.54(1.062~ 6.066),P=0.026]、未手术切除[β值=0.742,RR值(95%可信区间)为2.98(1.316~3.525),P=0.017]、存在NRAS突变[β值 =0.514,RR值(95%可信区间)为2.73(0.932~3.257),P=0.038]为预后不良的独立影响因素。
讨 论

图2 NRAS基因测序图 2A:外显子3上第61号密码中A被G取代(CAA→CGA),发生Q61R突变(杂合突变谷氨酰胺→精氨酸);2B:正常基因型
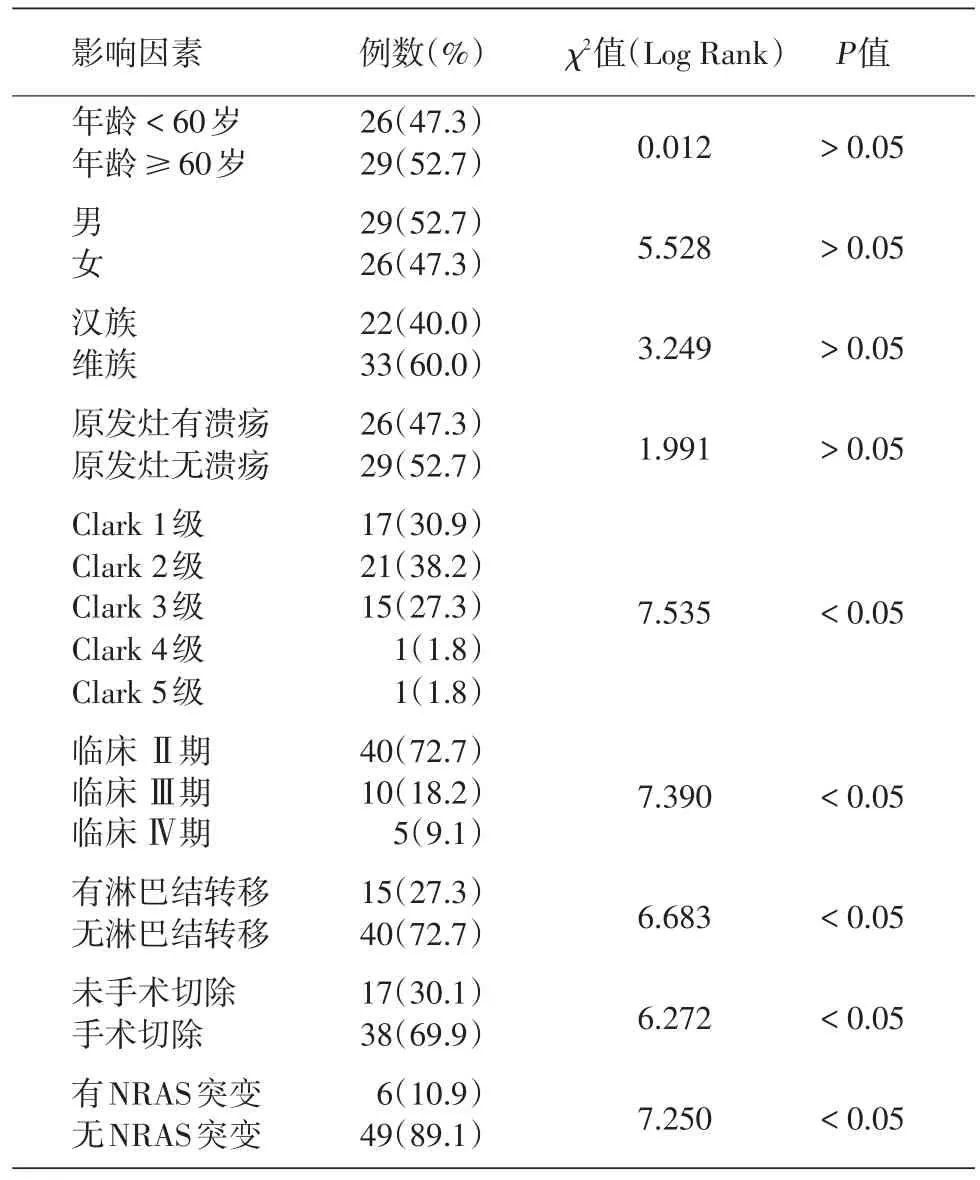
表1 影响肢端型黑素瘤生存时间的单因素分析
遗传易感性是黑素瘤发生的一个重要因素,可帮助阐释黑素瘤的发病机制,并促进分子靶向治疗的成熟。NRAS基因又名成神经细胞瘤鼠肉瘤癌基因,位于RAS/RAF/MEK/ERK途径,与黑素瘤发病密切相关。该基因首次从成神经细胞瘤中分离得到,定位于1号染色体,含7个外显子,基因全长85 kb,编码含495个氨基酸的蛋白质。在正常细胞中,RAS以非活化状态(GDP结合型)存在,当受到外源信号刺激,RAS发生磷酸化,构象改变而成为活化的GTP结合型,活化的GTP⁃RAS激活下游RAF信号转导蛋白,直到被降解。RAS基因最常见的激活方式为编码区内点突变。RAS位点的致瘤性点突变降低了RAS蛋白水解GTP为GDP的能力,其结果导致RAS蛋白与GTP持续性结合,引起下游通路持续性激活,使细胞产生不依赖于生长因子的恶性增殖,导致黑素瘤的发生。Greene等[6]和Rosso等[7]发现,NRAS的突变率在侵袭性黑素瘤的放射状生长期达55.2%,而在垂直生长期达75.9%,推测NRAS突变对于了解肿瘤生长及预后判断有一定的临床意义,在本研究的6例突变中,放射状生长2例,垂直性生长4例,与之前报道一致。
本研究中,肢端型黑素瘤好发于老年患者,发病年龄(62±11.8)岁,61~70岁肢端型黑素瘤患者最多,51~60岁次之,这与文献报道年龄分布基本相似[8]。指甲下及足跖是维吾尔族及汉族患者常见发病部位。肢端型黑素瘤起病时易被患者误认为是色素痣或是外伤后淤血,不能及时发现,故通常在数月后才被诊断,提示在临床诊疗时要提高对肢端型黑素瘤的认识,必要时结合组织病理、免疫组化等手段明确诊断,尽量避免漏诊、误诊,为患者争取更多生存时间。
研究显示,超过20%的黑素瘤患者存在NRAS基因突变[5],且突变主要位于第61、12、13位密码子[9⁃10],其中尤以第61位密码子突变率最高[11]。本研究55例肢端黑素瘤患者中,6例存在NRAS突变,位于第61位密码子,均为Q61R突变,该突变位点为突变热点[9⁃11]。本研究显示,6例NRAS突变患者中,4例存在淋巴结转移。有报道[12]显示,黑素瘤转移患者中NRAS突变率更高,提示NRAS突变可能与淋巴结甚至远处转移有关。
多因素Cox回归模型分析显示,临床分期、治疗方法、NRAS突变与预后有关,而单因素分析中Clark分级也与预后有关,这与本课题组前期分析一致[13]。研究[13]显示,Ⅰ、Ⅱ期患者皮损均限于局部,未发生转移,理论上可通过局部手术彻底清除肿瘤细胞,而Ⅲ、Ⅳ期患者已发生淋巴结或远处转移,治愈可能性较小,两者的预后及治疗方法有较大的区别。本研究显示,临床分期越晚,预后相对越差,且行病灶切除者预后稍好于未切除者。患者尽早手术切除病灶,可能延长生存时间。存在淋巴结及远处转移者临床分期通常较晚,而NRAS突变可能与淋巴结甚至远处转移相关[13]。本研究提示,NRAS突变与预后相关,突变者预后相对较差,NRAS突变可能为临床诊断提供一个依据,同时也可能成为一个新的预后评估指标。
[1]Long GV,Menzies AM,Nagrial AM,et al.Prognostic and clinico⁃pathologic associations ofoncogenic BRAF in metastatic melanoma[J].J Clin Oncol,2011,29(10):1239 ⁃1246.DOI:10.1200/JCO.2010.32.4327.
[2]郭芳,康晓静,唐小辉,等.新疆80例恶性黑素瘤BRAF基因突变分析[J].中华皮肤科杂志,2013,46(1):33⁃36.DOI:10.3760/cma.j.issn.0412⁃4030.2013.01.013.Guo F,Kang XJ,Tang XH,et al.Analysis of BRAF gene mutations in 80 patients with malignant melanoma in Xinjiang Uygur Autonomous Region[J].Chin J Dermatol,2013,46(1):33⁃36.DOI:10.3760/cma.j.issn.0412⁃4030.2013.01.013.
[3]Curtin JA,Busam K,Pinkel D,et al.Somatic activation of KIT in distinct subtypes of melanoma[J].J Clin Oncol,2006,24(26):4340⁃4346.DOI:10.1200/JCO.2006.06.2984.
[4] Kang XJ,Shi XH,Chen WJ,et al.Analysis of KIT mutations and c⁃KIT expression in Chinese Uyghur and Han patients with mela⁃noma[J].Clin Exp Dermatol,2016,41(1):81⁃87.DOI:10.1111/ced.12659.
[5] Flaherty KT,Hodi FS,Bastian BC.Mutation⁃driven drug develop⁃ment in melanoma[J].Curr Opin Oncol,2010,22(3):178⁃183.
[6]Greene VR,Johnson MM,Grimm EA,et al.Frequencies of NRAS and BRAF mutations increase from the radial to the vertical growth phase in cutaneous melanoma[J].J Invest Dermatol,2009,129(6):1483⁃1488.DOI:10.1038/jid.2008.374.
[7]Rosso R,Romagosa Y,Kirsner RS.Progression of NRAS and BRAF mutations in cutaneous melanoma[J].J Invest Dermatol,2009,129(6):1318.DOI:10.1038/jid.2009.107.
[8]孙东杰,高天文,李春英,等.肢端恶性黑素瘤100例临床和病理分析[J].中华皮肤科杂志,2003,36(10):556⁃558.DOI:10.3760/j.issn.0412⁃4030.2003.10.003.Sun DJ,Gao TW,Li CY,et al.Acral malignant melanoma:clinical⁃pathological features of 100 cases[J].Chin J Dermatol,2003,36(10):556⁃558.DOI:10.3760/j.issn.0412⁃4030.2003.10.003.
[9] Dahl C,Guldberg P.The genome and epigenome of malignant melanoma[J].APMIS,2007,115(10):1161⁃1176.DOI:10.1111/j.1600⁃0463.2007.apm_855.xml.x.
[10]Bloethner S,Scherer D,Drechsel M,et al.Malignant melanoma⁃⁃a genetic overview[J].Actas Dermosifiliogr,2009,100(Suppl 1):38⁃51.
[11]Jovanovic B,Egyhazi S,Eskandarpour M,et al.Coexisting NRAS and BRAF mutations in primary familial melanomas with specific CDKN2A germline alterations[J].J Invest Dermatol,2010,130(2):618⁃620.DOI:10.1038/jid.2009.287.
[12]Massi D,Simi L,Sensi E,et al.Immunohistochemistry is highly sensitive and specific for the detection of NRASQ61R mutation in melanoma[J].Mod Pathol,2015,28(4):487⁃497.DOI:10.1038/modpathol.2014.137.
[13]陈文静,康晓静,孙振柱,等.新疆地区96例维族恶性黑素瘤临床特征及预后分析[J].中国麻风皮肤病杂志,2015,31(5):259⁃261,264.Chen WJ,Kang XJ,Sun ZZ,et al.Clinical and prognostic analysis of 96 patients with malignant melanoma in Xinjiang Region[J].Chin J Lepr Skin Dis,2015,31(5):259⁃261,264.
Analysis of NRAS gene mutations and prognostic factors in patients with acral melanoma
Zeng Ying,Kang Xiaojing,Zhang Xiangyue,Jin Ying,Chai Li,Zeng Mingfeng,Wang Ying,Wang Weijia
Department of Dermatology and Venereology,People′s Hospital of Xinjiang Uygur Autonomous Region,Urumqi 830001,China(the current affiliation of the first author wasGraduate School,College of Medicine,Shihezi University,Shihezi 832002,Xinjiang,China)
ObjectiveTo detect NRAS gene mutations in patients with acral melanoma,and to analyze their relationship with the prognosis of acral melanoma.MethodsClinical and pathological data were collected from 55 patients with pathologically diagnosed acral melanoma.DNA was extracted from paraffin⁃embedded specimens from lesions of the 55 patients and 15 patients with nevus.PCR and direct DNA sequencing were performed to detect NRAS gene mutations.Univariate and multivariate analyses were performed using the Cox′s proportional hazards regression model.ResultsOf the 55 patients,6(10.9%)carried the Q61R mutation in codon 61 of the NRAS gene.No mutations were found in exon 1 or 2 of the NRAS gene in any of these paraffin⁃embedded specimens,and none of the pigmented nevus specimens harbored NRAS gene mutations.Of the 6 patients carrying NRAS gene mutations,4 had lymph node metastasis.Multivariate Cox regression analysis showed that independent factors of poor prognosis included advanced clinical stage(RR=2.54,95%CI:1.062-6.066,P< 0.05),not receiving surgical resection(RR=2.98,95%CI:1.316-3.525,P< 0.05),and carrying NRAS gene mutations(RR=2.73,95%CI:0.932-3.257,P< 0.05).Conclusions NRAS gene mutations may be associated with lymph node metastasis in patients with acral melanoma.The prognosis of acral melanoma may be associated with clinical staging,treatment strategies and NRAS gene mutations.Additionally,NRAS gene mutations may serve as a new index for predicting prognosis of acral melanoma.
Melanoma;NRAS gene;Mutation;Prognosis
Kang Xiaojing,Email:drkangxj666@163.com
康晓静,Email:drkangxj666@163.com
10.3760/cma.j.issn.0412⁃4030.2016.07.006
新疆维吾尔自治区国际科技合作计划(20146022)
Fund program:International Science and Technology Cooperation Project of Xinjiang Uygur Autonomous Region(20146022)
2015⁃09⁃30)
(本文编辑:周良佳 颜艳)

