熊果酸对干扰素γ刺激HaCaT细胞产生白细胞介素33的影响
胡华 宋向凤 孙敏 付丹丹 李敏 田中伟
453100河南,新乡医学院第一附属医院皮肤科(胡华、孙敏、付丹丹、李敏、田中伟);新乡医学院基础医学院(宋向凤)
熊果酸对干扰素γ刺激HaCaT细胞产生白细胞介素33的影响
胡华 宋向凤 孙敏 付丹丹 李敏 田中伟
453100河南,新乡医学院第一附属医院皮肤科(胡华、孙敏、付丹丹、李敏、田中伟);新乡医学院基础医学院(宋向凤)
目的探讨熊果酸对干扰素γ(IFN⁃γ)刺激HaCaT细胞产生白细胞介素33(IL⁃33)的影响及其机制。方法不同浓度熊果酸(0、0.1、1、5、10、20、40、80 μmol/L)分别刺激HaCaT细胞24、48、72 h,MTT法检测其对细胞增殖的影响。将HaCaT细胞与200 μg/L IFN⁃γ共培养建成炎性细胞模型,再与10和15 μmol/L熊果酸共培养,以IFN⁃γ诱导的HaCaT炎性细胞模型为对照,探讨熊果酸的抗炎作用,RT⁃PCR法检测IL⁃6和IL⁃33 mRNA的表达,Western印迹法检测IL⁃33、p⁃ERK1/2和ERK1/2蛋白的表达。结果MTT法检测显示,5~20 μmol/L熊果酸作用24 h对细胞活力影响不大,而40~80 μmol/L熊果酸在各个时间点均可明显抑制HaCaT细胞增殖(P< 0.05),故后续实验采用10和15 μmol/L浓度。HaCaT细胞经IFN⁃γ刺激后,IL⁃33 mRNA(0.812± 0.036)、IL⁃6 mRNA(0.947±0.091)表达量和IL⁃33蛋白表达(1.317±0.119)均显著高于空白对照组(分别为0.412±0.021、0.595±0.030和0.147±0.036,均P<0.05);而IFN⁃γ+10 μmol/L熊果酸组(分别为0.447±0.042、0.437±0.099和0.923±0.058)和IFN⁃γ+15 μmol/L熊果酸组(分别为0.438±0.028、0.350±0.075和0.564±0.113)又较IFN⁃γ组(分别为0.812±0.036、0.947±0.091和1.317±0.119)显著降低(均P<0.05),且这两个熊果酸组IL⁃33 mRNA水平与空白对照组相比差异无统计学意义(P>0.05),而IFN⁃γ+15 μmol/L熊果酸组IL⁃33蛋白水平显著低于IFN⁃γ +10 μmol/L熊果酸组(P< 0.05)。HaCaT细胞分别经IFN⁃γ刺激5、60 min后,p⁃ERK1/2蛋白表达均明显高于空白对照组。IFN⁃γ+15 μmol/L熊果酸5 min组和60 min组p⁃ERK1/2蛋白的相对表达量(0.458±0.053、0.302±0.054)分别低于IFN⁃γ 5 min组(0.941±0.042)和60 min组(0.509±0.032),差异均有统计学意义(P<0.05),而总ERK1/2蛋白表达量不变。结论熊果酸能够降低IFN⁃γ刺激的HaCaT细胞IL⁃33的表达量,其机制可能与调节ERK信号通路相关蛋白的表达有关。
熊果酸;干扰素γ;白细胞介素1;白细胞介素6;细胞外信号调节MAP激酶类;HaCaT细胞;白细胞介素33
抗白细胞介素(IL)⁃23、肿瘤坏死因子(TNF)和IL⁃17等细胞因子在银屑病治疗中的成功应用,使免疫靶向治疗成为治疗银屑病的新策略[1⁃3]。IL⁃33,一个新近发现的IL⁃1家族成员,在银屑病中表达明显增多,为阐明银屑病的发病机制提供了新前景[4⁃5]。熊果酸,一个五环三萜类化合物,是许多植物如苹果、小红莓、薄荷、迷迭香、牛至和梅干中的成分[6],具有抗氧化、抗炎、抗肿瘤、免疫调节等多种生物学活性[7⁃10]。文献[8]报道,在淋巴细胞中熊果酸通过抑制丝裂原活化蛋白激酶(MAPK)、NF⁃κB等信号通路的活化,减少IL⁃6、干扰素γ(IFN⁃γ)等炎性细胞因子的表达来发挥抗炎活性。尽管熊果酸在多种免疫相关疾病中发挥抗炎作用,然而,它在炎症性皮肤疾病中发挥着怎样的作用及其作用机制尚未阐明。本实验选取人角质形成细胞系HaCaT细胞为对象,探讨熊果酸对IFN⁃γ刺激HaCaT细胞产生IL⁃33、IL⁃6的影响及其可能的抗炎机制。
材料与方法
一、材料
人正常表皮永生化角质形成细胞系HaCaT细胞购自中国医学科学院基础医学研究所北京协和医学院细胞资源中心;用二甲基亚砜(DMSO,美国Sigma公司)溶解熊果酸(美国Sigma公司,纯度>90%)至20 mmol/L,分装后于-20℃保存备用,使用前用磷酸盐缓冲液(PBS)稀释为工作液浓度,DMSO终浓度 <0.01%;MEM/EBSS液体培养基(美国HyClone公司);胎牛血清(以色列Biological Industries公司);重组人IFN⁃γ(北京义翘神州生物技术有限公司);噻唑蓝(MTT,美国Sigma公司);Trizol核酸提取液(美国Invitrogen公司);抗IL⁃33鼠抗(美国Abcam公司);抗ERK1/2、p⁃ERK1/2兔抗(美国CST公司),二抗(HRP标记羊抗兔IgG、羊抗鼠IgG)(上海碧云天生物技术有限公司)。
二、方法
1.细胞培养:HaCaT细胞用含10%胎牛血清的MEM/EBSS培养基常规37℃、5%CO2培养箱中培养,取对数生长期细胞用于实验。
2.MTT法检测不同浓度熊果酸作用不同时间对HaCaT细胞增殖的影响:将HaCaT细胞以5×104个/ml接种于96孔板,每孔200 μl,每组设3个复孔。每孔加入熊果酸工作液,使其终浓度分别为0.1、1、5、10、20、40和80 μmol/L,空白对照组加等量DMSO。分别于培养24、48、72 h加MTT,细胞培养箱中继续孵育4 h,弃掉培养液,加入200 μl DMSO充分振荡,于490 nm波长处用酶标仪测定各孔吸光度A值,实验重复3次。
3.RT⁃PCR法检测IL⁃33和IL⁃6 mRNA表达:将HaCaT细胞以1.5×105个/ml接种于6孔板,每孔3 ml,用不同浓度IFN⁃γ(12.5、25、50、100、200 μg/L)刺激HaCaT细胞12 h,以正常培养的细胞为对照组。选取一个对IL⁃33 mRNA促进作用最明显的IFN⁃γ浓度作为后续诱导HaCaT炎性细胞模型的浓度。然后,实验分为:空白对照组(HaCaT细胞不作任何处理)、熊果酸对照组(10 μmol/L熊果酸组和15 μmol/L熊果酸组)、模型组(IFN⁃γ诱导的HaCaT炎性细胞模型,即IFN⁃γ组)和干预组(IFN⁃γ+10 μmol/L熊果酸组和IFN⁃γ +15 μmol/L熊果酸组)。所有实验组均作用12 h,其中,干预组先用IFN⁃γ预处理1 h,然后再加入熊果酸作用12 h。Trizol法提取总RNA后参照说明书进行反转录,然后进行PCR。引物由苏州金唯智生物科技有限公司合成,IL⁃33引物序列上游5′⁃GTGACGGTGCTGAT GGTAAGATG⁃3′,下游5′⁃CCTGGTCTGGCAGTGGTT TT⁃3′(130 bp);IL⁃6 引物序列上游 5′⁃CACACAGAC AGCCACTCACC⁃3′,下游 5′⁃TTTTCTGCCAGTGCCT CTTT⁃3′(139 bp);内参GAPDH 引物序列上游5′⁃TCAACAGCGACACCCACTCC⁃3′,下游5′⁃TGAGGTC CACCACCCTGTTG⁃3′(126 bp)。PCR 反应条件:95℃预变性5 min;95℃变性10 s、退火30 s、72℃延伸30 s,循环32次;72℃延伸10 min。PCR产物经1.5%琼脂糖凝胶电泳后成像,分别以目的基因扩增产物电泳条带总灰度与GAPDH电泳条带总灰度之比表示各自mRNA的相对强度,实验重复3次。RT⁃PCR图片采用Image J图像处理软件进行处理。由于IL⁃33丰度低,不易检测,而IL⁃6是经典的炎性因子,丰度高容易检测,故用IL⁃6做阳性对照,以排除药物无效因素。
4.蛋白印迹法检测IL⁃33、ERK1/2及p⁃ERK1/2蛋白的表达:将HaCaT细胞以1.5×105个/ml接种于6孔板,每孔3 ml,实验分组同上,检测IL⁃33蛋白表达。ERK1/2及p⁃ERK1/2蛋白表达的检测实验分组如下:空白对照组(HaCaT细胞不加任何处理)、15 μmol/L熊果酸组、IFN⁃γ 5 min组、IFN⁃γ 60 min组、IFN⁃γ +15 μmol/L熊果酸5 min组和IFN⁃γ +15 μmol/L熊果酸60 min组。联合组先用IFN⁃γ预处理,然后再加入熊果酸。提取各组细胞蛋白,制胶,上样,电泳,转膜,加入一抗IL⁃33(1∶1 000)、p⁃ERKl/2(1∶2 000)、ERKl/2(1∶1 000)和 β 肌动蛋白(1∶1 000),4℃孵育过夜,洗膜后分别加入二抗(1∶3 000)室温摇床孵育1 h,洗膜后加入化学发光液显色,X线曝光,显影,激光扫描仪扫描,分别以目的蛋白总吸光度与β肌动蛋白总吸光度之比表示各蛋白的相对强度,实验重复3次。Western印迹条带采用Image J图像处理软件进行处理。
5.统计学处理:数据以x±s表示,用SPSS19.0软件进行统计分析,采用重复测量的方差分析、单因素方差分析及LSD⁃t检验、析因设计的方差分析,P<0.05为差异有统计学意义。
结 果
一、熊果酸对HaCaT细胞增殖的影响
重复测量资料的方差分析显示,不同浓度熊果酸(0.1、1、5、10、20、40、80 μmol/L)对HaCaT细胞增殖的影响不同(F=153.5,P<0.001),24~72 h不同时间点间细胞存活率也有差异(F=191.2,P<0.001),且熊果酸浓度与作用时间有交互作用(F=18.01,P< 0.01),表明不同浓度熊果酸对HaCaT细胞增殖活性的作用随时间的变化趋势不完全一致。进一步分析显示,40~80 μmol/L熊果酸在各个时间点均可明显抑制HaCaT细胞增殖(P<0.05),而5 ~ 20 μmol/L熊果酸作用24 h对细胞活力影响不大,满足实验需要。所以后续实验只使用10和15 μmol/L浓度。见图1。
二、熊果酸对IFN⁃γ刺激的HaCaT细胞IL⁃33和IL⁃6 mRNA的影响
不同浓度IFN⁃γ(12.5、25、50、100、200 μg/L)刺激HaCaT细胞,IL⁃33 mRNA相对表达量分别为0.743± 0.114、0.881± 0.073、0.886± 0.064、0.891±0.105、1.058±0.034,对照组为0.742±0.023。经单因素方差分析,各组差异有统计学意义(F=7.016,P< 0.05),再行LSD⁃t检验发现,200 μg/L IFN⁃γ组IL⁃33 mRNA相对表达量显著高于其他各组,差异有统计学意义(均P< 0.05),说明200 μg/L IFN⁃γ对IL⁃33 mRNA表达的促进作用最为明显,因此后续IFN⁃γ诱导HaCaT炎性细胞模型均用此浓度。

图1 不同浓度熊果酸作用不同时间对HaCaT细胞活力的影响1:空白对照组;2 ~ 8:分别为0.1、1、5、10、20、40、80 μmol/L熊果酸组。5~20 μmol/L熊果酸作用24 h对细胞活力影响不大。a:与同一时间空白对照组比较,P<0.05
熊果酸和IFN⁃γ作用于HaCaT细胞,析因设计的方差分析显示,熊果酸与IFN⁃γ存在交互作用(P<0.01)。单独效应分析显示,HaCaT细胞经200 μg/L IFN⁃γ刺激后,IL⁃33和IL⁃6 mRNA表达量均显著高于空白对照组(P<0.05),而IFN⁃γ +10 μmol/L熊果酸组和IFN⁃γ +15 μmol/L熊果酸组IL⁃33、IL⁃6 mRNA表达量又较IFN⁃γ组显著降低(P<0.05),且这两个熊果酸组IL⁃33 mRNA水平恢复到空白对照组水平,与空白对照组相比差异无统计学意义(P>0.05)。见表1。
三、熊果酸对IFN⁃γ刺激的
HaCaT细胞中IL⁃33和p⁃ERK1/2、总ERK1/2蛋白表达的影响
蛋白印迹结果显示,熊果酸与IFN⁃γ对HaCaT细胞IL⁃33蛋白的表达有交互作用(P<0.01)。单独效应分析显示,HaCaT细胞经IFN⁃γ刺激后,IL⁃33蛋白表达显著高于空白对照组(P<0.05),而IFN⁃γ+10 μmol/L熊果酸组和IFN⁃γ +15 μmol/L熊果酸组均较IFN⁃γ组降低,差异有统计学意义(P< 0.05),且IFN⁃γ +15 μmol/L熊果酸组低于IFN⁃γ +10 μmol/L熊果酸组(P<0.05)。见表1,图2。
熊果酸对IFN⁃γ刺激的HaCaT细胞p⁃ERK1/2蛋白表达的影响,各组差异有统计学意义(F=72.075,P<0.05)。HaCaT细胞分别经IFN⁃γ刺激5 min、60 min后,p⁃ERK1/2蛋白表达均明显高于空白对照组。IFN⁃γ +15 μmol/L熊果酸5 min组和IFN⁃γ +15 μmol/L熊果酸60 min组p⁃ERK1/2蛋白的相对表达量(分别为0.458±0.053、0.302±0.054)分别低于IFN⁃γ 5 min组和IFN⁃γ 60 min组(0.941±0.042、0.509±0.032),差异有统计学意义(均P<0.05),而总ERK1/2蛋白表达量不变,见图3、4。
讨 论
淋巴细胞亚群失调和细胞因子表达异常是银屑病主要发病机制之一,因此用药物调节机体的免疫紊乱、恢复正常免疫状态一直是银屑病治疗的一个方向[11⁃12]。IL⁃33被认为是一种双效型细胞因子,类似于高迁移率族蛋白1(HMGB1),既可作为核蛋白而发挥生理调节作用,也可在细胞受到损伤时被释放至胞外,作为一个内源性的危险信号而发挥致炎作用。IL⁃33高表达于上皮细胞、内皮细胞和成纤维细胞[13],其受体ST2L主要表达于Th2细胞、肥大细胞等,故一般认为IL⁃33可诱导Th2细胞应答[5,14]。研究显示,IL⁃33与多种炎症性皮肤病(包括银屑病)密切相关[12]。Hueber等[5]通过活组织检测发现,与银屑病患者非病灶区皮肤组织相比,病灶区和病灶周围皮肤组织标本IL⁃33和ST2的表达均显著增加。本课题组前期研究也发现,银屑病患者病灶区皮肤组织IL⁃33及其受体ST2的表达均较健康对照组显著增多。提示IL⁃33/ST2在银屑病的发生发展中起着重要作用。
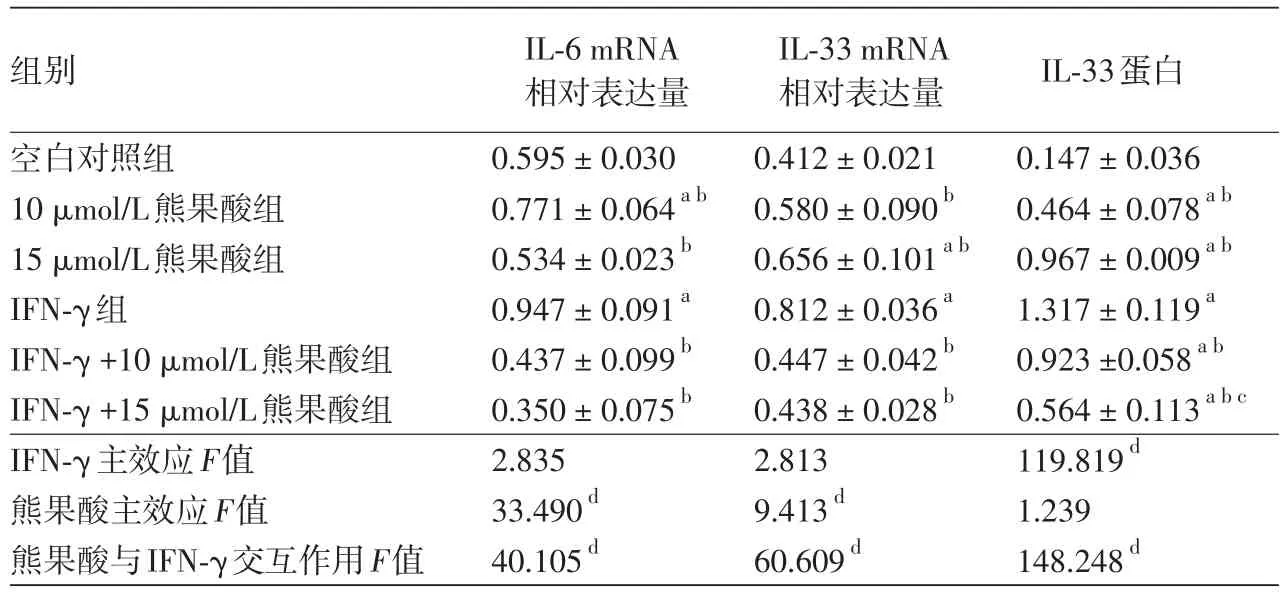
表1 熊果酸和干扰素γ(IFN⁃γ)对HaCaT细胞白细胞介素(IL)⁃6 mRNA、IL⁃33 mRNA和IL⁃33蛋白表达的影响(x± s)
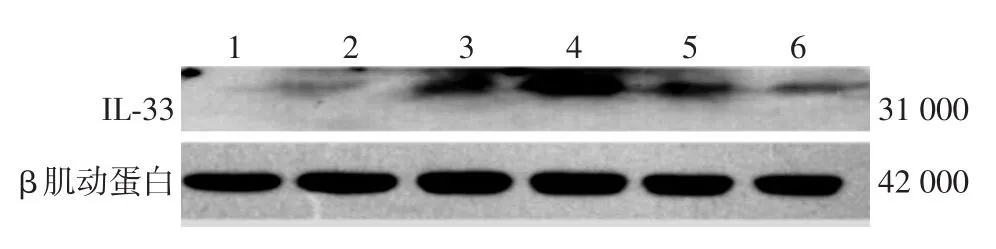
图2 不同浓度熊果酸对IFN⁃γ诱导的HaCaT细胞IL⁃33蛋白表达的影响 1:空白对照组;2:10 μmol/L熊果酸组;3:15 μmol/L熊果酸组;4:IFN⁃γ组;5:IFN⁃γ +10 μmol/L熊果酸组;6:IFN⁃γ +15 μmol/L熊果酸组。HaCaT细胞在IFN⁃γ作用下,IL⁃33蛋白表达量增高;加入10和15 μmol/L熊果酸后,IL⁃33蛋白表达量均降低

图3 15 μmol/L熊果酸对IFN⁃γ诱导的HaCaT细胞p⁃ERK1/2和总ERE1/2的影响 1:空白对照组;2:熊果酸组;3:IFN⁃γ 5 min组;4:IFN⁃γ 60 min组;5:IFN⁃γ + 熊果酸5 min组;6:IFN⁃γ + 熊果酸60 min组;IFN⁃γ作用于HaCaT细胞5 min、60 min,均可使ERK的磷酸化水平升高;加入熊果酸又可降低ERK的磷酸化水平
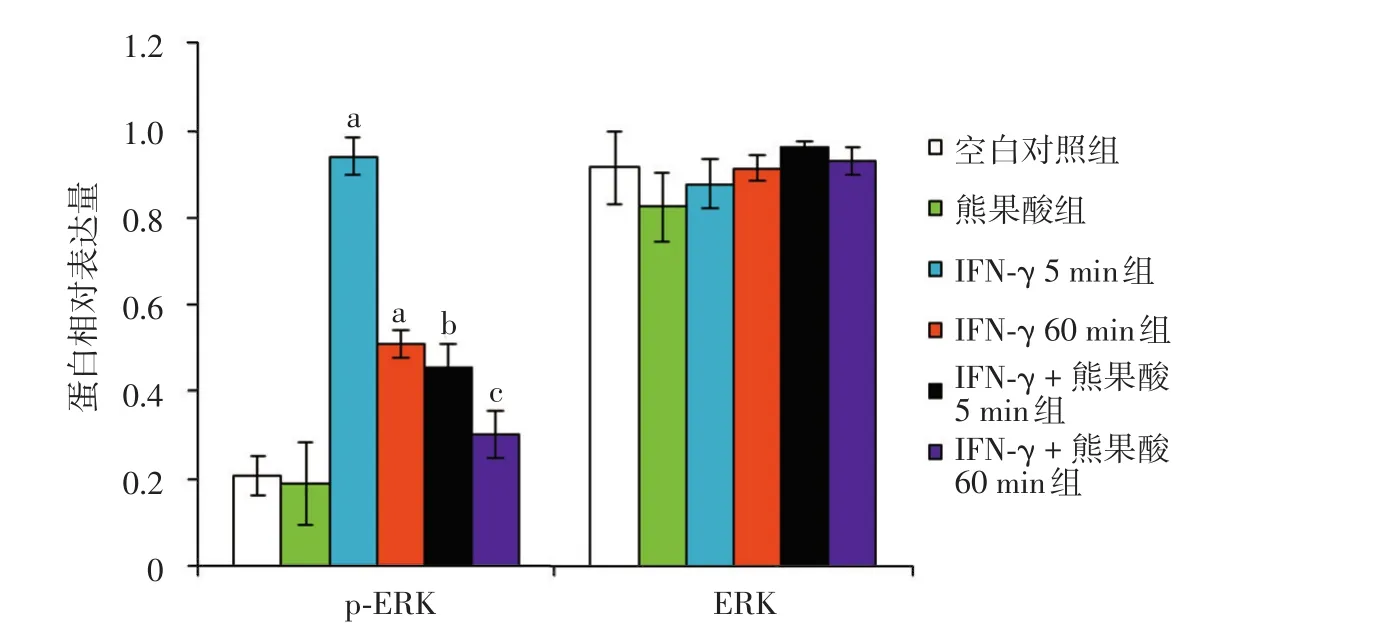
图4 15 μmol/L熊果酸对IFN⁃γ诱导的HaCaT细胞p⁃ERK1/2和总ERK1/2的影响 a:与空白对照组比较,P< 0.05;b:与IFN⁃γ 5 min组比较,P< 0.05;c:与IFN⁃γ 60 min组比较,P< 0.05
熊果酸的抗炎作用及其相关机制研究报道甚少。本研究预实验探究熊果酸对HaCaT作用的最适浓度,结果显示,5~20 μmol/L熊果酸对细胞活力影响不大,因此选用10和15 μmol/L两个浓度进行后续研究。由于INF⁃γ可诱导HaCaT细胞中IL⁃33和IL⁃6表达增高[15],本研究采用INF⁃γ刺激HaCaT细胞以制备细胞炎症模型,在此基础上加入熊果酸后,IL⁃33和IL⁃6表达量降低,说明熊果酸有抑制炎症的作用。此外,我们还发现,熊果酸单独作用于HaCaT细胞能够促进IL⁃33的表达,这可能与熊果酸具有的双向免疫调节作用有关[16],也可能是其作为一种外来刺激物对细胞内环境产生影响的结果。有研究报道了熊果酸这种双向免疫调节作用。You等[17]发现,在未活化的的巨噬细胞中,熊果酸可以通过反式激活NF⁃κB诱导NO和TNF⁃α mRNA表达增强,而在活化的巨噬细胞中,熊果酸则表现出抗炎作用。
为进一步探讨熊果酸抑制炎症性细胞因子表达的信号途径,我们选取了ERK信号途径,因为有报道熊果酸的抗炎作用主要是通过抑制AP⁃1、NF⁃κB 和 NF⁃AT 三大信号通路来实现的[8,18⁃19]。ERK、p38和JNK是活化AP⁃1的主要上游信号,而IFN⁃γ通过ERK、p38、EGFR等信号途径调节IL⁃33的表达[15,20]。因此,ERK信号途径可能是熊果酸降低炎症因子IL⁃33表达并发挥抗炎活性的主要通路之一。我们的研究结果也表明,熊果酸可抑制ERK的磷酸化水平,提示熊果酸可通过抑制ERK的活化来发挥抗炎活性。
综上,本实验首次研究了熊果酸对IFN⁃γ刺激的HaCaT细胞产生炎症因子的影响,并且探讨了熊果酸抑制IL⁃33表达的机制——抑制ERK信号通路活化。但熊果酸在p38、EGFR和JAK⁃STAT1信号通路中对IL⁃33表达是否有影响还未知,这将成为下一步研究重点。期望通过一系列研究探明熊果酸在炎症性皮肤病中的作用机制,为熊果酸在临床中的应用提供理论基础。
志谢 新乡医学院免疫学研究中心帮助完成实验
[1]Krueger GG,Langley RG,Leonardi C,et al.A human interleukin⁃12/23 monoclonal antibody for the treatment of psoriasis[J].N EnglJMed,2007,356(6):580⁃592.DOI:10.1056/NEJMoa062382.
[2]Lowes MA,Bowcock AM,Krueger JG.Pathogenesis and therapy of psoriasis[J].Nature,2007,445(7130):866 ⁃873.DOI:10.1038/nature05663.
[3] Ratner M.IL⁃17⁃targeting biologics aim to become standard of care in psoriasis[J].Nat Biotechnol,2015,33(1):3 ⁃4.DOI:10.1038/nbt0115⁃3.
[4] Schmitz J,Owyang A,Oldham E,et al.IL⁃33,an interleukin⁃1⁃like cytokine that signals via the IL⁃1 receptor⁃related protein ST2 and induces T helper type 2 ⁃associated cytokines[J].Immunity,2005,23(5):479⁃490.DOI:10.1016/j.immuni.2005.09.015.
[5] Hueber AJ,Alves⁃Filho JC,Asquith DL,et al.IL⁃33 induces skin inflammation with mast cell and neutrophil activation[J].Eur J Immunol,2011,41(8):2229 ⁃2237.DOI:10.1002/eji.201041360.
[6] Liu J.Pharmacology of oleanolic acid and ursolic acid[J].J Ethnopharmacol,1995,49(2):57⁃68.
[7] Liobikas J,Majiene D,Trumbeckaite S,et al.Uncoupling and antioxidant effects of ursolic acid in isolated rat heart mitochondria[J].JNatProd,2011,74(7):1640⁃1644.DOI:10.1021/np200060p.
[8] Checker R,Sandur SK,Sharma D,et al.Potent anti⁃inflammatory activity of ursolic acid,a triterpenoid antioxidant,is mediated through suppression of NF⁃κB,AP⁃1 and NF⁃AT[J].PLoS One,2012,7(2):e31318.DOI:10.1371/journal.pone.0031318.
[9] Shanmugam MK,Dai X,Kumar AP,et al.Ursolic acid in cancer prevention and treatment:molecular targets,pharmacokinetics and clinical studies[J].Biochem Pharmacol,2013,85(11):1579⁃1587.DOI:10.1016/j.bcp.2013.03.006.
[10] Ikeda Y,Murakami A,Fujimura Y,et al.Aggregated ursolic acid,a natural triterpenoid,induces IL⁃1beta release from murine peritoneal macrophages:role of CD36[J].J Immunol,2007,178(8):4854⁃4864.
[11]王刚.银屑病免疫学研究新进展[J].中华皮肤科杂志,2015,48(4):223⁃226.DOI:10.3760/cma.j.issn.0412⁃4030.2015.04.001.Wang G.Advances in the immunology of psoriasis[J].Chin J Dermatol,2015,48(4):223⁃226.DOI:10.3760/cma.j.issn.0412⁃4030.2015.04.001.
[12]宋向凤,田中伟.IL⁃33与皮肤炎症性疾病关系的研究进展[J].细胞与分子免疫学杂志,2014,30(9):1000⁃1003.DOI:10.13423/j.cnki.cjcmi.007107.Song XF,Tian ZW.Advances in the correlation between interleukin⁃33 and skin inflammatory disease[J].Chin J Cell Mol Immunol,2014,30(9):1000 ⁃1003.DOI:10.13423/j.cnki.cjcmi.007107.
[13] Xu D,Jiang HR,Kewin P,et al.IL⁃33 exacerbates antigen⁃induced arthritis by activating mast cells[J].Proc Natl Acad Sci USA,2008,105(31):10913 ⁃10918.DOI:10.1073/pnas.0801898105.
[14]Moussion C,Ortega N,Girard JP.The IL⁃1⁃like cytokine IL⁃33 is constitutively expressed in the nucleus of endothelial cells and epithelial cellsin vivo:a novel′alarmin′?[J].PLoS One,2008,3(10):e3331.DOI:10.1371/journal.pone.0003331.
[15]Meephansan J,Tsuda H,Komine M,et al.Regulation of IL⁃33 expression by IFN⁃γ and tumor necrosis factor⁃α in normal human epidermal keratinocytes[J].J Invest Dermatol,2012,132(11):2593⁃2600.DOI:10.1038/jid.2012.185.
[16] Ikeda Y,Murakami A,Ohigashi H.Ursolic acid:an anti⁃and pro⁃inflammatory triterpenoid[J].Mol Nutr Food Res,2008,52(1):26⁃42.DOI:10.1002/mnfr.200700389.
[17]You HJ,Choi CY,Kim JY,et al.Ursolic acid enhances nitric oxide and tumor necrosis factor⁃alpha production via nuclear factor⁃kappaB activation in the resting macrophages[J].FEBS Lett,2001,509(2):156⁃160.DOI:10.1016/S0014⁃5793(01)03161⁃1.
[18]Ma JQ,Ding J,Zhang L,et al.Ursolic acid protects mouse liver against CCl4⁃induced oxidative stress and inflammation by the MAPK/NF⁃κB pathway[J].Environ Toxicol Pharmacol,2014,37(3):975⁃983.DOI:10.1016/j.etap.2014.03.011.
[19] Yoon JH,Youn K,Ho CT,et al.p⁃Coumaric acid and ursolic acid from corni fructus attenuated β ⁃amyloid(25 ⁃35)⁃induced toxicity through regulation of the NF ⁃κB signaling pathway in PC12 cells[J].J Agric Food Chem,2014,62(21):4911 ⁃4916.DOI:10.1021/jf501314g.
[20]Li N,McLaren JE,Michael DR,et al.ERK is integral to the IFN⁃γ⁃mediated activation of STAT1,the expression of key genes implicated in atherosclerosis,and the uptake ofmodified lipoproteins by human macrophages[J].J Immunol,2010,185(5):3041⁃3048.DOI:10.4049/jimmunol.1000993.
Effects of ursolic acid on interleukin⁃33 expression in HaCaT cells induced by interferon⁃γ
Hu Hua,Song Xiangfeng,Sun Min,Fu Dandan,Li Min,Tian Zhongwei
Deparment of Dermatology,First Affiliated Hospital of Xinxiang Medical University,Xinxiang 453100,Henan,China(Hu H,Sun M,Fu DD,Li M,Tian ZW);School of Basic Medical Sciences,Xinxiang Medical University,Xinxiang 453100,Henan,China(Song XF)
ObjectiveTo evaluate effects of ursolic acid(UA)on interleukin⁃33(IL⁃33)expression in HaCaT cells induced by interferon⁃γ(IFN⁃γ),and to explore their mechanism.MethodsSome HaCaT cells were treated with UA at different concentrations(0,0.1,1,5,10,20,40 and 80 μmol/L)for 24,48 and 72 hours separately.Then,methyl thiazolyl tetrazolium(MTT)assay was conducted to evaluate cell proliferative activity.A cell model of inflammation was established by culture of HaCaT cells with the presence of 200 μg/L IFN⁃γ.Some HaCaT cells were classified into several groups to be treated with IFN⁃γ(200 μg/L)and UA(10 and 15 μmol/L)alone or in combination(firstly treated with IFN⁃γ followed by UA treatment),and those receiving no treatment served as the blank control group.Reverse transcription PCR(RT⁃PCR)was performed to detect mRNA expressions of IL⁃6 and IL⁃33,and Western⁃blot analysis to measure IL⁃33 protein expression after 12⁃hour culture.The expressions of extracelluar signal⁃regulated kinase 1/2(ERK1/2)and phosphorylated ERK1/2(p⁃ERK1/2)were also measured by Western⁃blot analysis after 5⁃and 60⁃minute treatments with IFN⁃γ and UA alone or in combination.ResultsMTT assay showed that the treatments with 5-20 μmol/L UA for 24 hours had no effects on cell proliferative activity,while 40-80 μmol/L UA could significantly inhibit it at 24,48 and 72 hours(allP< 0.05).Thus,10 and 15 μmol/L were chosen as the concentrations of UA for further study.After the treatment with 200 μg/L IFN⁃γ,there was a significant increase in the expressions of IL⁃33 mRNA(0.812 ± 0.036vs.0.412 ± 0.021),IL⁃6 mRNA(0.947 ± 0.091vs.0.595 ± 0.030)and IL⁃33 protein(1.317 ± 0.119vs.0.147 ± 0.036)in HaCaT cells compared with the blank control group(allP< 0.05).Compared with the IFN⁃γ group,the IFN⁃γ +10⁃μmol/L UA group and IFN⁃γ +15⁃μmol/L UA group both showed significantly decreased expressions of IL⁃33 mRNA(0.447 ± 0.042 and 0.438 ± 0.028 respectively,bothP< 0.05),IL⁃6 mRNA(0.437±0.099 and 0.350±0.075 respectively,bothP<0.05)and IL⁃33 protein(0.923±0.058 and 0.564±0.113 respectively,bothP< 0.05).There were no significant differences in IL⁃33 mRNA expression between the IFN⁃γ +10⁃or 15⁃μmol/L UA group and blank control group(P> 0.05),while IL⁃33 protein expression was significantly lower in the IFN⁃γ +15⁃μmol/L UA group than in the IFN⁃γ +10⁃μmol/L UA group(P< 0.05).The p⁃ERK1/2 protein expression significantly increased in HaCaT cells treated with IFN⁃γ for 5 and 60 minutes compared with the blank control group,but significantly decreased in the IFN⁃γ +15⁃μmol/L UA group compared with the IFN⁃γ group(0.458 ±0.053vs.0.941±0.042 at 5 minutes,0.302±0.054vs.0.509±0.032 at 60 minutes,bothP<0.05).However,no significant differences were observed in the total ERK1/2 protein expression between the IFN⁃γ +15⁃μmol/L UA group and IFN⁃γ group at 5 or 60 minutes.ConclusionUA can suppress IL⁃33 expression in HaCaT cells induced by IFN⁃γ,likely by regulating expressions of the ERK signaling pathway⁃related proteins.
Ursolic acid;Interferon⁃gamma;Interleukin⁃1;Interleukin⁃6;Extracellular signal⁃regulated MAP kinases;HaCaT cells;Interleukin⁃33
Tian Zhongwei,Email:zhonwt@xxmu.edu.cn
田中伟,Email:zhonwt@xxmu.edu.cn
10.3760/cma.j.issn.0412⁃4030.2016.07.013
河南省教育厅科学技术研究重点项目(13A320852);河南省中青年卫生科技创新型人才工程专项基金(201004159);河南省医学科技攻关计划重点项目(201502016)
Fund programs:Key Program for Science and Technology Research of Henan Educational Committee(13A320852);Special Funding of the Henan Health Science and Technology Innovation Talent Project(201004159);Medical Science and Technology Foundation of Henan Province(201502016)
2015⁃08⁃10)
(本文编辑:周良佳 颜艳)

