分子靶向抗肿瘤药物的皮肤不良反应及处理
王芳 唐旭华 周晖
510080广州,中山大学附属第一医院皮肤科
分子靶向抗肿瘤药物的皮肤不良反应及处理
王芳 唐旭华 周晖
510080广州,中山大学附属第一医院皮肤科
分子靶向抗肿瘤药物分为胞膜相关药物、胞内相关药物和免疫调节剂3类。胞膜相关药物包括表皮生长因子受体抑制剂(EGFRIs)、KIT和BCR⁃ABL抑制剂、血管生成抑制剂和多靶点酪氨酸激酶抑制剂等。胞内相关药物包括RAS⁃RAF⁃MEK⁃ERK通路抑制剂、PI3K⁃AKT⁃mTOR通路抑制剂、Hedgehog信号通路抑制剂等。免疫调节剂包括细胞毒性T淋巴细胞抗原抑制剂和程序性死亡1受体抑制剂等。不同种类的药物引起的皮肤不良反应有共性,也有不同。多数皮肤不良反应呈剂量相关性、可逆性。治疗需根据皮疹的严重程度,轻者对症处理,重者则减量或停药。本文综述分子靶向抗肿瘤药物引起的皮肤不良反应及其防治对策。
分子靶向治疗;抗肿瘤药;药物毒性;皮肤表现
分子靶向抗肿瘤药物作为治疗肿瘤的新药,应用逐渐增多。传统化疗药的作用靶点在细胞层面,在杀死癌细胞的同时对正常细胞也存在损伤。而分子靶向药物作用于肿瘤细胞的特定位点,对肿瘤细胞的杀伤选择性强,对正常细胞的影响较少,因此成为肿瘤药物治疗的热点。由于这类药物作用的靶点如血管内皮生长因子受体、表皮生长因子受体在皮肤组织也存在,靶向药物的皮肤不良反应并不少见,这些不良反应轻者影响患者的生活质量,重者导致减量或停药,影响抗肿瘤治疗的进程。因此,皮肤科医生亟需了解此类药物的相关皮肤不良反应及防治,以提高患者耐受性,改善其生活质量。分子靶向抗肿瘤药物根据作用靶点不同,可分为不同种类,我们就其皮肤不良反应及对策作一综述。
一、胞膜相关抑制剂
胞膜相关抑制剂作用在胞膜水平,包括表皮生长因子受体抑制剂(epidermal growth factor receptor inhibitor,EGFRI)、KIT和BCR⁃ABL抑制剂、血管生成抑制剂和多靶点酪氨酸激酶抑制剂,这些药物引起的皮肤不良反应各具特点,分述如下。
(一)表皮生长因子受体抑制剂:表皮生长因子/表皮生长因子受体(epidermal growth factor/epidermal growth factor receptor,EGF/EGFR)是肿瘤细胞增殖、迁移和血管生成的关键信号转导通路,在调节皮肤炎症、屏障功能和固有免疫中发挥重要作用[1]。EGFRI包括吉非替尼(gefitinib)、厄洛替尼(erlotinib)、西 妥 昔 单 抗(cetuximab)以 及 帕 尼 单 抗(panitumumab)等。EGFRI的皮肤不良反应常见,累及50%~90%的患者[2]。常见的皮肤反应被称为PRIDE综合征,“P”指丘疹脓疱性疹(papulopustular rash)、甲沟炎(paronychia),“R”指毛发生长调节改变(regulatory changes in hair),“I”指瘙痒(itching),“D”指干燥(dryness),“E”指EGFRIs[3]。丘疹脓疱性疹(又称痤疮样疹)最常见且最早出现,常发生在EGFRI治疗的第1周,其临床表现类似于寻常痤疮,但不伴粉刺、结节或囊肿(图1A、1B)。治疗轻症患者可外用弱效糖皮质激素、克林霉素或红霉素,中重度可口服米诺环素或多西环素,或系统应用小剂量异维A酸。丘疹脓疱性疹的严重程度与EGFRI的疗效和患者预后呈正相关[2]。甲沟炎是第二常见反应,出现在治疗后1~2个月,拇指(趾)最常受累,常表现为甲皱襞与甲小皮肿胀皲裂,甲周化脓性肉芽肿(图1C、1D),可使用抗菌肥皂预防感染,局部热敷或外用糖皮质激素或钙调磷酸酶抑制剂,严重者可口服四环素类抗生素治疗。毛发改变如头发卷曲、脱色、冗细、易断、生长缓慢甚至脱发(图1E),在EGFRI治疗数月后出现,停止用药1个月内可缓解。近半数患者可出现皮肤瘙痒,通过加强日常护理可缓解,严重者需系统应用抗组胺药[4],也可联用普瑞巴林或加巴喷丁。4%~35%的患者出现皮肤干燥,应加强保湿润肤,严重时联合外用中强效糖皮质激素[5]。
(二)KIT和BCR⁃ABL抑制剂:KIT和BCR⁃ABL抑制剂是bcr⁃abl融合蛋白、c⁃Kit和血小板源性生长因子受体(platelet⁃derived growth factor receptor,PDGFR)的酪氨酸激酶抑制剂,引起的皮肤反应与剂量相关,停药后可逆。此类药物包括伊马 替 尼(imatinib)、达 沙 替 尼(dasatinib)和 尼 洛 替 尼(nilotinib),可导致如下皮肤反应。
1.水肿:一般见于伊马替尼、达沙替尼,罕见于尼洛替尼。水肿可累及眶周、肢端,偶尔导致中心液体潴留,30%应用达沙替尼的患者可出现胸腔积液。水肿原因推测与PDGFR调节组织液平衡的功能有关,其产生减少将导致真皮组织液增加。处理包括低盐饮食(<2 g/d),使用利尿剂等;眶周水肿可外用去氧肾上腺素软膏[6]。
2.麻疹样发疹:平均用药9周后发疹,好发于躯干、前臂,偶尔累及面部。可外用或口服糖皮质激素、抗组胺药对症治疗[7]。
3.色素改变:1/3左右的患者可出现局限斑状或弥漫色素减退和色素脱失,一般在肤色深的个体中更常见[8]。色素减退与KIT和BCR⁃ABL抑制剂抑制调控黑素细胞活性、迁移和生存的c⁃kit蛋白有关[8]。3.6%的患者可出现甲、毛发和口腔黏膜色素沉着[9]。
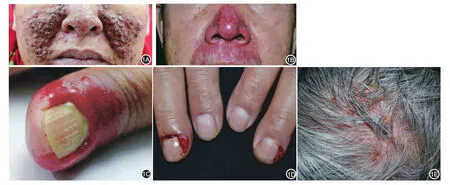
图1 厄洛替尼相关皮肤损害 1A:面部、鼻部红色丘疹、丘脓疱疹,有融合倾向,部分丘疹上覆结痂;1B:鼻部、须部红斑基础上有多个丘脓疱疹,未见结节、囊肿及粉刺;1C:右手拇指甲沟红肿、糜烂,甲板条纹;1D:双手中指可见甲周化脓性肉芽肿;1E:头皮红斑基础上散发脓疱,多处脓疱破溃、结痂,散在象牙白色脱发斑
4.其他皮损:荨麻疹样、苔藓样、糠疹样、银屑病样皮损,Stevens⁃Johnson 综合征[10],急性泛发性发疹型脓疱性皮病,Sweet综合征,蕈样肉芽肿,毛囊性黏蛋白病,迟发性皮肤卟啉病,穿通性毛囊炎[4,11]等均有报道。
(三)血管生成抑制剂:针对血管生成靶点的药物可以减少肿瘤组织中微血管形成,抑制肿瘤生长,但也会导致皮肤黏膜出血和伤口愈合不良。选择性抑制血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)的靶向药物主要是单克隆抗体贝伐单抗(bevacizumab)、兰尼单抗(ranibizumab)。皮肤黏膜有出血倾向时不推荐使用VEGFR抑制剂。若联合手术时须考虑到VEGFR抑制剂影响伤口愈合的潜在风险,建议手术后28 d才考虑联用[4,12]。此外,报道的皮疹包括斑丘疹性发疹、口腔炎、皮肤血栓形成性血管病[13]、溃疡性萎缩纹[14]等,处理措施主要为对症治疗,严重者考虑减药或停药。
(四)多靶点酪氨酸激酶抑制剂:多靶点酪氨酸激酶抑制剂除了靶向抑制VEGFR,还可拮抗其他酪氨酸激酶受体,发挥抑制肿瘤细胞血管生成和增殖的作用。常见的药物包括索拉非尼(sorafenib)和舒尼替尼(sunitinib)。74%应用索拉非尼及81%应用舒尼替尼的患者会出现皮肤反应[15]。
1.角化过度性手足反应:发病机制可能与VEGF被抑制、血管退行和继发血管修复能力下调有关[16]。一般在用药2~4周后掌跖部位出现对称性水肿性疼痛性炎症红斑,伴有角化过度和浅表水疱,重者导致跛行。呈剂量依赖性,停药后消退。轻者无疼痛时仅需应用润肤霜,也可联用角质溶解剂,如尿素或他扎罗汀。中度患者出现痛性皮损限制日常起居活动时,可加用普瑞巴林或非甾体类药物止痛,局部外用氯倍他索和利多卡因,并将药物剂量减半观察1~4周。重度患者需停药至少1周直至症状明显改善[16]。
2.口腔并发症:一般发生在治疗早期,与手足反应的严重度直接相关。治疗建议保持口腔卫生,口腔溃疡较轻时,可局部外用糖皮质激素;对中重度口腔疼痛者,可局部外用麻醉剂和抗菌剂等[17]。
3.毛发异常:脱发发生于开始治疗后的2~28周。索拉非尼所致的脱发皮损区新长出的毛发变脆、卷曲而色素加深。与之相反,舒尼替尼可导致10%的患者出现毛发色素脱失,与舒尼替尼影响具有调节酪氨酸酶(黑素合成关键酶)的干细胞因子受体通路有关,停药2~3周后恢复[18]。
4.颜面红斑:颜面红斑发生于63%应用索拉非尼的患者,舒尼替尼相对少见,表现类似脂溢性皮炎。皮疹一般在停药2个月内消退,多数颜面红斑的患者不需要任何治疗[15]。
5.皮肤色素异常:28%应用舒尼替尼的患者出现皮肤变黄,通常发生于颜面,不累及巩膜和口腔黏膜。常特征性地发生于治疗的第1~4周,停药后可自行消退[19]。
6.其他反应:包括麻疹样发疹、鳞状细胞癌、指甲改变、发疹性黑素细胞痣、泛发性毛发角化样皮损、躯干脱毛、乳头角化过度、表皮囊肿等[19⁃21]。
二、胞内信号通路抑制剂
RAS⁃RAF⁃MEK⁃ERK通路与PI3K⁃AKT⁃mTOR是两条重要的胞内信号转导通路,在细胞的生长、存活、增殖、凋亡、血管生成、自噬等过程中发挥重要功能,其调节异常与许多肿瘤的发生相关。
(一)RAS⁃RAF⁃MEK⁃ERK通路抑制剂:
1.RAF抑制剂:BRAF基因全名为鼠类肉瘤滤过性毒菌致癌基因同源体B1(v⁃raf murine sarcoma viral oncogene homolog B1),属于RAF基因家族。BRAF蛋白是RAS⁃RAF⁃MEK⁃ERK(MAPK)信号通路中的上游调节因子,也是人类肿瘤最常见的突变蛋白激酶之一。RAF蛋白磷酸化激活其下游底物丝氨酸/苏氨酸蛋白激酶(MEK)和胞外信号调节激酶(ERK),MEK和ERK磷酸化可调节细胞增殖、分化和凋亡。超过80%的皮肤黑素瘤患者发生MAPK信号通路遗传突变,最常见的突变为BRAF V600E,BRAF抑制剂威罗菲尼(vemurafenib)和达拉菲尼(dabrafenib)可选择性抑制BRAF V600E癌蛋白,阻断细胞过度增殖。BRAF抑制剂最常见毒性反应发生于皮肤,累及约74%的患者[22⁃23]。
(1)发疹性皮损:呈剂量依赖性,发生于治疗开始后几个月,停药或减量后可消退。可表现为颜面、躯干和手臂的丘疹脓疱,也可进而融合为麻疹样或中毒性红斑样皮损。轻度皮损局部外用润肤剂或糖皮质激素,也可联合口服抗组胺药,重度患者需要系统应用糖皮质激素,必要时中断治疗,待症状缓解后逐步加量回到原来的治疗剂量[24]。
(2)表皮新生物:推测与RAF抑制剂暴露了角质形成细胞早已存在的隐匿的日光诱导的RAS突变有关,不排除病毒诱发的细胞转化参与发病[25]。各种良恶性角化皮损如疣状角化病、鳞状细胞癌和角化棘皮瘤发生于开始治疗后的2~14周[26]。针对各种表皮新生物治疗手段包括冷冻、激光、光动力治疗、系统应用维A酸或手术切除等,药物剂量一般无需调整。良性表皮赘生物可外用角质剥脱剂、咪喹莫特、氟胞嘧啶等[27]。所有应用BRAF抑制剂的患者用药初应进行全身皮肤基线检查,对于用药前存在光损害皮损的患者用药期间应每2~4周随访皮疹变化。
(3)光敏性:7%~12%应用威罗菲尼的患者可发生光敏。因此应用BRAF抑制剂的患者应限制日晒,常规使用防晒霜(特别是防护长波紫外线)和穿紫外线防护服[28]。
(4)其他反应:包括皮肤干燥、瘙痒、皲裂、毛周角化病样皮损、甲沟炎、脱发、角化过度性手足反应、脂膜炎、黑素瘤等,以对症治疗为主[29]。此外,发疹性粟丘疹、表皮囊肿、棘层松解性皮病等也有报道[27]。
2.MEK抑制剂:MEK抑制剂的皮肤不良反应与EGFRI所致皮损相似,常表现为麻疹样发疹、丘疹脓疱样发疹、皮肤干燥、甲沟炎,处理策略相同。
(二)PI3K⁃AKT⁃mTOR通路抑制剂:哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一种丝氨酸/苏氨酸蛋白激酶,它主要通过PI3K/Akt/mTOR途径来调控细胞生长、增殖、细胞周期[30]。皮肤不良反应包括口腔炎、炎症性发疹、甲改变等。口腔炎表现为散在、孤立、浅表性口腔溃疡,通常呈剂量依赖性。轻度以普通漱口水漱口治疗,中重度可局部外用麻醉剂和(或)强效糖皮质激素。炎症性发疹形态包括麻疹样、湿疹样和痤疮样皮疹,经过和处理类似于EGFRI相关丘疹脓疱样疹。甲改变以甲沟炎最常见。此外,脱发、面部多毛、伤口愈合不良、瘙痒、干皮症、血管炎等亦有报道[31]。
(三)Hedgehog信号通路抑制剂:几乎所有的基底细胞癌患者均存在Hedgehog信号通路基因异常改变。Vismodegib是一种小分子化合物,抑制基底细胞癌中异常活化的Hedgehog通路。常见的皮肤不良反应是脱发,通常可逆,累及范围一般不超过50%,可局部外用米诺地尔直至靶向药物结束治疗后6个月[32]。
三、免疫调节剂
目前免疫调节剂主要针对T细胞表面表达的抑制性受体,此类药物包括细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte⁃associated antigen 4,CTLA⁃4)抑制剂和程序性死亡受体1(programmed death 1,PD⁃1)抑制剂。这些药物通过活化免疫系统,促进癌细胞清除,但也可导致免疫系统非特异性活化,造成不良反应。常见的皮肤不良反应包括皮炎、瘙痒和白癜风,与剂量相关,具有可逆性[9]。
(一)CTLA⁃4抑制剂:伊匹单抗(ipilimumab)是针对CTLA⁃4的重组人单克隆抗体,可促进非限制性T细胞活化,攻击肿瘤细胞,已被美国FDA批准用于转移性黑素瘤的免疫治疗。因伊匹单抗活化T细胞时,可增加天然免疫细胞的功能,从而产生自身免疫相关的不良反应。伊匹单抗的皮肤不良反应包括瘙痒、麻疹样发疹、白癜风样黑素瘤相关色素减退,一般发生于治疗开始后第3~6周。瘙痒性皮疹的患者外用糖皮质激素与尿素即可缓解,无需停药或减量。严重者可按相当于泼尼松1 ~ 2 mg·kg⁃1·d⁃1的用量系统应用糖皮质激素,出现坏死、大疱或出血性皮损时则须停药[33]。
(二)PD⁃1抑制剂:与CTLA⁃4抑制剂相似,PD⁃1抑制剂也会引起自身免疫相关不良反应。皮肤不良反应包括白癜风、发疹性损害和瘙痒,治疗主要是对症处理[34]。
总之,分子靶向抗肿瘤药物的皮肤不良反应常见,多数皮肤不良反应呈药物剂量依赖性和可逆性,与临床疗效相关,因此,需要正确认识和处理靶向药物的皮肤不良反应。由于靶向抗肿瘤药物上市时间尚短,需要多学科密切关注用药期间可能出现的各种不良反应,以达到合理用药的目的。
[1] Lichtenberger BM,Gerber PA,Holcmann M,et al.Epidermal EGFR controls cutaneous host defense and prevents inflammation[J].Sci Transl Med,2013,5(199):199ra111.DOI:10.1126/scitranslmed.3005886.
[2] Fakih M,Vincent M.Adverse events associated with anti⁃EGFR therapies for the treatment of metastatic colorectal cancer[J].Curr Oncol,2010,17 Suppl 1:S18⁃30.
[3] Madke B,Gole P,Kumar P,et al.Dermatological side effects of epidermal growth factor receptor inhibitors:'PRIDE'complex[J].Indian J Dermatol,2014,59(3):271⁃274.DOI:10.4103/0019⁃5154.131398.
[4] Macdonald JB,Macdonald B,Golitz LE,et al.Cutaneous adverse effects of targeted therapies:Part I:Inhibitors of the cellular membrane[J].J Am Acad Dermatol,2015,72(2):203 ⁃218.DOI:10.1016/j.jaad.2014.07.032.
[5] Segaert S,Van Cutsem E.Clinical signs,pathophysiology and management of skin toxicity during therapy with epidermal growth factor receptor inhibitors[J].Ann Oncol,2005,16(9):1425⁃1433.DOI:10.1093/annonc/mdi279.
[6] Severino G,Chillotti C,De Lisa R,et al.Adverse reactions during imatinib and lansoprazole treatment in gastrointestinal stromal tumors[J].Ann Pharmacother,2005,39(1):162 ⁃164.DOI:10.1345/aph.1E127.
[7] Basso FG,Boer CC,Corrêa ME,et al.Skin and oral lesions associated to imatinib mesylate therapy[J].Support Care Cancer,2009,17(4):465⁃468.DOI:10.1007/s00520⁃008⁃0536⁃8.
[8] Reyes⁃Habito CM,Roh EK.Cutaneous reactions to chemothera⁃peutic drugs and targeted therapy for cancer:Part II.Targeted therapy[J/OL].J Am Acad Dermatol,2014,71(2):217.e1⁃217.e11[2015⁃07⁃16].DOI:10.1016/j.jaad.2014.04.013.http://www.jaad.org/article/S0190⁃9622(14)01363⁃2/pdf.
[9] Li CC,Malik SM,Blaeser BF,et al.Mucosal pigmentation caused by imatinib:report of three cases[J].Head Neck Pathol,2012,6(2):290⁃295.DOI:10.1007/s12105⁃011⁃0325⁃4.
[10] Bois E,Holle LM,Farooq U.Late onset imatinib⁃induced Stevens⁃Johnson syndrome[J].J Oncol Pharm Pract,2014,20(6):476⁃478.DOI:10.1177/1078155213518226.
[11] Llamas⁃Velasco M,Steegmann JL,Carrascosa R,et al.Perforating folliculitis in a patient treated with nilotinib:a further evidence of C⁃kit involvement[J].Am J Dermatopathol,2014,36(7):592 ⁃593.DOI:10.1097/DAD.0b013e31828cf3b7.
[12] Ishak RS,Aad SA,Kyei A,et al.Cutaneous manifestations of anti⁃angiogenic therapy in oncology:Review with focus on VEGF inhibitors[J].Crit Rev Oncol Hematol,2014,90(2):152 ⁃164.DOI:10.1016/j.critrevonc.2013.11.007.
[13] Kiuru M,Schwartz M,Magro C.Cutaneous thrombogenic vasculo⁃pathy associated with bevacizumab therapy[J/OL].Dermatol Online J,2014,20(6):9.[2015⁃08⁃18].http://escholarship.org/uc/item/41f655g9.
[14] Farber SA,Samimi S,Rosenbach M.Ulcerations within striae distensae associated with bevacizumab therapy[J].J Am Acad Dermatol,2015,72(1):e33 ⁃e35.DOI:10.1016/j.jaad.2014.09.023.
[15] Lee WJ,Lee JL,Chang SE,et al.Cutaneous adverse effects in patients treated with the multitargeted kinase inhibitors sorafenib and sunitinib[J].Br J Dermatol,2009,161(5):1045⁃1051.DOI:10.1111/j.1365⁃2133.2009.09290.x.
[16] Blanchet B,Billemont B,Barete S,et al.Toxicity of sorafenib:clinical and molecular aspects[J].Expert Opin Drug Saf,2010,9(2):275⁃287.DOI:10.1517/14740330903510608.
[17] Boers⁃Doets CB,Epstein JB,Raber⁃Durlacher JE,et al.Oral adverse events associated with tyrosine kinase and mammalian target of rapamycin inhibitors in renal cell carcinoma:a structured literature review[J].Oncologist,2012,17(1):135 ⁃144.DOI:10.1634/theoncologist.2011⁃0111.
[18] Robert C,Spatz A,Faivre S,et al.Tyrosine kinase inhibition and grey hair[J].Lancet,2003,361(9362):1056.DOI:10.1016/S0140⁃6736(03)12805⁃X.
[19] McLellan B,Kerr H.Cutaneous toxicities of the multikinase inhibitors sorafenib and sunitinib[J].Dermatol Ther,2011,24(4):396⁃400.DOI:10.1111/j.1529⁃8019.2011.01435.x.
[20] Jiménez⁃Gallo D,Albarrán⁃Planelles C,Linares⁃Barrios M,et al.Eruptive melanocytic nevi in a patient undergoing treatment with sunitinib[J].JAMA Dermatol,2013,149(5):624 ⁃626.DOI:10.1001/jamadermatol.2013.263.
[21] Eaby⁃Sandy B,Grande C,Viale PH.Dermatologic toxicities in epidermal growth factor receptor and multikinase inhibitors[J].J Adv Pract Oncol,2012,3(3):138⁃150.
[22] Shimizu T,Tolcher AW,Papadopoulos KP,et al.The clinical effect of the dual⁃targeting strategy involving PI3K/AKT/mTOR and RAS/MEK/ERK pathways in patients with advanced cancer[J].Clin Cancer Res,2012,18(8):2316⁃2325.DOI:10.1158/1078⁃0432.CCR⁃11⁃2381.
[23] Chapman PB,Hauschild A,Robert C,et al.Improved survival with vemurafenib in melanoma with BRAF V600E mutation[J].N Engl J Med,2011,364(26):2507 ⁃2516.DOI:10.1056/NEJMoa1103782.
[24] Sosman JA,Kim KB,Schuchter L,et al.Survival in BRAF V600⁃mutant advanced melanoma treated with vemurafenib[J].N Engl J Med,2012,366(8):707⁃714.DOI:10.1056/NEJMoa1112302.
[25] Oberholzer PA,Kee D,Dziunycz P,et al.RAS mutations are associated with the development of cutaneous squamous cell tumors in patients treated with RAF inhibitors[J].J Clin Oncol,2012,30(3):316⁃321.DOI:10.1200/JCO.2011.36.7680.
[26] Chu EY,Wanat KA,Miller CJ,et al.Diverse cutaneous side effects associated with BRAF inhibitor therapy: a clinicopathologic study[J].J Am Acad Dermatol,2012,67(6):1265⁃1272.DOI:10.1016/j.jaad.2012.04.008.
[27] Macdonald JB,Macdonald B,Golitz LE,et al.Cutaneous adverse effects of targeted therapies:Part II:Inhibitors of intracellular molecular signaling pathways[J].J Am Acad Dermatol,2015,72(2):221⁃236.DOI:10.1016/j.jaad.2014.07.033.
[28] Dummer R,Rinderknecht J,Goldinger SM.Ultraviolet A and photosensitivity during vemurafenib therapy[J].N Engl J Med,2012,366(5):480⁃481.DOI:10.1056/NEJMc1113752.
[29] Huang V,Hepper D,Anadkat M,et al.Cutaneous toxic effects associated with vemurafenib and inhibition of the BRAF pathway[J].Arch Dermatol,2012,148(5):628 ⁃633.DOI:10.1001/archdermatol.2012.125.
[30] Lim HJ,Crowe P,Yang JL.Current clinical regulation of PI3K/PTEN/Akt/mTOR signalling in treatment of human cancer[J].J Cancer Res Clin Oncol,2015,141(4):671⁃689.DOI:10.1007/s00432⁃014⁃1803⁃3.
[31] Campistol JM,de Fijter JW,Flechner SM,et al.mTOR inhibitor⁃associated dermatologic and mucosalproblems [J].Clin Transplant,2010,24(2):149 ⁃156.DOI:10.1111/j.1399 ⁃0012.2010.01232.x.
[32] Chang AL,Solomon JA,Hainsworth JD,et al.Expanded access study of patients with advanced basal cell carcinoma treated with the Hedgehog pathway inhibitor,vismodegib[J].J Am Acad Dermatol,2014,70(1):60⁃69.DOI:10.1016/j.jaad.2013.09.012.
[33] Robert C,Thomas L,Bondarenko I,et al.Ipilimumab plus dacarbazine for previously untreated metastatic melanoma[J].N Engl J Med,2011,364(26):2517 ⁃2526.DOI:10.1056/NEJMoa1104621.
[34] Hamid O,Robert C,Daud A,et al.Safety and tumor responses with lambrolizumab(anti⁃PD⁃1)in melanoma[J].N Engl J Med,2013,369(2):134⁃144.DOI:10.1056/NEJMoa1305133.
Cutaneous adverse reactions to molecular targeted antitumor drugs and their management
Wang Fang,Tang Xuhua,Zhou Hui
Department of Dermatology,First Affiliated Hospital,Sun Yat⁃sen University,Guangzhou 510080,China
There are three kinds of molecular targeted antitumor drugs:inhibitors of membrane⁃associated therapeutic targets,inhibitors of intracellular signaling pathways,and immunomodulators.Inhibitors of membrane⁃associated therapeutic targets include epidermal growth factor receptor inhibitors(EGFRIs),KIT and BCR ⁃ABL inhibitors,antiangiogenic agents and multikinase inhibitors.Inhibitors of intracellular signals include inhibitors of the RAS⁃RAF⁃MEK⁃ERK pathway,PI3K⁃AKT⁃mTOR pathway and Hedgehog signaling pathway.Inhibitors of cytotoxic T lymphocyte associated⁃antigen(CTLA)and programmed death 1(PD ⁃1)belong to immunomodulatory agents.Cutaneous adverse effects of different molecular targeted antitumor drugs share some common features,but also differ from each other.Most of the side effects are dose⁃dependent and reversible.Management strategies should be adjusted according to the severity of skin eruptions.Dose tapering and even discontinuation of antitumor drugs are necessary for very severe cases,but for mild ones,symptomatic treatment might be enough.This article reviews cutaneous adverse reactions to molecular targeted therapy as well as their prevention and management.
Molecular targeted therapy;Antineoplastic agents;Drug toxicity;Skin manifestations
Zhou Hui,Email:zhouhongcai@126.com
周晖,Email:zhouhongcai@126.com
10.3760/cma.j.issn.0412⁃4030.2016.07.020
2015⁃08⁃07)
(本文编辑:尚淑贤)

