TNIP1基因多态性与汉族人系统性红斑狼疮相关性研究
王勇 韩建文 李鸿斌 阿拉腾楚鲁 孙志强 吕新翔 乌日娜
010050呼和浩特,内蒙古医科大学附属医院风湿科(王勇、李鸿斌),皮肤科(韩建文、阿拉腾楚鲁、孙志强、吕新翔、乌日娜)
·论著·
TNIP1基因多态性与汉族人系统性红斑狼疮相关性研究
王勇 韩建文 李鸿斌 阿拉腾楚鲁 孙志强 吕新翔 乌日娜
010050呼和浩特,内蒙古医科大学附属医院风湿科(王勇、李鸿斌),皮肤科(韩建文、阿拉腾楚鲁、孙志强、吕新翔、乌日娜)
目的 探讨人肿瘤坏死因子α诱导蛋白3(TNFAIP3)相互作用蛋白1(TNIP1)基因多态性与汉族人系统性红斑狼疮(SLE)的遗传关联性。方法 收集284例汉族人SLE和630例汉族人对照,选择TNIP1基因区域120个单核苷酸多态性(SNP),利用连接酶检测反应(LDR)对其进行基因分型,对分型数据利用PLINK 1.07和Haploview软件进行统计分析。结果 经过数据质控,最终105个SNP的分型数据进入最终统计分析。rs3805433C、rs12516176C、rs6869605C和rs4958882G的等位基因频率在SLE组(参考等位基因频率0.301~0.306)高于对照组(参考等位基因频率0.221~0.225),差异有统计学意义(OR:1.50~1.53,均P<4.72×10-4)。这4个SNP间存在强连锁不平衡(r2≥0.871,D′≥0.938),且与既往报道的SLE相关SNP rs10036748间存在中等程度的连锁不平衡(r2≥ 0.073,D′≥ 0.868)。单倍型分析发现,单倍型(H2:CCCGT)在病例组中的频率(0.290)显著高于对照组(0.210),差异有统计学意义(OR=1.54,P<4.72×10-4)。结论 TNIP1基因多态性与汉族人SLE具有相关性。
红斑狼疮,系统性;多态性,单核苷酸;遗传关联研究;基因,TNIP1
系统性红斑狼疮(SLE)是一种典型的自身免疫性疾病,表现为自身抗体产生、免疫功能紊乱、多个组织器官损伤。近年来遗传学研究发现了一大批SLE易感基因[1]。研究提示,人肿瘤坏死因子α诱导蛋白 3(TNFAIP3)相互作用蛋白 1(TNIP1)基因多态性与汉族人及欧洲人群的SLE均有相关性[2]。本研究根据HapMap 3期数据库及我们前期完成的汉族人SLE全基因组关联分析研究结果[2],选择TNIP1基因区域的120个单核苷酸多态性(single nucleotide polymorphisms,SNP),利用连接酶检测反应(ligase detection reaction,LDR)对其进行基因分型,探讨TNIP1基因多态性与汉族人SLE的相关性。
资料和方法
一、资料
1.研究对象:从内蒙古医科大学附属医院皮肤科及风湿免疫科收集汉族SLE患者284例,年龄11~72(35.22±11.39)岁,发病年龄 9~72(30.00±10.59)岁,女男比例为11.2∶1。从我院体检中心收集汉族健康对照630例,年龄17~80(35.98±15.96)岁,女男比例为11.8∶1。所有患者符合美国风湿病学会(ACR)SLE 诊断标准[3]。284 例 SLE 临床表型分布情况见表1。所有对照排除SLE及其他自身免疫性疾病,排除SLE及自身免疫病家族史。采集外周静脉血5 ml,乙二胺四乙酸(EDTA)抗凝,置于-80℃冰箱保存备用。本研究已通过内蒙古医科大学附属医院伦理委员会批准,并在实施过程中遵守赫尔辛基宣言,所有病例及对照均签署知情同意书。
2.SNP选择:根据HapMap 3期数据库,选择位于 TNIP1基因区域的 SNP(Chr5:150369701~150461190)。根据在中国人群中最小等位基因频率(MAF)>0.01,筛选出149个SNP。然后根据我们既往的全基因组关联分析研究结果,去除29个SNP(既往研究中P>0.1)[2]。最后对120个SNP进行基因分型。

表1 284例系统性红斑狼疮患者临床表型情况
二、方法
1.基因组DNA提取:利用基因组DNA提取试剂盒[康宁生命科学(吴江)有限公司]提取患者及对照基因组DNA,用分光光度仪分别于260 nm和280 nm波长处检测吸光度,计算DNA浓度,并用凝胶电泳检测DNA质量,所有DNA样本均合格。
2.引物及探针的合成:用Primer 3 online(Version 0.4.0)软件(http://frodo.wi.mit.edu/)和 Oligo(Version 6.31)软件设计特异性聚合酶链反应(PCR)引物和LDR探针,针对每个SNP位点设计2条引物,要尽量保证所有SNP位点引物的T值相同。根据LDR探针设计原则设计LDR的上下游探针[4-5],上游探针5′端用磷酸化修饰。PCR引物由上海瀚宇生物工程有限公司合成,LDR探针由上海英骏生物技术有限公司合成。
3.多重 PCR:PCR 反应体系 20 μl,1 μl模板,2 μl缓冲液,0.6 μl Mg2+,2 μl dNTP,0.2 μl TaqDNA聚合酶,2μl引物混合液,加双蒸水补足。PCR反应条件:95℃预变性 2 min;94℃ 30 s,56℃退火 1.5 min,65℃30 s,35个循环;最后65℃延伸10 min。
4.多重 LDR:LDR 反应体系 10 μl,1 μl Buffer缓冲液,1 μl探针混合液,0.05 μl Taq DNA 连接酶,4 μl PCR产物,加双蒸水补足10 μl。探针混合液浓度为2 μmol/L。LDR反应条件:95℃2 min预变性,94℃ 15 s,50℃ 25 s,进行 40个循环。
5.测序与基因分型:采用ABI3730测序仪测序分析反应产物,用Genemapper软件进行数据分析,判读各位点上各样本的基因分型。测序工作由上海翼和应用生物技术有限公司完成。
6.统计分析:所有SNP分型数据质控利用PLINK 1.07软件完成(http://pngu.mgh.harvard.edu/purcell/plink/)[6]。符合以下任意一条的 SNP 被剔除:分型得率<90%;MAF<1%;不符合Hardy-Weinberg平衡定律(P≤0.01)。经过质控后,计算每个SNP的等位基因频率,χ2检验比较病例组和对照组等位基因频率及基因型频率,并计算等位基因的相对危险度估计值比值比OR及其95%可信区间(CI)。对差异显著的SNP进行两两间连锁不平衡检验,计算两两间的 r2和 D′值,如果 r2> 0.5和 D′> 0.8,则认为SNP间存在强连锁不平衡。利用Haploview软件进行单倍型分析。所有统计检验均为双侧概率检验,根据Bonferroni多重检验校正原理,P<4.72×10-4(0.05/105)为差异有统计学意义。
结 果
一、样本及SNP质控
经过质控,15个SNP被剔除,其中1个SNP的MAF<0.01,14个 SNP经过 Hardy-Weinberg平衡检验,P≤0.01。最终284例SLE患者及630例对照的105个SNP的分型数据进入最终统计分析。SLE组与对照组间年龄、性别差异无统计学意义(P>0.05),具有可比性。
二、等位基因频率比较及连锁不平衡检验

表2 TNIP1基因区域39个SNP在系统性红斑狼疮组和对照组间的等位基因频率比较
经过 χ2检验,4 个 SNP(rs3805433、rs12516176、rs6869605、rs4958882)的等位基因频率在病例组和对照组间的差异有统计学意义(P<4.72×10-4)。另外35个SNP的等位基因频率在病例组和对照组间差异有统计学意义(P<0.05),但未达到Bonferroni校正检验水平(P>4.72×10-4),包括既往汉族人群中的全基因组关联分析研究报道的相关SNP(rs10036748,P=0.024),见表 2。另外 66个 SNP等位基因频率在病例组和对照组间差异无统计学意义(P>0.05,数据未显示),对rs3805433、rs12516176、rs6869605、rs4958882 及 rs10036748 这5个SNP进行两两间连锁不平衡检验,前4个SNP两两间均存在强连锁不平衡,而这4个SNP与rs10036748存在中等程度的连锁不平衡,见表3。Logisitic回归分析显示,当控制rs10036748作用后,其余4个SNP的等位基因频率差异均无统计学意义(P>0.21)。
三、单倍型分析
对 rs3805433、rs12516176、rs6869605、rs4958882及rs10036748这5个SNP进行单倍型分析,结果显示,单倍型(H2:CCCGT)的频率在SLE组中的频率(0.290)显著高于对照组(0.210),差异有统计学意义(P < 4.72× 10-4),见表 4。
四、临床表型分析
对病例组进行临床表型分层分析,分别按照发病年龄<20岁、蝶形红斑、盘状红斑、口腔溃疡、光敏感、滑膜炎、关节炎、血管炎、狼疮肾炎、神经系统受累、抗核抗体、血细胞减少、抗Sm抗体以及抗ds-DNA抗体共13项临床/实验室指标分为阳性组和阴性组。对两组间上述5个SNP等位基因频率及单倍型频率进行比较,均未发现差异有统计学意义(P>0.05)。

表3 汉族人系统性红斑狼疮组和对照组间差异有统计学意义的5个SNPa两两间的连锁不平衡分析(r2/D′)
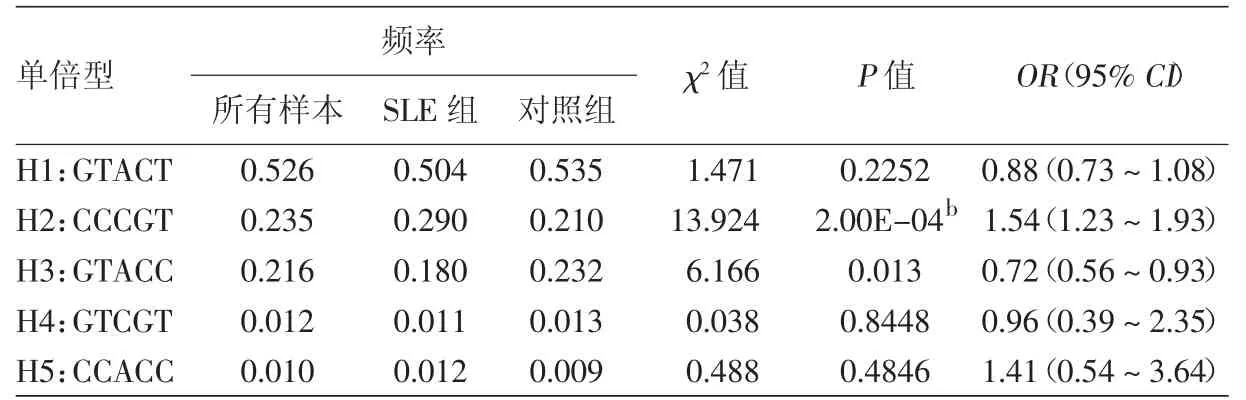
表4 汉族人系统性红斑狼疮(SLE)组和对照组间差异有统计学意义的5个SNPa单倍型分型
讨 论
TNIP1基因位于5号染色体,编码蛋白A20结合核因子κB抑制蛋白1(ABIN1)。TNIP1与其配体TNFAIP3相互作用可以下调核因子κB(NF-κB)病理通路的活性[7]。TNIP1 mRNA在外周血淋巴细胞、脾脏、骨骼肌、肾脏中均有表达[8]。NF-κB 的激活可以诱导TNIP1的表达,而TNIP1表达过度可通过肿瘤坏死因子(TNF)抑制 NF-κB 的活性[7]。
TNIP1和TNFAIP3两个相互作用的基因曾被证实是多种自身免疫性疾病的易感基因,如类风湿性关节炎、乳糜泻、溃疡性结肠炎、银屑病和 SLE[9-10]。TNIP1基因多态性与中国人SLE的相关性已在多项研究中有报道[2,11-13],提示 NF-κB 病理通路在多种自身免疫病的发生、发展中有着重要的作用。基因-基因交互作用分析也发现,NFKB1基因多态性rs28362491和TNIP1基因多态性rs3792783与SLE的相关性有叠加作用,二者均参与NF-κB病理通路[14]。TNIP1基因多态性可能通过影响基因表达或功能引起NF-κB病理通路异常,从而参与SLE的发病。
本研究连锁不平衡分析结果提示,新发现的4个SLE 相关 SNP(rs3805433、rs12516176、rs6869605、rs4958882)与既往报道的rs10036748存在中等程度的连锁不平衡,logisitic回归分析提示,这5个SNP与SLE的相关性可能来自于同一个疾病关联信号。
Adrianto 等[12]研究发现,在 TNIP1基因的启动子区域存在2个SLE相关的危险单倍型。本研究发现的危险单倍型(H2:CCCGT)位于 TNIP1基因的5′UTR到内含子5的范围内(长度约为22.7 kb),位置上与既往报道的危险单倍型有重叠[12]。在另外一项汉族人群的SLE关联分析研究中,Zhang等[15]发现的SLE危险单倍型也位于TNIP1基因的5′UTR区域。几项研究发现的SLE危险单倍型部分有重叠,均指向TNIP1基因的5′UTR区域,但是这些SLE危险单倍型间的具体关系仍未能明确,它们是否代表着同一个关联信号仍需要进一步的研究来阐明。但可以明确的一点是,无论是欧洲人群还是汉族人群中,TNIP1基因均是SLE的一个易感基因,且在SLE的发病机制中发挥着重要的作用。
在根据临床表型分层分析的结果中,我们未发现在各临床表型中上述5个SNP及单倍型频率的差异。2010年He等[16]在一项大样本量的基因型-表型分析研究中发现,rs10036748与光敏感具有相关性,但未发现与其他临床表型间的相关性。本研究临床表型分析阴性结果可能与样本量偏小有关。
Caster等[17]的小鼠动物模型研究发现TNIP1基因突变[D485N],当表达未激活的ABIN1时,小鼠可以发生类似自身免疫病的症状,并且出现狼疮肾炎的表现。另外,对两个人种的遗传关联研究发现,欧洲人群中与狼疮肾炎相关性最强的SNP是rs7708392,非洲裔人群中是rs4958881。本研究中SNP rs7708392在SLE和对照中的频率差异未达到Bonferroni多重检验校正水平(P<4.72×10-4),而rs4958881在既往我们进行全基因组关联分析研究中没有发现相关性(P=0.7626)[2],因此本次实验未对其进行分型实验。
本研究通过对TNIP1基因区域的105个SNP进行分型、统计分析,发现4个SLE相关的SNP和1个SLE危险单倍型,证实了TNIP1是汉族SLE的易感基因。但存在以下几点不足:①由于样本量有限,本研究的研究效力不足,一些与SLE关联性较弱的SNP可能被遗漏;②本研究没有覆盖低频SNP,仅仅对TNIP1基因区域MAF大于0.01的SNP进行了分析,低频SNP与疾病的相关性需要更大样本量的遗传关联研究来完成;③本研究发现的4个SLE相关SNP可能不是影响SLE易感性的原因SNP,需要更加精细的测序分析来鉴定SLE相关的原因SNP;④由于仅仅对单个位点进行关联分析研究,基因-基因交互作用研究仍有待进一步开展。
总之,本研究通过遗传关联分析研究,在TNIP1基因区域发现4个SLE相关SNP及一个危险单倍型,证实了TNIP1基因多态性与汉族人SLE的相关性,但仍需进一步的精细定位分析及功能学研究来阐明TNIP1基因在SLE发病机制中的作用。
[1]Deng Y,Tsao BP.Genetic susceptibility to systemic lupus erythematosus in the genomic era[J].Nat Rev Rheumatol,2010,6(12):683-692.DOI:10.1038/nrrheum.2010.176.
[2]Han JW,Zheng HF,Cui Y,et al.Genome-wide association study in a Chinese Han population identifies nine new susceptibility loci forsystemic lupus erythematosus [J].Nat Genet,2009,41(11):1234-1237.DOI:10.1038/ng.472.
[3]Hochberg MC.Updating the American College of Rheumatology revised criteria for the classification ofsystemic lupus erythematosus[J].Arthritis Rheum,1997,40(9):1725.
[4]Thomas G,Sinville R,Sutton S,et al.Capillary and microelectrophoretic separations of ligase detection reaction products produced from low-abundantpointmutationsin genomic DNA [J].Electrophoresis,2004,25(10-11):1668-1677.DOI:10.1002/elps.200405886.
[5]Yi P,Chen Z,Yu L,et al.Development of a PCR/LDR/capillary electrophoresis assay with potential for the detection of a betathalassemia fetal mutation in maternal plasma[J].J Matern Fetal Neonatal Med,2010,23 (8):920-927.DOI:10.3109/14767050903387060.
[6]Purcell S,Neale B,Todd-Brown K,et al.PLINK:a tool set for whole-genome association and population-based linkage analyses[J].Am J Hum Genet,2007,81 (3):559-575.DOI:10.1086/519795.
[7]Verstrepen L,Carpentier I,Verhelst K,et al.ABINs:A20 binding inhibitors of NF-kappa B and apoptosis signaling [J].Biochem Pharmacol,2009,78(2):105-114.DOI:10.1016/j.bcp.2009.02.009.
[8]Fukushi M,Dixon J,Kimura T,et al.Identification and cloning of a novel cellular protein Naf1,Nef-associated factor 1,that increases cellsurface CD4 expression[J].FEBS Lett,1999,442(1):83-88.DOI:10.1016/S0014-5793(98)01631-7.
[9]Maxwell JR,Gowers IR,Wilson AG.Complex genetic association of 6q23 with autoimmune rheumatic conditions [J].Arthritis Res Ther,2009,11(2):107.DOI:10.1186/ar2663.
[10]Ramos PS,Criswell LA,Moser KL,et al.A comprehensive analysis of shared loci between systemic lupus erythematosus(SLE)and sixteenautoimmune diseases reveals limited genetic overlap[J].PLoS Genet,2011,7(12):e1002406.DOI:10.1371/journal.pgen.1002406.
[11]Zhong H,Li XL,Li M,et al.Replicated associations of TNFAIP3,TNIP1 and ETS1 with systemic lupus erythematosus in asouthwestern Chinese population [J].Arthritis Res Ther,2011,13(6):R186.DOI:10.1186/ar3514.
[12]Adrianto I,Wang S,Wiley GB,et al.Association of two independent functional risk haplotypes in TNIP1 with systemic lupus erythematosus[J].Arthritis Rheum,2012,64 (11):3695-3705.DOI:10.1002/art.34642.
[13]Zuo XB,Sheng YJ,Hu SJ,et al.Variants in TNFSF4,TNFAIP3,TNIP1,BLK,SLC15A4 and UBE2L3 interact to confer risk of systemic lupuserythematosus in Chinese population[J].Rheumatol Int,2014,34(4):459-464.DOI:10.1007/s00296-013-2864-3.
[14]Cen H,Zhou M,Leng RX,et al.Genetic interaction between genes involved in NF-κB signaling pathway in systemic lupus erythematosus[J].Mol Immunol,2013,56 (4):643-648.DOI:10.1016/j.molimm.2013.07.006.
[15]Zhang DM,Cheng LQ,Zhai ZF,et al.Single-nucleotide polymorphism and haplotypes of TNIP1 associated with systemic lupuserythematosus in a Chinese Han population[J].J Rheumatol,2013,40(9):1535-1544.DOI:10.3899/jrheum.121391.
[16]He CF,Liu YS,Cheng YL,et al.TNIP1,SLC15A4,ETS1,RasGRP3 and IKZF1 are associated with clinical features of systemic lupuserythematosus in a Chinese Han population[J].Lupus,2010,19(10):1181-1186.DOI:10.1177/0961203310367918.
[17]Caster DJ,Korte EA,Nanda SK,et al.ABIN1 dysfunction as a genetic basis for lupus nephritis[J].J Am Soc Nephrol,2013,24(11):1743-1754.DOI:10.1681/ASN.2013020148.
Association analysis between TNIP1 gene polymorphisms and systemic lupus erythematosus in a Chinese Han population
Wang Yong,Han Jianwen,Li Hongbin,Alateng Chulu,Sun Zhiqiang,Lyu Xinxiang,Wu Rina
Department of Rheumatism,Affiliated Hospital of Inner Mongolia Medical University,Hohhot 010050,China(Wang Y,Li HB);Department of Dermatology,Affiliated Hospital of Inner Mongolia Medical University,Hohhot 010050,China(Han JW,Alateng CL,Sun ZQ,Lyu XX,Wu RN)
Objective To investigate association between polymorphisms of the tumor necrosis factor α-induced protein 3 (TNFAIP3)interacting protein 1 (TNIP1)gene and systemic lupus erythematosus(SLE)in a Chinese Han population.Methods Blood samples were collected from 284 patients with SLE of Han nationality(SLE group)and 630 healthy controls of Han nationality (control group).Ligase detection reaction (LDR)was performed to determine the genotypes of 120 single nucleotide polymorphisms (SNPs)in the TNIP1 gene.Data were analyzed with the PLINK 1.07 package and Haploview software.Results After quality control,data on 105 SNPs underwent statistical analysis finally.Four SNPs including rs3805433,rs12516176,rs6869605 and rs4958882 in the TNIP1 gene were significantly associated with SLE (OR:1.50-1.53,allP<4.72×104),and there was a significant increase in the frequency of rs3805433 C,rs12516176 C,rs6869605 C and rs4958882 G alleles in the SLE group (0.301-0.306)compared with the control group(0.221-0.225).There was strong linkage disequilibrium between these 4 SNPs(r2≥ 0.871,D′≥0.938).In addition,moderate linkage disequilibrium was observed between these 4 SNPs and a previously reported SLE-related SNP rs10036748 (r2≥ 0.073,D′≥ 0.868).The frequency of the haplotype H2:CCCGT was significantly higher in the SLE group than in the control group(0.290 vs.0.210,OR=1.54,P < 4.72 × 10-4).Conclusion TNIP1 gene polymorphisms are associated with SLE in Chinese Han population.
Lupus erythematosus,systemic;Polymorphism,single nucleotide;Genetic association studies;Genes,TNIP1
Han Jianwen,Email:hanjianwen1981@hotmail.com
韩建文,Email:hanjianwen1981@hotmail.com
10.3760/cma.j.issn.0412-4030.2016.03.003
国家自然科学基金(31160192、81160189);内蒙古自治区卫生和计划生育委员会医疗卫生科研计划项目(201303057);内蒙古自治区高等学校“青年科技英才支持计划”(NJYT-14-B17);内蒙古医科大学青年创新基金(NY2011QN005)
Fund programs:National Natural Science Foundation of China (31160192,81160189);Medical and Health ResearchProjectof Health and Family Planning Commission of Inner Mongolia Autonomous Region of China(201303057);Program for Young Talents in Science and Technology in Higher Education Institutions of Inner Mongolia Autonomous Region of China(NJYT-14-B17);Youth Innovation Fund of Inner Mongolia MedicalUniversity(NY2011QN005)
2015-07-02)
(本文编辑:周良佳 颜艳)

