重叠综合征患者血清肾上腺素及去甲肾上腺素表达水平的研究
王文静,王 萍,郭 阳
(1.聊城市第二人民医院,山东聊城252600;2.昌吉回族自治州人民医院,新疆昌吉831100)
重叠综合征患者血清肾上腺素及去甲肾上腺素表达水平的研究
王文静1,王 萍2,郭 阳2
(1.聊城市第二人民医院,山东聊城252600;2.昌吉回族自治州人民医院,新疆昌吉831100)
目的 探讨血清肾上腺素(E)和去甲肾上腺素(NE)在重叠综合征(OS)中的表达及与患者缺氧程度的相关性。推测E及NE对重叠综合征的发生发展的作用。方法 选取慢性阻塞性肺疾病患者(单纯COPD组)、阻塞性睡眠呼吸暂停低通气综合征患者(单纯OSAHS组)、重叠综合征患者(OS组)及对照组各30例,四组患者均行肺功能检查及多导睡眠监测,记录睡眠呼吸暂停低通气指数(AHI)、夜间最低血氧饱和度(LSaO2)、平均血氧饱和度(MSaO2)、最长呼吸暂停时间(LAT)。并采用酶联免疫法分别检测四组患者的E及NE的表达水平,对各项指标进行统计学处理。结果 (1)多导睡眠检测指标:OS组患者AHI、LAT均高于单纯OSAHS组、单纯COPD组、对照组(P<0.05),而LSaO2、MSaO2均低于单纯OSAHS组、单纯COPD组、对照组(P<0.05)。(2)E及NE的表达水平:OS组患者的E及NE表达水平均高于单纯OSAHS组、单纯COPD组、对照组(P<0.01)。(3)各组E及NE与睡眠监测指标的相关性:OS组及OSAHS组患者血清E及NE与AHl、LAT呈正相关(P<0.01),与LSaO2及MSaO2呈负相关(P<0.05)。COPD组患者血清E及NE与 AHI、LAT无相关性(P>0.05),与LSaO2及MSaO2呈负相关(P<0.05)。结论 OS患者较单纯COPD和OSAHS患者更易引起交感神经活性增强,E及NE表达水平的失调与病变严重程度密切相关。缺氧可能通过影响E及NE的水平促进重叠综合征病情的发生及发展。
重叠综合征; 慢性阻塞性肺疾病; 阻塞性睡眠呼吸暂停低通气综合征; 肾上腺素; 去甲肾上腺素
重叠综合征(overlap syndrome,OS)[1]是指慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)合并阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)的患者。为呼吸系统的常见疾病,有研究表明在成人中其发病率高达3%~4%[2]。由于重叠综合征患者同时存在COPD及 OSAHS引起的上下气道的双重阻塞,与单纯 COPD或 OSAHS患者相比,夜间低氧程度更加明显[3-4],更易产生呼吸衰竭、夜间低氧血症,更易引起血压升高、心律失常、继发性红细胞增多、脑血管意外、心肌梗死、睡眠质量差、睡眠期间死亡等并发症[5],有研究说明重叠综合征患者的生活质量更差,发病率及死亡率更高[6],但其发病机制尚不十分清楚。随着 COPD及OSAHS发病机制研究的日益深入,有关肾上腺素(epinephrine,E)及去甲肾上腺素(norepinephrine,NE)在COPD与OSAHS病变的发生发展过程中所起的作用逐渐被认识和强调,以往对肾上腺素及去甲肾上腺素的研究仅局限在单纯COPD和OSAHS。对OS发生发展的机制研究甚少。本实验通过研究肾上腺素及去甲肾上腺素在OS中的表达及睡眠呼吸的相关指标,进而探讨肾上腺素及去甲肾上腺素在OS发生发展中的作用及机制。
资料与方法
1 研究对象
选择2013年9月至2014年9月在昌吉州人民医院呼吸内科门诊和住院的患者。主诉为慢性咳嗽、咳痰和(或)睡眠时打鼾、白天嗜睡的患者,行多导睡眠监测(polysomnongraphy PSG)和肺功能检查,根据PSG结果和肺功能结果,将患者分为4组:
1.1 单纯COPD组 COPD患者共有30例,均为稳定期患者。其中男性20例,女性10例,平均年龄59.0±8.4岁,体质指数24.27±3.72kg/m2。COPD的入选标准:依据中华医学会呼吸病学分会慢性阻塞性肺疾病诊治指南(2013年修订版)[7]确诊,即:肺功能具有不完全性可逆的气流受限,应用支气管扩张剂后第一秒用力呼气容积占用力肺活量百分比(FEV1/FVC)<70%。患者近1月无急性发作及严重感染,咳嗽、咳痰、气短等症状较平稳。行 PSG检查排除OSAHS的患者。
1.2 单纯OSAHS组 OSAHS患者共有30例。其中男性21例,女性9例。平均年龄55.3±9.0岁,体质指数29.48±3.43kg/m2。OSAHS的入选标准:行 PSG监测符合 OSAHS诊断标准[8],即:每夜 7小时睡眠过程中呼吸暂停和(或)低通气反复发生30次以上或睡眠呼吸暂停低通气指数(AHI)≥5次/小时并伴有夜间睡眠打鼾、白天嗜睡等临床症状。既往无COPD病史并行肺功能检查除外COPD的患者。
1.3 OS组 OS患者共有30例。其中男性24例,女性6例。平均年龄59.3±9.3岁,体质指数30.16±3.86kg/m2。OS的入选标准:根据患者的临床表现、胸片、心电图、血气分析、肺功能及 PSG监测证实患者同时符合OSAHS和COPD的诊断[7,8]。
1.4 对照组 对照组共有30例。其中男性16例,女性14例。平均年龄57.4±9.1岁,体质指数25.68±4.74kg/m2。对照组入选标准:详细询问患者无慢性咳嗽、咳痰,无打鼾、夜间憋气、晨起头痛、乏力、困倦等症状,无心、脑、肾及肝脏等器官器质性病变等病史。行肺功能、PSG等检查排除COPD及OSAHS的患者。
排除标准:所有研究对象均排除肺结核、肺纤维化、肺脓肿、支气管扩张、支气管哮喘等呼吸系统疾病、库欣综合征、原发性慢性肾上腺皮质功能减退症等代谢异常的疾病,急性感染性疾病、恶性肿瘤、自身免疫性疾病、高血压、冠心病、糖尿病、急慢性肾功能衰竭、脑血管疾病等。且近期3个月内无创伤、手术史。
2 方法
2.1 主要实验试剂 肾上腺素定量检测试剂盒(酶联免疫法)及去甲肾上腺素定量检测试剂盒(酶联免疫法)均购自北京北方生物技术研究所。
2.2 肺功能检查 采用美国MedGraphics肺功能仪进行肺功能检查。
2.3 PSG检查 采用 SW-SM20000C多导睡眠检测仪进行PSG检查。嘱受试者检查当天不饮酒、不饮浓茶和咖啡等兴奋性饮料,不服用镇静药物等对睡眠有影响的药物,起居正常。
2.4 标本采集及测定 所有研究对象均于第二日清晨空腹、平卧位、清醒状态下采取肘静脉血5mL注入分离胶促凝管中,混匀后3000r/min离心15min,取离心的血清于EP管中置于-70℃冰箱中冻存待测,测定前使标本在室温复溶。E及NE采用酶联免疫吸附法,检测时所有操作严格按试剂盒说明书进行操作,由专人进行测定。
3 统计学处理
采用SPSS17.0软件进行统计学分析,符合正态分布的计量资料的所有数据均以均数±标准差(±s)表示。方差齐时,多组间均数比较采用单因素方差分析,组间的多重比较采用LSD-t检验,方差不齐时采用秩和检验。两变量间的相关分析采用person相关分析,α=0.05为检验水准。P<0.05为差异有统计学意义。
结 果
1 多导睡眠检测指标比较
OS组患者AHI及LAT均高于单纯OSAHS组、单纯COPD组、对照组,差异有统计学意义(P<0.05),且单纯 OSAHS组高于单纯COPD组和对照组,差异有统计学意义(P<0.05),单纯COPD组与对照组比较差异无统计学意义。四组患者LSaO2比较差异均有统计学意义(P<0.05)。OS组、单纯OSAHS组、单纯COPD组患者LSaO2及MSaO2均明显低于对照组(P<0.05),且三组中OS组降低最明显,其次为单纯OSAHS组(见表1)。
表1 各组多导睡眠检测指标比较(±s)
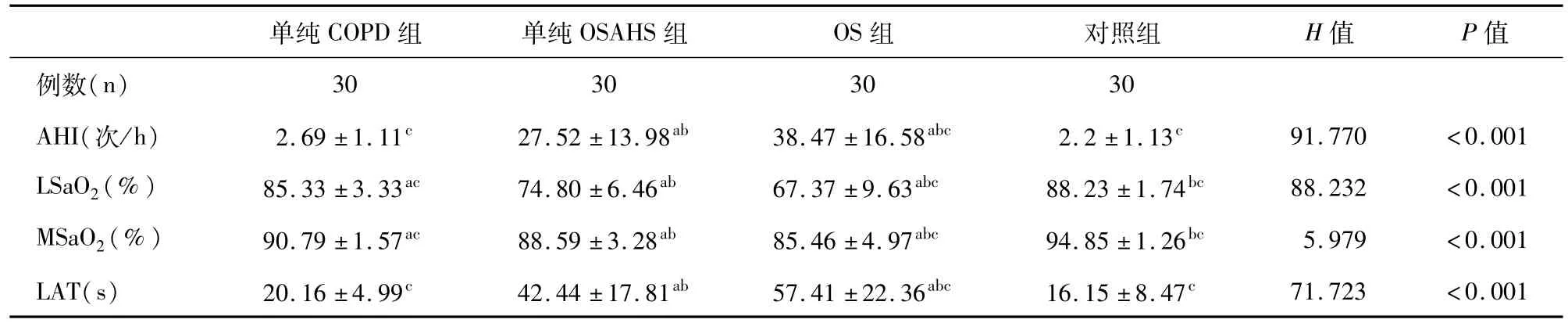
表1 各组多导睡眠检测指标比较(±s)
注:与对照组相比,a P<0.01;与单纯COPD组相比,b P<0.01;与单纯 OSAHS组相比,c P<0.01
单纯COPD组单纯OSAHS组OS组对照组H值P值例数(n)30303030 AHI(次/h)2.69±1.11c27.52±13.98ab38.47±16.58abc2.2±1.13c91.770<0.001 LSaO2(%)85.33±3.33ac74.80±6.46ab67.37±9.63abc88.23±1.74bc88.232<0.001 MSaO2(%)90.79±1.57ac88.59±3.28ab85.46±4.97abc94.85±1.26bc5.979<0.001 LAT(s)20.16±4.99c42.44±17.81ab57.41±22.36abc16.15±8.47c71.723<0.001
2 N及NE表达水平比较
四组患者N及NE比较差异均有统计学意义(P<0.01)。OS组、单纯OSAHS组、单纯COPD组患者N及NE的表达水平均明显高于对照组(P<0.05),且三组中OS组增高最明显,其次为单纯OSAHS组(见表2)。
表2 各组肾上腺素及去甲肾上腺素表达水平比较(±s)
注:与对照组相比,a P<0.05,与单纯COPD组相比,b P<0.05,与单纯OSAHS组相比,c P<0.05
单纯COPD组单纯OSAHS组OS组对照组F值P值30303030 E(ng/L)320.29±142.14ac400.81±160.04ab481.80±189.95abc238.28±114.36bc13.853<0.001 NE(ng/L)586.79±193.63ac715.24±260.49ab883.39±295.10abc455.90±198.05bc例数(n)17.261<0.001
3 各组的E与睡眠监测指标的相关性分析
COPD组的E与AHI、LAT无相关性(P>0.05),与 LSaO2及 MSaO2呈负相关(P<0.05)。OSAHS组的E与AHI、LAT呈正相关(P<0.01),与LSaO2及MSaO2呈负相关(P<0.05)。OS组的E与AHl、LAT呈正相关(P<0.01),与LSaO2及MSaO2呈负相关(P<0.05)(见表3)。
4 各组的NE与睡眠监测指标的相关性分析
COPD组的NE与AHI、LAT无相关性(P>0.05),与 LSaO2及 MSaO2呈负相关(P<0.05)。OSAHS组的NE与AHI、LAT呈正相关(P<0.01),与LSaO2及MSaO2呈负相关(P<0.05)。OS组的NE与AHl、LAT呈正相关(P<0.01),与LSaO2及MSaO2呈负相关(P<0.05)(见表4)。
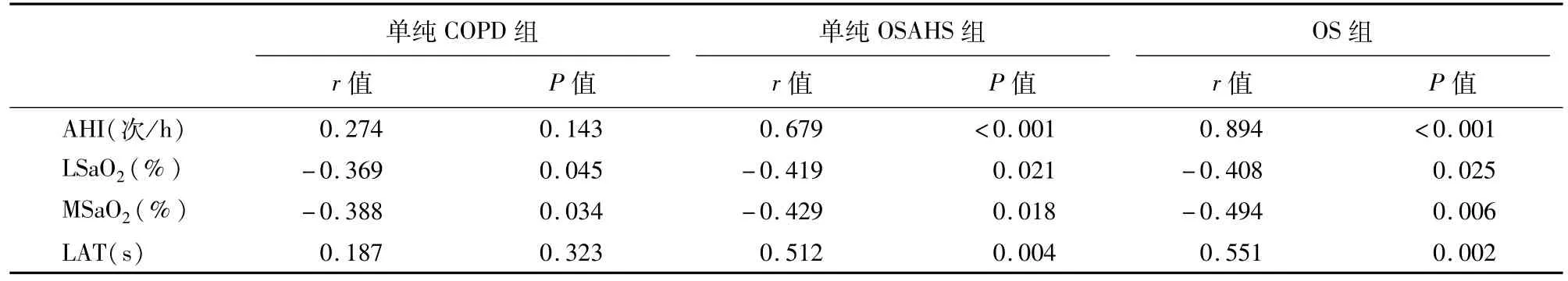
表4 各组血清去甲肾上腺素表达水平与睡眠监测指标的相关性
讨 论
与文献报道一致[11]。OS患者夜间低氧血症较单纯OSAHS及单纯COPD患者更为严重的可能机制包括:①OS患者存在明显的肺通气功能障碍,膨胀的肺泡使肺泡毛细血管受压,使肺毛细血管减少,导致通气/血流比例失调,进而引起低氧血症;②OS患者仰卧位时膈肌向头侧移位,加之OS患者多伴有肥胖,肥胖导致腹内压增加,均使膈肌代偿功能降低,周围气道闭合导致通气/血流比例失调,加重机体缺氧;③有研究表明,COPD合并OSAHS时,OSAHS患者睡眠时上气道软组织和舌根后坠等,吸气时,胸腔负压的加大,软腭及舌根后坠更加明显,使上气道阻力增加,加重呼吸肌负荷,诱发呼吸肌疲劳。
有研究表明交感神经系统活性在OSAHS的发生、发展中发挥着重要作用,是联系OSAHS及相关疾病的重要纽带。而有关OS患者中交感神经活性的研究甚少。本研究发现与对照组相比,OS组、单纯OSAHS组、单纯COPD组患者N及NE的表达水平均明显增高(P<0.05),且三组中OS组增高最明显,其次为单纯OSAHS组。表明OS患者、单纯OSAHS及单纯COPD患者均存在交感神经兴奋性增高。且OS患者较单纯OSAHS及单纯COPD患者交感神经兴奋性增高更加明显。主要原因考虑为OS患者除存在COPD引起的通气及换气功能障碍外,同时存在OSAHS引起的睡眠期间反复出现的呼吸暂停及低通气,使其低氧血症及高碳酸血症较单纯COPD及单纯OSAHS患者更为严重,低氧刺激中枢及外周化学感受
OSAHS是以患者睡眠中反复发生上气道完全或不完全阻塞而导致频繁的呼吸暂停或通气量减少、严重打鼾、白天嗜睡,睡眠结构紊乱为特征的疾病,伴有间断的低氧血症或合并高碳酸血症[9-10],是一种慢性睡眠呼吸疾病。COPD是一种以进行性、不完全可逆性气流受限为特征的慢性炎症性呼吸系统疾病。OSAHS与COPD并存时称之为OS。OS患者同时存在上气道与外周气道阻塞,与单纯COPD和单纯OSAHS患者相比,存在更严重的通气及换气功能障碍。故OS患者有更加严重的低氧血症且持续时间较长,亦可致高碳酸血症,严重时可引起神经调节功能失调,出现儿茶酚胺、肾素-血管紧张素、内皮素分泌增加,微血管收缩,内分泌功能紊乱及血液动力学改变等,造成组织器官缺血、缺氧,导致多器官功能损害,预后可能比单纯COPD和单纯OSAHS患者更差。
在年龄、性别及体重指数差异无统计学意义的前提下,本研究结果显示,OS组患者AHI及LAT均高于单纯OSAHS组、单纯 COPD组、对照组,且单纯OSAHS组高于单纯COPD组和对照组,差异有统计学意义,单纯COPD组与对照组比较差异无统计学意义。OS组、单纯OSAHS组、单纯COPD组患者 LSaO2及MSaO2均明显低于对照组(P<0.05),且三组中OS组降低最明显,其次为单纯OSAHS组。表明OS患者出现睡眠呼吸紊乱的频率更高,程度更重,睡眠呼吸暂停时间更长,与睡眠相关的夜间低氧血症更为严重,器,导致交感神经激活,肾上腺素及去甲肾上腺素分泌增多。有研究显示,与缺氧对交感神经活性的影响相比,呼吸暂停对交感神经活性的影响更大,更能刺激交感神经的激活,释放NE及E[12]。与本研究得出的结果一致,即单纯OSAHS患者与单纯COPD患者相比,交感神经活性更强。本研究得出结果表明OS患者交感神经活性增加最为明显,使发生心脑血管并发症的危险性增加,因此通过本研究可推测,在OS的发生、发展过程中,交感神经系统的过度激活起着不可忽视的重要作用。
本研究发现单纯 COPD组的E及NE与 AHI、LAT无相关性,与LSaO2及 MSaO2呈负相关。考虑主要与COPD患者引起低氧血症及高碳酸血症的途径有关,COPD患者主要通过长期慢性炎症造成的外周气道阻力的增加所致的通气和换气功能障碍引起机体的缺氧和二氧化碳潴留[13],而这种机制导致的低氧血症及高碳酸血症的发生不存在时间差异。单纯OSAHS组的E及NE与AHI、LAT呈正相关,与LSaO2及MSaO2呈负相关。特别是与AHI的相关性最强,说明OSAHS患者交感神经过度激活、E及NE过度表达主要是由夜间短暂而间断出现的呼吸暂停及低通气造成的机体缺氧及二氧化碳潴留引起。OS组的E及NE与AHI、LAT呈正相关,与LSaO2及MSaO2呈负相关,说明随着OS患者病情的加重,AHI、LAT越高,LSaO2、MSaO2越低,夜间睡眠紊乱加重,呼吸暂停及低通气导致的体内低氧血症及二氧化碳潴留越重,刺激交感神经活性增强,体内血浆E及NE的表达水平越高。出现这种结果的原因主要考虑与OS患者同时具有 COPD及OSAHS引起的双重损害。机体对缺氧及二氧化碳潴留的反应性下降。夜间呼吸驱动降低,与单纯COPD及单纯OSAHS患者相比,OS患者夜间体内低氧血症及高碳酸血症更重[14]。OS患者出现间断及持续的缺氧,刺激机体交感神经激活,分泌过多的E及NE。
综上所述,OS患者由于同时存在COPD引起的慢性持续缺氧及OSAHS引起的与睡眠有关夜间间断低氧,使其低氧血症及高碳酸血症较单纯COPD及单纯OSAHS患者更为严重,夜间睡眠质量更差,严重影响了患者的生活质量[15]。且本文通过对OS患者体内E及NE表达水平的研究,证明OS患者交感神经系统过度激活,易引起呼吸衰竭、心力衰竭、恶性心律失常、猝死等并发症。因此,在临床中对于肥胖的COPD患者应行PSG检查,对于有慢性咳嗽、咳痰气喘等症状的OSAHS患者行肺功能检查,从而减少对重叠综合征的漏诊率,达到早期诊断及治疗,并通过抑制交感神经的过度激活来延缓病情的发展及并发症的发生,提高重叠综合征患者的生活质量、降低病死率。
[1]Flenley D C.Sleep in chronic obstructive lung disease.Clin Chest Med,1985,6(4):651-661.
[2]Bednarek M.The overlap syndromof chronic obstructive pulmonary disease and obstructive sleep apnoea.Pneumonol Alergol Pol,2011,79(2):67-69.
[3]林强,陈洪.睡眠呼吸暂停综合征与慢性阻塞性肺疾病的相关分析.临床肺科杂志,2010,15(10):1407-1408.
[4]Weitzenblum E,Chaout A,Kessler R,et al.Overlap syndrome obstructive sleepapneainpatients withchronicobstructive pulmonary disease.Proc Am Thorac Soc,2008,5(2):237-241.
[5]Pleasants R A,Ohar J A,Croft J B,et al.Chronic obstructive pulmonary disease and asthma-patient characteristics and health impairment.COPD,2014,11(13):255-266.
[6]Marin JM,Soriano JB,Carrizo S J,et al.Outcomes in patients with chronic obstructive pulmonary disease and obstructive sleep apnea:the overlap syndrome.Am JRespir Crit Care Med,2010,182(3):325-331.
[7]中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2013年修订版).中华结核和呼吸杂志,2013,36(4):255-264.
[8]中华医学会呼吸病学分会睡眠呼吸障碍学组.阻塞性睡眠呼吸暂停低通气综合征诊治指南(2011年修订版).中华结核和呼吸杂志,2012,35(1):9-12.
[9]陈宝元.阻塞性睡眠呼吸暂停综合征领域的发展与展望.临床内科杂志,2012,29(4):233-236.
[10]尹琦,任涛.睡眠呼吸暂停低通气综合征概述.临床内科杂志,2012,29(4):221-223.
[11]Park M,Azevedo LCP,Maciel A T,et al.Evolutive standard base ex-cess and serum lactate level in severe sepsis and septic shock patientsresuscitatedwithearlygoal-directedtherapystill outcomemarkers.Clinics,2006,61(1):47-52.
[12]Mills P J,Kennedy B P,Loredo J S,et al.Effects of nasal continuous positive airway pressure and oxygen supplementation on norepinephrine kinetics and cardiovascular responses in obstructive sleep apnea.JAppl Physiol,2006,100(1):343-348.
[13]陈飞鹏,俞朝贤,陈晓军,等.慢性阻塞性肺疾病及阻塞性睡眠呼吸暂停低通气综合征患者呼吸阻抗和睡眠呼吸紊乱的研究.中国综合临床,2008,24(9):855-857.
[14]韩锋锋,王妍敏,黄雁西,等.双水平持续气道正压通气治疗重叠综合征的临床疗效.实用医学杂志,2006,22(15):1776-1777.
[15]Kauppi P,Kupiainen H,Lindqvist A,et al.Overlap syndrome of asthma and COPD predicts low quality of life.JAsthma,2011,48(3):279-285.
(李 凌编辑)
The Study of the Expressive Level of Serum Epinephrine and Norepinephrine in Overlap Syndrome Patients
WANGWen-jing,WANG Ping,GUO Yang
(The Second People’s Hospital of Liaocheng,Liaocheng 252600,China)
Objective To explore expression level of serum epinephrine(E)and norepinephrine(NE)in patients with overlap syndrome(OS)and its correlation with hypoxia degree.To speculate role and mechanism of E and NE in OS.M ethods We enrolled 30 patients with COPD(COPD group),30 patients with obstructive sleep apnea hypopnea syndrome(OSAHS group),30 patients with OS(OS group)and 30 normal people as control.All patients were monitored for pulmonary function and polysomnography,apnea hypopnea index(AHI).Lowest oxygen saturation(LSaO2),mean oxygen saturation(MSaO2)and longest apnea time(LAT)were recorded.The level of E and NE were detected by euzymelinked immunosorbend assay.Results(1)Polysomnography parameters of AHIand LAT of OS group were significantly higher than those in the other three groups(P<0.05).LSaO2and MSaO2in OS group were significantly lower than those in the other three groups(P<0.05).(2)The expressive level of E and NEwere significantly higher in OS patients than those in the other three groups(P<0.01).(3)The correlation of between E,NE andpolysomnography parameters in different groups:E and NE in OS and OSAHS groups showed positive correlation with AHIand LAT(P<0.01),but negative correlation with LSaO2and MSaO2(P<0.05).E and NE in COPD group had no correlation with AHI and LAT(P>0.05),but negative correlation with LSaO2and MSaO2(P<0.05).Conclusion The sympathetic nervous activity of OS patients is higher than it in COPD and OSAHS patients.The abnormal expression of N and NE in OS patients is related to the seriousiness of the disease.The level of E and NE affected by hypoxia might promote the deterioration of OS.
Overlap syndrome; Chronic obstructive pulmonary disease; Obstructive sleep apnea—hypopnea syndrome; Epinephrine; Nore-pinephrine
10.11748/bjmy.issn.1006-1703.2016.06.007
2016-03-27;
2016-05-23
新疆昌吉州科技攻关项目
王文静(1988—),女,硕士研究生。
郭阳,主任医师,教授,研究方向:主要研究睡眠呼吸暂停综合征。E-mail:zyygy2009@163.com

