沙漠小球藻的蛋白双向电泳分析
牟 云,汪文伦,严 国,王会敏,高剑峰
(石河子大学 生命科学学院,新疆石河子 832000)
沙漠小球藻的蛋白双向电泳分析
牟云,汪文伦,严国,王会敏,高剑峰*
(石河子大学 生命科学学院,新疆石河子 832000)
为建立适用于小球藻(Chlorellasp. TLD6B)蛋白质组分析的双向电泳体系,该研究比较了TCA/丙酮沉淀法和Trisol提取法对小球藻蛋白的提取效果,不同pH梯度IPG胶条(pH3~10和 pH4~7)、不同蛋白质上样量、不同聚焦程序对小球藻蛋白的分离效果。结果表明:(1)采用Trisol提取法可获得较高纯度蛋白,当选择24 cm pH 3~10的线性IPG胶条时,上样量为500 μg,聚焦80 000 Vh效果最佳,可分辨蛋白点达726个;当选择24 cm pH 4~7的线性IPG胶条时,上样量为1 000 μg,聚焦80 000 Vh效果最佳,可分辨蛋白点达1 230个。(2)该实验随机挑选了10个胶内蛋白点进行MALDI-TOF/TOF-MS鉴定分析表明,其中8个蛋白点鉴定成功,进一步说明Trisol提取法可适用于小球藻双向电泳分析。
小球藻;双向电泳;Trisol提取法
双向电泳(2-DE)作为蛋白质组学研究的核心技术由O’Farrell于1975年建立[1],其利用蛋白质等电点和分子量的差异可一次性分离几千甚至几万的蛋白质点,具有较高的灵敏度和分辨率。目前,2-DE技术已在细菌、真菌、动植物[2-4]中被广泛应用,但关于微藻、特别是小球藻的2-DE技术则报道的相对较少。在2-DE技术中,蛋白提取和体系优化是最为重要的环节,小球藻中含有大量的多糖、淀粉、脂质等干扰物质,因此寻求适合的蛋白提取方法极为重要;此外,由于不同植物的生物学特征、生理生化特征不尽相同,不同植物的最适电泳条件也不尽相同[5],所以探求小球藻的最适电泳条件有一定的必要性。
小球藻为球形或椭圆形、绿色、单细胞藻类植物,也是真核微生物的一种。其细胞直径3~8 μm,是地球上最早的生命之一,出现在20多亿年前,遗传相对保守,其广泛分布于海洋、土壤和荒漠。作为分布广泛的单细胞低等生物,小球藻是在单细胞水平上研究植物逆境胁迫条件下蛋白表达及其调控的绝佳材料。目前,国内外关于藻类抗逆蛋白组学的研究日趋活跃。同时,小球藻作为重要的生物质能源的储备资源也被广泛应用。Wang等[6]通过双向电泳技术研究了雨生红球藻细胞壁蛋白质对氧化应激的反应。Liska等[7]从蛋白组学角度分析了杜氏盐藻的耐盐性机制。Wagner等[8]通过双向电泳技术研究了雷氏衣藻的昼夜节律蛋白。Murugaiyan J等[9]研究了致病无绿藻和非致病无绿藻之间的蛋白组学差异。Song等[10]通过双向电泳技术比较分析了正常和缺氮组球等鞭金藻的蛋白组学变化,从蛋白组学水平揭示了氮元素对小球藻产油的影响。
沙漠小球藻作为一种低等的单细胞植物,其个体生长的分子机制尚不明确;截止至今大规模培养小球藻未取得突破性进展。为了深入研究小球藻个体生长的分子机制和其对干旱、高盐等逆境的应答机制,从蛋白组学和基因组学水平研究其蛋白和基因的表达差异就显得尤为重要。因此,本研究比较了TCA/丙酮沉淀法和Trisol提取法对小球藻蛋白的提取效果,同时比较了不同pH梯度IPG胶条(pH3~10和 pH4~7)、不同蛋白质上样量、不同聚焦程序对小球藻蛋白的分离效果;建立了一套沙漠小球藻2-DE技术方法,不仅为沙漠小球藻抗逆蛋白组学研究提供了技术条件,也为其他陆生藻类的蛋白组学研究提供了基础资料。
1 材料与方法
1.1材料
实验所用藻种由本实验室从新疆塔克拉玛干沙漠沙样中分离、纯化并鉴定。将Chlorellasp.(TLD6B)原藻液以10%接种量转至3个装有500 mL BBM培养基的1 000 mL三角瓶中;接种后的藻样置于光照箱中培养,光照强度4 000 lx,12 h光照,温度23 ℃;至对数生长期离心收集藻体用于后续实验。
1.2实验方法
1.2.1蛋白质提取(1)TCA/丙酮沉淀法参见Damerval等[11]的方法。(2)Trisol提取法参见Fred等[12]的方法。具体步骤为:取适量藻液6 000 r/min离心5 min,所得藻泥用蒸馏水洗3次;液氮研磨破壁,加入1 mLTrisol试剂,室温下静置5 min,加入200 μL三氯甲烷于细胞裂解产物中,充分混匀,室温下静置5 min,之后4℃、12 000 r/min离心15 min,弃无色顶层;加入300 μL乙醇,4℃、12 000 r/min离心5 min;将上清转移到新离心管中并加入1.5 mL异丙醇,室温下静置20 min,之后12 000 r/min离心10 min;所得沉淀用95%乙醇清洗之后在用80%预冷丙酮沉淀30 min,12 000 r/min 离心10 min,弃上清,沉淀空气中干燥。
1.2.2蛋白样品的裂解及定量加入一定体积的裂解液(7 mol/L尿素,2 mol/L硫脲,4%CHAPS,2%IPG buffer,1%DTT)溶解蛋白,30℃水浴促溶2 h,15 000 r/min离心30 min;上清即为蛋白液。采用蛋白质定量试剂盒(2-D Quant-Kit, GE-Healthcare)对所提蛋白进行定量。
1.2.3SDS-PAGE 蛋白电泳采用常规SDS-PAGE对所提蛋白进行分离;其中分离胶浓度为12%,浓缩胶浓度为5%,上样量为30 μg;电泳完毕采用考马斯亮蓝法进行染色。
1.2.4双向电泳一向等电聚焦采用24 cm线性IPG胶条(GE-Healthcare),根据蛋白浓度确定上样量,用水化液(7 mol/L尿素,2 mol/L硫脲,2%CHAPS,0.5%IPG buffer,1%DTT,0.0002%溴酚蓝)补齐至450 μL。在泡胀盘中对胶条进行过夜被动泡胀后,使用Ettan IPGphor3等电聚焦仪进行第一向等电聚焦,聚焦程序为:100 V 2 h;300 V 3 h;1 000 V 3 h;3 000 V 3 h;8 000 V 3 h;8 000 V,分别聚焦60 000 Vh、70 000 Vh、80 000 Vh;500 V,任意时间。聚焦完成的胶条立即进行平衡,平衡分两步,每次15 min。平衡液Ⅰ含6 mol/L 尿素、2% SDS、75 mmol/L Tris-HCl (pH 8.8)、20% Glycerol (甘油)、0.000 2%溴酚蓝和1% DTT,平衡液Ⅱ含6 mol/L 尿素、2% SDS、75 mmol/L pH 8.8Tris-HCl、20% Glycerol和2.5% Iodacetamide(碘乙酰胺)。每次平衡后用蒸馏水冲洗胶条并于滤纸上沥干水分。将平衡后的胶条放入二向胶上,并用0.5%低熔点琼脂糖封胶,使用EttanDaltSix垂直板电泳仪进行第二向SDS-PAGE蛋白电泳,调恒温水浴15 ℃,每张10 mA电泳30 min,然后每张38 mA电泳5~6 h,待溴酚蓝前沿到达凝胶底部停止电泳。
1.2.5图像扫描与分析使用ImageScannerⅢ对图像进行扫描,并用Labscan软件进行照相,图像分辨率300 dpi;用ImageMaster Platinum 7.0对扫描结果进行分析。
1.2.6挖点及胶内酶解与质谱分析根据ImageMaster Platinum 7.0软件分析的结果,用200 μL枪头(根据蛋白点大小减去前端适当部分)插取蛋白点,并放入PCR小管中,送上海生工生物工程股份有限公司完成胶内酶解及质谱分析。将得到的肽质量指纹图提交到Mascot (www.matrixscience.com)蛋白数据库进行搜索,搜索参数设定如下:检索数据库为NCBInr,物种选择绿色植物,胰蛋白酶酶解,固定修饰为Carbamidomethyl (C),可变修饰为Acetyl (Protein N-term)、Deamidated (NQ)、Dioxidation (W)、Oxidation (M),肽段偏差100 ppm。
2 结果与分析
2.1不同蛋白质提取方法的比较分析
采用Trisol提取法和TCA/丙酮沉淀法提取小球藻的全蛋白,结果(图1)显示。2种蛋白提取方法均能获得较为清晰的条带,Trisol法提取的蛋白大致分布在18.4 ~116.0 kD之间;TCA/丙酮沉淀法提取的蛋白大致分布在25.0 ~116.0 kD之间,说明对于分子量小于25.0 kD的蛋白该方法不能有效提取,造成了蛋白的丢失(图1,A)。Trisol提取法获得的蛋白溶液浓度为(9.87±0.52) mg/mL,而TCA/丙酮沉淀法所获蛋白浓度则为(4.93±0.56) mg/mL(图1,B)。综上说明Trisol提取法更适用于小球藻蛋白的提取和后续的双向电泳实验。
2.2不同蛋白上样量的双向电泳结果比较
为了使电泳图像有更高的分辨率,对双向电泳中蛋白的上样量进行了对比分析。
用Trisol提取法提取小球藻全蛋白,分别选用24 cm、pH 3~10和pH 4~7 IPG胶条。选用24 cm、pH 3~10的IPG胶条时分别取1 100、800和500 μg的蛋白样品进行上样;选用24 cm、pH 4~7 IPG胶条时分别取1 200和1 000 μg蛋白样品进行上样。结果(图2)显示,采用pH 3~10 IPG胶条,上样量为1 100 μg时,蛋白基本不能聚焦成规则的点且横条纹严重,蛋白图谱中可识别的蛋白点仅有172个(图2,A);上样量为800 μg时,蛋白点数较多,但一些高丰度蛋白点过大导致饱和重叠现象的发生,蛋白图谱中可识别的蛋白点有333个(图2,B);上样量为500 μg时,蛋白点清晰且无横条纹,聚焦效果好,蛋白图谱中可识别的蛋白点高达726个,能更好地满足实验分析的需求(图2,C)。采用pH 4~7 IPG胶条,上样量为1 200 μg时,同样高丰度蛋白掩盖了部分低丰度蛋白的分离,可识别蛋白点有935个(图2,D);减少上样量至1 000 μg,蛋白点相对清晰,图谱质量较佳,可识别的蛋白点高达1 230个(图2,E)。

A.不同蛋白提取方法制备的蛋白SDS-PAGE分析;B.不同蛋白提取方法所得蛋白浓度比较;M.蛋白质标准分子量;1~3和a. Trisol提取法;4~6和b. TCA/丙酮沉淀法图1 不同蛋白提取方法的比较A. SDS-PAGE of proteins extracted by different methods; B.Comparison of protein concentrations; M. Protein molecular weight marker; 1~3 and a.Trisol extraction;4~6 and b.TCA/acetone precipitationFig.1 Comparison of different protein extraction methods

A~C为pH 3~10 IPG胶条所得图谱,上样量分别为1 100、800和500 μg;D~E为pH 4~7 IPG胶条所得图谱,上样量分别为1 200和1 000 μg图2 不同上样量2-DE图谱比较 A~C were 2-DE maps which using pH 3~10 linear IPG strip, loading volume were 1 100 ,800 and 500 μg, respectively; D~E were 2-DE maps which using pH 4~7 linear IPG strip, loading volume were 1 200 and 1 000 μg, respectivelyFig.2 2-DE maps of different loading volumes
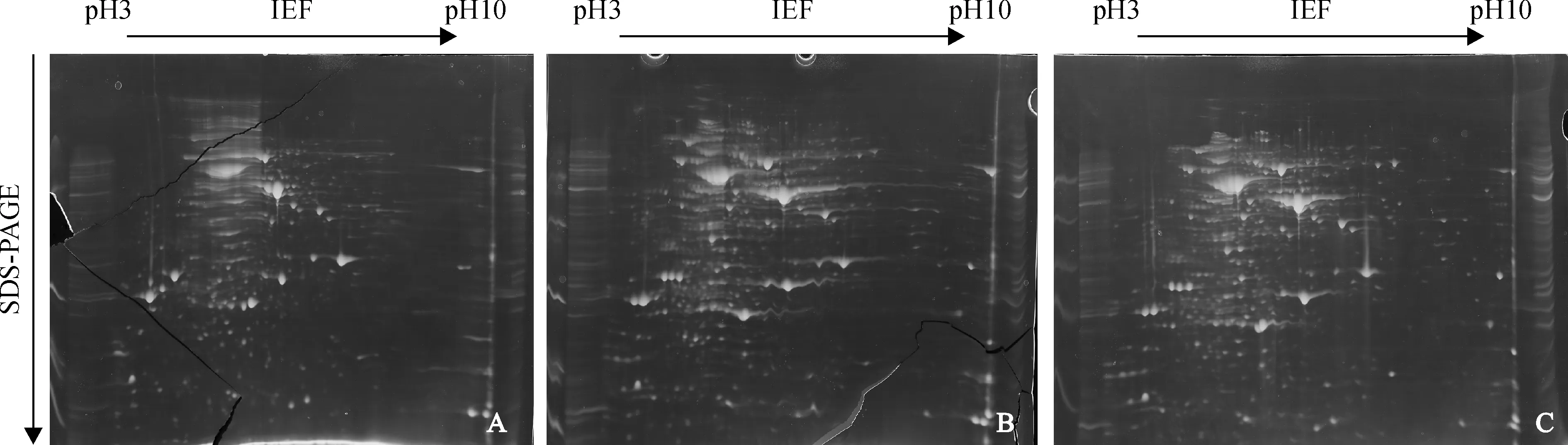
图3 不同聚焦程序的2-DE图谱比较A.60 000 Vh;B. 70 000 Vh;C.80 000 VhFig.3 2-DE maps of different IEF time
2.3不同聚焦程序的双向电泳结果比较
采用pH 3~10 IPG胶条,上样量500 μg,聚焦时间分别为60 000 Vh、70 000 Vh和80 000 Vh,电泳结果(图3)显示,聚焦时间为60 000 Vh时,电泳图谱中存在大量的横条纹且可分辨的蛋白点较少,仅有196个(图3,A);聚焦时间为70 000 Vh时,图谱中的横条纹相对减少,但仍存在部分横条纹,说明一些蛋白还未充分聚焦,可分辨的蛋白点为398个(图3,B);聚焦时间为80 000 Vh时,图谱中横条纹明显减少,可分辨的蛋白点达到763个(图3,C)。而pH 4~7 IPG胶条的聚焦程序优化建立在pH 3~10 IPG胶条的基础之上,采用80 000 Vh的聚焦时间可获得较高质量的蛋白图谱(图2,E)。由此可见,采用pH 3~10和pH 4~7IPG胶条时,聚焦80 000 Vh可获得分辨率高且横条纹少的电泳图谱。
2.4小球藻蛋白的质谱分析鉴定
随机选取pH 4~7的2-DE图谱中10个蛋白点进行质谱鉴定(图4),8个蛋白点鉴定成功(表1),其中点C15得分210,序列覆盖度为15%,为捕光叶绿素a/b结合蛋白I型;点C16得分151,序列覆盖度为7%,为一个表达蛋白;点C17得分108,序列覆盖度为5%,为ABC转运蛋白底物结合蛋白;点C18得分102,序列覆盖度为9%,为外膜蛋白/肽聚糖结合(脂)蛋白;点C19得分290,序列覆盖度为2%,为ATP合酶β亚基;点C21得分58,序列覆盖度为1%,为假想蛋白VITISV_024100;点C22得分98,序列覆盖度为33%,为核酮糖磷酸异构酶;点C24得分108,序列覆盖度为3%,为假想蛋白CHLNCDRAFT_138237。说明从电泳图谱中挖取的蛋白点可较好地满足后续的实验分析要求。

图4 用于质谱分析的10个蛋白点Fig.4 Ten randomly selected protein spots on 2-DE gel wereidentified by mass spectrometry表1 蛋白点MALDI-TOF-TOF 质谱鉴定结果Table 1 Identification of selected protein spots using MALDI-TOF-TOF
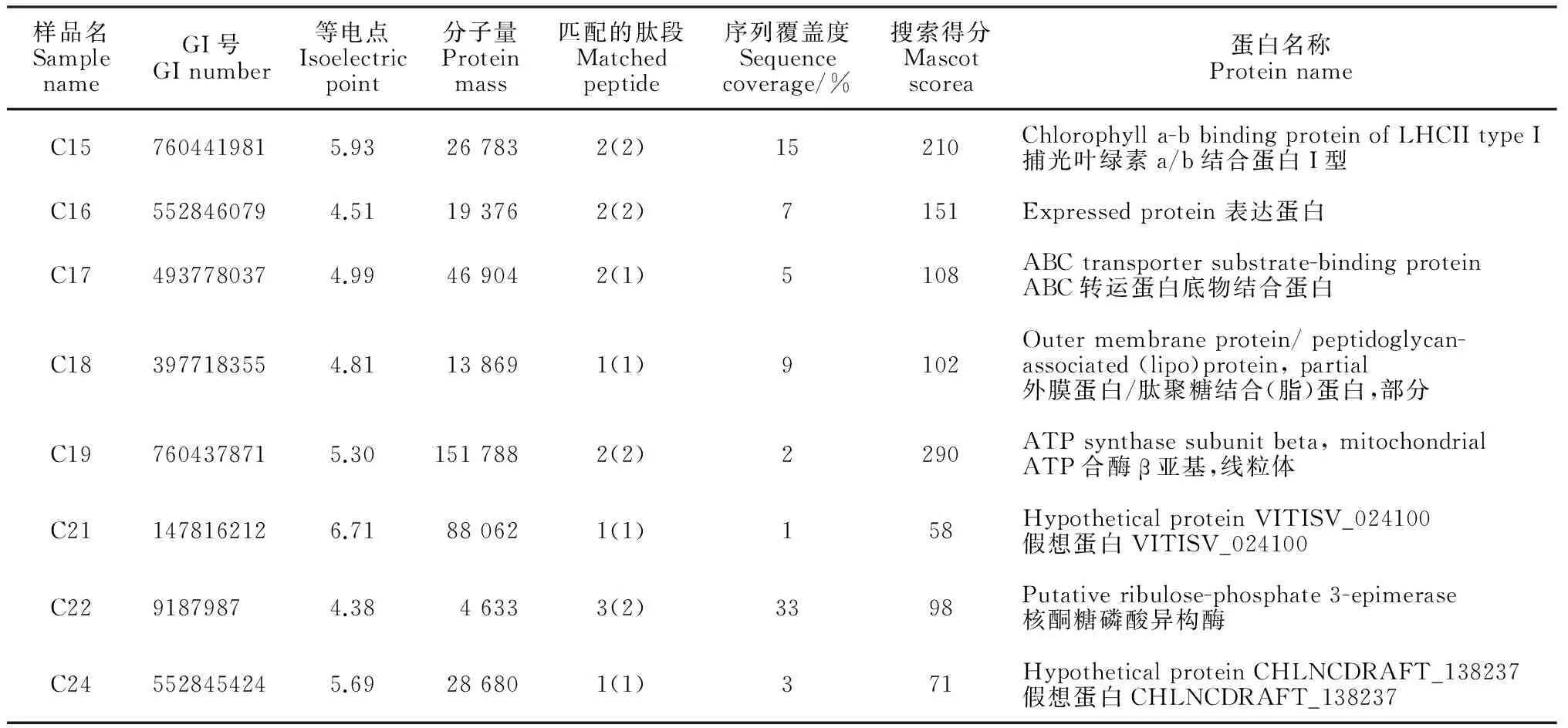
样品名SamplenameGI号GInumber等电点Isoelectricpoint分子量Proteinmass匹配的肽段Matchedpeptide序列覆盖度Sequencecoverage/%搜索得分Mascotscorea蛋白名称ProteinnameC157604419815.93267832(2)15210Chlorophylla-bbindingproteinofLHCIItypeI捕光叶绿素a/b结合蛋白I型C165528460794.51193762(2)7151Expressedprotein表达蛋白C174937780374.99469042(1)5108ABCtransportersubstrate-bindingproteinABC转运蛋白底物结合蛋白C183977183554.81138691(1)9102Outermembraneprotein/peptidoglycan-associated(lipo)protein,partial外膜蛋白/肽聚糖结合(脂)蛋白,部分C197604378715.301517882(2)2290ATPsynthasesubunitbeta,mitochondrialATP合酶β亚基,线粒体C211478162126.71880621(1)158HypotheticalproteinVITISV_024100假想蛋白VITISV_024100C2291879874.3846333(2)3398Putativeribulose-phosphate3-epimerase核酮糖磷酸异构酶C245528454245.69286801(1)371HypotheticalproteinCHLNCDRAFT_138237假想蛋白CHLNCDRAFT_138237
3 讨 论
在双向电泳整个环节中,蛋白提取、IPG胶条pH范围选择、上样量和聚焦时间是影响电泳图谱质量的必要因素。由于不同植物所含蛋白量和组分各不相同,因而对每种植物都需要进行体系优化[5]。
TCA/丙酮沉淀法是现今提取植物蛋白的常用方法之一,已在国内外被广泛应用[13-14]。但此方法最大的弊端在于所提蛋白很难复溶,会导致一部分蛋白的缺失。Fred Wang-Fat Lee等[12]以亚历山大藻和斯克里普藻为研究对象,采用Trisol提取法对这两种微藻的蛋白进行提取,得到的双向电泳图谱分辨率高,重复性好。
朱方超等[15]比较了TCA/丙酮沉淀法和改良酚法对水稻种子提取效果的影响,发现TCA/丙酮沉淀法获得的电泳图谱中存在部分蛋白点的丢失,类似的情况在本实验中也得到了体现。与TCA/丙酮沉淀法相比,Trisol提取法可更有效去除小球藻中的色素、多糖、脂质等干扰电泳结果的物质且所提蛋白相对完整;此外,该方法还可减少高丰度蛋白对电泳结果的影响。所以,本实验采用Trisol提取法提取小球藻蛋白。
理论上,pH 3~10 IPG胶条比pH4~7 IPG胶条可分离得到更多的蛋白点,能更好地反映植物组织细胞内蛋白的表达情况。但是小球藻蛋白大多集中在pH5~7之间,极酸、极碱蛋白相对较少,采用pH3~10的IPG胶条就会使蛋白过于集中,无法使不同蛋白点有效分开,从而导致电泳图谱的分辨率降低。多数学者采用pH4~7的IPG胶条进行植物蛋白的分离,如甘露等[16]采用pH4~7 IPG胶条对甘蓝型油菜蛋白进行分离,王珊珊等[17]也采用pH4~7 IPG胶条对黄瓜根系蛋白进行分离,Nicola等[18]在研究缺氮条件下硅藻的蛋白变化时采用了pH4~7 IPG胶条。但并非所有植物都可采用pH 4~7IPG胶条进行分离,当研究极酸和碱性蛋白时,采用pH3~10 IPG胶条才可达到分离效果[19]。本实验分别研究了pH4~7和pH3~10 IPG胶条的最适电泳条件,为后续的实验奠定了基础。
在双向电泳过程中,上样量也决定了实验的成败。提高上样量有利于低丰度蛋白的检出,但过高的上样量则会导致盐离子浓度过高,从而使一向等电聚焦不完全,蛋白图谱则会出现较多的横条纹,严重影响实验分析[20];而过低的上样量则不利用低丰度蛋白的显现。梁文裕等[21]在发菜双向电泳的优化实验中采用24 cm、pH4~7 IPG胶条,上样量为1 500 μg时能得到较清晰的蛋白图谱。石海波等[22]在玉米籽粒的双向电泳优化实验中采用24 cm、pH3~10 IPG胶条,上样量为800 μg时能得到较清晰的蛋白图谱。因此,上样量的选择不仅要根据IPG胶条的pH范围来考虑,还要根据实验材料、IPG胶条的长度、染色方法等因素综合考虑。在本实验中,当选择24 cm、pH3~10 IPG胶条时,上样量为500 μg,效果最佳;当选择24 cm、pH4~7 IPG胶条时,上样量为1 000 μg,效果最佳。
等电聚焦程序设置的好坏直接影响电泳图谱的分辨率,一般采用低电压除盐、缓慢升压的方式进行等电聚焦。因植物蛋白样品中含大量的盐分,低电压则有助于盐分的去除,使电压最终能升到预设值。本实验对24 cm pH4~7和pH3~10 IPG胶条聚焦80 000 Vh,均可得到分辨率较高的蛋白图谱。
本研究的小球藻分离自塔克拉玛干沙漠,生长于此的小球藻及其他植物经过百万年的进化,已经完全适应了沙漠的极端环境。为了深入了解其逆境适应性,采用双向电泳技术揭示干旱胁迫和高盐胁迫下小球藻蛋白调控机制,不仅能从单细胞水平阐明低等植物在水、盐胁迫下蛋白表达情况,更重要的是,能够通过比较分析了解低等植物的单个细胞和高等植物组织中的每个细胞在抗逆过程中的功能,从而能够解析高等植物的细胞、组织和器官乃至整个植株在抗逆过程中各自发挥的作用,从而为更加全面、系统地认识植物抗逆分子机制奠定基础。
本研究通过对沙漠小球藻双向电泳体系优化,建立了一套适用于小球藻的双向电泳技术体系。采用Trisol提取法提取蛋白的纯度和浓度均能达到实验的要求;当选用24 cm pH3~10线性IPG胶条时,上样量为500 μg,聚焦80 000 Vh,所得蛋白图谱分辨率高,可分辨蛋白点达726个;当选用24 cm pH4~7线性IPG胶条时,上样量为1 000 μg,聚焦80 000 Vh,所得蛋白图谱分辨率高,可分辨蛋白点达1 230个。
[1]O’FARRELL PH. High resolution two-dimensional electrophoresis of proteins[J].JournalofBiologicalChemistry, 1975, 250(10):4 007-4 021.
[2]MOLLOY MP, PHADKE ND, MADDOCK JR, et al. Two-dimensional electrophoresis and peptide mass fingerprinting of bacterial outer membrane proteins[J].Electrophoresis, 2001,22(9):1 686-1 696.
[3]SHIGEMITSU T, SAITO Y, MORITA S,etal. Separation and identification of rice prolamins by two-dimensional gel electrophoresis and amino acid sequencing[J].BioscienceBiotechnology&Biochemistry,2012,76(3):594-597.
[4]颜新培,钟伯雄,徐孟奎,等.家蚕催青前期胚胎蛋白质双向电泳图谱分析[J].昆虫学报, 2005,48(2):295-300.
YAN X P, ZHONG B X, XU M K,etal. Analysis of protein patterns from embryo of silkworm Bombyxmori at earlier stage by two dimensional polyacrylamide gel electrophoresis[J].ActaEntomologicaSinica, 2005,48(2):295-300.
[5]赵玲玲,毕青,周雪,等.大白菜根系蛋白质双向电泳体系优化[J].分子植物育种,2015,(1):178-183.
ZHAO L L,BI Q,ZHOU X,etal.Optimizing two-dimensional gel electrophoresis system for root proteins of Chinese Cabbage (BrassicarapaL. ssp.Pekinensis)[J].MolecularPlantBreeding,2015,(1):178-183.
[6]WANG S B, CHEN F, SOMMERFELD M,etal. Proteomic analysis of molecular response to oxidative stress by the green algaHaematococcuspluvialis(Chlorophyceae)[J].Planta, 2004,220(1):17-29.
[7]LISKA A J, SHEVCHENKO A, PICK U,etal. Enhanced photosynthesis and redox energy production contribute to salinity tolerance in Dunaliella as revealed by homology-based proteomics[J].PlantPhysiology,2004,136(1):2 806-2 817.
[8]WAGNER V, FIEDLER M, MARKERT C,etal. Functional proteomics of circadian expressed proteins fromChlamydomonasreinhardtii[J].FebsLetters, 2004,559(1-3):129-135.
[9]MURUGAIYAN J, WEISE C, BERGEN MV,etal. Two-dimensional proteome reference map ofProtothecazopfiirevealed reduced metabolism and enhanced signal transduction as adaptation to an infectious life style[J].Proteomics, 2013,13(17):2 664-2 669.
[10]SONG P P, LI L, LIU J. Proteomic analysis in nitrogen-deprivedIsochrysisgalbanaduring lipid accumulation[J].PlosOne, 2013,8(12):1-13.
[11]DAMERVAL C, DE VIENNE D, ZIVY M,etal. Technical improvements in two‐dimensional electrophoresis increase the level of genetic variation detected in wheat-seedling proteins[J].Electrophoresis, 1986,7(7):52-54.
[12]LEE W F, LO C L. The use of Trizol reagent (phenol/guanidine isothiocyanate) for producing high quality two-dimensional gel electrophoretograms (2-DE) of dinoflagellates.[J].JournalofMicrobiologicalMethods,2008,73(1):26-32.
[13]HAO R, ADOLIGBE C, JIANG B,etal. An optimized trichloroacetic acid/acetone precipitation method for two-dimensional gel Electrophoresis analysis of Qinchuan Cattle Longissimus Dorsi Muscle Containing High Proportion of Marbling[J].PlosOne, 2015,10(4):1-12.
[14]赖童飞,董薇,贾银华,等.棉花胚珠蛋白三氯乙酸丙酮法与酚抽提法的比较分析[J].农业生物技术学报,2009,17(2):317-322.
LAI T F, DONG W, JIA Y H,etal. Evaluations of Trichloroacetic acid-acetone method and phenol method for protein extraction from cotton ovule[J].JournalofAgriculturalBiotechnology, 2009,17(2):317-322.
[15]朱方超,贾瑞宗,孙勇,等.水稻种子蛋白双向电泳方法的建立和质谱初步分析[J].分子植物育种,2015,(11):2 446-2 452.
ZHU F C,JIA R Z,SUN Y,etal. Establishment of two-dimensional electrophoresis protocol and primary analysis by mass spectrometry for rice (OryzasativaL.) Seed Proteome[J].MolecularPlantBreeding, 2015,(11):2 446-2 452.
[16]甘露,李殿荣,臧新,等.甘蓝型油菜蛋白质双向电泳体系的建立[J].作物学报,2010,36(4):612-619.
GAN L,LI D R,ZANG X,etal. Construction of protein two-dimensional polyacrylamide gel electrophoresis system forBrassicanapus[J].ActaAgronomicaSinica,2010,36(4):612-619.
[17]王珊珊,郝宇涵,任婧祺,等.黄瓜根系蛋白质组分析的双向电泳技术条件优化.[J].沈阳农业大学学报, 2012,43(2): 233-236.
WANG S S,HAO Y H,REN J Q,etal. Optimization of two-dimensional electrophoresis for proteome of cucumber root[J].JournalofShenyangAgriculturalUniversity, 2012,43(2):233-236
[18]HOCKIN NL, MOCK T, MULHOLLAND F,etal. The response of diatom central carbon metabolism to nitrogen starvation is different from that of green algae and higher plants[J].PlantPhysiology, 2012,158(1):299-312.
[19]李肖芳,韩和平,王旭初,等.适用于盐生植物的双向电泳样品制备方法[J]. 生态学报,2006,26(6):1 848-1 853.
LI X F,HAN H P,WANG X C,etal. A protein extraction method suitable for two dimensional electrophoresis analysis of halophytes[J].ActaEcologicaSinica, 2006,26(6):1 848-1 853.
[20]A GÖRG R G A, BOGUTH G, UUML,etal. Two-dimensional polyacrylamide gel electrophoresis with immobilized pH gradients in the first dimension (IPG-Dalt): the state of the art and the controversy of vertical versus horizontal systems[J].Electrophoresis, 1995,16(7): 1 079-1 086.
[21]梁文裕,王星,焦广飞,等.发菜蛋白质组双向电泳技术的建立及优化[J]. 西北植物学报, 2009,29(8):1 550-1 556.
LIANG W Y,WANG X,JIAO G F,etal. Establishment and optimization of two-dimensional gel electrophoresis for proteome of nostoc flagelliforme[J].ActaBot.Boreal.-Occident.Sin., 2009,29(8):1 550-1 556.
[22]石海波, 王云生, 冯勇, 高聚林, 白海, 苏二虎. 玉米籽粒蛋白质双向电泳技术体系的优化[J].华北农学报,2015,30(1):171-176.
SHI H B,WANG Y S,FENG Y,etal. Optimization of maize grain protein two-dimensional electrophoresis system[J].ActaAgriculturaeBoreali-Sinica,2015,30(1):171-176.
(编辑:宋亚珍)
Analysis of Two-dimensional Electrophoresis Protocol For Desert Chlorella(Chlorellasp. TLD6B) Proteome
MU Yun, WANG Wenlun, YAN Guo,WANG Huiming, GAO Jianfeng*
(College of Life Science, Shihezi University, Shihezi, Xinjiang 832000,China)
In order to establish a two-dimensional gel electrophoresis (2D-E)protocol for proteomic study of desert chlorella (Chlorellasp. TLD6B), we compared the performances of protein extraction methods from desert chlorella betweenTCA/ acetone precipitation method and Trisol extraction. The chose pH gradient gel strips and protein loading volume were also optimized. Our results showed that: (1) trisol extraction could obtain high pure protein. The improved 2-DE system for desert chlorella was come out as follows: we distinguished 726 proteins with linear IPG strips of 24 cm in length with the pH ranges from 3 to 10, 500 μg loading volume, 80000 Vh of IEF time. We distinguished 1230 proteins with linear IPG strips of 24 cm in length with the pH ranges from 4 to 7, 1 000 μg loading volume, 80 000 Vh of IEF time. (2) Ten randomly selected protein spots were identified by using MALDI-TOF/TOF-MS to confirm the establishment of two-dimensional electrophoresis protocol could be used for primary analysis of desert chlorella proteome.
Chlorella;two-dimensional gel electrophoresis (2D-E);Trisol extraction
1000-4025(2016)09-1905-07doi:10.7606/j.issn.1000-4025.2016.09.1905
2016-05-20;修改稿收到日期:2016-07-27
国家自然科学基金(31460276)
牟 云(1992-),女,在读硕士研究生,主要从事可再生能源的开发与利用相关研究。E-mail:1171534413@qq.com
高剑峰,教授,博士生导师,主要从事可再生能源的开发与利用相关研究。E-mail:jianfengg@shzu.edu.cn
Q503
A

