根尖维管组织在狗蔷薇类原球茎发生中的作用
刘凤栾,闵 睫,陈 青,田代科,赵梁军
(1 中国农业大学 园艺学院,北京 100193;2 上海辰山植物园 中国科学院上海辰山植物科学研究中心,上海市资源植物功能基因组学重点实验室,上海 201602)
根尖维管组织在狗蔷薇类原球茎发生中的作用
刘凤栾1,2,闵睫2,陈青2,田代科2,赵梁军1*
(1 中国农业大学 园艺学院,北京 100193;2 上海辰山植物园 中国科学院上海辰山植物科学研究中心,上海市资源植物功能基因组学重点实验室,上海 201602)
为了解狗蔷薇(RosacaninaL.)类原球茎发生机制,以建立月季高效再生体系,探讨了根尖内部维管组织在狗蔷薇愈伤-不定根根尖膨大发育为类原球茎过程中所起作用。剪切试验发现,脱离愈伤的狗蔷薇不定根根尖不能诱导类原球茎形成;桥接培养表明,通过维管组织向根尖运输外源激素TDZ诱导类原球茎发生的效率高于共质体运输方式;TIBA(2, 3, 5-triiodobenzoic acid)处理限制了根尖维管组织向分生区的延伸速度,并最终影响了类原球茎发生率;在类似狗蔷薇愈伤-不定根结构的蒺藜苜蓿(MedicagotruncatulaGaertn.)根段-不定根上也重现了根尖被诱导发育为绿色球体过程。由此表明,愈伤-不定根中完整的维管组织是狗蔷薇类原球茎发生的结构基础之一,揭示获得与愈伤-不定根类似的内部结构和组合模式的外植体(如毛状根),并将其视为整体进行诱导培养,是建立月季类原球茎再生体系的前提之一。
狗蔷薇;类原球茎;维管组织;蔷薇属;TDZ
类原球茎(protocorm-like body,PLB)原指兰科植物茎尖、叶片等外植体被诱导产生类似其种子萌发过渡态——原球茎的一种组织结构[1-2],认为它是包含了未分化的薄壁细胞团和多个分生中心的类似嫩茎的器官[3],在植物高效再生、遗传转化、次生代谢物质生产及植物发育生物学研究等领域具有良好的应用价值[4]。我们课题组首次在狗蔷薇(RosacaninaL.)叶片愈伤产生的不定根根尖上成功诱导出类原球茎[5],并发现香水月季(R.odorataSweet)、多花蔷薇(R.multifloraThunb.)和月季(R.hybridaL.)等9种蔷薇属植物亦可不同程度地重现此过程[6-7]。已有研究表明,狗蔷薇类原球茎是体胚与器官发生的聚合体[5, 8],且再生率极高,为蔷薇属植物潜在的良好遗传转化受体[9]。结合其相关功能基因RcSERK1(SOMATICEMBRYOGENESISRECEPTOR-LIKEKINASE1)[10]、RcWUS(WUSCHEL)[11]、RcKN1(KNOX1)[12]、RcLEC1(LEAFYCOTYLEDON1)等在拟南芥及烟草中的表达规律和功能验证,以及细胞分裂素[13-14]和生长素[15]在诱导其发生过程中的调控作用等研究结果,初步证明:狗蔷薇类原球茎发生为“不定根根尖激素平衡破坏 — 根尖分生中心分化 — 体胚发生和器官发生(类原球茎发生) — 再生芽”过程,并发现偏蓝光和红光分别有利于其启动发生和分化萌发[16]。同时,此过程仅局限于不定根根尖分生区,易于解剖观察与定位,且内部发育与外部形态对应准确,取材方便,故此再生体系也是研究蔷薇属植物细胞分化、器官发生的良好体系。基于上述特点,狗蔷薇类原球茎对蔷薇属植物具有重要的研究和利用价值,进一步了解其发生机制,对建立月季类原球茎再生体系以用于工厂化快繁和分子育种具有指导作用。
不同于其它植物类原球茎使用独立的茎尖、叶片切块等外植体即可被诱导[4, 17],狗蔷薇类原球茎的发生要求将其叶片产生的愈伤-不定根视为整体进行培养[5, 8]。针对这一独特现象,本研究以狗蔷薇类原球茎发生体系为研究对象,通过比较不同培养方式下愈伤-不定根根尖的形态发育及其类原球茎发生特点,分析维管组织在诱导狗蔷薇类原球茎发生过程中作用,为阐明蔷薇属植物类原球茎发生的分子机理提供参考。
1 材料和方法
1.1材料与试剂
狗蔷薇类原球茎再生体系:以狗蔷薇叶片为外植体,在MS + 1.5 mg/L 2,4-D培养基中暗培养4周后,其叶片愈伤形成大量不定根。将愈伤-不定根转接至1/2 MS + 20 mg/L TDZ培养基上光照培养,可诱导不定根根尖膨大产生大量类原球茎,类原球茎经转接培养可萌芽成为新植株,此即狗蔷薇类原球茎再生体系[5,8](图1)。试验材料为各个处理下不同发育时期的愈伤-不定根根尖及其类原球茎。蒺藜苜蓿(2HA)由中国科学院植物研究所赠送。形态解剖采用常规石蜡切片切片技术,Olympus BX-51显微镜观察拍照。
1.2方法
1.2.1不定根维管组织完整性对根尖类原球茎形成的影响随机选取具有5~7条不定根的愈伤,进行不定根剪切培养试验(图2):剪取10个愈伤的所有不定根根尖(S1,约0.1 cm),均分2份,于诱导培养基中分别竖置和平置培养;其剩余的愈伤-不定根(C-S2)与上述竖置、平置根尖S1培养于同一皿中,重复3皿。同样操作,剪取上半部不定根(S3),剪取整条不定根(S5),剪切不定根成根段(S6)进行竖置与平置培养,各自剩余部分的愈伤-不定根培养于对应皿中。对照为正常诱导、未剪切的愈伤-不定根。
培养5 d和15 d时,采样S2、S4不定根各20条,切片观察不定根切口位置发育状况。培养40 d时,统计各处理不定根根尖类原球茎发生率。发生率=形态发生不定根数/总不定根数。

A、a. 0 d的愈伤-不定根;B、b. 培养5 d时,根尖变绿,PVE延生至分生区,细胞功能发生转变;C、c. 培养12 d,根尖呈纺锤体,其内部细胞分化为薄壁细胞;D、d. 培养30 d,膨大根尖表面形成类原球茎;E、e. 培养35 d,类原球茎萌芽。PLB. 类原球茎;PVE. 孔纹管分子;RC. 根冠;VT. 维管组织。绿色圆圈. 根尖干细胞池位置。图1 狗蔷薇类原球茎发生发育过程A, a. Callus - rhizoids;B, b. PVE extended to the meristem where the cells dedifferentiation began at 5 days on TDZ medium;C, c. Spindle-shaped tips showing parenchyma cells at 12 days on TDZ medium;D, d. PLBs were formed on the rhizoid tips at 30 days;E, e. PLBs generated buds at 35 days. PLB. Protocorm-like body;PVE. Pitted vessel element;RC. Root cap;VT. Vascular tissue. Green circle. Stem cell nicheFig.1 The developmental process of PLBs formation in R. canina

S1. 剪取0.1 cm根尖;C-S2. 剪去0.1 cm根尖的愈伤-不定根;S3. 剪取上半部的不定根;C-S4. 剪去上半部根尖的愈伤-不定根;S5. 剪取整条根培养;S6. 剪切整条根为多个根段培养;C. 愈伤图2 愈伤-不定根的剪切处理示意图S1. 0.1 cm tip;C-S2. Callus-rhizoids without 0.1 cm tips;S3. The upper half tip;C-S4. Callus-rhizoids without the upper half tips;S5. The whole rhizoid was cut for culturing;S6. Rhizoid segments were cultured;C. CallusFig.2 Schematic of cutting treatment on the callus-rhizoids

0-T. 愈伤在1/2 MS培养基而根尖在TDZ诱导培养基;T-0. 愈伤在TDZ诱导培养基而根尖在1/2 MS培养基图3 愈伤-不定根的桥接培养示意图0-T. Callus was cultured on 1/2MS medium while rhizoid tips on TDZ-induction medium;T-0. Callus was cultured on TDZ-induction medium while rhizoid tips on 1/2MS mediumFig.3 Schematic of bridging culture of callus-rhizoids
1.2.2不定根维管组织对根尖早期发育的影响在一个培养皿中制作2种不同培养基,一侧为正常的1/2 MS + TDZ诱导培养基,一侧为无诱导激素的1/2 MS培养基(图3)。剪掉过长或过短不定根,愈伤保留约1.0 cm不定根1~2条,然后将愈伤-不定根分别搭接于两侧培养基。每皿正、反桥接各5个愈伤-不定根,每侧正常接种5个愈伤-不定根作为对照(CK1、CK2),重复10皿。培养40 d后,统计不定根根尖类原球茎发生率。
1.2.3不定根维管组织向顶延伸速度对根尖发育的影响生长素的极性运输促使维管组织的向前分化和延伸[18-19]。作为生长素的竞争底物,TIBA可与根尖内部运输生长素的PINs蛋白结合,进而抑制生长素的极性运输[20-21]。不同浓度TIBA均抑制狗蔷薇类原球茎的发生,0.1 mmol/L TIBA为其半抑制浓度,故选择此浓度进行试验。(1)TIBA抑制培养后转至TDZ诱导培养:在TDZ+0.1 mmol/L TIBA抑制培养基接种愈伤-不定根,每皿20个,共20皿。预培养1、3、5和7 d后,分别转移3皿外植体至TDZ培养基上诱导培养,同时剪取1皿约50个根尖,切片观察其发育状态;剩余2~4皿不转接、持续抑制培养作为对照(CKTIBA)。(2)TDZ诱导培养后转至TIBA抑制培养,操作方法同上,剩余2~4皿持续诱导培养作为对照(CKTDZ)。2个处理均在转换培养基培养40 d后,统计愈伤-不定根根尖类原球茎发生率。
1.2.4不定根(维管组织)长度对根尖类原球茎发生的影响将愈伤-不定根接入TDZ培养基诱导类原球茎,每皿20个外植体,重复5皿。培养5 d后,按长度分成短(≤0.5 cm)、中(0.5 ~ 1.0 cm)和长(≥1.0 cm)等3种不定根,每种剪取根尖(长度0.3 ~ 0.5 cm)各20个,FAA固定,制作石蜡切片。培养12 d后,统计3种不定根根尖发育状态;培养40 d后,统计3种不定根根尖类原球茎发生率。
1.2.5类愈伤-不定根外植体的类原球茎诱导及其形态学观察类似狗蔷薇叶片愈伤可形成不定根,课题组以蒺藜苜蓿(2HA)组培苗根段为外植体诱导获得不定根:将2HA组培苗的根切成约0.5 cm长度,接种至P4+ 10 μmol/L NAA + 0.2 mmol/L GSSG培养基[22],黑暗培养3周后,根段表面形成大量不定根。模拟狗蔷薇愈伤-不定根诱导类原球茎的条件,可诱导此根段-不定根根尖膨大成为绿色球体,但未能进一步形成类原球茎。为了解造成此差异的原因,在诱导培养5、9 、20 和30 d后,对蒺藜苜蓿根段-不定根进行根尖取样,每时期20个,进行石蜡切片、解剖学观察。
2 结果与分析
2.1愈伤-不定根维管组织完整性对根尖类原球茎形成的作用
将不定根由愈伤剪切下诱导培养,无论是竖置或平置的根尖S1、半条根S3、整条根S5和由整条根剪取的根段S6,均无法形成类原球茎。相反,剪去根尖S1和上半部S3后,剩余C-S2和C-S4不定根切口位置产生类原球茎,但发生率降低,分别为15.2%和20.7%(图4)。
切片显示,剪切处理的C-S2和C-S4在培养5 d时,两者不定根切口位置细胞分裂为排列紧密的小细胞(图5,A),并可见多条清晰的导管分子。至15 d时,切口处细胞膨大发育为一团愈伤组织(图5,B),40 d后愈伤表面产生类原球茎。剪切试验结果表明,愈伤-不定根作为有机整体,即保证愈伤与不定根内部维管组织的完整性,是狗蔷薇类原球茎可独特发生的前提之一。
2.2不定根维管组织在根尖早期分化中的作用
桥接培养中,两种相反桥接方式的根尖类原球茎发生率差异显著(图6)。愈伤在TDZ培养基-根尖在无TDZ培养基的T-0培养方式,诱导根尖类原球茎发生率显著低于正常诱导培养CK1,但显著高于与其反向的0-T培养方式(图6)。分析造成此差异的主要原因为:T-0通过维管组织而0-T经胞间连丝向不定根根尖输送激素与营养物质,前者运输效率及能力远大于后者,由此导致了不同的根尖早期分化及功能转变效率[8],进而影响了根尖后期类原球茎诱导效果。

图中不同小写字母表示0.05水平差异显著,下同。图4 不同剪切处理对根尖类原球茎诱导的效果Different normal letters indicate significant difference at 0.05 level,the same as belowFig.4 The PLBs formation on the rhizoids with different cutting treatments
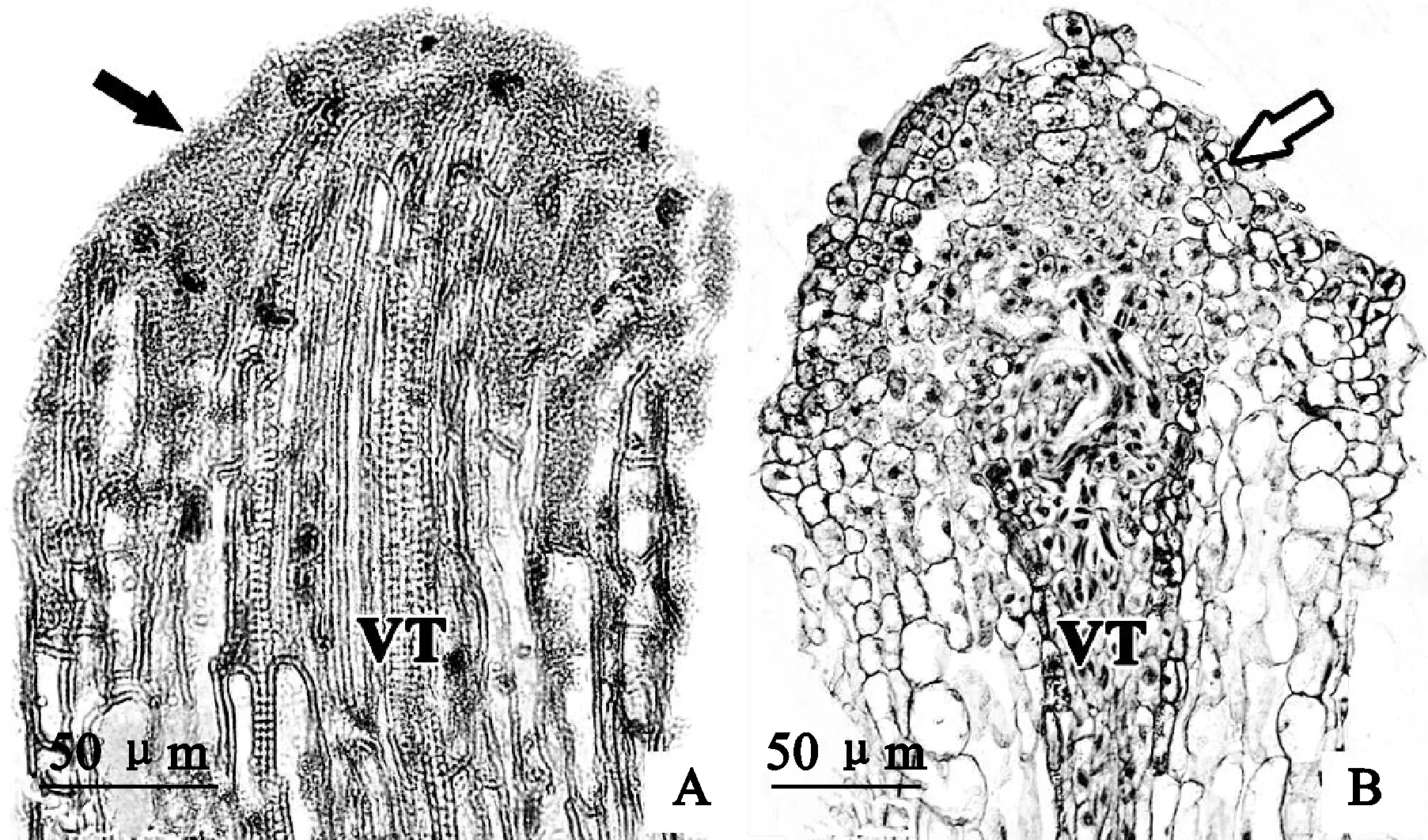
A.诱导培养5 d,切除根尖不定根的切口处细胞分裂为小细胞(黑色箭头所示);B. 诱导培养15 d,不定根切口小细胞膨大发育成为愈伤组织(白色箭头所示),维管组织(VT)发达图5 切除根尖不定根切口的发育解剖A. Lots of little cells were observed at the incision of the rhizoid ithout tip (black arrow);B. Little cells on the rhizoid incision swelled into callus (white arrow),and vascular tissue was well developedFig.5 Histological analyses of the rhizoids without tips

图6 不同桥接方式培养下根尖类原球茎发生率的差异Fig.6 Different rates of PLBs formation between two ways of bridging culture
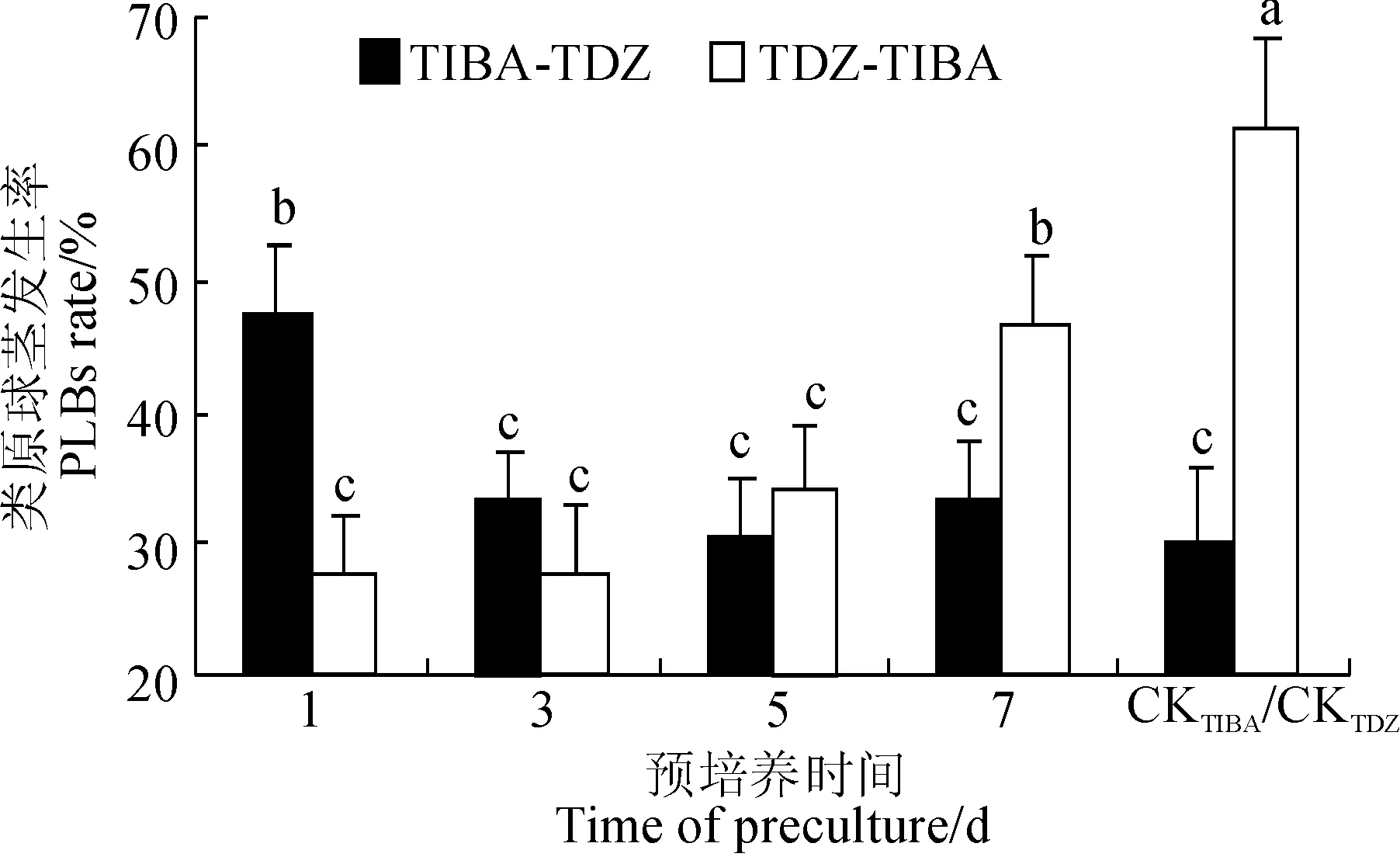
TIBA-TDZ. 在TIBA抑制培养基预培养特定天数后转移至TDZ诱导培养基继续培养;TDZ-TIBA. 在TDZ诱导培养基预培养特定天数后转移至TIBA抑制培养基继续培养; X轴CKTDZ/CKTIBA.CKTIBA. 愈伤-不定根在TIBA抑制培养基上持续培养作为对照;CKTDZ. 愈伤-不定根在TDZ诱导培养基持续培养作为对照图7 TIBA或TDZ预培养对狗蔷薇类原球茎发生的影响TIBA-TDZ. Callus-rhizoids were transferred to TDZ medium after TIBA-preculture;TDZ-TIBA. Callus-rhizoids were transferred to TIBA medium after TDZ-preculture;X-axis CKTIBA / CKTDZ. Callus-rhizoids were cultured on TIBA or TDZ medium all the timeFig.7 The effects of preculture on TIBA or TDZ medium for PLBs formation
2.3不定根维管组织延迟发育对根尖类原球茎发生的抑制作用
抑制培养1 d再转入诱导培养,其根尖类原球茎诱导率显著高于持续抑制培养CKTIBA。然而,过长抑制预培养(≥3 d)会导致不可逆的抑制效果,这些愈伤-不定根再转移至诱导培养,其类原球茎发生率与持续抑制培养CKTIBA差异不大(图7)。反之,诱导预培养7 d再抑制培养的愈伤-不定根,其类原球茎发生率虽低于持续诱导培养CKTDZ但高于持续抑制培养CKTIBA,这表明,诱导预培养可一定程度消除TIBA对不定根根尖膨大发育的抑制作用,但同时统计结果显示,少于7 d的诱导预培养无此显著抵消效果(图7)。
切片观察发现,抑制培养不定根的根尖发育进程较诱导培养滞后2 ~3 d:抑制培养7 d 时,仅少部分根尖样品的维管组织延伸至根尖分生区,而此事件在正常诱导5 d时即可大量发生(图8)。这暗示,生长素运输抑制剂TIBA的存在,扰乱了愈伤-不定根根尖内部的生长素极性输出,进而阻碍不定根维管组织向根尖的快速分化、延伸。因此,此抑制试验间接证明了愈伤-不定根维管组织对狗蔷薇类原球茎发生的重要作用。

A.抑制培养3 d,根尖根冠解体,分生区结构秩序混乱;B.抑制培养5 d,2 ~ 3条导管(箭头)延伸至分生区;C.抑制培养7 d,维管束逐渐成熟,PVE出现在原分生区中柱细胞位置;a ~ c. 正常TDZ诱导下根尖发育过程图8 TIBA对根尖维管组织向顶延伸的阻碍作用A. Stem cell niche became disorder and rhizoid cap started to disintegrate at 3 days on TIBA medium;B. Two-three vessels extended to the meristem at 5 days on TIBA medium;C. Vascular tissue matured,PVE formed at stele area; a-c. The normal process of callus-rhizoids cultured on TDZFig.8 The establishment of vascular channel was delayed by TIBA
2.4不定根维管组织长度与根尖发育状态的关系
不同长度不定根在诱导培养基上发育不同步。长度越短,根尖膨大越快,形成类原球茎的能力越强(表1)。切片结果显示,同一时期相比,长度小于0.5 cm不定根的维管组织向根尖延伸速度最快、到达分生区最早,且分生区细胞发生分化、分裂最早(数据未显示)。与之相比,长度大于1.0 cm不定根内部维管组织发育相对迟缓。这表明,不定根长度及维管组织延伸速度与狗蔷薇根尖类原球茎的发生存在密切关系。
2.5蒺藜苜蓿根段-不定根类原球茎诱导及其形态学分析
在诱导培养基培养20 d后,蒺藜苜蓿根段-不定根(图9,A)根尖膨大成绿色球体(图9,B、C)。培养至30 d,根尖绿色球体衰老、解体,无类原球茎发生。与狗蔷薇愈伤-不定根发育形态学比较,两者根尖膨大发育至绿色球体过程相似,均经历维管组织向顶延伸、分生区细胞分化、根尖外围细胞膨大(图8,a ~ c)等事件。之后阶段产生差别:蒺藜苜蓿根尖绿色球体外层细胞凋亡,其内层细胞未分化出类原球茎分生中心(图9,D),且最终未能形成类原球茎。导致此结果的具体原因需进一步探讨。

表1 不定根长度对根尖发育及其类原球茎发生的影响Table 1 The effect of rhizoid length on the development of rhizoid tips and PLBs
注. 表中百分比为形态发生不定根数/总不定根数,为平均值±标准误差;a、b表示差异显著性(P< 0.05)
Note. The percentage including mean ± SE means of the number of developing rhizoids / the total number of rhizoids;a and b show significant difference (P< 0.05)
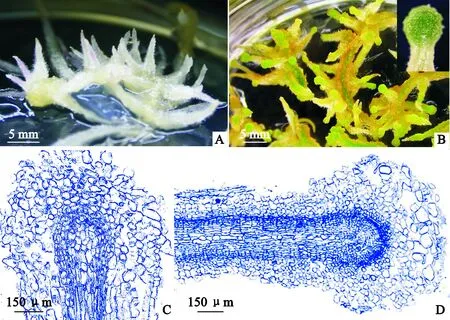
A.蒺藜苜蓿根段被诱导出白色不定根;B.根段-不定根培养20 d,不定根根尖形成绿色球体;C.不定根根尖外围细胞膨大发育,原有序组织结构丧失;D.球体根尖外围细胞开始解体图9 蒺藜苜蓿根尖类原球茎的诱导A. Many white rhizoids were inducted on the root segments;B. Rhizoid tips developed into green globular tips at 20 days;C. The outer cells of rhizoid tips were swelling;D. The outer cells of globular rhizoids started to disintegrateFig.9 PLBs induction from the rhizoid tips of Medicago truncatula
3 讨 论
在外源高浓度TDZ培养基上,狗蔷薇不定根根尖失去原有的延伸功能,其结构有序、功能确定的分生组织转变为分裂活跃、脱分化的细胞群,经分生中心发育成类原球茎,此即狗蔷薇类原球茎的形态发育过程[8,23]。与其它植物类原球茎的诱导方式不同,此再生体系的独特发生,与将愈伤-不定根整体作为外植体、而非传统培养方式以不定根切段或愈伤单独为外植体有关:在剪切试验中,将不定根从愈伤分离进行独立培养,破坏了两者结合时其内部完整封闭的维管组织所具备的毛细管作用,根尖无法快速从培养基中吸收激素和营养,故不能改变自身发育进程。
桥接试验中,在向不定根根尖输送营养与外源激素方式上,T-0和0-T处理存在极大不同:前者为通过维管组织的外质体运输,后者是经细胞质与胞间连丝的共质体运输。前者运输物质能力显著高于后者,这保证了短时间内向根尖分生区汇聚大量外源激素与物质,进而诱导后续发育事件[8,24-25]。同时,结合前者根尖内部发育较后者快速的形态事实(数据未显示),说明维管组织的存在对不定根根尖前期功能转变具有重要催化作用。
已有研究表明,生长素是导管分子分化的先决条件[26-27],其极性运输促使了维管组织的向前分化和延伸[18-19]。在本研究中,作为生长素运输蛋白抑制剂的TIBA,抑制已有维管组织向不定根根尖分生区的延伸,最终阻碍了根尖膨大发育、降低了类原球茎发生率。此试验反证了愈伤-不定根内部维管组织的快速向顶延伸对狗蔷薇类原球茎发生的促进作用。此外,不定根越短,根尖膨大越早、类原球茎发生率越高,暗示不定根维管组织长度也会对狗蔷薇类原球茎的形成产生影响。
前人使用不同浓度TDZ,在完整种苗的下胚轴[28]、子叶节[29-32]等部位诱导形成体胚或幼芽。在此过程中,除运输营养物质以外,种苗内部的维管组织亦可能起着对TDZ(或其衍生物)的快速运输、汇集作用。
上述资料表明,依赖完整独立的维管组织,愈伤至不定根根尖之间建立了一条‘运输通道’,使得培养基(‘源’)中营养与外源激素可被快速运输至不定根的根尖(‘库’),从而引发了根尖膨大发育[8,15],即封闭独立的维管组织是催化狗蔷薇根尖功能转变、诱导类原球茎发生的结构基础之一。这提示,月季中建立类原球茎再生体系的前提是寻找或建立类似狗蔷薇愈伤-不定根这种独特结构模式的外植体,或其它类似具独立成熟维管组织的结构组织。本研究中,以类似愈伤-不定根的蒺藜苜蓿根段-不定根为外植体,虽未最终诱导类原球茎,但成功实现了不定根根尖的膨大发育,一定程度上辅证了上述推论的合理性。此外,易自发形成毛发不定根的植物,或受发根农杆菌侵染易产生毛发根的植物,亦可尝试通过愈伤/茎段-不定根等外植体诱导其类原球茎发生。
[1]徐程,詹忠根,张铭. 中国兰的组织培养[J]. 植物生理学报,2002,38(2):171-174.
XU C,ZHAN Z G,ZHANG M. Tissue culture of Chinese orchid[J].PlantPhysiologyJournal,2002,38(2):171-174.
[2]MOREL G M.Producing virus-free cymbidiums[J].AmericanOrchidSocietyBulletin,1960,29:495-497.
[3]詹忠根,徐程,张铭. 兰科植物原球茎(类原球茎 )的形态建成[J]. 种子,2002,5:36-37.
ZHAN Z G,XU C,ZHANG M. The Morphogenesis of protocorms(protocorm-like body) in orchids[J].Seed,2002,5:36-37.
[4]姜福星,刘凤栾,赵梁军. 植物类原球茎的研究与应用[J]. 核农学报,2012,26(3):478-483.
JIANG F X,LIU F L,ZHAO L J. Research and application of plant protocorm-like body[J].JournalofNuclearAgriculturalSciences,2012,26(3):478-483.
[5]TIAN C W,CHEN Y,ZHAO X L,etal. Plant regeneration through protocorm-like bodies induced from rhizoids using leaf explants ofRosaspp[J].PlantCellReport,2008,27(5):823-831.
[6]郭艳超,张倩,田传卫,等. 香水月季类原球茎(PLBs)途径再生植株的研究[J]. 中国农业大学学报,2008,13(5):29-34.
GUO Y C,ZHANG Q,TIAN C W,etal. Regeneration ofRosaodoratavia protocorm-like bodies[J].JournalofChinaAgriculturalUniversity,2008,13(5):29-34.
[7]田传卫,尚爱芹,张建甫,等. 多花蔷薇假珠芽诱导、体细胞胚发生及植株高效再生[J]. 园艺学报,2008,35(3):403-408.
TIAN C W,SHANG A Q,ZHANG J F,etal. Pseudobulbils induction,somatic embryogenesis and shoot regeneration inRosamultifloraThunb[J].ActaHorticulturaeSinica,2008,35(3):403-408.
[8]LIU F L,ABDURAZAK I,XI L,etal. Morphohistological analysis of the origin and development ofRosacaninaprotocorm-like bodies[J].ScientiaHorticulturae,2014,167:107-116.
[9]毕玲,刘凤栾,董爱香,等. 狗蔷薇类原球茎遗传转化体系的建立[J]. 核农学报,2012,26(2):270-274.
BI L,LIU F L,DONG A X,etal. Establishment of genetic transformation system in protcorm like-body(PLB) ofRosacanina[J].JournalofNuclearAgriculturalSciences,2012,26(2):270-274.
[10]XU K D,LIU Q L,YANG H F,etal. Isolation and molecular characterisation ofRcSERK1:ARosacaninagene transcriptionally induced during initiation of PLBs[J].AfricanJournalofBiotechnology,2011,10(20):4 011-4 017.
[11]姜福星,刘凤栾,赵梁军. 狗蔷薇RaWUS基因的超量表达诱导转基因烟草根系形成不定芽[J]. 林业科学,2011,47(12):43-52.
JIANG F X,LIU F L,ZHAO L J. Overexpression ofRaWUSgene ofRosacaninainducing shoot regeneration from root tip of transgenic tobacco[J].ScientiaSilvaeSinicae,2011,47(12):43-52.
[12]姜福星,张建甫,刘凤栾,等. 狗蔷薇RcKN1基因的克隆及功能分析[J]. 农业生物技术学报,2012,20(7):715-725.
JIANG F X,ZHANG J F,LIU F L,etal. Cloning and functional characterization ofRcKN1 gene fromRosacaninaL[J].JournalofAgriculturalBiotechnology,2012,20(7):715-725.
[13]GAO B,FAN L S,LI X X,etal.RcRR1,aRosacaninatype-A response regulator gene,is involved in cytokinin-modulated rhizoid organogenesis[J].PLoSONE,2013,8(8):e72914. doi:10.1371/journal.pone.0072914.
[14]王玲,高彬,温超,等. 狗蔷薇细胞分裂素氧化酶基因RcCKX5的克隆及表达分析[J]. 园艺学报,2014,41(7):1 418-1 426.
WANG L,GAO B,WEN C,etal. Isolation and expression analysis of cytokinin dehydrogenase geneRcCKX5 inRosacanina[J].ActaHorticulturaeSinica,2014,41(7):1 418-1 426.
[15]刘凤栾,寇亚平,陈晓丽,等. 狗蔷薇生长素输出载体基因PIN1和PIN2的分离与表达分析[J]. 园艺学报,2014,41(5):925-934.
LIU F L,KOU Y P,CHEN X L,etal. Cloning and expression analysis ofPIN1 andPIN2 encoding auxin efflux carriers inRosacanina[J].ActaHorticulturaeSinica,2014,41(5):925-934.
[16]赵宏伟,寇亚平,王轲永,等. 光质对狗蔷薇类原球茎发生和植株再生的影响[J]. 中国农业大学学报,2015,20(4):113-119.
ZHAO H W,KOU Y P,WANG K Y,etal. Effects of light quality onRosacaninaPLBs induction and plant regeneration[J].JournalofChinaAgriculturalUniversity,201520(4):113-119.
[17]张超,王广东. 文心兰原球茎形态发生与可溶性物质及抗氧化酶的关系[J]. 西北植物学报,2009,29(8):1 607-1 613.
ZHANG C,WANG G D. Soluble substance and antioxidase activities changes during protocorm-like body morphogenesis inOncidium[J].ActaBotanicaBoreali-OccidentaliaSinica,2009,29(8):1 607-1 613.
[18]ALONI R. Foliar and axial aspects of vascular differentiation:Hypotheses and evidence[J].JournalofPlantGrowthRegulator,2001,20:22-34.
[19]YE Z H. Vascular tissue differentiation and pattern formation in plants[J].AnnualReviewofPlantBiology,2002,53:183-202.
[20]BLILOU I,XU J,WILDWATER M,etal. The PIN auxin efflux facilitatior network controls growth and patterning inArabidopsisroots[J].Nature,2005,433:39-44.
[21]GRUNEWALD W,FRIML J. The march of the PINs:developmental plasticity by dynamic polar targeting in plant cells[J].TheEuropeanMolecularBiologyOrganizationJournal,2010,29(16):2 700-2 714.
[22]IMIN N,NIZAMIDIN M,WU T,etal. Factors involved in root formation inMedicagotruncatula[J].JournalofExperimentalBotany,2007,58(3):439-451.
[23]张建甫,田传卫,毕玲,等. 狗蔷薇类根体和类原球茎发生发育的组织学研究[J]. 园艺学报,2014,41(6):1 167-1 174.
ZHANG J F,TIAN C W,BI L,etal. Studies on the histology and ultrastructure of the initiation of rhizoids and protocorm-like bodies(PLBs)induced from the leaf explants ofRosacanina[J].ActaHorticulturaeSinica,2014,41(6):1 167-1 174.
[24]IOIO R D,LINHARES F S,SCACCHI E,etal. Cytokinins determineArabidopsisroot-meristem size by controlling cell differentiation[J].CurrentBiology,2007,17(8):678-682.
[25]SU Y H,LIU Y B,ZHANG X S. Auxin-cytokinin interaction regulates meristem development[J].MolecularPlant,2011,4(4):616-625.
[26]ROBERTS L W,GAHAN P B,ALONI R. Hormonal aspects of vascular differentiation. Vascular differentiation and plant growth regulators[M]. Berlin:Springer-Verlag,1988.
[27]NELSON N D,HILLIS W E. Ethylene and tension wood formation inEucalyptusgomphocephala[J].WoodScienceandTechnology,1978,12(4):309-315.
[28]VICTOR J M R,MURCH S J,KRISHNARAJ S,etal. Somatic embryogenesis and organogenesis in peanut:the role of thidiazuron and N6-benzylaminopurine in the induction of plant morphogenesis[J].PlantGrowthRegulation,1999,28:9-15.
[29]MURTHY B N S,MURCH S J,SAXENA P K. Thidiazuron:a potent regulator ofinvitroplant morphogenesis[J].InvitroCellular&DevelopmentalBiology-Plant,1998,34:267-275.
[30]CHHABRA G,CHAUDHARY D,VARMA M,etal. TDZ-induced direct shoot organogenesis and somatic embryogenesis on cotyledonary node explants of lentil(LensculinarisMedik.) [J].PhysiologyandMolecularBiologyofPlants,2008,14:347-353.
[31]RADHAKRISHNAN R,RAMACHANDRAN A,RANJITHA KUMARI B D. Rooting and shooting:Dual function of thidiazuroninvitroregeneration of soybean(Glycinemax. L)[J].ActaPhysiologiaePlantarum,2009,31:1 213-1 217.
[32]SINGH N D,SAHOO L,SARIN N B,etal. The effect of TDZ on organogenesis and somatic embryogenesis in pigeonpea(CajanuscajanL. Millsp)[J].PlantScience,2003,164:341-347.
(编辑:宋亚珍)
Role of Vascular Tissue of Rhizoids for Protocorm-like Bodies Regeneration inRosacanina
LIU Fengluan1,2, MIN Jie2, CHEN Qing2, TIAN Daike2, ZHAO Liangjun1*
(1 College of Horticulture,China Agricultural University,Beijing 100193,China;2 Shanghai Key Laboratory of Plant Functional Genomics and Resources,Shanghai Chenshan Plant Science Research Center,the Chienese Academy of Science,Shanghai Chenshan Botanical Garden,Shanghai 201602,China)
Protocorm-like bodies (PLBs) regeneration system has been established for severalRosaspp. More understandings on the process of PLBs formation, including what roles of vascular tissue of rhizoids play in the incipient stage, will contribute to the establishment of PLBs protocols in cut roses. We proposed a hypothesis named ‘vascular channel’: Through the vascular tissue inR.caninarhizoids, high concentration of TDZ (thidiazuron) containing in medium was quickly and largely transported to rhizoid meristem, resulting in the rhizoid meristem cells shifting their functions, which initiated PLBs development. In the present study, we provided some evidence on the rationality of this hypothesis. Both whole callus-free rhizoids and its segments were cultured either vertically or horizontally on the induction medium with TDZ, no PLBs formed. During the bridging culture, the efficiency of PLBs induction was higher in the callus-rhizoids relied on apoplastic transport than symplastic transport. The TIBA (2, 3, 5-triiodobenzoic acid) treatment had suppressed the elongation of vascular tissue towards to the rhizoid meristem, which finally led to a low rate of PLBs formation. Furthermore, the partial process of PLBs system was reproduced inMedicagotruncatulaGaertn., their rhizoid tips derived from the rhizoid segment were induced into green ellipsoidal bodies. These findings indicated that the vascular tissue ofR.caninacallus - rhizoids being capable of rapidly delivering nutrients and hormones was critical for PLBs development, and it must be closed and complete from the callus to the rhizoid tip. Based on this, we proposed that the prerequisite for achieving a PLBs system of cut roses is to induce callus-rhizoids or similar explants possessing a transporting system that could rapidly aggregate hormones and nutrients.
Rosacanina;protocorm-like body;vascular tissue;Rosa;TDZ
1000-4025(2016)09-1764-08doi:10.7606/j.issn.1000-4025.2016.09.1764
2016-06-04;修改稿收到日期:2016-07-26
国家自然科学基金(NSFC 31171993)
刘凤栾(1984-),男,博士,助理研究员,主要从事园林植物遗传育种与花发育的研究。E-mial:19liu19@163.com
赵梁军,教授,博士生导师,从事园林植物栽培生理与分子生物学研究。E-mail:zhaolj5073@sina.com
Q813.1+3; Q944.5
A

