内蒙古大青山灌木铁线莲根围丛枝菌根真菌群落季节动态研究
刘 敏,峥 嵘,白淑兰*,青 云,闫 伟,贾学文
(1 内蒙古农业大学 林学院,呼和浩特010019;2 内蒙古师范大学 生命科学与技术学院,呼和浩特010022;3 鄂尔多斯市林业治沙科学研究院,内蒙古鄂尔多斯017000)
内蒙古大青山灌木铁线莲根围丛枝菌根真菌群落季节动态研究
刘敏1,峥嵘2,白淑兰1*,青云2,闫伟3,贾学文3
(1 内蒙古农业大学 林学院,呼和浩特010019;2 内蒙古师范大学 生命科学与技术学院,呼和浩特010022;3 鄂尔多斯市林业治沙科学研究院,内蒙古鄂尔多斯017000)
采用Illumina MiSeq测序技术研究了内蒙古大青山干旱阳坡灌木铁线莲(Clematisfruticosa)根围丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)群落的季节动态,并利用冗余分析(redundancy analysis,RDA)和Mantel test分析了土壤和植被因子与AMF之间的关系,为进一步探索灌木铁线莲-AMF共生体对不同季节环境变化的响应提供理论依据。结果表明:(1)灌木铁线莲根围AMF孢子密度不存在显著的季节性差异,根系侵染率和丛枝丰度从春季至秋季呈下降趋势。(2)3个季节共检测出163个AMF OTUs(operational taxonomic units),春季、夏季、秋季分别为116 OTUs、76 OTUs和70 OTUs。(3)夏季和秋季的AMF丰富度(实测OTUs数和Chao1指数)以及多样性(Shannon-Wiener 指数和Invsimpson指数)显著低于春季,但夏、秋季间无显著异。(4)主成分分析和PERMANOVA分析表明,夏季和秋季的AMF群落组成与春季存在显著差异,而AMF群落组成在夏季与秋季间差异不显著。(5)RDA分析表明,采样季节、植被盖度、植物多样性、土壤含水量和土壤有机质对AMF Shannon-Wiener指数、Invsimpson指数、Chao1指数和实测OTUs数均产生显著影响;Mantel test分析发现,采样季节是影响AMF群落组成和菌根侵染率的主导因子,但对孢子密度无显著影响,而土壤有机质是影响孢子密度的主导因子。
灌木铁线莲;丛枝菌根真菌;季节动态;Illumina MiSeq测序
受全球气候变化和人类活动的影响,内蒙古大青山土壤及植被资源遭受到严重破坏,尤其是阳坡,很多地区均成为沟壑纵横、岩石裸露的荒山。灌木铁线莲(Clematisfruticosa)作为该生境主要的护土灌木,在水土保持及防治土壤侵蚀等方面发挥着重要作用。丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)可与地球上大多数植物形成共生体,能够提高植物对养分的吸收[1]、增强植物抗干旱胁迫能力[2-3]、提高土壤团聚体稳定性[4],还能影响植物生物量、生长速度和生产力[5-6]。所以,灌木铁线莲能在内蒙古大青山阳坡干旱和贫瘠环境中生存,必然与AMF共生有很大关联。
研究表明,AMF侵染率、孢子密度、多样性和群落组成均存在季节性变化规律[7-10],但也有研究认为AMF群落组成和多样性无季节性差异[11]。可见,季节变化对AMF群落的影响无固定模式。此外,非生物和生物因素的季节性变化均可能影响AMF群落组成。例如,在美国北卡罗来纳州的草原地区,植被群落组成的季节性变化会显著影响AMF群落组成[12];而Baidnard等[7]却发现土壤磷酸盐含量、含水量和宿主植物种类是导致不同季节AMF群落变化的主要原因。也有研究表明,AMF群落的季节动态变化与宿主植物物候有关。Senes-guerrero等[13]发现秘鲁安第斯山脉地区的马铃薯幼苗期、开花期和衰老期的AMF群落存在显著差异;Cuenca等[14]发现在热带或亚热带的雨季(植物开花期或结果期)AMF丰富度要低于干季(植物生长期)。因此,AMF群落的季节动态不仅受土壤理化性质和植物群落季节性变化的影响,还与宿主植物的种类和物候有关。那么,内蒙古大青山灌木铁线莲根系菌根侵染率、孢子密度和AMF群落组成是否会出现季节性变化规律,可能会受哪些因素的影响,均为本研究拟探讨的问题。
1 材料和方法
1.1研究区概况及样品采集
研究区位于内蒙古大青山呼和浩特段,属典型的温带大陆性气候,年平均气温3 ~ 5 ℃,年平均降雨量320 ~ 450 mm,年平均蒸发量1 800 ~ 2 300 mm。内蒙古大青山地区灌木铁线莲生长期为5月,开花期为7 ~ 8月,果期为9月[15]。所以,本研究分别于 2014年5月(春)、7月(夏)和9月(秋)在水磨村(40°58′55″N,111°51′34″E)、小井沟(40°58′25″N,111°50′44″E)和白石头沟(40°47′37″N,111°26′47″E)样地随机设置3个3 m×3 m样方,调查样方中植被盖度及植物群落组成,每个样方随机选择3株灌木铁线莲,在距植株0 ~ 10 cm处挖根围土壤,采集0 ~ 20 cm深处的细根样和土样(每次采样均取相同植株),相同样方的样本混合均匀,组成一个混合样本。混合样本首先取大约20 g左右土壤放入到铝盒中,用于测定土壤含水量。剩余土壤一部分贮存在-20 ℃冰箱中,用于分子鉴定;另一部分风干,测定孢子密度和土壤理化性质。根样用蒸馏水清洗数次后放在装有FAA固定液(5 mL 甲醛,5 mL醋酸和90 mL 70%乙醇)的玻璃瓶中,用于AMF侵染率测定。
1.2土壤理化性质测定
土壤含水量、pH、有机质、速效氮和速效磷含量的测定分别使用烘干法、电位法、重铬酸钾氧化法、碱解扩散法和0.5 mol/L碳酸氢钠浸提-钼锑抗比色法[16]。
1.3丛枝菌根真菌孢子分离和根侵染率测定
将采集的幼嫩根系剪成长度为1 cm左右根段,10% KOH溶液浸泡并在90 ℃水浴锅加热1 h,碱性H2O2溶液(10 mL 30% H2O2,3 mL NH4OH,加蒸馏水至600 mL)软化20 min,1% HCl酸化3 min,0.05%曲利苯蓝乳酸甘油溶液(乳酸∶甘油=1∶1)浸泡并在90 ℃水浴锅加热3 h,最后在乳酸甘油溶液中脱色48 h。将脱色后的根段置于载玻片上在显微镜下观察,利用十字交叉法[18]测定AMF侵染率和丛枝丰度。
1.4土壤DNA提取、PCR扩增和测序
取0.2 g土样,按照E.Z.N.A.Soil DNA Kit(OMEGA,USA)的说明提取土壤DNA。利用琼脂糖凝胶电泳查看DNA的完整性,利用Qubit2.0 DNA Detection Kit(Life Technologies,USA)精确定量DNA浓度,以确定PCR反应加入的DNA量。利用Illumina MiSeq测序技术和AMV4.5NF(5′-AAGCTCGTAGTT GAATTTCG-3′)/AMDGR(3′-CCCAACTATCCCTATTATCAT-5′)引物[19]评估AMF群落组成。为保证Illumina MiSeq测序顺利进行和多个样本同时测序,需在引物中添加Illumina平台adapter和7 bp-barcode(标签序列)。采用two-step PCR进行PCR扩增,反应体系为50 μL,包括10 ng DNA模板(第一次PCR)或者是20 ng PCR产物(第二次PCR)、5 μL 10×PCR buffer、0.5 μL dNTP(10 mmol/L each)、0.5 μLTaqDNA聚合酶(5 U/μL)、0.5 μL引物(50 μmol/L,前后引物各0.5 μL),最后用ddH2O补充到50 μL。反应程序为:95 ℃预变性5 min;95 ℃变性15 s,55 ℃ 退火15 s,72 ℃ 延伸30 s,循环25次;最后72 ℃延伸10 min。PCR产物用1.5%琼脂糖凝胶电泳分离,按照SanPrep 柱式 DNA 胶回收试剂盒(上海生工,中国)操作说明回收PCR产物。回收产物用Qubit2.0 DNA Detection Kit(Life Technologies,USA)测定浓度,根据浓度,将所有样本按1∶1比例充分混合,进行Illumina MiSeq测序。
1.5测序结果分析
Illumina MiSeq测序得到的是双端序列数据,首先根据双端测序reads之间的overlap关系,将成对reads 拼接成一条序列,对reads质量和拼接效果进行质量控制过滤,根据序列首尾两端的barcode和引物序列区分样本得到有效序列,并校正序列方向。质量控制过滤主要是去掉短片段序列、含有错误的barcode和引物的序列和融合后reads质量控制得分在20以下的序列。利用Flash(1.2.3)[20]和Prinseq(0.20.4)[21]分别进行序列拼接和质量控制过滤。按序列间距离对序列进行归类,利用CROP方法[22]以97%相似性分类OTUs(operational taxonomic units)。使用Blast首先在GenBank数据库进行比对,排除非球囊菌门(Glomeromycota)OTUs数。然后在MaarjAM 数据库[23]中再次比对OTUs序列,进一步确认AMF OTUs分类学信息。
1.6统计处理
1.规范乡(镇、街道)统战委员、统战工作人员的配备要求。按照乡(镇、街道)、村(社区)的具体区划,将支持、协调甚至主导推进园区、楼宇、经济板块等统战工作作为乡(镇、街道)、村(社区)党建工作的重要任务,既避免特定辖区内基层统战工作的多头开展、资源浪费,又保证基层统战工作不留死角、协同推进。
统计分析前,对土壤理化性质、植被盖度、孢子密度、菌根侵染率、AMF丰富度和多样性等数据进行标准化处理。利用SPSS软件(20.0)对不同季节数据进行单因素方差分析,LSD多重比较检验不同季节间的差异显著性。利用Mothur软件(1.30.1)对实测OTUs数、Chao1指数、Shannon-Wiener指数和Invsimpson指数进行rarefaction分析。为比较不同季节AMF群落组成的差异性,利用PCORD软件(5.0)进行主成分分析(principal coordinate analysis,PCoA)和PERMANOVA分析。利用Canoco软件(4.5)的冗余分析(redundancy analysis,RDA)描绘不同季节AMF丰富度和多样性指数与采样季节、土壤和植被因子间的关系。Mantel test进一步检验AMF群落组成、孢子密度和菌根侵染率与采样季节、土壤和植被因子间的关系。
2 结果与分析
2.1样地土壤理化性质及植被因子季节变化特征
由表1可以看出,样地春季土壤速效氮、速效磷和有机质含量显著高于夏季和秋季;夏季土壤含水量显著高于春季和秋季;夏季和秋季植被盖度显著高于春季;土壤pH值和植物Shannon-Wiener多样性指数在3个季节间无显著差异。
2.2丛枝菌根真菌孢子密度和根系侵染率季节变化
从图1可以看出,灌木铁线莲根围土壤AMF孢子密度在春季、夏季和秋季不存在显著差异;灌木铁线莲根系AMF侵染率较高,所有样本(n=27)AMF侵染率均超过95%,且春季和夏季根系侵染率显著高于秋季;丛枝丰度在3个季节之间均呈显著差异,其中春季最高,秋季最低。相关性分析表明,灌木铁线莲根围土壤AMF孢子密度与采样季节无显著相关性,根系侵染率和丛枝丰度与采样季节极显著负相关(r=-0.741,P=0.000;r=-0.896,P=0.000),说明随灌木铁线莲的生长(5月)、开花(7月)、结实(9月),其根系AMF侵染率和丛枝丰度呈下降趋势。

表1 不同季节土壤和植被因子比较Table 1 The comparison of soil and plant factors in different seasons
注:数据为均值±标准误(n=9);同一行数据后不同字母表示在 0.05 水平上差异显著
Note: Data are means±SE. Data with different letters in the same line indicate significant differences at 0.05 level

同一组柱子上不同字母表示在 0.05 水平上差异显著;误差棒代表标准误。图1 不同季节AMF孢子密度及侵染率Columns with different letters at the same group indicate significant differences at 0.05 level; error bars indicate standard errorsFig.1 Spore density and colonization of AMF in different seasons
2.3根围土壤丛枝菌根真菌群落组成及其季节变化特征
随测序样本数的不断增加,不同季节AMF物种累积曲线基本上达到平缓期(图2),说明在本研究中每个季节测序样本数量是充足的。Illumina Miseq测序共检测到300 718条序列,被归类为295 OTUs。AMF序列数目为204 122,占总数的67.88%,所有序列被分类为163 OTUs,属于球囊霉属(Glomus)、uncultured-Glomeromycota、多样孢囊霉属(Diversispora)、近明球囊霉属(Claroideoglomus)、盾巨孢囊霉属(Scutellospora)、管柄囊霉属(Funeliformis)、Rhizophagus、类球囊霉属(Paraglomus)、Ambispora、Septoglomus和原囊霉属(Archaeospora)。其中球囊霉属序列数和OTUs数目最多,其次为uncultured-Glomeromycota,第三为多样孢囊霉属,其余属数目较少(表2)。

图2 不同季节AMF物种累积曲线Fig.2 Species accumulation curves of AMF in different seasons
图3为不同季节AMF群落组成,3个季节总共检测到163个AMF OTUs,春季、夏季、秋季分别为116、76和 70 OTUs。各季节AMF群落的优势属均为球囊霉属。随着季节变化,球囊霉属、uncultured-Glomeromycota、盾巨孢囊霉属、RhizophaugusOTUs数目基本呈下降趋势,而多样孢囊霉属OTUs数目夏季最多,管柄囊霉属和AmbisporaOTUs数目在3个季节保持不变。此外,近明球囊霉属只存在于春季和秋季,类球囊霉属只存在于春季和夏季,Septoglomus只存在于春季,原囊霉属只存在于夏季。基于Bray-Curtis距离对不同季节AMF群落组成进行PERMANOVA分析(表3),结果发现,夏季和秋季AMF群落组成与春季存在显著差异,而AMF群落组成在夏季和秋季的差异并不显著,这与PCoA分析结果是一致的(图4)。
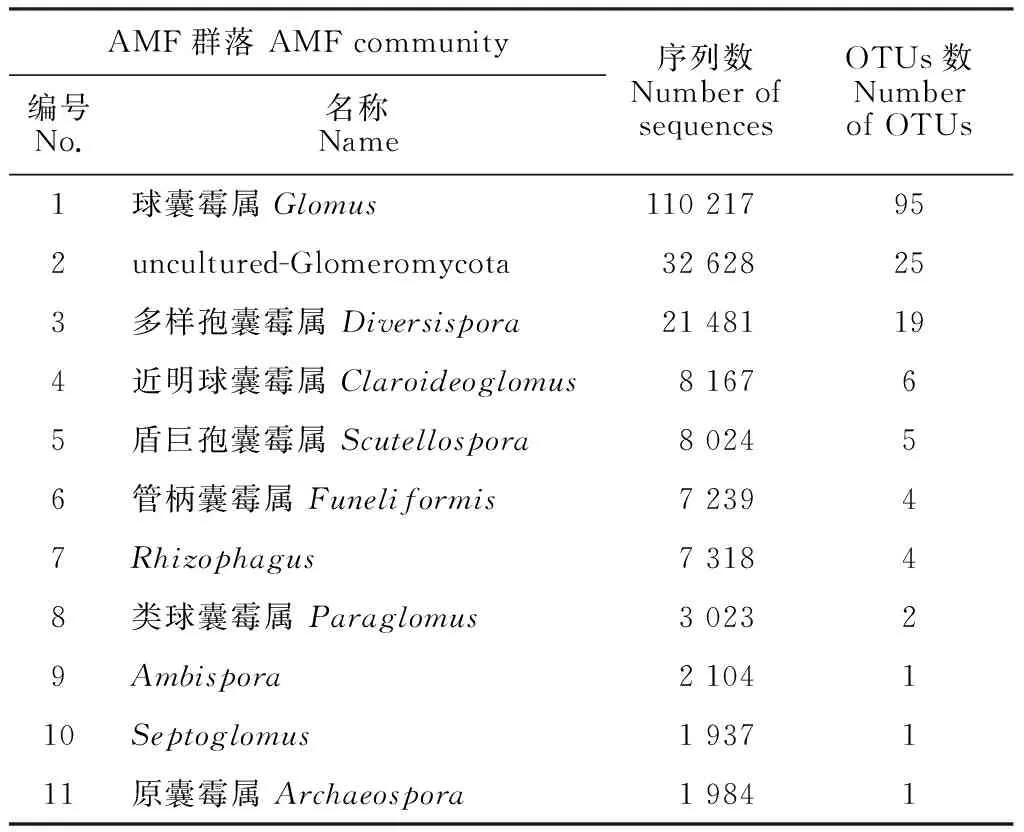
表2 Illumina MiSeq测序得到的AMF序列数和OTUs数Table 2 Number of sequences and OTUs of AMF from all soil samples obtained by Illumina MiSeq sequencing

1. 球囊霉属;2. Uncultured-Glomeromycota;3. 多样孢囊霉属;4. 近明球囊霉属;5. 盾巨孢囊霉属;6. 管柄囊霉属;7. Rhizophagus;8. 类球囊霉属;9. Ambispora;10. Septoglomus;11. 原囊霉属图3 不同季节AMF群落组成1. Glomus; 2. Uncultured-Glomeromycota; 3. Diversispora; 4. Claroideoglomus; 5. Scutellospora; 6. Funeliformis; 7. Rhizophagus; 8. Paraglomus; 9. Ambispora; 10. Septoglomus; 11. ArchaeosporaFig.3 Community composition of AMF based on number of OTUs in different seasons

表3 不同季节AMF群落组成的PERMANOVA分析Table 3 The results of PERMANOVA analysis of AMF community composition in different seasons

图4 不同季节AMF群落的主成分分析Fig.4 Principal coordinate analysis (PCoA) of AMF community from different seasons
2.4不同季节丛枝菌根真菌丰富度和多样性指数的稀疏曲线分析
利用实测OTUs数、Chao1指数、Shannon-Wiener指数和Invsimpson指数的稀疏曲线评估和比较不同季节AMF丰富度和多样性(图5)。当AMF序列数超过30 000时,所有曲线均基本上达到平缓期,说明本研究测序得到的AMF丰富度和多样性能够很好地描述不同季节的AMF。此外,春季AMF丰富度(实测OTUs数和Chao1指数)和多样性(Shannon-Wiener 和Invsimpson多样性指数)显著高于夏季和秋季(LSD检验,P< 0.05)。实测OTUs数和Chao1指数值分别从春季的116、121.96,降低到夏季的76、77和秋季的70、70(图5,A、B);相应地,Shannon-Wiener 和Invsimpson多样性指数值分别从春季的3.62、20.26,降低到夏季的3.21、14.78和秋季的3.07、12.89(图5,C、D)。然而,夏季和秋季的AMF丰富度和多样性无显著差异(LSD检验,P> 0.05)。
2.5根围土壤理化性质和植被因子对丛枝菌根真菌的影响
RDA分析结果表明(图6),第一轴和第二轴的解释量分别为20.52%和5.28%,采样季节、植被盖度、植被多样性、土壤含水量和土壤有机质显著影响AMF多样性指数(Shannon-Wiener指数和Invsim-pson指数)和丰富度指数(Chao1指数和实测OTUs数,P< 0.05)。AMF丰富度指数和多样性指数与采样季节、植被盖度、植被多样性和土壤含水量呈显著负相关,与土壤有机质呈显著正相关。
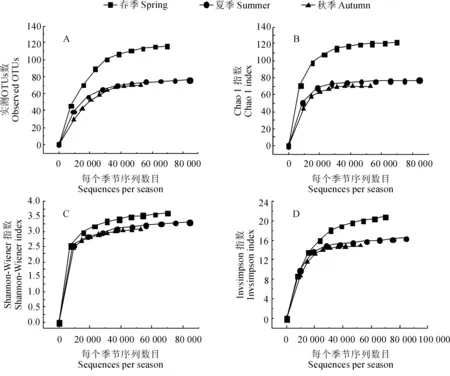
图5 不同季节AMF物种丰富度(A、B)和多样性指数(C、D)的稀疏曲线Fig.5 Rarefaction curves of AMF richness (A and B) and diversity (C and D) in different seasons
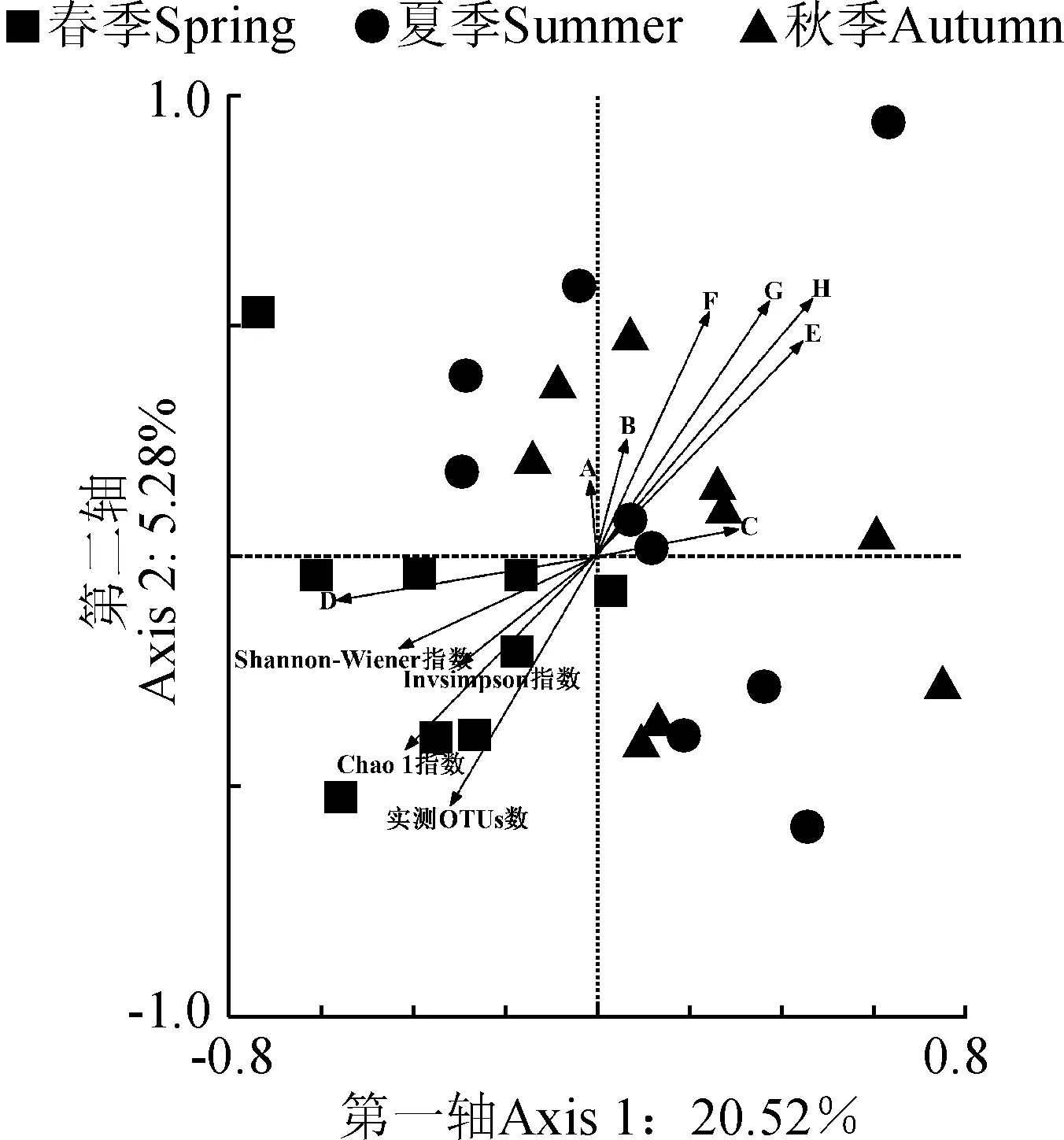
A. pH;B. 速效氮;C. 速效磷; D. 土壤有机质;E. 土壤含水量;F. 植物Shannon-Wiener多样性指数;G. 植被盖度;H. 采样季节图6 AMF丰富度和多样性与采样季节、土壤和植被因子RDA分析图A. pH; B. Available N; C. Available P; D. Soil organic matter; E. Soil moisture content; F. Shannon-Wiener index; G. Plant coverage; H. Sampling seasonsFig.6 RDA ordination plot showed the relationships between AMF richness and diversity, sampling seasons, soil and plant factors
另外,利用Mantel test分析AMF群落组成、孢子密度和菌根侵染率与采样季节、土壤和植被因子之间的关系(表4),结果发现:土壤有机质含量显著影响AMF群落组成、孢子密度和菌根侵染率;采样季节显著影响AMF群落组成和菌根侵染率;土壤含水量、植物多样性和植被盖度显著影响AMF群落组成;采样季节是影响AMF群落组成和菌根侵染率的主导因子,土壤有机质是影响孢子密度的主导因子。
3 讨 论
本研究利用Illumina MiSeq测序技术首次探讨了内蒙古大青山干旱阳坡灌木铁线莲根围AMF群落季节动态。虽然引物具有特异性,仍检测到一些不属于球囊菌门的序列,但AMF实测OTUs数、Chao 1丰富度指数、Shannon-Wiener多样性指数和Invsimpson多样性指数的稀疏曲线均基本上达到平缓期,说明本研究得到的AMF丰富度和多样性能很好地描述不同季节的AMF。本研究共检测到AMF序列204 122条和163 OTUs,明显高于使用焦磷酸测序和相同引物得到的结果[24-25],这可能与Illumina MiSeq测序具有较高的测序深度和产生较低的错配序列有关,同时也表明灌木铁线莲根围土壤中蕴含着丰富的AMF资源。
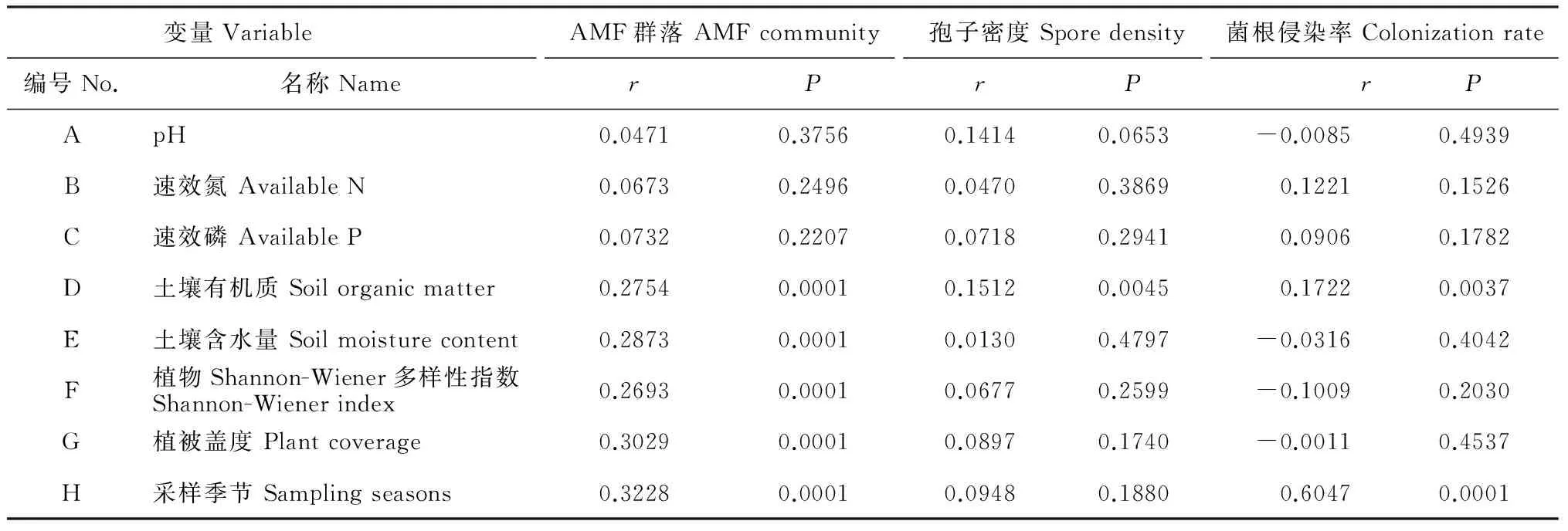
表4 AMF群落、孢子密度和菌根侵染率与采样季节、土壤和植被因子之间关系的Mantel test分析Table 4 Relationships of AMF community, spore density and colonization rate with sampling seasons, soil and plant factors by Mantel test
春季AMF丰富度和多样性显著高于夏季和秋季,而夏季和秋季AMF丰富度和多样性差异并不显著,这可能与采样时灌木铁线莲所处物候期有关。宿主植物是AMF碳水化合物提供者,对于AMF具有重要影响。植物不同生长阶段,其对碳水化合物的需求会有所差异,从而间接影响AMF群落。春季为灌木铁线莲营养生长阶段(生长期),随着植物叶片的增多,光合作用产物会逐渐超过植物地上部分生长的需求,流动到根部的碳水化合物会增多,从而维持较高的AMF丰富度和多样性。随着季节的变化,植物进入生殖生长阶段(开花期和结实期)。研究发现,植物开花期和结实期比生长期需要更多的碳水化合物[26-28],这时大量的碳水化合物被运送到正在发育的生殖器官,加之根部对碳水化合物的竞争力最弱[29],导致运送到根部的碳水化合物大大减少,使AMF丰富度和多样性降低。此外,与夏季和秋季相比,春季土壤温度较低,而较低的土壤温度会降低植物直接从土壤中吸收养分的速率[30],土壤温度在10℃时,AMF能够促进植物对养分的吸收[31],这也可能是导致春季AMF丰富度和多样性较高的原因之一。从春季到秋季,灌木铁线莲根系AMF侵染率和丛枝丰度呈下降趋势。据报道,Zangaro等[9]发现巴西南部地区的热带雨林植物AMF侵染率在春季和夏季高于秋季,刘永俊等[10]发现柠条(Caraganakorshinskii)AMF侵染率从春季至秋季呈下降趋势,丛枝丰度呈上升趋势;Hazard等[32]发现黑麦草(Loliumperenne)最低的AMF侵染率和丛枝丰度均出现在春季,出现这些结果的原因可能与相关研究的宿主植物种类不同有关。
本研究的RDA和Mantel test结果表明,影响灌木铁线莲根围AMF群落的主导因子是采样季节。在其它地区,Santos-gonzalez等[11]发现季节变化不会影响瑞典草原生态系统的夏枯草(Prunellavulgaris)和蝶须(Antennariadioica)根系AMF群落组成;而在苏格兰的草原生态系统,Vandenkoornhuyse等[33]则发现采样季节显著影响丝状剪股颖(Agrostiscapillaris)和白三叶(Trifoliumrepens)根围AMF群落组成;在半干旱生态系统,刘永俊等[10]指出柠条根系3个季节的AMF群落组成和多样性指数均有一定的差异。这些不同的研究结果表明,生态系统及宿主植物均可能会影响采样季节与AMF丰富度、多样性和群落组成间的关系。本研究中,土壤含水量与AMF丰富度和多样性呈显著负相关,可能原因是随着土壤含水量的下降,植物需要依赖更多的AMF来增强自身对于干旱环境的适应性,这是植物应对环境恶化的一种有效生态策略;土壤有机质与AMF丰富度和多样性呈显著正相关,并且是影响AMF孢子密度的主导因素,这与Yang等[34]的研究结果一致。此外,本研究中,植被盖度和植物多样性与AMF丰富度和多样性呈显著负相关,这与前人的研究结果则相反,如异叶青兰(Dracocephalumheterophyllum)和多枝黄耆(Astragaluspolycladus)根系AMF丰富度与植被盖度呈显著正相关[35],植物多样性与长叶车前(Plantagolanceolata)根系AMF多样性呈显著正相关[36]。所以,在季节变化主导下的多种非生物因素和生物因素的综合作用影响着AMF群落。
综上所述,本研究利用Illumina MiSeq测序技术首次探讨了内蒙古大青山干旱阳坡灌木铁线莲根围AMF群落的季节动态,结果发现夏季和秋季AMF丰富度、多样性和群落组成无显著差异,但AMF丰富度和多样性显著低于春季,群落组成与春季也存在显著差异,可能与灌木铁线莲物候有很大关联;季节是影响AMF群落和根系侵染率的主导因子,而影响孢子密度的主导因子是土壤有机质。研究结果为进一步探索灌木铁线莲-AMF共生体对不同季节环境变化的响应提供了理论依据。但当前的研究仅关注灌木铁线莲生长季节的AMF群落季节动态,那么在温度较低的冬季,其根围AMF群落组成是怎样的,AMF对灌木铁线莲在内蒙古大青山地区寒冷冬季的生存发挥怎样的作用,是未来应当关注的问题。
[1]SMITH S E, SMITH F A. Fresh perspectives on the roles of arbuscular mycorrhizal fungi in plant nutrition and growth[J].Mycologia, 2012, 104(1): 1-13.
[2]LI T, LIN G, ZHANG X,etal. Relative importance of an arbuscular mycorrhizal fungus (Rhizophagusintraradices) and root hairs in plant drought tolerance[J].Mycorrhiza, 2014, 24(8): 595-602.
[3]RUIZ-LOZANO J M, PORCEL R, AROCA R. Evaluation of the possible participation of drought-induced genes in the enhanced tolerance of arbuscular mycorrhizal plants to water deficit[M]. Berlin Heidelberg: Springer, 2008: 185-205.
[4]LI X L, ZHANG J L, GAI J P,etal. Contribution of arbuscular mycorrhizal fungi of sedges to soil aggregation along an altitudinal alpine grassland gradient on the Tibetan Plateau[J].EnvironmentalMicrobiology, 2015,17(8): 2 841-2 857.
[5]HELGASON T, MERRYWEATHER J, DENSION J,etal. Selectivity and functional diversity in arbuscular mycorrhizas of co-occurring fungi and plants from a temperate deciduous woodland[J].JournalofEcology, 2002, 90(2): 371-384.
[6]ZHAO R X, GUO W, BI N,etal. Arbuscular mycorrhizal fungi affect the growth, nutrient uptake and water status of maize (ZeamaysL.) grown in two types of coal mine spoils under drought stress[J].AppliedSoilEcology, 2015, 88: 41-49.
[7]BAINARD L D, BAINARD J D, Hamel C,etal. Spatial and temporal structuring of arbuscular mycorrhizal communities is differentially influenced by abiotic factors and host crop in a semi-arid prairie agroecosystem[J].FEMSMicrobiologyEcology, 2014, 88(2): 333-344.
[8]HEWINS C R, CARRINO-KYKER S R, Burke D J. Seasonal variation in mycorrhizal fungi colonizing roots ofAlliumtricoccum(wild leek) in a mature mixed hardwood forest[J].Mycorrhiza, 2015, 25(6): 469-483.
[9]ZANGORA W, ROSTIROLA L V, de SOUZA P B,etal. Root colonization and spore abundance of arbuscular mycorrhizal fungi in distinct successional stages from an Atlantic rainforest biome in southern Brazil[J].Mycorrhiza, 2013, 23(3): 221-233.
[10]刘永俊, 郑红, 何雷, 等. 柠条根系中丛枝菌根真菌的季节性变化及影响因素[J]. 应用生态学报, 2009, 20(5): 1 085-1 091.
LIU Y J, ZHENG H, HE L,etal. Seasonal variation and related affecting factors of arbuscularmycorrhizal fungi inCaraganakorshinskiiroots[J].ChineseJournalofAppliedEcology, 20(5): 1 085-1 091.
[11]SANTOS-GONZALEZ J C, FINALAY R D, TEHLER A. Seasonal dynamics of arbuscular mycorrhizal fungal communities in roots in a seminatural grassland[J].AppliedandEnvironmentalMicrobiology, 2007, 73(17): 5 613-5 623.
[12]PRINGLE A, BEVER J D. Divergent phenologies may facilitate the coexistence of arbuscular mycorrhizal fungi in a North Carolina grassland[J].AmericanJournalofBotany, 2002, 89(9): 1 439-1 446.
[13]SENES-GUERRERO C, TORRES-CORTE G, PFEIFFER S,etal. Potato-associated arbuscular mycorrhizal fungal communities in the Peruvian Andes[J].Mycorrhiza, 2014, 24(6): 405-417.
[14]CUENCA G, LOVERA M. Seasonal variation and distribution at different soil depths of arbuscular mycorrhizal fungi spores in a tropical sclerophyllous shrubland[J].Botany, 2010, 88(1): 54-64.
[15]马毓泉. 内蒙古植物志(第2卷)[M]. 呼和浩特: 内蒙古人民出版社, 1989.
[16]鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.
[17]LI X L, GEORGE E, MARSCHNER H. Phosphorus depletion and pH decrease at the root-soil and hyphae-soil interfaces of VA mycorrhizal white clover fertilized with ammonium[J].NewPhytologist, 1991, 119(3): 397-404.
[18]MCGONIGLE T, MILLER M, EVANS D,etal. A new method which gives an objective measure of colonization of roots by vesicular-arbuscular mycorrhizal fungi[J].NewPhytologist, 1990, 115(3): 495-501.
[19]SATO K, SUYAMA Y, SAITO M,etal. A new primer for discrimination of arbuscular mycorrhizal fungi with polymerase chain reaction-denature gradient gel electrophoresis[J].GrasslandScience, 2005, 51: 179-181.
[20]MAGOC T, SALZBERG S L. FLASH: fast length adjustment of short reads to improve genome assemblies[J].Bioinformatics, 2011, 27(21): 2 957-2 963.
[21]SCHMIEDER R, EDWARDS R. Quality control and preprocessing of metagenomic datasets[J].Bioinformatics, 2011, 27(6): 863-864.
[22]HAO X L, JIANG R, CHEN T. Clustering 16S rRNA for OTU prediction: a method of unsupervised Bayesian clustering[J].Bioinformatics, 2011, 27(5): 611-618.
[23]ÖPIK M, VANATOA A, VANATOA E,etal. The online database MaarjAM reveals global and ecosystemic distribution patterns in arbuscular mycorrhizal fungi (Glomeromycota) [J].NewPhytologist, 2010, 188(1): 223-241.
[24]GEEL M, CEUSTERMANS A, HEMELRIJCK W,etal. Decrease in diversity and changes in community composition of arbuscular mycorrhizal fungi in roots of apple trees with increasing orchard management intensity across a regional scale[J].MolecularEcology, 2015, 24(4): 941-952.
[25]LIN X G, FENG Y Z, ZHANG H Y,etal. Long-term balanced fertilization decreases arbuscular mycorrhizal fungal diversity in an arable soil in North China revealed by 454 pyrosequencing[J].EnvironmentalScience&Technology, 2012, 46(11): 5 764-5 771.
[26]INGLESE P, BARBERA G, LA MANTIA T. Seasonal reproductive and vegetative growth patterns and resource allocation during cactus pear fruit growth[J].HortScience, 1999, 34(1): 69-72.
[27]PARSONS A, ROBSON M. Seasonal changes in the physiology of S24 perennial ryegrass (LoliumperenneL.) 3. Partition of assimilates between root and shoot during the transition from vegetative to reproductive growth[J].AnnalsofBotany, 1981, 48(5): 733-744.
[28]杨高峰, 贺晓, 易津. 华北驼绒藜种子发育期各器官间碳水化合物的再分配[J]. 草业学报, 2013, 22(4): 327-333.
YANG G F, HE X, YI J. Allocation of carbohydrate during seed development ofCeratoidesarboresens[J].ActaPrataculturaeSinica, 2013, 22(4): 327-333.
[29]WARDLAW I F. Tansley Review No. 27 The control of carbon partitioning in plants[J].Newphytologist, 1990, 116(3): 341-381.
[30]PREGITZER K, KING J. Effects of soil temperature on nutrient uptake[M]. Berlin Heidelberg: Springer, 2005, 277-310.
[31]BARRETT G, CAMPBEL C, FITTER A,etal. The arbuscular mycorrhizal fungusGlomushoican capture and transfer nitrogen from organic patches to its associated host plant at low temperature[J].AppliedSoilEcology, 2011, 48(1): 102-105.
[32]HAZARD C, BOOTS B, KEITH AM,etal. Temporal variation outweighs effects of biosolids applications in shaping arbuscular mycorrhizal fungi communities on plants grown in pasture and arable soils[J].AppliedSoilEcology, 2014, 82: 52-60.
[33]VANDENKOOMHUYSE P, HUSBAND R, DANIELL T,etal. Arbuscular mycorrhizal community composition associated with two plant species in a grassland ecosystem[J].MolecularEcology, 2002, 11(8): 1 555-1 564.
[34]YANG H S, YUAN Y G, ZHANG Q,etal. Changes in soil organic carbon, total nitrogen, and abundance of arbuscular mycorrhizal fungi along a large-scale aridity gradient[J].Catena, 2011, 87(1): 70-77.
[35]LIU Y J, HE J X, SHI G X,etal. Diverse communities of arbuscular mycorrhizal fungi inhabit sites with very high altitude in Tibet Plateau[J].FEMSMicrobiologyEcology, 2011, 78(2): 355-365.
[36]JOHNSON D, VANDENKOORNHUYSE P J, LEAKE J R,etal. Plant communities affect arbuscular mycorrhizal fungal diversity and community composition in grassland microcosms[J].NewPhytologist, 2004, 161(2): 503-515.
(编辑:裴阿卫)
Seasonal Dynamics of Arbuscular Mycorrhizal Fungal Community in the Rhizosphere ofClematisfruticosain the Daqingshan Mountains, Inner Mongolia
LIU Min1, ZHENG Rong2, BAI Shulan1*, QING Yun2, YAN Wei3, JIA Xuewen3
(1 College of Forestry, Inner Mongolia Agricultural University, Hohhot 010019, China; 2 College of Life Science and Technology, Inner Mongolia Normal University, Hohhot 010022, China; 3 Institute of Forestry and Sand Science of Ordos, Ordos ,Inner Mongolia 017000, China)
With the method of Illumina MiSeq sequencing, we investigated the seasonal dynamics of arbuscular mycorrhizal fungal community in the rhizosphere ofClematisfruticosain the arid sunny slopes of the Daqingshan Mountains. By the methods of redundancy analysis (RDA) and Mantel test, we also analyzed the relationships between AMF and soil and plant factors. It would provide important scientific basis to further discuss the response ofC.fruticosa-AMF symbioses to climate changes in different seasons. The results indicated that: (1) Spore density of AMF was no significant difference among seasons, but colonization rate and arbuscule abundance of AMF had a decreasing trend from spring to autumn. (2) A total of 163 AMF OTUs (operational taxonomic units) were detected in three seasons, 116 OTUs, 76 OTUs and 70 OTUs were detected in spring, summer and autumn, respectively. (3) AMF richness (Observed OTUs and Chao 1 index) and diversity (Shannon-Wiener index and Invsimpson index) of summer and autumn were significantly lower than that of spring, but there were no significant differences between summer and autumn. (4) Principal coordinate analysis and PERMANOVA analyses indicated that AMF community compositions of summer and autumn were significantly different from that of spring, while the difference was not significant in summer and autumn. (5) RDA analysis showed that sampling season, plant coverage, plant diversity, soil moisture content and soil organic matter significantly influenced Shannon-Wiener index, Invsimpson index, Chao 1 index and Observed OTUs of AMF. Mantel test indicated that sampling season was the driving factor to affect community composition and colonization rate of AMF, but had no significantly influence on spore density, soil organic matter was the driving factor to influence spore density.
Clematisfruticosa; arbuscular mycorrhizal fungi; seasonal dynamics; Illumina MiSeq sequencing
1000-4025(2016)09-1891-09doi:10.7606/j.issn.1000-4025.2016.09.1891
2016-06-12;修改稿收到日期:2016-08-21
国家自然科学基金(31360125)
刘敏(1989-),女,在读博士研究生,主要从事菌根生物技术研究。E-mail:liumin19890110@yeah.net
白淑兰,博士,教授,主要从事菌根生物技术研究。E-mail:baishulan2004@163.com
Q939.96; Q938.1
A

