短叶对齿藓组织培养的研究
高叶青, 任冬梅, 赵小丹,赵东平,隋嫣鸿
(内蒙古大学 生命科学学院,呼和浩特010021)
短叶对齿藓组织培养的研究
高叶青, 任冬梅*, 赵小丹,赵东平,隋嫣鸿
(内蒙古大学 生命科学学院,呼和浩特010021)
以采自白云鄂博主矿区的短叶对齿藓为试验材料,研究了不同消毒剂以及不同浓度植物激素6-BA和IAA对短叶对齿藓愈伤组织诱导和分化的影响。结果表明:短叶对齿藓配子体最佳消毒剂及作用时间为体积浓度百分比75%乙醇浸泡30 s,再用质量浓度0.1 g/L升汞消毒90 s;采用Knop培养基培养短叶对齿藓茎叶段,质量浓度为0.1 mg/L 6-BA促进愈伤组织分化形成配子体,质量浓度1.0 mg/L 6-BA则抑制短叶对齿藓愈伤组织形成,IAA有助于原丝体的萌发生长。
短叶对齿藓;组织培养;植物激素
短叶对齿藓(Didymodontectorum)属于苔藓植物门藓纲丛藓科对齿藓属[1]。植物体高1.0~1.5 cm,密集垫状丛生,多见于钙质土壤或岩石,绿色或棕黄色。茎直立,单一或分枝,茎横切面具厚壁细胞和透明细胞,中轴明显分化。假根着生于基部。叶干燥时紧贴于茎,潮湿时倾立,阔卵状披针形,从中部突然狭窄至叶尖,叶上部明显凹陷;叶细胞单层,KOH反应呈红色。叶边全缘,强烈背卷,单层细胞;中肋极顶或轻微突出叶尖,中肋中上部腹表面细胞短矩形或方形,具疣;中肋横切面呈椭圆形或圆形,主细胞1~2层,腹厚壁细胞带弱,1~2层或不分化,背厚壁细胞带显著,2~4层。叶上部细胞圆方形或方形,细胞壁稍加厚,具有1~3个钝圆疣或分叉疣;基部细胞不分化或轻微分化,短矩形或圆方形,不透明,光滑,细胞壁薄,无壁孔;基部边缘细胞不分化,方形或亚方形。叶腋处着生大量芽胞,棕色或棕黄色,球形,由4~8个细胞构成,表面光滑[2]。雌雄异株。雌苞叶显著长于茎叶,分化明显。蒴柄和孢蒴直立,红棕色,孢蒴圆柱形或卵圆形,蒴齿条状,齿片32[1-2]。
很多种类的苔藓植物生长于裸露岩石、岩面薄土或石壁上,生命力极强,能抵抗极端干旱环境[3-4],对污染物反应敏感,并对包括稀土元素在内的各种重金属元素有着显著的吸收与富集作用。因此,苔藓植物现被广泛作为一种监测环境的指示植物[5]。以苔藓作为试验材料研究其对白云鄂博矿区稀土元素的富集特性,及其在矿区环境修复方面的作用具有重要意义。
为探索并验证苔藓植物对稀土元素的富集能力,需要运用大量无菌、均一化的苔藓植物材料。苔藓对植物激素十分敏感,对添加的种类要求苛刻,有些植物激素起到正向诱导作用,有些则有抑制作用[6]。因此,不同种类的苔藓植物诱导愈伤组织时对植物激素的种类要求有所不同。陈静文[7]使用Knop培养基成功地研究出诱导小立碗藓产生愈伤组织最佳的植物激素及其浓度配比。目前,有关短叶对齿藓组织培养研究在国内还鲜有报道,本试验研究了2种植物激素6-BA和IAA对短叶对齿藓愈伤组织诱导和分化的影响,为短叶对齿藓植物快繁体系建立提供科学依据。
1 材料和方法
1.1材料
2013~2014年从白云鄂博矿区采集新鲜的苔藓植物样,放置于通风干燥处自然晾干。待土样干燥后装到牛皮纸质的植物标本袋内保存备用。
通过室内镜检(Leica EZ4 HD)观察鉴定苔藓植物种类,挑选丛藓科、对齿藓属的短叶对齿藓标本作为组培材料标本号201308044。白云鄂博主矿石下土生,从短叶对齿藓纯群落中随机选取30株,测量植物体高度,植物体高度在1.5~2.2 cm之间,平均高度为1.87 cm。
1.2材料清洗准备
将选好的植株放入培养皿中用蒸馏水浸泡,至植物体完全舒展开,接着用自来水流水冲洗20~30 min,至表面的泥土、沙粒等杂质被全部冲洗干净,然后再用无菌水浸泡并用超声波洗涤3次,每次6 min,洗净后捞出,剪取植株上部绿色部分,截成0.2~0.3 cm的茎叶段,作为组培外植体材料,放置于垫有灭菌滤纸的培养皿上备用。
1.3消毒剂及消毒时间的筛选
在无菌超净工作台内,将处理好的外植体用75% 的酒精浸泡30 s,依次放入无菌水中漂洗3次,然后分别用0.01、0.05和0.1 g/L升汞(贵州省铜仁化学试剂厂)溶液消毒各10、30、60、90和120 s,再用无菌水漂洗5次,取出,用灭菌滤纸吸干外植体表面的水分。将各处理分别接种于Knop(各成分均由国药集团化学试剂有限公司提供)基本培养基上,每个培养皿中接4个外植体。本实验均选用Knop作为基本培养基,pH值为7.5,蔗糖浓度为1.5%,培养条件为:培养温度20 ℃,光照强度3 300 Lx,光培养16 h暗培养8 h[8]。
将另外一组外植体用体积浓度1%、1.5% 和2%NaClO溶液消毒处理各45、60和90 s作为对照组,分别接种于Knop培养基上,20 d后发现仅1.5% NaClO溶液消毒90 s的未染菌,至30 d时全部染菌。消毒剂筛选结果表明:用75%酒精和0.1 g/L升汞消毒后外植体污染率最低。
2 结果与分析
2.1愈伤组织的诱导
选取75%酒精和0.1 g/L升汞消毒处理,将处理好的短叶对齿藓外植体接入到100 mL的培养瓶中,每个培养瓶中接入5个外植体,并且将0.5、1.0和1.5 mg/L 6-BA和IAA依次添加到6个培养瓶中,1个对照,该实验设置3个重复。光照培养箱(上海一恒科学有限公司)培养。
40 d后,挑选愈伤组织一样分别添加0.5 mg/L 6-BA和0.5 mg/L IAA的培养瓶(各1瓶)水平放倒,经过5 d后发现瓶内植株长势快速,在愈伤组织下方产生大量深绿色、致密、垫状的原丝体,原丝体增多,微小的配子体植株数量也很多,而呈直立放置的0.5 mg/L 6-BA和0.5 mg/L IAA培养瓶中愈伤长势较慢、明显稀疏。这体现了湿度条件对植物发育的影响(图1)。50 d后观察发现培养瓶中愈伤组织未继续增殖,并开始出现很多褐色的原丝体,这可能是老化的表现,也可能是次生代谢物造成的影响。60 d后将有褐色原丝体的短叶对齿藓无菌苗和愈伤组织重新进行继代培养10瓶,并在培养基中加入了1%的活性炭,以防止褐变、老化现象的发生。经过12 d的培养发现,除了1瓶被污染外(整瓶颜色呈紫红色,属于一种细菌污染),其余9瓶长得非常好,污染率仅1%,而且之前产生的次生代谢物明显被活性炭所吸收,有更多的原丝体和配子体出现在培养瓶中。培养得到的短叶对齿藓植株非常健壮,长出来的小植株苗通过显微镜观察测量了它们的高度:最短的植株是0.11 mm,最长的是1.2 mm。
2.2愈伤组织的分化
再一次选取IAA和6-BA这2种植物激素,将愈伤组织诱导中生长状况良好,大小一致的愈伤组织转接到添加不同浓度(0.1 mg/L、0.5 mg/L、1.0 mg/L)生长激素的Knop分化培养基上,每个培养皿中接3块愈伤组织。
CK是对照组,不添加任何激素;1号培养基中加入0.5 mg/L IAA;2号培养基中加入0.1 mg/L 6-BA;3号培养基中加入1.0 mg/L 6-BA;4号培养基中加入0.5 mg/L 6-BA;5号培养基中加入1.0 mg/L IAA;6号培养基中加入0.1 mg/L IAA。
经过10 d后观察记录,结果显示:对照组CK中愈伤组织周围经过再分化都长出了嫩绿色的原丝体;1号中培养基颜色发黄,愈伤组织无分化;2号愈伤组织周围长出极少数的原丝体,但其上长出的配子体最多;3号培养基中出现少数的原丝体,配子体分化较多;4号培养基中只有2个愈伤组织周围长出一点原丝体,配子体居多;5号培养基中颜色发黄,
愈伤组织无分化;6号培养基中有2个长出了原丝体,统计结果见表1。只有添加了6-BA的2号、3号和4号的培养基中长出了配子体,表明6-BA可以促进愈伤组织分化形成配子体;而不添加任何激素的对照组中原丝体最多,生长最好;低浓度的IAA(0.1 mg/L)有助于愈伤组织分化形成原丝体。
对上述生长90 d后的原丝体和配子体再1次拍照记录,结果如图2。在3种浓度的IAA中,0.1mg/L IAA分化出的原丝体最长,直径最大(图2,A、G);而1.0 mg/L IAA中原丝体短而稠密,呈鲜绿色(图2,C);0.5 mg/L IAA原丝体相对较长,呈黄绿色(图2,B)。不同浓度的6-BA中,0.1 mg/L的6-BA和0.5 mg/L 6-BA中都有配子体(图2,D、E),但1.0 mg/L的6-BA中配子体很少,原丝体居多(图2,F)。
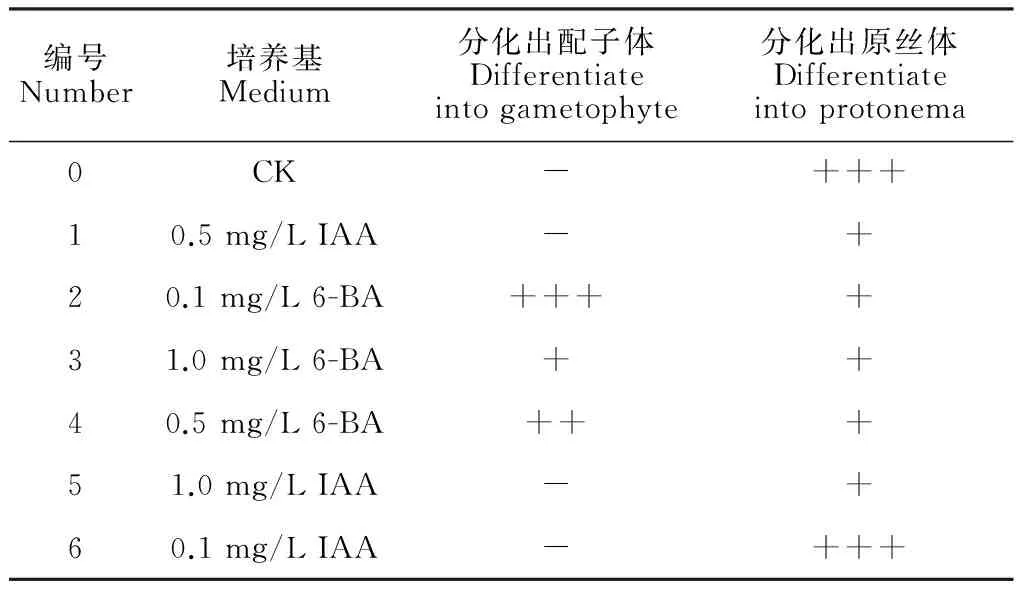
表1 激素对愈伤组织分化的影响Table 1 Effect of hormones on callus differentiation
注:+表示有;++表示较多;+++表示很多;-表示无
Note: +A few; ++ More; +++ The most; - None

A. 0.5 mg/L IAA诱导形成的愈伤;B. 20倍解剖镜下拍摄的配子体;C. 0.5 mg/L 6-BA诱导形成的愈伤;D. 30倍解剖镜下拍摄的愈伤图1 40 d后的愈伤组织A. Cullus induced by 0.5 mg/L IAA; B. Gametophyte filmed in 20 times anatormical lens; C. Cullus induced by 0.5 mg/L 6-BA; D. Cullus filmed in 30 times anatormical lensFig.1 The callus after 40 days
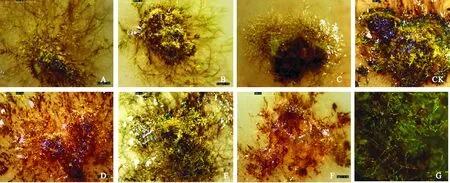
A~C依次为0.1、0.5、 1.0 mg/L IAA分化出的原丝体;D~F依次为0.1、0.5、1.0 mg/L 6-BA分化出的配子体及原丝体;CK为对照,G为35倍解剖镜下拍摄的0.1 mg/L IAA分化出的原丝体图2 90 d后生长的配子体和原丝体A-C. Protonemata differentiated by 0.1, 0.5 and 1.0 mg/L IAA, respectively; D-F. Gametophyte differentiated by 0.1, 0.5 and 1.0 mg/L 6-BA, respectively; CK. Contrast; G. Filmed in 35 times anatormical lens of the protonemata differentiated by 0.1 mg/L IAAFig. 2 Growth of gametophyte and protonemata after 90 days
3 讨 论
本研究通过组织培养技术成功建立了短叶对齿藓配子体的再生体系,获得了大量纯净、均一化的组培植物材料,以供后续试验之用。主要研究结论如下:
(1)短叶对齿藓配子体最佳消毒方法为:用蒸馏水浸泡0.5 h左右,将其在流水下冲洗20~30 min,再用超声波洗涤3次,然后用浓度为75%酒精浸泡30 s和0.1 g/L升汞消毒90~120 s,无菌水漂洗至少3次。
(2)短叶对齿藓愈伤组织诱导中,培养基中添加不同激素及其不同浓度有不同的影响。1.0 mg/L 6-BA容易诱导外植体形成原丝体;0.5 mg/L 6-BA和IAA单独添加时都可以诱导短叶对齿藓形成愈伤。湿度增加会促进原丝体生长,水平放倒的培养瓶中原丝体数量较直立放置的明显增多;添加1%活性炭可以吸收次生代谢物,有效防止褐化现象产生。
(3)短叶对齿藓愈伤组织分化中,初期(10 d)不添加任何生长激素的愈伤组织分化形成原丝体最好;到90 d时低浓度的IAA(0.1 mg/L)促进原丝体生长也较好;而较低浓度的6-BA(0.1和0.5 mg/L)促进愈伤组织分化形成配子体数量较多。
本试验得出的短叶对齿藓最佳扩繁条件是:使用Knop培养基,蔗糖浓度为1.5%,IAA和6-BA都能诱导出愈伤组织,但添加低浓度的6-BA和IAA(0.5 mg/L)形成的愈伤组织较好。陈静文[7]认为糖浓度为2%,同时添加0.05 mg/L 6-BA愈伤组织最好;而添加IAA可长出更多的原丝体。同时她认为培养基中稍加一定量酒石酸铵,pH 6.5,糖浓度为0.5%时,培养在(25±1)℃、3 500 Lx的光照下,小立碗藓的配子体生长最好。高永强等[6]用不同的植物激素诱导牛角藓的愈伤组织,认为GA3和2,4-D效果最好;IAA和GA3对苔藓的原丝体和蒴柄的生长有促进效果。李艳红等[9]培养立碗藓原丝体时,发现0.5 mg/L 2,4-D和6-BA能长出愈伤。而对于白云鄂博矿区的短叶对齿藓,IAA和6-BA都能诱导出愈伤组织,并且浓度不同的6-BA对短叶对齿藓愈伤诱导影响很大。而且关于原丝体变成褐色这种现象,潘一廷等[10]报道认为可能是细胞内多酚氧化物增加、积累从而被多酚酶氧化后造成的;魏华等[11]报道从苔藓植物中分离到的次生代谢物质有生物碱、黄酮、萜类、木脂体和酚类化合物等。就次生物质来讲,凡是被子植物中有的苔藓植物中都有。然而加入活性炭后可将苔藓植物分泌的次生代谢物吸收。曾有人报道6-BA浓度为1.5 mg/L时原丝体分化出芽体;然而白云鄂博矿区的短叶对齿藓愈伤组织在0.1 mg/L 6-BA中分化出的芽体最多,而不添加任何激素的培养基中愈伤组织分化出的原丝体团数最大。
[1]白学良. 内蒙古苔藓植物志 [M]. 呼和浩特: 内蒙古大学出版社, 1997: 191-199.
[2]张桐瑞. 蒙古高原对齿藓属对齿藓组的分类学研究[D]. 呼和浩特: 内蒙古大学, 2016.
[3]王爱霞, 方炎明. 苔藓监测空气重金属污染技术的研究进展[J]. 西南林业大学学报, 2011, 31(5) : 87-94.
WANG A X, FANG Y M. Research advances in bryophyte monitoring technology to heavy metal pollution in the atmosphere [J].JournalofSouthwestForestryUniversity, 2011, 31(5): 87-94.
[4]吴玉环, 程国栋, 高谦. 苔藓植物的生态功能及在植被恢复与重建中的作用[J]. 中国沙漠, 2002, 23(3): 215-220.
WU Y H, CHENG G D, GAO Q. Bryophyte’s ecology functions and its significances in revegetation [J].JournalofDesertResearch, 2002, 23(3): 215-220.
[5]孙玉斌, 于欣宇, 宋士伟, 等. 鼠尾藓和砂藓对重金属富集能力的研究[J]. 黑龙江畜牧兽医, 2015,(17):10-12.
SUN Y B, YU X Y, SONG S W,etal. Enrichment ability ofMyurocladamaximowicziiandRacomitriumcanescensfor heavy metals [J].HeilongjiangAnimalScienceandVeterinaryMedicine, 2015,(17):10-12.
[6]高永超, 薛红, 沙伟, 等. 大量元素对牛角藓愈伤组织悬浮细胞的生理效应[J]. 植物生理学通讯, 2003, 39(6): 595-598.
GAO Y C, XUE H, SHA W,etal. Physiological effect of major elements on the suspended cells ofcratoneuronfilicinum[J].PlantsPhysiologyComunications, 2003, 39(6): 595-598.
[7]陈静文, 曹同, 施定基. 植物激素对小立碗藓愈伤组织诱导及分化影响[J]. 上海师范大学学报(自然科学版), 2006, 35(4): 70-74.
CHEN J W, CAO T, SHI D J. The effect of plant hormones to callus inducement and differentiation ofPhyscomitrellapatens(Hedw) B. S. G. [J].JournalofShanghaiNormalUniversity(Nature Sciences), 2006, 35(4): 70-74.
[8]赵小丹. 短叶对齿藓组织培养及其复合群的分类学研究[D]. 呼和浩特: 内蒙古大学, 2015.
[9]李艳红, 宋秀珍, 张便勤. 不同培养基及酶对立碗藓原丝体的作用研究[J]. 植物研究, 2004, 24(2): 192-196.
LI Y H, SONG X Z, ZHANG B Q. Effects of different media and enzymes on protonema ofPhyscomitriumsphaeri[J].BulletinofBotantcalResearch, 2004, 24(2): 192-196.
[10]潘一廷, 施定基, 杨明丽, 等. 小立碗藓愈伤组织诱导和培养[J]. 植物生理学通讯, 2005, 41(3): 293-296.
PAN Y T, SHI D J, YANG M L,etal. Callus induction and culture ofPhyscomitrellapatens[J].PlantPhysiologyComunications, 2005, 41(3): 293-296.
[11]魏华, 王亚琴, 李菁. 尖叶拟船叶藓原丝体沉水培养的发育特征[J]. 吉首大学学报(自然科学版), 2006, 27(6): 95-98.
WEI H, WANG Y Q, LI J. Characteristics of protonema of development of submerged culture inDolichomitriopsisdiversiformis[J].JournalofJishouUniversity(Nature Science edition), 2006, 27(6): 95-98.
(编辑:宋亚珍)
Tissue Culture ofDidymodontectorum
GAO Yeqing, REN Dongmei*, ZHAO Xiaodan, ZHAO Dongping, SUI Yanhong
(College of Life Science, Inner Mongolia University, Hohhot 010021, China)
WithDidymodontectorumcollected from the main mine of Baiyun obo as experimental material, we studied the effect of different disinfectants and different concentrations of plant hormone 6-BA and IAA, respectively on callus induction and differentiation. It showed that the best disinfectant forD.tectorumgametophyte is 75% alcohol immersion for 30 s and 0.1 g/L mercuric chloride for 90 s. Using Knop medium to culture the upper stem-leaf segments ofD.tectorum, and a low concentration of 6-BA (0.1 mg/L) promotes callus differentiation and gametophyte formation. However, high concentration of 6-BA (1.0 mg/L) restrains the callus formation. IAA helps protonemata germinate.
Didymodontectorum; tissue culture; plant hormone
1000-4025(2016)09-1900-05doi:10.7606/j.issn.1000-4025.2016.09.1900
2016-04-05;修改稿收到日期:2016-08-18
国家自然科学基金(31360142, 31260046);内蒙古大学高层次人才引进项目
高叶青(1991-),女,在读硕士研究生,主要从事苔藓植物组织培养研究。E-mail:1562405242@qq.com
任冬梅,副教授,硕士生导师,主要从事苔藓植物分类及区系生态研究。E-mail: rendongmei1970@aliyun.com
Q813.1; Q949.35
A

