南京地区慢性阻塞性肺疾病患者的阻塞性睡眠呼吸暂停低通气综合征流行状况
王文晶 谷 伟 张希龙
·论著·
南京地区慢性阻塞性肺疾病患者的阻塞性睡眠呼吸暂停低通气综合征流行状况
王文晶1谷伟1张希龙2
目的探讨南京地区慢性阻塞性肺疾病(COPD)患者阻塞性睡眠呼吸暂停低通气综合征(OSAHS)的发状况及其相关特征。方法对受试人群进行病情评估,内容包括:BMI、6 min步行试验测试、慢性阻塞性肺病评估测试(CAT)、Epworth嗜睡量表(ESS)测试、肺功能检测、多导睡眠监测(PSG)。结果共计纳入患者40例,其中患有重叠综合征(OS)的患者为21例(52.5%),仅患COPD而不存在OSAHS的为19例(47.5%)。两组间BMI、颈围有显著性差异。肺功能和6 min步行试验两组间均无显著性差异。多导睡眠监测结果提示两组间存在显著性差异,OS组呼吸暂停低通气指数(AHI)明显较高,为22.2±19.3次/h,而COPD非OSAHS组基本正常。CAT评分和ESS测试显示两组间有显著性差异。结论C级至D级COPD患者具有较高的OSAHS发病率,OS患者较单纯COPD患者生活质量和睡眠质量更差。
肺疾病,慢性阻塞性;低通气综合征,睡眠呼吸暂停,阻塞性;重叠综合征;呼吸暂停低通气指数
慢性阻塞性肺疾病(chronic obstructive lung disease, COPD)是全球第四位致死性疾病,每年有约270万人死于此病,大于40岁的成人中COPD的全球发病率在10%以上[1]。一项全球多中心的调查研究显示,COPD在男性中的发病率为15.8%,女性为5.5%[2]。心血管事件是COPD患者一个公认的死亡原因,其并发症还包括中风、急性冠脉综合征、肺栓塞以及心律失常等。究其主要原因,是对COPD的认识不足或诊断缺失。
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea/hypopnea syndrome, OSAHS)是一种睡眠呼吸障碍性疾病,由于睡眠过程中上气道部分或完全闭塞导致低氧血症,伴或者不伴有高碳酸血症,以及睡眠觉醒[3-4]。Peppard等[5]发现临床典型的OSAHS发病率近几十年来有逐渐上升趋势,有的地区已经高达6%~13%。同COPD相似,OSAHS的发病率也会随着年龄的增长而升高[6]。
由于COPD和OSAHS的症状出现缓慢,不易察觉,其诊断很容易被忽视或延迟。但是,与OSAHS相关的心血管疾病却很容易被发现,甚至会发生在没有白天嗜睡症状的患者中[7]。近年来发现,OSAHS在COPD的患者中的发病率呈现逐年上升趋势,两者合并出现称之为重叠综合征(overlap Syndrome, OS)[8]。不同研究报道的OS发病率亦不相同。某些流行病学调查显示,COPD患者中OSAHS的发病率大约在10%~15%[9]。
临床同时患有COPD和OSAHS的病理生理学机制至今知之甚少,其对人体的影响亦不甚明了。近年来的研究显示,两种疾病同时出现导致了更高的死亡率;而且如果针对OSAHS不治疗,会增加COPD的急性加重风险[10]。与单独患其中一种疾病相比,患有OS的人群无论白天或夜间均存在更严重的低氧血症,夜间血氧饱和度越低的患者越容易出现肺动脉高压[11]。COPD合并OSAHS的病死率提高了7倍[12]。因此研究重叠综合征势在必行,有可能从中获得这类患者出现更高心血管事件发生率和死亡率的答案。
肺部康复评估治疗体系对于慢性肺部疾病患者的有效性已经被证实,它作为一项标准治疗,能够有效地控制和缓解临床症状、改善心肺功能,并能节省社会医疗资源、减少经济负担[13-15]。患者一旦出现相关的合并症就需要启动肺部康复评估治疗程序。
重叠综合征在高危人群中的发病率目前尚不明确。因此,我们设计了此项前瞻性研究,选择南京部分地区COPD患者,评估是否存在OSAHS并研究其相关特征。
资料与方法
一、研究对象和纳入标准
本研究选择2012年1月至2014年12月南京市第一医院呼吸科符合2011年慢性阻塞性肺病的全球创意(Globe initiative for chronic Obstructive Lung Disease, GOLD)分级的C级至D级的COPD患者,年龄大于40岁,有吸烟史(吸烟指数>10包·年)。OSAHS的诊断标准为2011年中华医学会所颁布的标准,即:每夜7 h睡眠过程中呼吸暂停及低通气反复发作30次以上,或呼吸暂停低通气指数(apnea hypopnea index, AHI)≥5次/h,呼吸暂停事件以阻塞性为主,伴打鼾、睡眠呼吸暂停、白天嗜睡等症状。其中睡眠呼吸暂停是指:睡眠过程中口鼻呼吸气流消失或明显减弱(较基线幅度下降≥90%),持续时间≥10 s。低通气是指:睡眠过程中口鼻气流较基线水平降低≥30%并伴血氧饱和度下降≥4%,持续时间≥10 s;或者是口鼻气流较基线水平降低≥50%并伴血氧饱和度下降≥3%,持续时间≥10 s。对于睡眠过程中需要吸氧的患者,纳入标准排除了血氧饱和度的下降。
二、研究方法
受试人群签署知情同意书,继而进行病情评估,内容包括:BMI(Body Mass Index)、6 min步行试验测试、慢性阻塞性肺病评估测试(COPD Assessment Test, CAT)、Epworth嗜睡量表测试(Epworth Sleepiness Score, ESS)、肺功能检测、多导睡眠监测(Polysomnography, PSG)(Alice 5 PSG Recorder, Respironics Inc, US)。
三、 统计学方法
所有数据分析使用SPSS17.0软件,组间分析采用t检验。P≤0.05作为差异有统计学意义。
结 果
共纳入符合COPD诊断标准的患者47例,排除拒绝纳入者、PSG不配合以及脱落病例,最终有40例患者完成本项研究,包括23例男性患者(57.5%),17例女性患者(42.5%)。其中患有重叠综合征的患者21例(52.5%),仅患COPD而不存在OSAHS的患者19例(47.5%)。患者一般情况、肺功能、多导睡眠监测、6 min步行试验、CAT评分、Epworth嗜睡量表测试等结果见表1。受试者的平均年龄在66.1±5.5岁。两组之间年龄无显著性差异。但BMI指数两组间有显著性差异(P<0.01),颈围亦有显著性差异(P<0.05)。两组间吸烟指数没有显著性差异。肺功能两组间均无显著性差异。多导睡眠监测结果提示两组间存在显著性差异(P<0.001),OS组AHI明显较高,为22.2±19.3次/h,而COPD非OSAHS组基本正常。6 min步行试验无显著性差异。CAT评分两组间存在显著性差异(P<0.05),OS组CAT评分相对较高,为15.8±3.8。ESS测试显示两组间有显著性差异(P<0.05)。
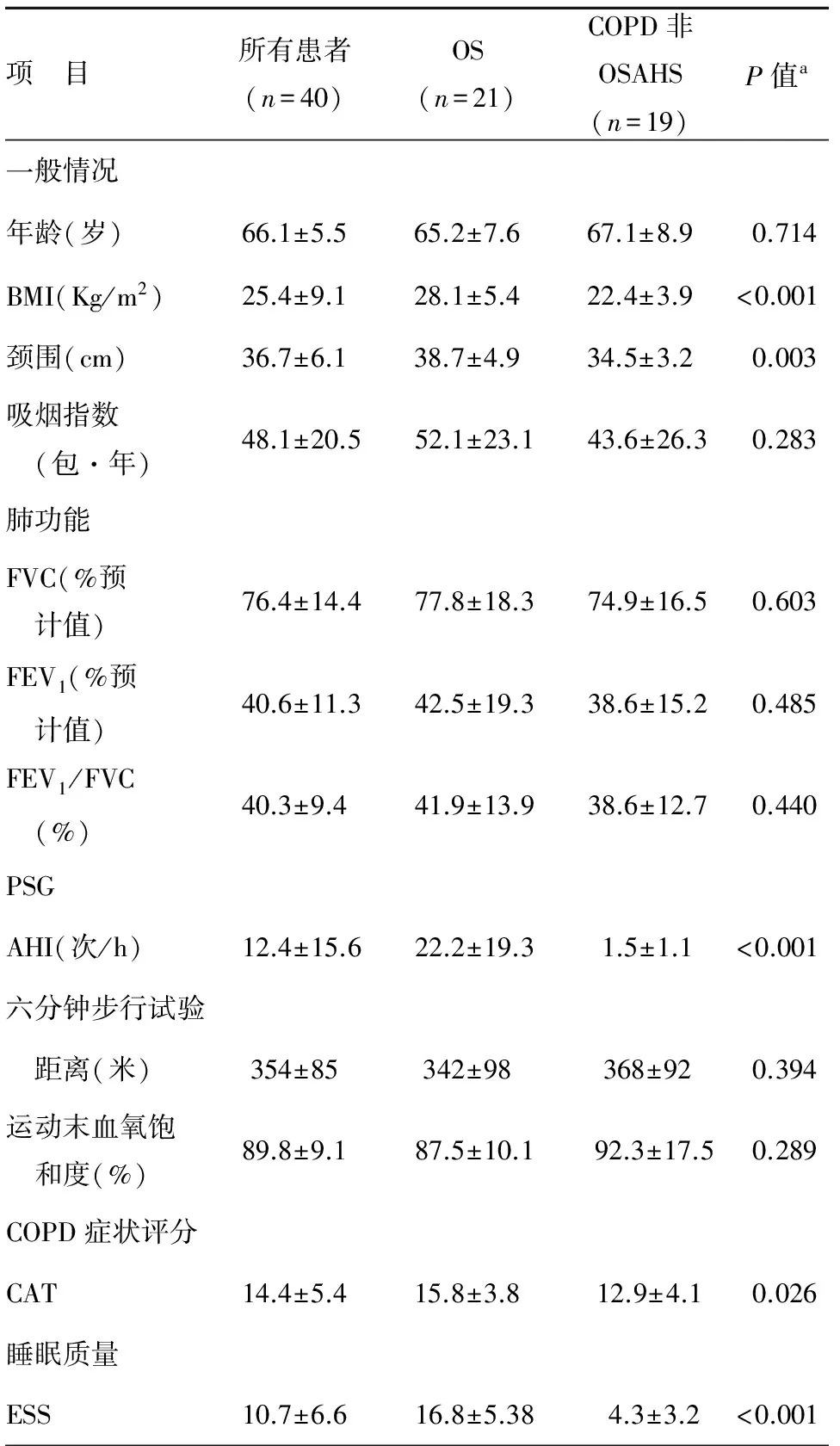
表1 患者一般情况及各项指标检测结果
注:a:OS组与COPD非OSAHS组的对比
讨 论
与既往研究相比,本次研究观察到在C级至D级的COPD患者罹患OSAHS的比例较A级、B级的COPD患者更高。Epworth嗜睡量表测试和PSG的结果显示,重叠综合征患者的睡眠质量较单纯COPD患者更差,且AHI更高。这些也许是导致部分COPD人群具有更高心血管事件发生率的重要原因,而且这类人群的生活质量可能降低。本研究发现的OS患者大多数既往未曾被诊断为OSAHS,提示临床中容易忽视此诊断而造成患者受到更进一步的病理损害。
本研究结果显示,OS患者和单纯COPD患者相比并没有更严重的肺功能、运动耐力或血氧饱和度的下降,这可能与我们选择的调查人群有关。本研究纳入的COPD人群为C级至D级的患者,如果能纳入更多的A级至B级的患者,可能OS组和单纯COPD组会出现显著性差异。这可能存在某种程度上的选择偏倚[16]。但是,由此次CAT评估结果来看,OS患者生活质量较单纯COPD患者更差。因而,尽管肺功能、运动耐力等客观检测结果未见差异,但本研究依然具有一定的意义。
OSAHS本身是造成睡眠质量下降的原因,其他慢性疾病也可能导致睡眠障碍,但COPD合并OSAHS的患者存在更严重的睡眠障碍,这可能与COPD本身有关。与单纯OSAHS相比,COPD合并OSAHS患者存在更严重的低氧血症,甚至有时伴有更严重的高碳酸血症[17]。究其原因,睡眠过程中化学感受器的敏感性下降,通气受限,小气道阻力增高,呼吸肌功能障碍,包括咳嗽、咳痰等症状都会加重缺氧和二氧化碳潴留,构成协同损伤效应[18-19]。这些原因最终造成的患者生活质量的下降。除了以上病理生理机制,可能还隐含着很多其他导致COPD和OSAHS互相加重的原因。例如呼气末肺容积对咽部气道开放影响很大,因此拥有较高肺通气量的COPD患者能够减轻上气道的塌陷[20]。相反,肺容积减小也会影响上气道的通气功能,肺的顺应性是至关重要的因素,肺气肿患者的肺间质出现病变,肺的扩张受限,从而导致上气道下方的牵引力减弱,最终影响了上气道的稳定性。因此患有严重肺气肿的人群睡眠质量也较差。Krachman等[19]研究了25例存在COPD和肺气肿的患者,发现其睡眠质量都很差,夜间血氧饱和度下降现象非常普遍。
本研究与以往的研究相符,BMI与OSAHS也存在一定的弱相关性[21]。我们此次研究中,BMI在正常范围内的患者也存在OSAHS。虽然COPD终末期患者多伴有恶液质,这一因素虽然可能成为避免发生OSAHS的有利因素,但是这一类患者因为戒烟、长期使用糖皮质激素等因素可能再次使体重增加,从而诱发OSAHS。因此,介于疾病不同发展阶段的影响以及药物的使用等多种因素存在,BMI也就具有不确定性,不适宜作为疾病的预测因子。
本次研究显示OS组和单纯COPD组6 min步行试验时血氧饱和度无显著性差异,与既往一些研究报道不完全一致,可能与我们所选择的入组人群有关。因为部分OS患者缺氧较为明显,入组前患者已长期吸氧,可能对血氧饱和度的判断有所影响。虽然吸氧在一定程度上影响了最终研究结果,但对于严重气流受限的患者单纯氧疗的作用还是不大,这类患者甚至会出现更严重的并发症[22]。值得注意的是,此次研究虽然很多患者最终诊断患有OSAHS,但初始问诊其主诉夜间呼吸暂停、白天嗜睡等症状并不明确,这可能与被其他更严重的病情症状所掩盖有关。
此项研究提示,C级至D级COPD患者具有较高的OSAHS发病率,生活质量和睡眠质量更差。长期氧疗、无创通气治疗等可能起到保护性作用,为改善这类患者的生活质量,延缓并发症的出现,尚需在今后的工作中做出更详尽的监测、评估和研究。
1任成山, 钱桂生. 慢性阻塞性肺疾病发病机制研究现状与展望[J/CD]. 中华肺部疾病杂志: 电子版, 2009, 2(2): 104-115.
in reported and objectively measured sleep in COPD[J]. Int J Chron Obstruct Pulmon Dis, 2016, 11: 151-160.
3李涛平. 阻塞性睡眠呼吸暂停低通气综合征与多器官疾病的关系[J/CD]. 中华肺部疾病杂志:电子版,2011,4(4):259-264.
4曹洁, 王彦, 陈宝元. 睡眠呼吸暂停综合征的系统性损害及应对策略[J/CD]. 中华肺部疾病杂志: 电子版, 2014, 7(6): 611-613.
5Peppard PE, Young T, Barnet JH, et al. Increased prevalence of sleep-disordered breathing in adults[J]. Am J Epidemiol, 2013, 177(9): 1006-1014.
6Kleisiaris CF, Kritsotakis EI, Daniil Z, et al. Assessing the risk of obstructive sleep apnoea-hypopnoea syndrome in elderly home care patients with chronic multimorbidity: a cross-sectional screening study[J]. Springerplus, 2016, 5: 34.
7Kent BD, Garvey JF, Ryan S, et al. Severity of obstructive sleep apnoea predicts coronary artery plaque burden: a coronary computed tomographic angiography study[J]. Eur Respir J, 2013, 42(5):1263-1270.
8Khatri SB, Ioachimescu OC. The intersection of obstructive lung disease and sleep apnea[J]. Cleve Clin J Med, 2016, 83(2): 127-140.
9Konikkara J, Tavella R, Willes L, et al. Early recognition of obstructive sleep apnea in patients hospitalized with COPD exacerbation is associated with reduced readmission[J]. Hosp Pract (1995), 2016, 44(1): 41-47.
10Wang Y, Hu K, Liu K, et al. Obstructive sleep apnea exacerbates airway inflammation in patients with chronic obstructive pulmonary disease[J]. Sleep Med, 2015,16(9): 1123-1130.
11Gothi D, Gupta SS, Kumar N, et al. Impact of overlap syndrome on severity of acute exacerbation of chronic obstructive pulmonary disease[J]. Lung India, 2015, 32(6): 578-583.
12Molnar MZ, Mucsi I, Novak M, et al. Association of incident obstructive sleep apnoea with outcomes in a large cohort of US veterans[J].Thorax, 2015, 70(9): 888-895.
13Mota S, Guell R, Barreiro E, et al. Clinical outcomes of expiratory muscle training in severe COPD patients[J]. Respir Med, 2007, 101(3): 516-524.
14Mota S, Guell R, Barreiro E, et al. Relationship between expiratory muscle dysfunction and dynamic hyperinflation in advanced chronic obstructive pulmonary disease[J]. Arch Bronconeumol, 2009, 45(10): 487-495.
15Ries AL, Bauldoff GS, Carlin BW, et al. Pulmonary Rehabilitation: Joint ACCP/AACVPR Evidence-Based Clinical Practice Guidelines[J]. Chest, 2007, 131(5 Suppl): 4s-42s.
16Sharma B, Feinsilver S, Owens RL, et al. Obstructive airway disease and obstructive sleep apnea: effect of pulmonary function[J]. Lung, 2011, 189(1): 37-41.
17Collop N. Sleep and sleep disorders in chronic obstructive pulmonary disease[J]. Respiration, 2010, 80(1): 78-86.
18Kittivoravitkul P, Kaw R, Hatipoglu U, et al. Determinants of Wake Pco2 and Increases in Wake Pco2 over Time in Patients with Obstructive Sleep Apnea[J]. Ann Am Thorac Soc, 2016, 13(2): 259-264.
19Krachman SL, Chatila W, Martin UJ, et al. Physiologic correlates of sleep quality in severe emphysema[J]. COPD, 2011, 8(3): 182-188.
20Squier SB, Patil SP, Schneider H, et al. Effect of end-expiratory lung volume on upper airway collapsibility in sleeping men and women[J]. J Appl Physiol (1985), 2010, 109(4): 977-985.
21Peppard PE, Young T, Palta M, et al. Longitudinal study of moderate weight change and sleep-disordered breathing[J]. JAMA, 2000, 284(23): 3015-3021.
22Wellman A, Malhotra A, Jordan AS, et al. Effect of oxygen in obstructive sleep apnea: role of loop gain[J]. Respir Physiol Neurobiol, 2008, 162(2): 144-151.
(本文编辑:王亚南)
王文晶,谷伟,张希龙. 南京地区COPD患者的OSAHS流行状况[J/CD]. 中华肺部疾病杂志: 电子版, 2016, 9(2): 171-174.
Prevalence of obstructive sleep apnea-hypopnea syndrome in patients with chronic obstructive pulmonary disease in Nanjing
WangWenjing1,GuWei1,ZhangXilong2.
1DepartmentofRespirology,NanjingHospitalaffiliatedtoNanjingMedicalUniversity(NanjingFirstHospital),Nanjing210006,China;2DepartmentofRespiratoryMedicine,FirstAffiliatedHospitalofNanjingMedicalUniversity,Nanjing210029,ChinaCorrespondingauthor:ZhangXilong,Email:athena_wang1980@126.com
ObjectiveThe purpose of this study was to investigate prevalence of obstructive sleep apnea-hypopnea syndrome (OSAHS) in patients with moderate to severe chronic obstructive pulmonary disease(COPD) to test the hypothesis that COPD is associated with an increased prevalence of OSAHS. Methods Patients with moderate to severe COPD of Nanjing were enrolled prospectively. Exercise tolerance, questionnaires related to symptoms, sleep, and quality of life, and polysomnography were obtained. Results Forty patients had full polysomnography suitable for analysis. OSAHS was present in 21 subjects (52.5 %). The differences of BMI, neck circumference between overlap syndrome (OS) group and COPD group were significant. Assessments of lung function and exercise tolerance between two groups were the same. Results of PSG showed significantly higher apnea hypopnea index (AHI)(22.2±19.3 events/h) of OS group than that of COPD group, which was almost normal. We found a marked difference ofCAT and ESS results between the two groups. ConclusionObstructive sleep apnea is highly prevalent in moderate to severe COPD patients. Quality of life and sleep is also poor among this selected group.
Chronic obstructive pulmonary disease;Obstructive sleep apnea/hypopnea syndrome;Overlap Syndrome;Apnea hypopnea index
10.3877/cma.j.issn.1674-6902.2016.02.012
210006 南京医科大学附属南京医院呼吸科1
210029 南京医科大学第一附属医院呼吸科2
王文晶,Email: athena_wang1980@126.com
R563
A
2016-02-15)

