2,6-二甲基-3,5-吡啶二甲酰腙衍生物的合成及与DNA的作用
李志芬,乔 俊,陆 均,王君玲,许 琳*
(1.山西大同大学化学与环境工程学院,山西大同037009;2.上海衡欣检测技术有限公司,上海201821)
2,6-二甲基-3,5-吡啶二甲酰腙衍生物的合成及与DNA的作用
李志芬1,乔 俊1,陆 均2,王君玲1,许 琳1*
(1.山西大同大学化学与环境工程学院,山西大同037009;2.上海衡欣检测技术有限公司,上海201821)
本文以2,6-二甲基-1,4-二氢吡啶-3,5-二甲酸二乙酯为原料,通过氧化、肼解得到2,6-二甲基-3,5-吡啶二甲酰肼,该甲酰肼和芳香醛反应合成了4个2,6-二甲基-3,5-吡啶二甲酰腙衍生物,合成路线设计合理,反应条件温和,产率高,目标化合物的结构用氢谱和质谱进行了表征,通过EB竞争实验测定了它们与DNA的结合常数约为104左右,表明该类酰腙化合物可以与DNA发生作用。
吡啶;酰腙;人工核酸酶;DNA
近十几年来,人工核酸酶的研究取得了很大进展,这些成果将有助于细胞学、分子生物学的发展,并有可能应用于基因治疗中。因为天然核酸酶的活性中心有一个或多个金属离子参与反应,所以以金属配合物作为人工核酸酶的研究受到了广泛的关注,其中就包括许多酰腙金属配合物[1-2]。但是金属及金属配合物类核酸酶涉及到的多数为有氧化或还原活性的金属离子,很可能发生一些比较复杂的化学反应,比如金属离子从配合物中解离出来,或发生一些难以控制的氧化还原反应,这样就使得金属类人工核酸酶潜在的应用价值受到了限制[3-4]。非金属人工核酸酶相对更安全。近年来,科研人员逐渐发现了几类非金属人工核酸酶,包括短肽、胍类衍生物、大环多胺衍生物、环糊精衍生物、以及酰腙衍生物[5-8]。人工核酸酶对DNA的作用可以分为2步,第1步是与DNA结合,第2步是催化断裂DNA。因此判断一种化合物是否为非金属人工核酸酶的首要条件是其可以与DNA结合,本文通过文献调研设计合成了4个酰腙化合物,并测定了它们在没有金属参与的情况下与DNA的结合能力。
1 实验部分
1.1 仪器与试剂
主要仪器:瓦里安INOVA-400MHZ核磁共振仪,安捷伦液质仪,瓦里安Cary Eclipse荧光分光光度计。试剂:乙酰乙酸乙酯,磷酸氢二铵,乌洛托品,过硫酸铵,水合肼,4-N,N-二甲氨基苯甲醛,2-羟基-3-甲氧基苯甲醛,4-(2-吡啶基)-苯甲醛,4-吡啶甲醛。小牛胸胁DNA,溴化乙锭(EB),二甲基亚砜(DMSO),乙醇,丙酮,均为市售,分析纯。
1.2 合成实验
根据文献[9]合成2,6-二甲基-1,4-二氢吡啶-3,5-二甲酸二乙酯(化合物1),化合物1用过硫酸铵氧化得到2,6-二甲基-3,5-吡啶二甲酸乙酯(化合物2),化合物2通过与水合肼反应制备2,6-二甲基-3,5-吡啶二甲酰肼(化合物3),化合物3通过与醛反应合成目标产物2,6-二甲基-3,5-吡啶二甲酰腙(化合物4),共合成了4个不同结构的酰腙化合物,其中4a-c是未见报道的新化合物。具体合成路线见图1。
1.2.1 2,6-二甲基-3,5-吡啶二甲酸乙酯的合成(化合物2)
250 mL 三口瓶中加入24.80 g(97.93 mmol)2,6-二甲基-1,4-二氢吡啶-3,5-二甲酸二乙酯,丙酮30 mL,冷却至0 ℃。44.70 g(195.86 mmol)过硫酸铵溶解于120 mL水中,将过硫酸铵水溶液缓慢滴加到上述丙酮溶液中,室温反应3h后,减压蒸出部分溶剂直到有白色固体析出,过滤得到2,6-二甲基-3,5-吡啶二甲酸乙酯15.50 g,产率63%。
1.2.2 2,6-二甲基-3,5-吡啶二甲酰肼的合成(化合物3)
250 mL 三口瓶中加入14 g(55.72 mmol)2,6-二甲基-3,5-吡啶二甲酸乙酯,100 mL乙醇,26.50 mL(445.80 mmol)85%水合肼,加热回流6h后,减压蒸馏除去乙醇得到粗品,用无水乙醇多次洗涤,干燥后得到白色粉末8.83 g(化合物3),产率71%。

图1 目标化合物合成路线
1.2.3 2,6-二甲基-3,5-吡啶二甲酰腙(4a-d)
100 mL反应瓶中加入5 mL 2,6-二甲基-3,5-吡啶二甲酰肼(3.98 mmol)水溶液,然后加入15 mL芳香醛(7.96 mmol)的乙醇溶液,滴入5滴冰醋酸,加热回流3h后,冷却,抽滤,用水和乙醇分别洗涤三次,得到酰腙化合物。
4a白色固体,产率93%,1H NMR(400 MHz,DMSO-d6)δ 12..20(s,2H),8.68(d,J=4.6 Hz,3H),8.58(d,J=4.6 Hz,1H),8.43(d,J=4.1 Hz,1H),8.30(d,J=6.3 Hz,1H),8.09(d,J=10.6 Hz,1H),7.79-7.62(m,3H),7.38 ~ 7.34(m,1H),2.63,2.48(s,6H)。ESI-MS:m∕z=402.5([M+H]+)。
4b白色固体,产率74%,1H NMR(400 MHz,DMSO-d6)δ 12.12 ~ 12.01(m,2H),8.76 ~ 8.63(m,2H),8.38(d,J=5.3 Hz,1H),8.28 ~ 7.82(m,12H),7.73(s,1H),7.57(t,J=9.4 Hz,1H),7.38(dt,J=16.5,8.4 Hz,2H),2.65,2.50(s,6H)。ESI-MS:m∕z=554([M+H]+)
4c淡黄色固体,产率97%,1H NMR(400 MHz,DMSO-d6)δ 12.08(br,s,2H),10.70(br,s,2H),8.60 ~ 8.40(m,2H),8.11(m,1H),7.24 ~ 7.12(m,2H),7.10 ~ 7.01(m,2H),6.93 ~ 6.82(m,2H),3.84,3.78(s,6H),2.684,2.47(s,6H)。ESI-MS:m∕z=492.8([M+H]+)。
4d 白色粉末,产率84%,1H NMR(400 MHz,DMSO-d6)δ 11.75 ~ 11.57(m,2H),8.16(d,J=6.0 Hz,1H),7.96(d,J=12.8 Hz,1H),7.78(s,1H),7.53(t,J=7.7 Hz,3H),7.25(dd,J=11.7,8.9 Hz,1H),6.76(d,J=8.9 Hz,3H),6.67,6.49(d,J=8.8 Hz,1H),2.99,2.92,2.83(s,12H),2.60,2.47(s,6H)。ESI-MS:m∕z=486.9([M+H]+)。
1.3 2,6-二甲基-3,5-吡啶二甲酰腙与DNA的作用
溴乙啶(EB)本身没有荧光,当加入DNA后,溴乙啶的平面大环结构插入到DNA的碱基对之间,产生强的荧光,当再加入一个可以和DNA能够发生作用的小分子化合物后,该荧光会逐渐减弱,甚至被完全萃灭。该试验常用来证明小分子化合物与DNA的相互作用,并计算两者的结合常数[10]。
实验步骤:①配制Tris缓冲溶液(5 mol∕L Tris-HCl∕50 mmol∕L NaCl,pH 7.4)。②将 CT-DNA 溶解在水中,用紫外-可见分光光度计测定CT-DNA的浓度,将其稀释到100 μmol∕L。③配制10 μmol∕L的EB水溶液。④将CT-DNA加入到EB溶液中,二者浓度比为(10∶1),用荧光分光光度计测定其荧光强度。⑤向上述溶液中加入一定浓度的小分子化合物(0.5~5 mmol),发现随着小分子化合物的加入。荧光强度逐步减弱,当低于50%时,结束实验。⑥根据公式KEB·[EB]=Kapp·[compound](KEB=1.0×107L∕mol),计算小分子化合物与DNA的结合常数。图2~5是酰腙4a~4d与DNA作用的光谱图,通过计算我们得到4种酰腙化合物与DNA的结合常数分别是:2.4×104L∕mol(4a),2.9×104L∕mol(4b),2.2×104L∕mol(4c),3.6×104L∕mol(4d)。
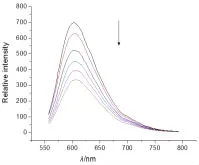
图2 EB/DNA荧光光谱随着化合物4a的加入的变化
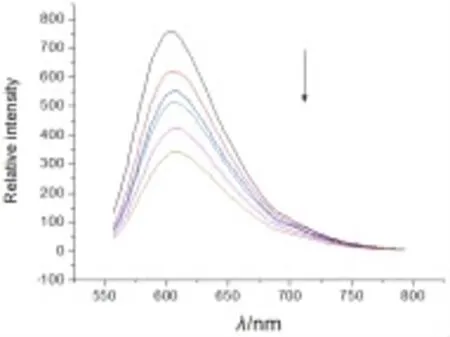
图3 EB/DNA荧光光谱随着化合物4b的加入的变化

图4 EB/DNA荧光光谱随着化合物4c的加入的变化
2 结果与讨论
2,6-二甲基-3,5-吡啶二甲酰腙衍生物的合成路线较短,反应条件温和,产率高,目标产物分别用核磁共振氢谱和质谱进行了表征,结构正确。在与DNA作用的研究中,我们发现随着酰腙化合物的加入,EB-DNA体系的荧光强度逐渐下降,说明酰腙化合物可以与DNA结合,当荧光强度下降到50%时,我们通过计算得到了这4种化合物与DNA的结合常数约为104L∕mol,其作用机理可能是通过平面芳环对DNA碱基对的插入来完成的。结果表明该类酰腙化合物可作为非金属人工核酸酶的重要研究对象。

图5 EB/DNA荧光光谱随着化合物4d的加入的变化
[1]Morrow J R,Amyes T L,Richard J P.Phosphate binding energy and catalysis by Small and large Molecules[J].Acc Chem Res,2008,41(4):539-548.
[2]Aiba Y,Sumaoka J,Komiyama M.Artificial DNA cutters for DNA manipulation and genome engineering[J].Chem Soc Rev,2011,40(12):5657-5668.
[3]Smith J,Ariga K,Anslyn E V.Enhanced imidazole-catalyzed RNA cleavage induced by a bis-alkylguanidinium receptor[J].J Am Chem Soc,1993,115(1):362-364.
[4]Boerner L J,Zaleski J M.Metal complex-DNA interactions:from transcription inhibition to photoactivated cleavage[J].Curr Opin Chem Biol,2005,9(2):135-144.
[5]Scheffer U,Strick A,Ludwig V,et al.Metal-Free Catalysts for the hydrolysis of RNA derived from guanidines,2-Aminopyridines,and 2-Aminobenzimid-azoles[J].J Am Chem Soc,2005,127(7):2211-2217.
[6]Sheng X,Lu X M,Zhang J J,et al.Synthesis and DNA cleavage activity of artificial receptor 1,4,7-triazacyclononane containing guanidinoethyl and hydroxyethyl side arms[J].J Org Chem,2007,72(5):1799-1802.
[7]Feng Y P,Cao S L,Xiao A S,et al.Studies on cleavage of DNA by N-phosphoryl branched peptides[J].Peptides,2006,27(6):1554-1560.
[8]Li Z F,Qiao J,Jia Z F,et al.Synthesis of the Pyridine Hydrazones as Metal-free Artificial Nucleases[J].Chem.Lett,2015,44(9):1243-1244.
[9]Cui L Y,Zhang M,Xu Z,et al.Synthesis of 2,6-dimethyl-3,5-pyridinediary-hydrazones in Water[J].Shanghai Univ(Nat Sci Ed.),2006,12(4):412-414.
[10]Dong X D,Wang X Y,Lin M X,et al.Promotive Effect of the Platinum Moiety on the DNA Cleavage Activity of Copper-Based Artificial Nucleases[J].Inorg Chem,2010,49(5):2541-2549.
Synthesis and DNA Action of 2,6-Dimethylpyridine-3,5-Dicarbohydrazide
LI Zhi-fen1,QIAO Jun1,LU Jun2,WANG Jun-ling1,XU Lin1*
(1.School of Chemical and Environmental Engineering,Shanxi Datong University,Datong Shanxi,037009;
2.Shanghai Hengxin Testing Technology Co.,Ltd,Shanghai,201821)
2,6-dimethyl-1,4-dihydropyridine-3,5-dicarboxylate was oxided,then reacted with hydrazine hydrate to produce 2,6-dimethylpyridine-3,5-dicarbohydrazide,which reacted with aromatic aldehyde to give four 2,6-Dimethylpyridine-3,5-Dicarbohydrazide with high rate,the reaction conditions was gentle and the title compounds were characterized with1H NMR and MASS.Results indicate that these compounds can bind to calf thymus DNA and the apparent binding constants were about 104.
pyridine;hydrazide;artificial nucleases;DNA
O625.43
A
1674-0874(2016)01-0038-03
2015-11-25
李志芬(1982-),女,山西大同人,博士,讲师,研究方向:人工核酸酶的设计与合成。∗许琳,女,教授,通信作者。
〔责任编辑 杨德兵〕

