元蘑液体菌种的优化培养
李延雷, 陈炜东, 滕素岩, 高书成
(1.黑龙江省东宁县暖泉子林场,黑龙江牡丹江 157200;2.黑龙江省东宁县林业局,黑龙江牡丹江 157200)
元蘑液体菌种的优化培养
李延雷1, 陈炜东2, 滕素岩2, 高书成1
(1.黑龙江省东宁县暖泉子林场,黑龙江牡丹江 157200;2.黑龙江省东宁县林业局,黑龙江牡丹江 157200)
[目的] 筛选元蘑液体菌种培养基配方,优化液体菌种培养工艺。[方法] 通过设置不同的液体培养基配方、不同的接种条件(包括不同菌龄、不同接种量)和不同的培养条件(包括不同转速、不同培养时间),以菌丝体生物量、菌丝球密度及菌丝球形态为指标进行元蘑液体菌种的筛选。[结果] 液体培养元蘑菌种的最佳培养基配方为:200 g马铃薯、150 g稻草粉、10 g玉米粉、20 g葡萄糖、3 g蛋白胨、2 g酵母膏、维生素B11片;最佳接种菌龄为5 d;最佳接种量为9%;最佳培养转速为160 r/min;最佳培养时间为7 d。[结论] 元蘑液体菌种经过优化培养,菌丝体生物量、菌丝球密度及菌丝球形态都有很大提高。
元蘑;液体菌种;优化培养
Optimized Culture of Liquid Strains ofHohenbueheliaserotina
元蘑[Hohenbueheliaserotina(Perts: Fr.)Sing.]隶属真菌界真菌门担子菌亚门层菌纲伞菌目侧耳科亚侧耳属[1],又称亚侧耳、黄蘑、冻蘑,分布于吉林、黑龙江、河北、山西、广西、陕西、四川、云南、西藏等地区,以东北林区最多。元蘑具有极高的营养价值,其质地柔嫩、味道鲜美、食味独特,含有蛋白质、脂肪、碳水化合物、维生素和矿质元素等多种营养成分[2-3],被誉为“山珍”“健康食品”“长寿食品”等,在古代《奉天通志》中就曾有记载,在民间有很长的食用历史。元蘑不仅具有很高的营养价值,而且是一种地方性草药,具有疏风活络、强筋壮骨的功效[4]。中医学认为,元蘑性甘、温、能祛风活络、清热燥湿,适用于癫痫、肝硬化腹水、风湿痛、肌肉痛和目赤肿痛等症状[4]。
目前,在元蘑的人工栽培过程中普遍采用试管母种制作原种、再扩大制作栽培种的固体菌种接种培育法,这种方法生产效率低,菌丝满袋周期长且菌龄不一致。液体发酵生产液体菌种则可以克服上述缺点,是一种适合规模化、工厂化的菌种制备技术。笔者对元蘑液体菌种制备过程中培养基配方进行了筛选,对其生产工艺进行了优化,以期为元蘑的大规模工厂化生产提供技术支撑。
1 材料与方法
1.1供试菌株供试菌株保存于东北林业大学森林保护学科实验室。
1.2试验方法
1.2.1培养基的制备。试验使用的分离培养基为PDA培养基,其制作方法如下:将马铃薯洗净去皮,用电子天平称取200 g,切成1 cm×1 cm×1 cm的小块,用纱布包好后放入1 000 mL水中煮沸,待马铃薯块软化后捞出。加入葡萄糖20 g和琼脂15 g,再次煮沸,加水补足1 000 mL,再用双层纱布过滤,pH自然,倒入锥形瓶内,将瓶口用封口膜封好后,用高压灭菌锅高压湿热灭菌,121 ℃下灭菌20 min。灭菌结束后,待培养基温度降低至不烫手但未凝固时,在超净工作台内,将经过灭菌的PDA培养基定量倒入直径8 cm的培养皿中,装液量为20 mL,凝固后备用。
1.2.2液体培养基的制备。试验共采用5种液体培养基,各培养基制作方法如下:①对照组(液体培养基CK)。马铃薯处理方法同PDA,加入20 g葡萄糖,再次煮沸,加水补足1 000 mL,再用双层纱布过滤,pH自然,倒入500 mL锥形瓶内,每个锥形瓶分装300 mL液体培养基,封口膜封口后,放入高压灭菌锅内,121 ℃下灭菌30 min以备用。②试验组 Ⅰ。马铃薯处理方法同PDA,与150 g稻草放入1 000 mL水中煮沸,约20 min后捞出,加入10 g玉米粉,煮约10 min,然后用双层纱布过滤,再加入20 g葡萄糖、3 g蛋白胨、2 g酵母膏和维生素B11片,待融化后进行分装和灭菌,分装与灭菌方法同对照组。③试验组 Ⅱ。马铃薯处理方法同PDA,与15 g麦麸放入1 000 mL水中煮沸,约20 min后捞出,用双层纱布过滤,再加入20 g葡萄糖、1 g磷酸二氢钾、500 mg硫酸镁,待融化后进行分装和灭菌,分装与灭菌方法同对照组。④试验组Ⅲ。称取10 g玉米粉和10 g豆饼粉加入1 000 mL水中煮沸,约10 min后捞出,4层纱布过滤,过滤后加入20 g蔗糖和2 g酵母膏继续煮,待融化后进行分装和灭菌,分装与灭菌方法同对照组。
1.2.3不同液体培养基配方对菌丝生长的影响。将PDA斜面培养基保存的元蘑菌种,接种于新的PDA平板培养基中心,待菌丝长满整个平板培养基后,用内径5 mm已灭菌的打孔器在距平板中心接种点4 cm处打孔,将菌龄一致的菌块转接到各组液体培养基中,每瓶液体培养基接入菌块10块,每个配方设置5个重复。将接入菌块的液体培养基锥形瓶放入恒温振荡器内,在25 ℃、130 r/min的条件下培养7 d,观察菌丝球形态,并检测菌丝球密度和生物量。
1.2.4元蘑液体培养条件的优化。
1.2.4.1种子培养。以筛选得到的最佳液体培养基,进行液体发酵培养。接种方法同“1.2.3”,接种后置于25 ℃恒温箱中静止培养1 d,然后放入25 ℃的恒温振荡器中以130 r/min的转速恒温培养一定天数,备用。
1.2.4.2接种菌龄对菌丝生长的影响。以10%的接种量,分别向装有300 mL最佳液体培养基的500 mL三角瓶中接入菌龄为3、5、7、9、11 d的种子,在25 ℃的恒温振荡器中以130 r/min转速避光培养,每个处理4次重复。培养5 d后,检测菌丝体生物量。
1.2.4.3接种量对菌丝生长的影响。采用最适接种菌龄的种子,分别按3%、6%、9%、12%、15%的接种量,接种于装有300 mL培养液的500 mL三角瓶中,在25 ℃的恒温振荡器中以130 r/min的转速避光培养,每个处理4次重复。培养5 d后,检测菌丝体生物量。
1.2.4.4摇床转速对菌丝生长的影响。采用最适菌龄和最适接种量,接种于装有300 mL培养液的500 mL三角瓶中,放入恒温振荡器中,分别以120、140、160、180、200 r/min的转速于25 ℃恒温下培养,每个处理4次重复。培养5 d后,检测菌丝体生物量。
1.2.4.5培养时间对菌丝生长的影响。采用最适菌龄和最适接种量,接种于装有300 mL培养液的500 mL三角瓶中,放入恒温振荡器中,在最佳转速下25 ℃恒温培养,每个处理4次重复。分别在培养3、5、7、9、11 d后,收集菌丝体,检测菌丝体生物量。
1.2.5各项菌种质量指标的检测。
1.2.5.1菌丝球密度的测定。将培养的液体菌种摇匀后,用移液器吸取1 mL的菌液,加入到9 mL的无菌水中稀释10倍,测定菌丝球个数。
1.2.5.2生物量的测定。取50 mL液体菌种,2 000 r/min离心20 min,去上清,菌丝体沉淀经蒸馏水充分洗涤后,用滤纸过滤,待滤液无色透明后收集菌丝体,80 ℃下真空干燥至恒重,使用电子天平准确称重。按照以下公式计算菌丝体生物量:
2 结果与分析
2.1不同液体培养基配方对菌丝生长的影响由表1可知,对照组和3个试验组液体培养基的菌丝生长情况表现出较大差异。试验组 Ⅰ 的菌丝生长情况最佳,菌丝体生物量和菌丝球密度分别达到5.3 g/L和159个/mL,试验组 Ⅲ 次之,试验组 Ⅱ 较差,对照组的菌丝生长情况最差。试验组培养基的营养比对照组更加丰富,因此试验组菌丝的生长情况好于对照组。从菌丝球性状来看,3个试验组之间没有明显差异,菌丝球均为米黄色,大小均匀且稠密,而对照组菌丝球较为稀疏。从菌丝萌发时间来看,试验组 Ⅰ 和Ⅲ只需1 d,试验组 Ⅱ 需要2 d,而对照组则需要3 d才能萌发,这大大延缓了菌丝体生长对数期的到来。由此可见,试验组 Ⅰ 液体培养基配方更适合用于液体培养元蘑菌丝体。

表1 液体培养基配方对菌丝生长的影响
2.2不同接种菌龄对菌丝生长的影响不同菌龄的菌丝体所处的生长期不同,其活力也存在较大差异,因此选择不同菌龄的菌种对菌丝体后期的生长影响较大。由表2可知,接种菌龄在3~11 d,随菌龄的增加,菌丝体生物量和菌丝球密度先增加后减少。当菌龄为3 d时,菌丝体生物量和菌丝球密度为5.1 g/L和157个/mL;当菌龄为5 d时,菌丝体生物量和菌丝球密度达到最大,分别为6.9 g/L和214个/mL,此后随菌龄增加,菌丝体生物量和菌丝球密度逐渐减小;当菌龄为11 d时,菌丝体生物量和菌丝球密度减小至5.9 g/L和181个/mL,但仍然高于菌龄为3 d时。从菌丝球性状来看,菌龄为3 d时,菌丝球为米黄色,大小均一但比较稀疏,而菌龄达到11 d时,菌丝球为米黄色,虽然较稠密,但大小不均一,只有菌龄在5~9 d时,菌丝球性状较好。因此,选择菌龄为5 d时的液体菌种,菌丝体的生长情况最佳。
2.3不同接种量对菌丝生长的影响接种量对液体培养菌丝体的生长情况影响较为显著。由表3可知,在相同培养时间的条件下,接种量越大,菌丝体的生物量和菌丝球密度也越大。当接种量为12%时,菌丝体生物量和菌丝球密度均达到最大值,分别为6.9 g/L和219个/mL。当接种量为9%时,菌丝体生物量和菌丝球密度与接种量12%差异不显著,分别为6.8 g/L和212个/mL;当接种量为3%时,菌丝体的生物量和菌丝球密度最小,分别为4.7 g/L和139个/mL。从菌丝球性状来看,当接种量在6%以上时,菌丝球均表现为米黄色,大小均一,稠密;当接种量为3%时,菌丝球较为稀疏。因此,从节约菌种的角度来看,接种量为9%最为合适。
表2接种菌龄对菌丝生长的影响
Table 2Effects of age of inoculation strains on the growth of the mycelia
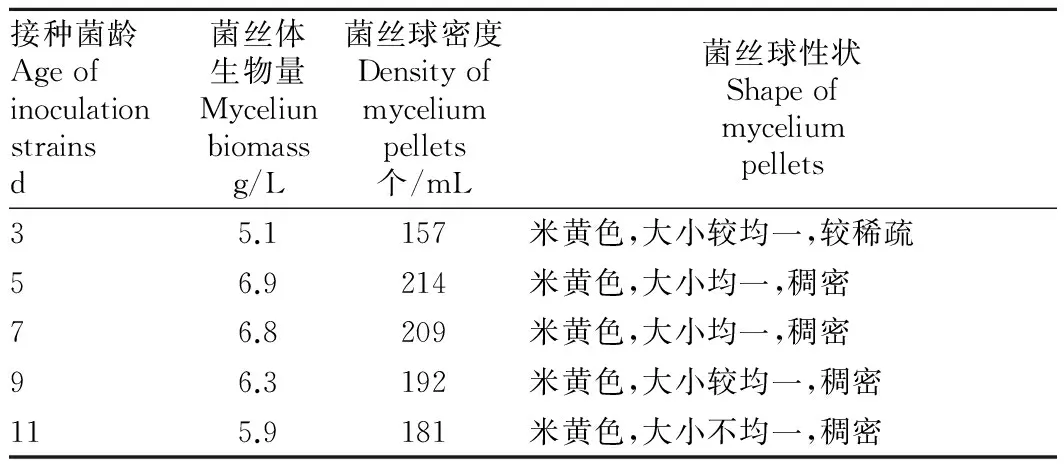
接种菌龄Ageofinoculationstrainsd菌丝体生物量Myceliunbiomassg/L菌丝球密度Densityofmyceliumpellets个/mL菌丝球性状Shapeofmyceliumpellets35.1157米黄色,大小较均一,较稀疏56.9214米黄色,大小均一,稠密76.8209米黄色,大小均一,稠密96.3192米黄色,大小较均一,稠密115.9181米黄色,大小不均一,稠密
表3不同接种量对菌丝生长的影响
Table 3Effects of amount of inoculation on the growth of the mycelia

接种量Amountofinoculation%菌丝体生物量Myceliunbiomassg/L菌丝球密度Densityofmyceliumpellets个/mL菌丝球性状Shapeofmyceliumpellets34.7139米黄色,大小较均一,较稀疏65.5168米黄色,大小均一,较稠密96.8212米黄色,大小均一,稠密126.9219米黄色,大小均一,稠密156.9217米黄色,大小均一,稠密
2.4不同摇床转速对菌丝生长的影响液体培养时不同转速对菌丝生长也有一定程度的影响。由表4可知,当转速为120~160 r/min时,随着转速的增加,菌丝体生物量和菌丝球密度也在逐渐增加。当转速为160 r/min时,菌丝体生物量和菌丝球密度达到最大值,分别为7.1 g/L和223个/mL;当转速为120 r/min时,菌丝体生物量和菌丝球密度最小,分别为6.1 g/L和182个/mL;当转速为180和200 r/min时,菌丝体生物量分别为6.8和6.9 g/L,菌丝球密度分别为211和214个/mL,与转速160 r/min相比略有下降。从菌丝球性状来看,各转速之间的差异不大,都表现为菌丝球米黄色,大小均一且稠密。因此,液体培养时,160 r/min为最佳的培养转速。
2.5不同培养时间对菌丝生长的影响液体培养时不同培养时间对菌丝生长有极显著的影响。由表5可知,液体培养至11 d时,菌丝体生物量和菌丝球密度都达到最大值,分别为7.3 g/L和241个/mL;液体培养3~7 d时,随着培养时间的延长,菌丝体生物量和菌丝球密度也逐渐增加。液体培养3 d时,菌丝体生物量和菌丝球密度都最小,分别为5.2 g/L和157个/mL;液体培养7 d时,菌丝体生物量和菌丝球密度与培养9 d时无显著差异,菌丝体生物量为7.2 g/L,菌丝球密度为237个/mL。在菌丝球性状方面,液体培养5 d后,菌丝球颜色为米黄色,大小均一且稠密,培养时间不足5 d时,菌丝球则相对稀疏。因此,从生产周期来看,液体培养时间为7 d时,效果最佳。
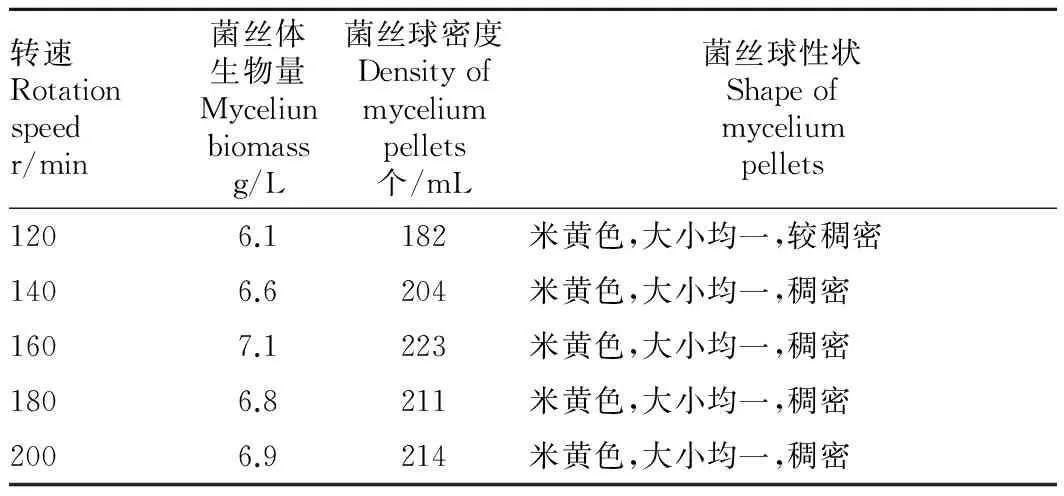
表4 不同转速对菌丝生长的影响

表5 不同培养时间对菌丝生长的影响
3 结论与讨论
元蘑质地柔嫩、味道鲜美,不仅具有很高的营养价值,而且具有一定的药用功效。液体培养生产液体菌种是一种适合规模化、工厂化生产食用菌的菌种制备技术,具有接种效率高、菌种萌发快、菌丝生长快等优点。然而,关于元蘑液体菌种培养的研究却鲜有报道。辛树权等[5]研究发现以元蘑菌丝体生物量为指标时,最佳氮源为马铃薯,最佳碳源为葡萄糖,最佳无机盐为磷酸二氢钾,最佳pH为6.0。笔者对元蘑液体菌种制备过程中培养基配方和培养条件进行了筛选,发现液体培养元蘑菌种的最佳培养基配方为试验组Ⅰ,最佳接种菌龄为5 d,最佳接种量为9%,最佳培养转速为160 r/min,最佳培养时间为7 d。该研究结果可为元蘑的大规模工厂化生产提供科学指导和技术支撑。
[1] 曹德宾,刘英,王艳芹.元蘑[J].农业知识,2007(5): 12-15.
[2] 曹瑞敏,王志才,陈海燕,等.长白山野生亚侧耳中部化学成分及微量元素分析[J].中国中药杂志,1995(4): 233-234.
[3] 姚永志,左锦静,王垒.元蘑游离必需氨基酸的测定[J].食品研究与开发,2009(9): 146-148.
[4] 李茹光,王策篇,杨成录,等.东北食用药用及有毒蘑菇[M].长春: 东北师范大学出版社,1992: 62-66.
[5] 辛树权,赵骥,沈永.不同培养条件对元蘑菌丝生长的影响[J].北方园艺,2013(10): 140-142.
LI Yan-lei1,CHEN Wei-dong2,TENG Su-yan2et al
(1.Dongning Nuanquanzi Forest Farm,Mudanjiang,Heilongjiang 157200; 2.Dongning Forestry Bureau,Mudanjiang,Heilongjiang 157200)
[Objective] To screen the medium formula of liquid strains ofHohenbueheliaserotinato optimize the culture process of liquid strains.[Method] By setting different liquid medium formulas,inoculation conditions (including strain age and amount of inoculum) and culture conditions (including rotation speed and culture time),culture conditions of liquid strains ofH.serotinawere optimized by myceliun biomass,density and shape of mycelium pellets.[Result] The optimal formula of the liquid medium ofH.serotinastrains are shown as follows: potato 200 g,straw powder 150 g,corn flour 10 g,glucose 20 g,peptone 3 g,yeast extract 2 g,and a piece of vitamin B1; the optimal age of strains was 5 d; the optimal amount of inoculum was 9%; the optimal rotation speed was 160 r/min; the optimal culture time was 7 d.[Conclusion] By optimized culture,the myceliun biomass,density and shape of mycelium pellets ofH.serotinawere greatly improved.
Hohenbueheliaserotina; Liquid seed; Optimized culture
中央财政林业科技推广示范资金项目。
李延雷(1983- ),男,黑龙江大庆人,高级工程师,从事食用菌推广工作。
2016-07-08
S 646
A
0517-6611(2016)26-0001-03

